Die Geschichte der epigenetischen Biomarker begann 2013. Dann stellte Steve Horvath, ein Pionier in dieser Richtung, ein Spezialist auf dem Gebiet der Genetik und Biostatistik, ein Mitarbeiter der Universität von Kalifornien in Los Angeles, seine revolutionäre neue Methode zur Bestimmung des biologischen Alters vor, die "epigenetische Uhr". Wie der Name schon sagt, basierte diese Methode auf Veränderungen im Epigenom, nämlich der DNA-Methylierung.
Die DNA-Methylierung ist einer der epigenetischen Mechanismen zur Regulation der Genexpression. Während der Methylierung bindet die Methylgruppe der CH3-speziellen Enzyme an eine der DNA-Basen, Cytosin. Infolgedessen wird 5-Methylcytosin gebildet und die Genexpression wird inaktiviert - der Transkriptionsprozess wird blockiert. Wie Sie heute wissen, ist die DNA-Methylierung ein dynamischer Prozess. Es kann sich unter dem Einfluss externer Faktoren ändern, ist mit der Entwicklung einer Reihe von Pathologien verbunden und kann von mehreren nächsten Generationen vererbt werden. Die Methylierung spielt eine Schlüsselrolle bei der Deaktivierung von Fremd-DNA sowie bei den Entwicklungs- und Alterungsprozessen. Die altersbedingten Veränderungen der Methylierung, die als "epigenetische Drift" bezeichnet werden, werden beschrieben. Mit zunehmendem Alter werden also Hypomethylierung (Demethylierung) und damit verbundene chromosomale Instabilität beobachtet. Darüber hinaus tritt mit zunehmendem Alter auch der umgekehrte Prozess auf - die Hypermethylierung bestimmter Promotorregionen, einschließlich bestimmter Tumorsuppressorgene, die mit der Entwicklung von Pathologien verbunden ist [1]. Im Allgemeinen wird heute angenommen, dass Methylierungsänderungen eine Schlüsselrolle beim Altern spielen.
Basierend auf der Tatsache, dass das chronologische Alter in vielen Regionen des Genoms mit vorhersagbaren Veränderungen des Epigenoms, der Hypo- und Hypermethylierung verbunden ist, wurde die erste Generation epigenetischer Alterungsbiomarker entwickelt, die auf DNA-Methylierung basieren. Im Jahr 2011 zeigte der erste Artikel von Wissenschaftlern der University of California in Los Angeles mit dem Titel „Epigenetischer Prädiktor des Alters“, dass die DNA-Methylierung einen klaren Zusammenhang mit dem Alter hat. Im Jahr 2013 identifizierte Steve Horvat mithilfe einer computergestützten Technik des maschinellen Lernens 353 Methylierungsstellen, die in hohem Maße mit dem chronologischen Alter einer Person korrelierten und die Grundlage für die erste „epigenetische Uhr“ oder „kroatische Uhr“ bildeten [2].
Die Bedeutung dieser Entdeckung ist schwer zu überschätzen. Es muss gesagt werden, dass die Erfolgsgeschichte von S. Horvat voller Dramen ist, die nicht erfunden wurden. Nach den Memoiren von Horvat selbst wollten sie seinen Artikel über eine neue epigenetische Methode zur Altersmessung in mehr als einer der Zeitschriften zunächst nicht akzeptieren. Er musste ständig von Rezensenten den gleichen Satz hören, dass "es zu schön ist, um wahr zu sein". Aber Horvath gab nicht auf und widmete seine ganze Zeit der Fertigstellung der neuen Methode: "Ich schrieb in jeder Freizeit, als wäre es das letzte Mal, dass ich meinen Artikel fertigstellte." Kurz vor Abschluss der Arbeit in der kroatischen Familie ereignete sich eine Katastrophe - seine kürzlich geborene Tochter starb. Dies beunruhigte den hartnäckigen Wissenschaftler jedoch nicht. Die neueste Ausgabe seines Artikels wurde von Genome Biology erneut abgelehnt. Und nachdem Horvath einen weiteren kritischen Kommentar von Rezensenten erhalten hatte, tat er in seinen Erinnerungen drei Dinge, die nicht getan werden sollten: „Nachdem ich die Kommentare von Rezensenten gelesen hatte, verbrachte ich die nächsten 10 Minuten damit, drei Dinge zu tun, die niemals getan werden sollten. Zuerst ging ich zum Kühlschrank und trank drei Flaschen Bier so schnell ich konnte. Zweitens kehrte ich zum Computer zurück und schrieb einen Brief an den Herausgeber. Drittens habe ich es gesendet. " Und diesmal lächelte ihn das Glück an, sein Artikel wurde angenommen.

Wie kann eine „epigenetische Uhr“ nützlich sein? Laut dem Autor der Entdeckung kann diese Methode eine große Rolle bei der Beurteilung der Wirksamkeit von Anti-Aging-Interventionen spielen, da sie die Wartezeit auf Ergebnisse erheblich verkürzen kann. Darüber hinaus wird angenommen, dass die von Kroatien identifizierten Methylierungsstellen nicht nur Marker sind, sondern auch aktive Teilnehmer am Altern (zumindest einige). Was Forschern ein potenzielles therapeutisches Ziel im Kampf gegen das Altern und altersbedingte Pathologien bietet. Diese neue Methode kann auch im Strafverfahren nützlich sein, wenn Altersproben aus Gewebeproben erforderlich sind. Aber natürlich gewann die „epigenetische Uhr“ später die größte Bedeutung für die Vorhersage von Krankheiten und die Erhöhung des Sterblichkeitsrisikos.
Wie sich herausstellte, zeigte die "epigenetische Uhr" im embryonalen Stamm einen Wert von "Null" und induzierte pluripotente Zellen, Spermatozoen, Eizellen und Plazentazellen. Und in den ersten 5 Lebensjahren - ein beschleunigter Verlauf, der mit der Entwicklung des Körpers verbunden ist. Im Alter von 21 Jahren verlangsamte sich die „epigenetische Uhr“ allmählich und lief dann mit einer mehr oder weniger gleichmäßigen Geschwindigkeit, wobei sich ihre Leistung unter dem Einfluss externer Faktoren änderte. Darüber hinaus stellte sich heraus, dass verschiedene Gewebe mit unterschiedlichen Geschwindigkeiten altern. Am anfälligsten für Alterungsprozesse war das Brustgewebe bei Frauen. Aus epigenetischer Sicht altert das Gehirn am langsamsten, und Blut- und Knochenzellen weisen eine leicht beschleunigte Alterung auf [3].
Im selben Jahr 2013 wurde von chinesischen und amerikanischen Wissenschaftlern ein Artikel veröffentlicht, in dem eine andere Version der „epigenetischen Uhr“ vorgestellt wurde - die „Hannum-Uhr“. Gregory Hannum, Bioingenieur an der Universität von Kalifornien an der Universität von Kalifornien in San Diego, und seine Kollegen untersuchten DNA-Methylierungsprofile von 450.000 CpG-Dinukleotiden aus Blutzellen von Menschen im Alter von 19 bis 101 Jahren und identifizierten 71 Methylierungsstellen, die am stärksten mit dem Alter korrelierten [4]. Der Hauptunterschied zwischen der „Hannum-Uhr“ und der „kroatischen Uhr“ besteht in ihrer Spezifität: DNA-Proben werden wie bei der kroatischen Methode aus Blutzellen und nicht aus Gewebe entnommen.
Sehr schnell wurde der Hauptwert der „epigenetischen Uhr“ klar. Der Vergleich ihres Fortschritts mit dem chronologischen Alter ist von großem prognostischen Wert für die Beurteilung des Mortalitätsrisikos aus allen Gründen und die Entwicklung vieler Pathologien. Wenn die "epigenetische Uhr" es eilig hat, gibt es Krankheiten, beschleunigtes Altern und Verkürzung der Lebensdauer. Wenn sie langsamer als das chronologische Alter sind, bestehen gute Chancen auf Langlebigkeit. Studien haben gezeigt, dass die „epigenetische Uhr“ eine hohe Korrelation mit der Mortalität aller Ursachen und altersbedingten Krankheiten aufweist.Im Jahr 2015 führten Horvat und Kollegen Studien durch, um den Zusammenhang zwischen Lungenkrebs und epigenetischem Alter zu bestimmen. Nach Analyse der Daten von 2.029 Personen wurde festgestellt, dass die Beschleunigung des epigenetischen Alters mit einem erhöhten Risiko für Lungenkrebs verbunden war, und diese Beziehung war bei Rauchern und Menschen über 70 stärker: „Die Ergebnisse zeigten, dass standardisierte Indikatoren für die Beschleunigung des epigenetischen Alters (IEAA) vorhanden waren signifikant assoziiert mit der Inzidenz von Lungenkrebs (HR: 1,50, P = 3,4 × 10 -3). Darüber hinaus haben wir gezeigt, dass die Assoziation bei älteren Menschen (70 Jahre oder älter) oder bei Rauchern, die derzeit Raucher sind, möglicherweise noch stärker ist. Im Allgemeinen zeigen unsere Ergebnisse, dass die IEAA ein nützlicher Biomarker für die Beurteilung der Anfälligkeit für Lungenkrebs unter dem Gesichtspunkt des biologischen Alterns sein kann “[5].
Im selben Jahr stellte eine andere Gruppe von Forschern die Beziehung des "epigenetischen Alters" zum Todesrisiko aus allen Gründen bei Menschen über 60 Jahren fest. Zur Analyse wurden Daten aus vier Studien (insgesamt 4658 Personen) herangezogen, deren Durchschnittsalter bei den Teilnehmern 79,1, 69,5, 66,3 bzw. 72,9 Jahre betrug. Das epigenetische Alter wurde mit zwei Methoden bestimmt: der „kroatischen Uhr“ (basierend auf 353 CpG-Methylierungsstellen) und der „Hannum-Uhr“ (basierend auf 71 CpG-Methylierungsstellen). Beide Methoden zeigten eine starke Korrelation miteinander, obwohl die Basissätze nur an 6 CpGs-Stellen übereinstimmten. Die Ergebnisse der Studie zeigten, dass die Beschleunigung des „epigenetischen Alters“ im Vergleich zur chronologischen um 5 Jahre das Mortalitätsrisiko bei Menschen um 16% erhöhte. Die Autoren folgerten: „Beschleunigte Alterungsraten aufgrund von DNA-Methylierung sind vererbte Faktoren, die die Mortalität vorhersagen, unabhängig von Gesundheitszustand, Lebensstilfaktoren oder bekannten genetischen Faktoren. Daher kann davon ausgegangen werden, dass das vorhergesagte Alter der DNA-Methylierung eine „epigenetische Uhr“ ist, die das biologische Alter misst, das zusammenpasst, jedoch nicht immer parallel zum chronologischen Alter, und Vorhersagen über die Lebenserwartung geben kann “[6].
Im Jahr 2016 führten deutsche Onkologen eine Studie durch, in der der Zusammenhang zwischen beschleunigtem epigenetischem Altern und Mortalität durch Krebs, Herz-Kreislauf-Erkrankungen und allen anderen Ursachen beschrieben wurde. Für ihre Arbeit verwendeten sie die „epigenetische Uhr“ von Horvath und Hannum. Das DNA-Methylierungsalter wurde in einer Kohorte von 1863 älteren Menschen, die an der ESTHER-Studie teilnahmen, mit einem Durchschnittsalter von 62,5 Jahren bewertet. Die Ergebnisse zeigten, dass ein epigenetisches Alter, das größer als chronologisch war, mit einer höheren Mortalität verbunden war. Eine 5-jährige Beschleunigung des nach der kroatischen Methode ermittelten „epigenetischen Alters“ führte zu einer Erhöhung der Mortalität um 22% und nach der Hannum-Methode um 16% [7].
2016 führte ein großes internationales Forscherteam unter der Leitung von Steve Horvath eine groß angelegte Metaanalyse durch, in der Daten von 13.089 Personen aus drei rassischen / ethnischen Gruppen untersucht wurden: Weiße, Hispanoamerikaner und Afroamerikaner. Das epigenetische Alter wurde hier ebenfalls nach zwei Methoden bestimmt: der „kroatischen Uhr“ und der „Hannum-Uhr“. Diese Arbeit zeigte, dass eine Beschleunigung der „epigenetischen Uhr“ um 1 Jahr (verglichen mit dem chronologischen Alter) das Mortalitätsrisiko aus allen Gründen auf 4% erhöhte. Darüber hinaus wurde auch der gegenteilige Effekt beobachtet: Die Verlangsamung der „epigenetischen Stunden“ führte zu einem geringeren Mortalitätsrisiko. Darüber hinaus haben die Forscher ein interessantes Phänomen festgestellt: „Wir haben festgestellt, dass 5 Prozent der Menschen einen schnelleren Verlauf des biologischen Alters haben, was zu einer kürzeren Lebensdauer führt. Beschleunigtes Altern erhöht das Sterberisiko dieser Menschen in jedem Erwachsenenalter um 50 Prozent. “[8, 9]
Eine Reihe externer Faktoren, die den Verlauf der „epigenetischen Uhr“ beeinflussen, sind ebenfalls bekannt. Im Jahr 2017 beschrieben Horvath und Kollegen das Verhältnis von Ernährung, Alkohol, Bildung und Bewegung im Verlauf der epigenetischen Zeit. Laut den Autoren selbst bestätigte ihre Arbeit die seit langem bekannte Wahrheit: Eine Ernährung mit Gemüse, Fisch und magerem Fleisch, moderater Alkoholkonsum, körperliche Aktivität und Bildung verlangsamen den Verlauf der epigenetischen Zeit und tragen zur Verlängerung des Lebens bei. Erhöhte Insulin- und Glucosespiegel, C-reaktives Protein und Triglyceride sowie übermäßiges Körpergewicht und hoher Blutdruck beschleunigten die Alterung des Epigenoms. In derselben Studie fanden Wissenschaftler keine positive Wirkung des Antidebasikums Metformin auf den Verlauf der epigenetischen Zeit [10]. Im selben Jahr zeigten finnische Forscher erneut den Zusammenhang zwischen Fettleibigkeit und beschleunigtem epigenetischen Altern [11].
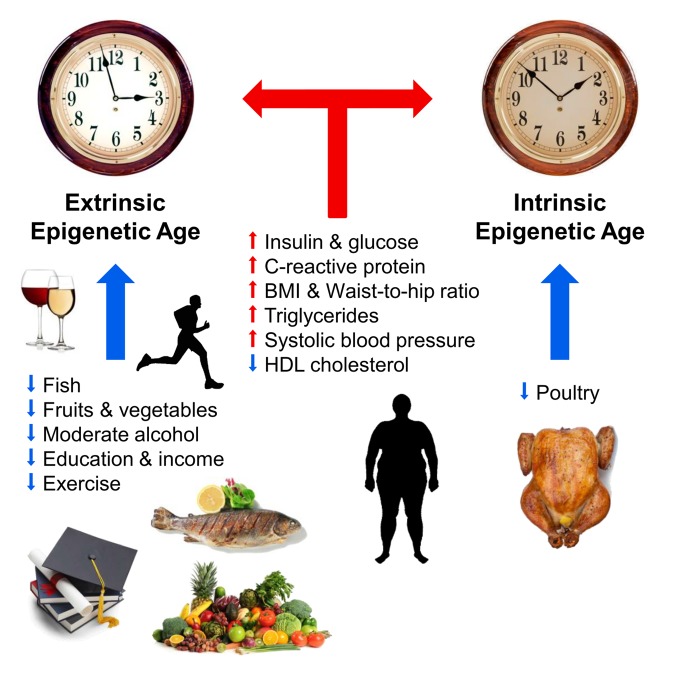
Abb. 1
Faktoren, die das epigenetische Alter beeinflussen (ab [10]).
Blaue und rote Pfeile zeigen Faktoren an, die das Altern verlangsamen bzw. beschleunigen. Die Uhr symbolisiert die externe epigenetische Uhr (extrinsische epigenetische Uhr, eine erweiterte Version der Hannum-Methode) und die interne epigenetische Uhr (intrinsische epigenetische Uhr, kroatische Uhr). Positive Auswirkungen auf den Verlauf der epigenetischen Zeit (Verlangsamung): Fisch, Geflügel, Gemüse und Obst, Lipoproteine hoher Dichte, mäßiger Alkohol, Bildung und körperliche Aktivität. Negativ den Verlauf der epigenetischen Zeit beeinflussen (beschleunigen): erhöhte Spiegel an Insulin, Glukose, C-reaktivem Protein, Triglyceriden, hohem Blutdruck, erhöhtem Körpergewicht und einem falschen Verhältnis von Taille und Hüfte.Verschiedene Forscherteams haben den Zusammenhang zwischen dem Verlauf der epigenetischen Zeit und den physischen und kognitiven Funktionen, dem Down- und Werner-Syndrom, der HIV-Infektion, der Alzheimer-Krankheit und den Wechseljahren beschrieben [12-17]. Ein klarer Zusammenhang zwischen Langlebigkeit und Verlangsamung der „epigenetischen Uhr“ wurde auch am Beispiel italienischer 100-jähriger Hundertjähriger gezeigt [18]. Steve Horvath konnte seine Methode lange Zeit nicht verwenden, um den beschleunigten Verlauf des biologischen Alters während der Hutchinson-Guildford-Progerie vorherzusagen. Dieses Jahr wurde dieses Problem jedoch gelöst: Er und seine Kollegen entwickelten spezielle „epigenetische Uhren“ auf der Basis von Fibroblasten, die aus 391 CpG-Stellen bestehen und als „Haut-Blut-Uhren“ bezeichnet werden [19].
Die nächste Phase der Arbeit von S. Horvat war die Entwicklung eines wirksameren Biomarkers für das Altern mit verbesserten diagnostischen Fähigkeiten, die das Mortalitätsrisiko aufgrund verschiedener Ursachen und die Entwicklung altersbedingter Krankheiten vorhersagen. Der Nachteil der früheren „epigenetischen Uhren“ laut Horvath war, dass die Verwendung des chronologischen Alters als Standard zur Bestimmung von Altersabweichungen CpG-Stellen ausschließen kann, deren Methylierungsprofile keine starken zeitabhängigen Änderungen aufweisen. Stattdessen zeigen sie nur die Diskrepanz zwischen biologischem und chronologischem Alter. Daher ist es wichtig, nicht nur CpGs zu erfassen, die den Unterschied zur chronologischen Zeit aufweisen, sondern auch solche, die Unterschiede im Risiko und im physiologischen Status bei Personen gleichen chronologischen Alters aufweisen. 2018 wurde ein neuer Biomarker namens DNAm PhenoAge, wurde erstellt.
In der ersten Phase analysierte das Team von S. Horvath an einer großen Stichprobe von 9926 Personen, Teilnehmern der NHANES III-Studie, die Beziehung zwischen 42 klinischen Biomarkern und dem chronologischen Alter zum Mortalitätsrisiko. Als Ergebnis wurden 9 Biomarker bestimmt, um das phänotypische Alter vorherzusagen:
1. Albumin
2. Kreatinin
3. Glukose
4. C-reaktives Protein
5. Prozentsatz der Lymphozyten
6. Das durchschnittliche Volumen der roten Blutkörperchen
7. Die Breite der Verteilung der roten Blutkörperchen
8. Anzahl der weißen Blutkörperchen
9. Alkalische Phosphatase.Dann validierten sie die ausgewählten Biomarker - überprüften ihr phänotypisches Altersmodell in einer anderen Stichprobe von Personen (6209 Personen). Die Überprüfung ergab eine Korrelation zwischen dem Anstieg des phänotypischen Alters und dem erhöhten Mortalitätsrisiko aus allen Gründen: Ein einjähriger Anstieg des phänotypischen Alters war mit einem 9% igen Anstieg des Mortalitätsrisikos aus allen Gründen verbunden, einem 9% igen Anstieg des Mortalitätsrisikos aufgrund altersbedingter Erkrankungen und einem 10% igen Anstieg des Mortalitätsrisikos aufgrund von Herzerkrankungen Gefäßerkrankungen, ein 7% iger Anstieg des Todesrisikos durch Krebs, ein 20% iger Anstieg des Todesrisikos durch Diabetes und ein 9% iger Anstieg des Todesrisikos durch Atemwegserkrankungen.
In der zweiten Phase der Studie assoziierten die Autoren die DNA-Methylierung mit dem phänotypischen Alter. Wissenschaftler haben identifiziert, welche methylierten GpC-Stellen mit diesen 9 klinischen Biomarkern assoziiert sind, die das phänotypische Alter vorhersagen. Sie identifizierten 513 CpGs solcher Stellen, die das phänotypische Alter vorhersagten. Ein neuer epigenetischer Marker wurde DNAm PhenoAge genannt. Der Test zeigte eine ziemlich hohe Genauigkeit des neuen Biomarkers: Zwischen 1998 und 2007 betrug die durchschnittliche Änderung des DNAm-PhenoAge 8,51 Jahre, während die durchschnittliche Änderung des klinischen phänotypischen Alters 8,88 Jahre betrug.
Danach testeten die Forscher ihren neuen Marker-Biomarker anhand von Daten aus vier großen Studien, der Frauengesundheitsinitiative (n = 4207), der Framingham-Herzstudie (n = 2553), der normativen Altersstudie (n = 657) und der Jackson-Herzstudie (n) = 1747). Die Ergebnisse zeigten, dass DNAm PhenoAge in allen Studien (unabhängig vom chronologischen Alter) signifikant mit einem nachfolgenden Mortalitätsrisiko assoziiert war: Ein einjähriger Anstieg von DNAm PhenoAge war mit einem Anstieg des Gesamtmortalitätsrisikos um 4,5% verbunden.
Die genetische Analyse von DNAm PhenoAge zeigte, dass die darin verwendeten 513 CpG-Stellen 41 CpGs aufweisen, die mit der kroatischen Uhr identisch sind, und 6 CpGs, die mit der Hannum-Uhr identisch sind. Bei allen drei epigenetischen Methoden wurden fünf identische CpGs gefunden. 149 CpGs aus DNAm PhenoAge befinden sich in Clustern von CpG-Dinukleotiden (CpG-Inseln).
Alle während der Studie von Steve Horvath und seinem Team erhaltenen Daten zeigten, dass der neue Biomarker einen großen prädiktiven Wert für die Bestimmung des Risikos altersbedingter Krankheiten und des Mortalitätsrisikos hat. „
Mit einem innovativen zweistufigen Verfahren haben wir einen neuen epigenetischen Biomarker für das Altern entwickelt, DNAm PhenoAge, der frühere Biomarker in Bezug auf Vorhersagen für verschiedene Alterungsfaktoren, einschließlich Mortalität aus allen Gründen, Krebs, allgemeine Gesundheit, körperliche Funktionsfähigkeit und Alzheimer-Krankheit, weit übertroffen hat. Obwohl dieser Biomarker unter Verwendung von Vollblutdaten entwickelt wurde, korreliert er stark mit dem Alter in jedem getesteten Gewebe und jeder getesteten Zelle. Basierend auf einer eingehenden Transkriptionsanalyse in sortierten Zellen fanden wir heraus, dass ein erhöhtes epigenetisches Alter im Vergleich zum chronologischen Alter mit einer erhöhten Aktivierung von proinflammatorischen und Interferonwegen und einer verringerten Aktivierung von Transkriptions- / Translationsmechanismen, einer Reaktion auf DNA-Schäden und mitochondrialen Signaturen verbunden ist. Im Allgemeinen kann dieser einzelne epigenetische Biomarker des Alterns die Risiken für eine Vielzahl von Ergebnissen in verschiedenen Geweben und Zellen abdecken und ein Verständnis für die wichtigen Wege des Alterns vermitteln. “[20]Verfasser: Alexey Rzheshevsky.Referenzliste- Vayserman A. M., Voitenko V. P., Mekhova L. V. Epigenetische Epidemiologie altersbedingter Erkrankungen. Ontogenese 2011.42, 1–21;
- Horvath S. DNA-Methylierungsalter von menschlichen Geweben und Zelltypen. Genome Biol. 2013.14, R115.
- Josh Mitteldorf. Methylierungsalterungsuhr: Ein Update. 14. Februar 2018.
- Hannum, G; Guinney, J; Zhao, L; Zhang, L; Hughes, G; Sadda, S; Klotzle, B; Bibikova, M; Fan, JB; Gao, y; Deconde, R; Chen, M; Rajapakse, ich; Freund, S; Ideker, T; Zhang, K (2013). Genomweite Methylierungsprofile zeigen quantitative Ansichten der Alterungsraten des Menschen. Mol Cell. 49: 359 & ndash; 367.
- Morgan E. Levine, H. Dean Hosgood, Brian Chen, Devin Absher, Themistocles Assimes and Steve Horvath. DNA methylation age of blood predicts future onset of lung cancer in the women's health initiative. Aging (Albany NY). 2015 Sep; 7(9): 690–700.
- Riccardo E Marioni, Sonia Shah, et al. DNA methylation age of blood predicts all-cause mortality in later life. Genome Biol. 2015; 16(1): 25.
- Laura Perna, Yan Zhang, Ute Mons, Bernd Holleczek, Kai-Uwe Saum, and Hermann Brenner. Epigenetic age acceleration predicts cancer, cardiovascular, and all-cause mortality in a German case cohort. Clin Epigenetics. 2016; 8: 64.
- Brian H. Chen, Riccardo E. Marioni et al. DNA methylation-based measures of biological age: meta-analysis predicting time to death Aging (Albany NY). 2016 Sep; 8(9): 1844–1859.
- Epigenetic clock predicts life expectancy. ScienceDaily. 28 September 2016.
- Quach A1, Levine ME1 et al. Epigenetic clock analysis of diet, exercise, education, and lifestyle factors. Aging (Albany NY). 2017 Feb 14;9(2):419-446.
- Nevalainen T, Kananen L, Marttila S, Jylhävä J, Mononen N, Kähönen M, Raitakari OT, Hervonen A, Jylhä M, Lehtimäki T, Hurme M. Obesity accelerates epigenetic aging in middle-aged but not in elderly individuals. Clin Epigenetics. 2017 Feb 14;9:20.
- Marioni RE, Shah S, McRae AF, Ritchie SJ, Muniz-Terrera G, Harris SE, Gibson J, Redmond P, Cox SR, Pattie A, Corley J, Taylor A, Murphy L, et al.. The epigenetic clock is correlated with physical and cognitive fitness in the Lothian Birth Cohort 1936. Int J Epidemiol. 2015; 44:1388–96.
- Horvath S, Garagnani P, Bacalini MG, Pirazzini C, Salvioli S, Gentilini D, Di Blasio AM, Giuliani C, Tung S, Vinters HV, Franceschi C. Accelerated epigenetic aging in Down syndrome. Aging Cell. 2015; 14:491–95.
- Horvath S, Levine AJ. HIV-1 Infection Accelerates Age According to the Epigenetic Clock. J Infect Dis. 2015; 212:1563–73.
- Maierhofer A, Flunkert J, Oshima J, Martin GM, Haaf T, Horvath S. Accelerated epigenetic aging in Werner syndrome. Aging (Albany NY). 2017; 9:1143–52.
- Levine ME, Lu AT, Bennett DA, Horvath S. Epigenetic age of the pre-frontal cortex is associated with neuritic plaques, amyloid load, and Alzheimer's disease related cognitive functioning. Aging (Albany NY). 2015; 7:1198–211
- Levine ME, Lu AT, Chen BH, Hernandez DG, Singleton AB, Ferrucci L, Bandinelli S, Salfati E, Manson JE, Quach A, Kusters CD, Kuh D, Wong A, et al.. Menopause accelerates biological aging. Proc Natl Acad Sci USA. 2016; 113:9327–32.
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, Mari D, Arosio B, Monti D, Passarino G, De Rango F, D'Aquila P, Giuliani C, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (Albany NY). 2015; 7:1159–70.
- Steve Horvath, Junko Oshima et al. Epigenetic clock for skin and blood cells applied to Hutchinson Gilford Progeria Syndrome and ex vivo studies. Aging. Volume 10, Issue 7, pp 1758—75.
- 20. Morgan E. Levine, Ake T. Lu, et al. An epigenetic biomarker of aging for lifespan and healthspan. Aging (Albany NY). 2018 Apr; 10(4): 573–591.