In den letzten Jahrzehnten hat die Wissenschaft bedeutende Fortschritte bei der Behandlung von Krebs erzielt, und obwohl wir noch weit davon entfernt sind, diese schreckliche Krankheit vollständig zu besiegen, verfügen Ärzte immer mehr über Instrumente, um Tumore zu zerstören oder ihr Wachstum zu begrenzen. Die Hauptsache ist, dass sie Krebspatienten die Möglichkeit geben, länger zu leben.
Eines dieser Instrumente ist die Aktivierung der eigenen Immunität einer Person gegen Krebszellen. Diesem Thema ist ein ganzer Bereich gewidmet - die Immunonkologie. Es wird viel Aufmerksamkeit darauf gerichtet, in diesem Bereich werden heute die meisten Forschungsarbeiten durchgeführt und die vielversprechendsten Medikamente entwickelt.
Wir von
Medicine 24/7 setzen die Immuntherapie aktiv ein - und wir sehen, dass sie gute Ergebnisse liefert. Wir sind zwar mit der Tatsache konfrontiert, dass viele Patienten diese Behandlungsmethode überhaupt nicht kennen oder sie als noch unzureichend untersucht und nicht vertrauenswürdig betrachten.
In dieser Veröffentlichung werden wir versuchen, die Fragen zu klären: Was ist Immuntherapie, wie funktioniert sie und wer kann helfen.
 Judy Perkins. Sie hatte terminalen Brustkrebs, der mit der neuesten Immuntherapiemethode vollständig geheilt wurde.Versteckte Bedrohung. Wie geht Krebs
Judy Perkins. Sie hatte terminalen Brustkrebs, der mit der neuesten Immuntherapiemethode vollständig geheilt wurde.Versteckte Bedrohung. Wie geht KrebsKrebszellen sind mutierte Rebellen, denen es gelungen ist, das System zu überlisten.
Im Laufe des Lebens durchlaufen alle Körperzellen streng definierte Entwicklungsstadien, erfüllen bestimmte Funktionen, vermehren sich nach strengen Regeln und werden schließlich alt und sterben ab. Dies ist ein natürlicher Prozess. Der programmierte Tod alter Zellen, die viel Schaden angehäuft haben, wird als Apoptose bezeichnet.
Unter dem Einfluss von Vererbung oder nachteiligen externen Faktoren akkumulieren einige Zellen jedoch genetische Fehler und „rebellieren“: Sie weigern sich, nach dem von der Natur festgelegten Algorithmus zu leben, beginnen sich unkontrolliert zu vermehren oder sterben nicht rechtzeitig ab. Dies ist nicht ungewöhnlich. Möglicherweise treten in jedem Fall regelmäßig Krebszellen auf - dies ist normal. Fast immer werden solche „Emporkömmlinge“ vom internen Sicherheitsdienst des Körpers getötet -
Immunität .
Eine der Hauptrollen in diesem Prozess spielen T-Lymphozyten oder einfacher
T-Zellen . Sie reagieren auf ein
Antigen (eine dem Körper fremde Substanz), erkennen und zerstören potenzielle Feinde: zum Beispiel Mikroben oder unangemessenes Spendermaterial. Normalerweise töten T-Lymphozyten auch die Körperzellen ab, die zu mutieren begannen und sich nicht gemäß den Regeln verhalten. Daher tritt Krebs nicht bei jedem auf - in der Mehrzahl wird die Immunität mit Störungen fertig, bevor sie sich ausbreiten.
Aber der Krebs versucht zu überleben und die Tumorzellen versuchen, so viele Ressourcen wie möglich zu erfassen, um "erfolgreicher" zu werden. Sie vermehren sich schneller, sezernieren den vaskulären Wachstumsfaktor (um mehr Blut und Nährstoffe für den Tumor zu gewinnen), entwickeln Resistenzen gegen Medikamente und zwingen Stammzellen, das Wachstum von Tumorgewebe zu fördern (und täuschen irreführende Signale mit der Bitte um Regeneration).
Krebszellen erzielen besondere Erfolge bei der Verkleidung: Einige von ihnen entfernen spezielle Antigenproteine von ihrer Oberfläche, an denen T-Zellen sie erkennen können. Andere scheiden spezielle Moleküle aus, die das Immunsystem unterdrücken, und einige bilden sogar Hybride mit Makrophagen (eine der Arten von Immunzellen) - und werden buchstäblich zu Supermächten!
Einerseits hilft ihnen die Verwandtschaft mit normalen Körperzellen dabei - eine Art angeborene Verkleidung. Andererseits erhöht die genetische Variabilität von Krebszellen die Anpassungsfähigkeit. Je mehr Mutationen sich zum Zeitpunkt ihrer Malignität (Umwandlung in Malignität) in der DNA der Zelle angesammelt haben, desto größer sind die Chancen, die Immunantwort zu überleben und einen erfolgreichen Einfangplan zu entwickeln.
Erwachen der Macht. Geschichte der NobelentdeckungenDie menschliche Immunität ist eigentlich eine echte Armee rücksichtsloser Mörder, und nach jeder "Kampfoperation" zur Neutralisierung eines anderen Feindes müssen sie beruhigt und von einem Militär in eine friedliche Position versetzt werden. Dieser Mechanismus senkt die Temperatur auf normale Werte und stoppt die Entzündung, wenn die Gefahr vorüber ist und die Infektion besiegt wurde.
2018 wurde der Nobelpreis für Physiologie oder Medizin an den Amerikaner James Ellison und den Japaner Tasuk Honjo für ihre unabhängigen Entdeckungen auf demselben Gebiet verliehen: Wie genau erfolgt dieser Wechsel vom aggressiven zum ruhigen Modus?
Keiner der Wissenschaftler dachte zuerst an eine Krebsbehandlung. Beide wollten ein klareres Verständnis der Funktionsweise der Immunantwort. Zu diesem Zeitpunkt war klar, dass sich auf der Oberfläche von T-Zellen und auf der Oberfläche von Antigen-präsentierenden Zellen (
APC ) Rezeptormoleküle befinden, die aufeinander einwirken und das Immunsystem provozieren oder verlangsamen.
TCR wurde entdeckt
- ein T-Zell-Rezeptor, an dem T-Zellen "feindliche" Proteine erkennen, die bei APC exponiert sind.
Wir fanden den Haupthistokompatibilitätskomplex MHC (Haupthistokompatibilitätskomplex), mit dessen Hilfe APCs Stücke von Fremdproteinen zur Identifizierung von T-Zellen präsentieren. Peter Doherty und Rolf Zinkernagel erhielten ihren Nobelpreis für die Entdeckung dieses Szenarios.
Wissenschaftler verstanden, dass Rezeptoren auf der Oberfläche von T-Zellen in Verbindung mit Co-Stimulatoren auf der Oberfläche von APC arbeiten. Protein
CD28 von der Oberfläche von T-Zellen wurde bereits
1980 isoliert, bald wurde das B7-Molekül auf der Oberfläche von APC gefunden. Während der Experimente übertrugen die Forscher der Ellison-Gruppe das
B7- Gen auf Krebszellen und sie wurden von gesundem Gewebe abgestoßen. Es stellte sich heraus, dass B7 an CD28 auf der T-Zelle bindet und damit seine Arbeit beginnt: Die T-Zelle zerstört die Tumorzelle, auf deren Oberfläche das B7-Protein "herausragt".
Im Jahr
1987 entdeckte Ellison das
zytotoxische T-Lymphozyten-Antigen-4 CTLA-4 (zytotoxisches T-Lymphozyten-assoziiertes Antigen-4) - und stellte fest, dass die Struktur dieses Proteins dem seit langem bekannten CD28 ähnlich ist und auch an B7 binden kann - jedoch mit Dies funktioniert genau umgekehrt: Es stoppt die Immunantwort.
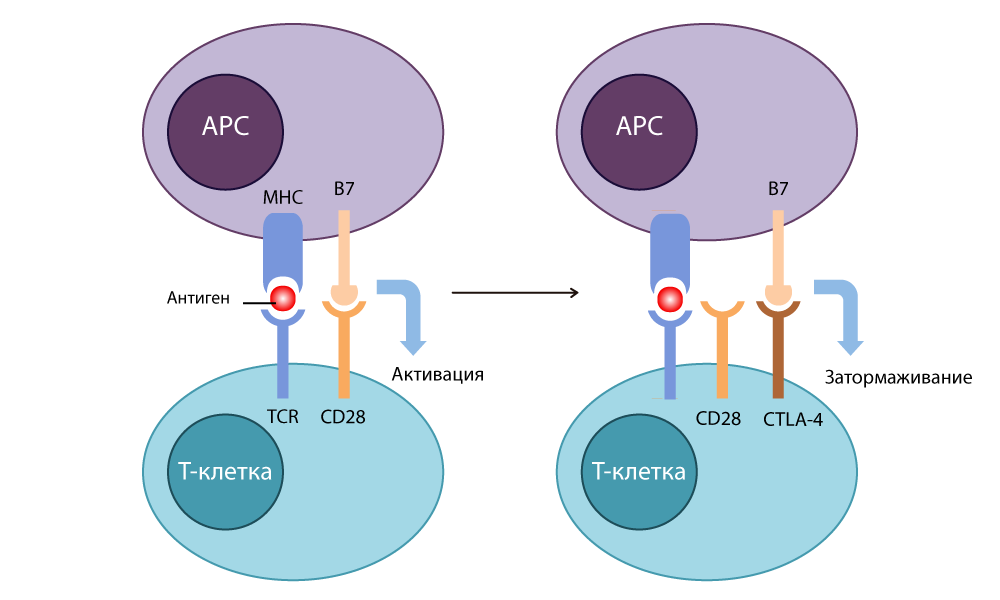 CTLA-4-Aktion
CTLA-4-AktionErstens wollten Ärzte diese „Bremse“ verwenden, um Autoimmunerkrankungen zu bekämpfen (wenn die Immunität beginnt, gesunde Körperzellen anzugreifen). Aber Allison hat sich eine brillante Sache ausgedacht: Drücken Sie nicht auf die Bremse, sondern schalten Sie sie aus.
Er entwickelte einen Inhibitor-Antikörper (Schalter), der an CTLA-4 bindet und verhindert, dass es sich mit B7 schließt, um Immunantworten auszuschalten. Freie B7-Moleküle, die an CD28 gebunden waren, aktivierten die T-Zelle und waren bereit, erneut zu töten. Als er 1995 Experimente an krebskranken Krebsmäusen durchführte, wurde klar, dass sich selbst listige Krebszellen bei ausgeschalteter Bremse nicht vor solchen T-Lymphozyten verstecken konnten. Im Jahr 2010 wurden erfolgreiche Studien an hoffnungslosen Patienten durchgeführt. Bei einigen Patienten verschwand das Melanom zusammen mit Metastasen - ein unglaubliches Ergebnis!
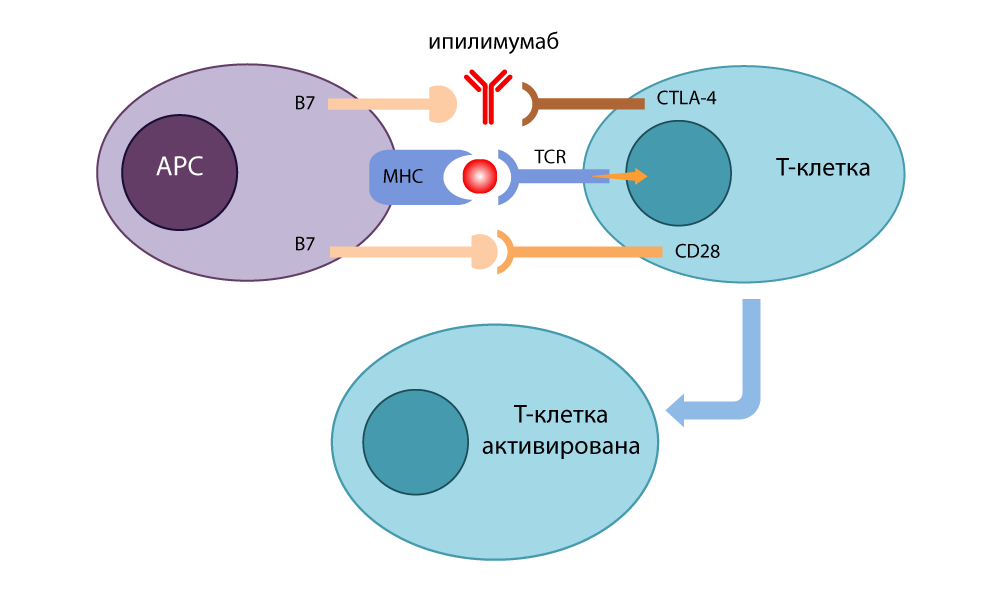 Die Wirkung des CTLA-4-Inhibitors - Ipilimumab
Die Wirkung des CTLA-4-Inhibitors - IpilimumabZur gleichen Zeit fand
Tasuku Honjo in Kyoto ein weiteres Rezeptormolekül auf der Oberfläche der T-Zelle:
PD-1 (Programmed Cell Death Protein-1 , Programmable Cellular Death Protein-1). Während der Experimente (erneut an langleidenden Mäusen) stellten die Japaner fest, dass die Deaktivierung des für dieses Protein kodierenden Gens bei Mäusen Symptome einer Autoimmunerkrankung hervorruft - das heißt, die PD-1-Hemmung schaltete auch die „Bremsen“ von T-Lymphozyten aus und machte sie aggressiv und aktiv.
Honjo fand heraus, dass PD-1 die T-Zelle in den Schlafmodus versetzt, wenn sie an das PD-L1 / PD-L2-Protein auf der Oberfläche einer Antigen-präsentierenden Zelle (APC) bindet. Der PD-1-Inhibitor öffnete diese Verbindung und aktivierte die T-Zellen erneut. Die Wirkung dieser „Bremse“ war ähnlich wie bei CTLA-4, sie nahm jedoch einen anderen Weg.
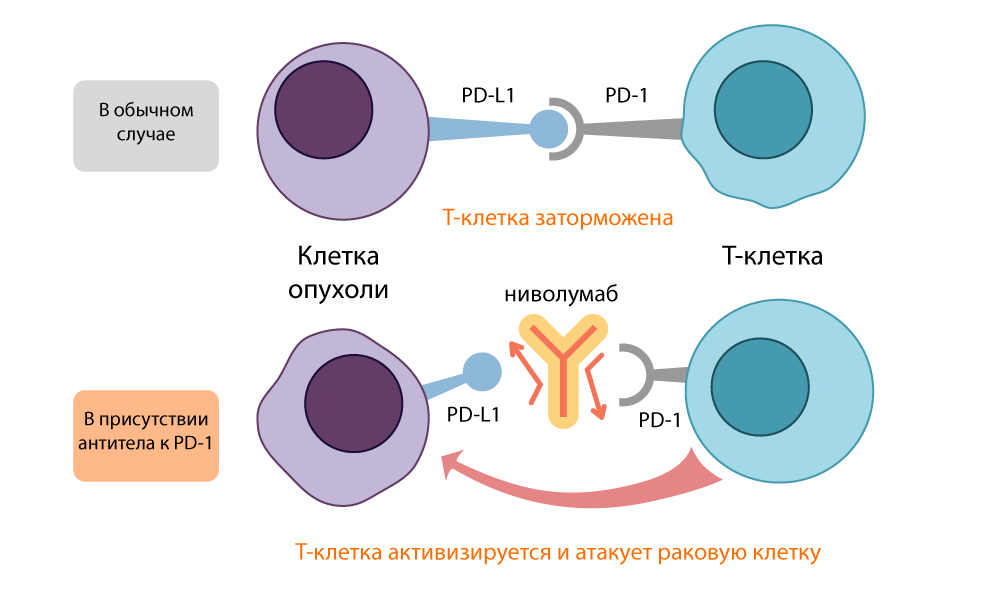 Die Wirkung des PD-L1-Inhibitors - Nivolumab
Die Wirkung des PD-L1-Inhibitors - NivolumabBeide offenen "inhibitorischen" Moleküle, CTLA-4 und PD-1, wurden als
Immunkontrollpunkte (Checkpoints) bezeichnet - es ist ihre Anzahl und Aktivität, die T-Zellen dazu bringt, eine Entscheidung zu treffen: sich zu beruhigen oder zu kämpfen.
Es stellte sich heraus, dass CTLA-4-Blocker im Allgemeinen die Immunität aller T-Zellen aktivieren und der PD-1-Inhibitor spezifischer auf Tumore wirkt, weil Viele Krebszellen tragen das „zweite Puzzleteil“, das PD-L1 / PD-L2-Molekül. Aus diesem Grund birgt die Behandlung mit PD-1-Inhibitoren ein geringeres Risiko für Komplikationen.
Die Immunität schlägt zurück. Welche Checkpoint-Inhibitoren helfenAllison und Honjo haben nicht nur einen ernsthaften Beitrag zum Verständnis physiologischer Prozesse geleistet, sondern auch eine Welle grundlegend neuer praktischer Forschung in der angewandten Medizin eingeleitet.
Die Entdeckung der Hemmung von Immunkontrollpunkten (IKT) eröffnet einen grundlegend neuen Bereich für die Suche nach Lösungen. Zuvor waren Methoden zur Krebsbekämpfung: Operation, Bestrahlung und Chemotherapie - direkt auf den Tumor selbst gerichtet, auf die Zerstörung von Krebszellen. Jetzt haben Ärzte ein riesiges Forschungsfeld in eine völlig andere Richtung: die Veränderung der Interaktion von Krebszellen mit ihrer Umwelt.
Übrigens war es dieser grundlegende Unterschied, der den Ärzten einen echten Durchbruch verschaffte. Bisher war der Tumor je nach Standort betroffen. Bei Brustkrebs ist ein Medikament bei Magenkrebs ein völlig anderes. Und der IKT-Hemmer Pembrolizumab wurde 2017 zum ersten Mal in der Geschichte der Onkologie als Medikament zur Behandlung von Krebs in einem Organ registriert - wenn nur die Tests bestätigen, dass der Tumor eine besondere Eigenschaft hat: Mikrosatelliteninstabilität. Das heißt, ihre DNA ist besonders anfällig für Mutationen. Bisher war es nie möglich, Krebs gegen ein häufiges Symptom zu heilen. Dies ist eine großartige Leistung.
Die Revolution war das Ergebnis des Einsatzes neuer Medikamente gegen die aggressivsten Krebsarten: Das metastatische Melanom im Stadium IV wurde als unheilbar angesehen. Und Patienten mit einer solchen Diagnose, die 2010 das Medikament Ipilimumab (CTLA-4-Blocker) erhielten - erhielten ein zusätzliches Lebensjahr -, sodass die Entwicklung des Tumors aufhörte. Bei 58% von ihnen nahm der Tumor um ein Drittel ab.
Bei der Behandlung von nichtkleinzelligem Lungenkrebs mit Nivolumab (PD-1-Hemmer) verringerte sich das Todesrisiko von Patienten um 40%.
Pembrolizumab (ebenfalls ein PD-1-Inhibitor) zeigte eine 43% ige Abnahme des Tumorwachstums in der mit Melanom behandelten Gruppe. 74% der Patienten lebten im Laufe des Jahres ohne Verschlechterung, 18 Monate lang waren es 71%. Es ist wichtig, dass die Wirkung der Verschreibung des Arzneimittels die Nebenwirkungen in allen Stadien der Entwicklung der Krankheit überwog.
Heute behandeln CTLA-4- und PD-1-Inhibitoren Melanome (einschließlich nicht operierbarer), nicht-kleinzelligen Lungenkrebs, Plattenepithelkarzinome des Kopfes und des Halses, Nierenzellkarzinome, bestimmte Arten von Lymphomen, Krebs des Rektums, der Blase und Tumoren mit Mikrosatelliteninstabilität.
Von besonderem Interesse sind Studien, die die Wirksamkeit einer
Kombinationstherapie sowohl mit Anti-PD-1- als auch mit Anti-CTLA-4-Arzneimitteln zeigen.
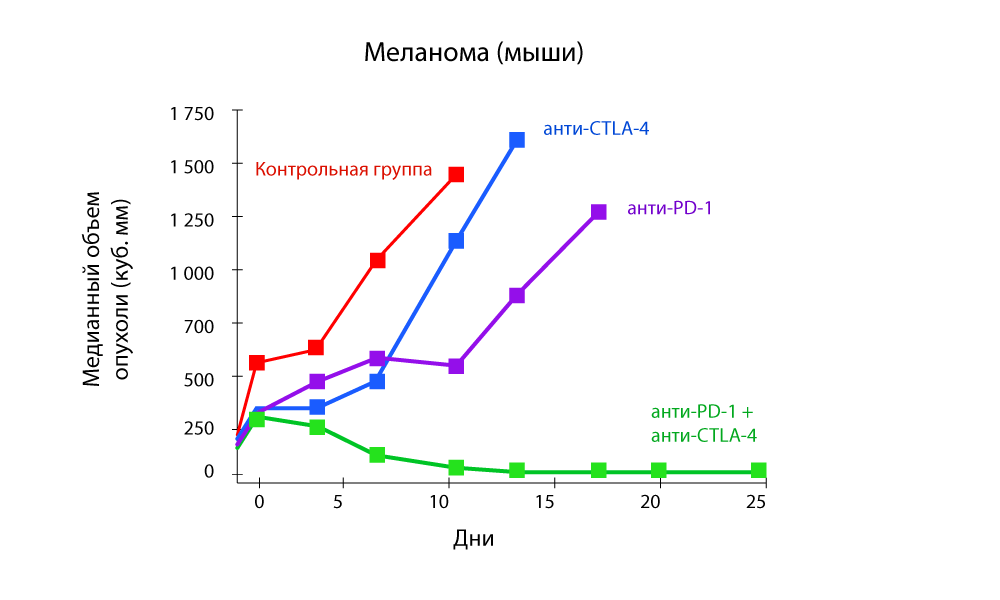 Änderung des Tumorvolumens - eine starke Abnahme mit der Kombination von Anti-PD-1- und Anti-CTLA-4-Medikamenten
Änderung des Tumorvolumens - eine starke Abnahme mit der Kombination von Anti-PD-1- und Anti-CTLA-4-Medikamenten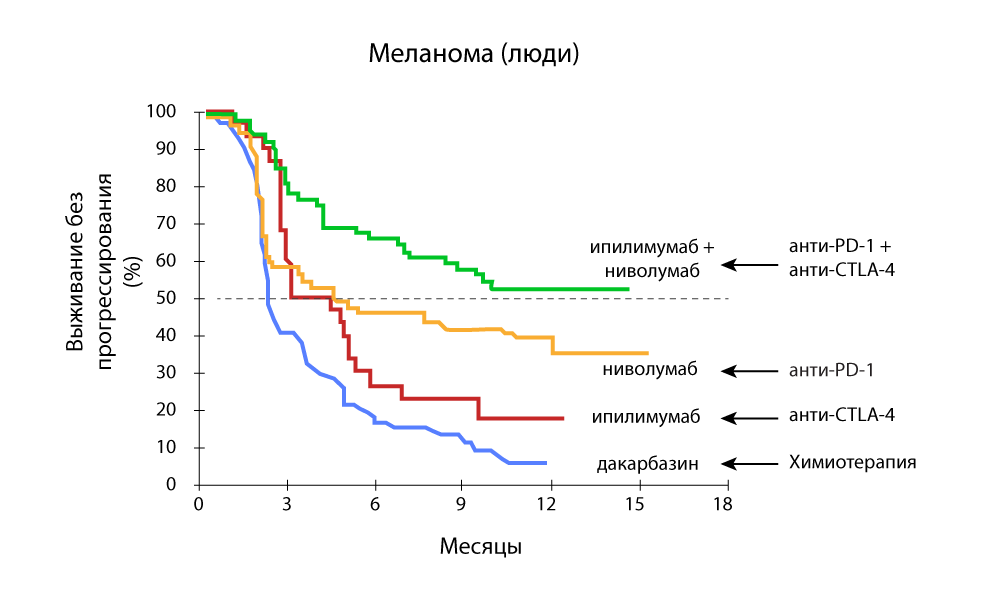 Progressionsfreies Überleben - Die Kombination von Anti-PD-1- und Anti-CTLA-4-Medikamenten ist effektiver
Progressionsfreies Überleben - Die Kombination von Anti-PD-1- und Anti-CTLA-4-Medikamenten ist effektiverBei Medicine 24/7 setzen wir Pembrolizumab und Nivolumab erfolgreich ein, seit sie in der Russischen Föderation registriert sind. Wir verfolgten alle ausländischen Forschungen und freuten uns darauf, das Arsenal wieder aufzufüllen.
Angriff der Klone. Gentechnisch veränderte ImmunitätInhibitoren von Immunkontrollpunkten stehen zu Recht im Rampenlicht, aber dieser Mechanismus ist immer noch nicht perfekt und kann keinen Krebs heilen. Es ist gut, dass sich in der Immuntherapie Forschungsbereiche aktiv entwickeln. Eine der vielversprechendsten ist die
CAR-T-Therapie .
Der Buchstabe T im Namen der Methode ist alle die gleichen unveränderlichen T-Zellen unserer Immunität. CAR (Chimärer Antigenrezeptor) ist ein chimärer Antigenrezeptor. Warum heißt der Rezeptor chimär? Weil es aus mehreren Teilen zusammengesetzt ist, die aus verschiedenen Zellen stammen - unter Verwendung der Fähigkeiten von Gentechnikern.
Gewöhnliche T-Zellen haben einen spezifischen
TCR- Rezeptor
(T-Zell-Rezeptor) . Er "fühlt" alle Zellen des Körpers auf seinem Weg und sendet, wenn er ein fremdes Molekül auf der Oberfläche der Zelle wahrnimmt, ein aktivierendes Signal an die T-Zelle. Dies wiederum befasst sich entweder mit dem unerwünschten Alien selbst oder setzt spezielle Wirkstoffe (Zytokine) frei und fordert andere Immunzellen auf, "es zu sortieren". Töte T-Zellen sehr effizient.
Richtig, nicht sehr genau. Wir haben weit weniger TCR-Spezies als Antigene. Daher können T-Zellen viele Antigene an ihrem TCR erkennen, jedoch nur annähernd. Krebszellen nutzen diese Schwäche unseres Sicherheitssystems oft aus und geben vor, „ihre eigenen“ zu sein.
Die Evolution löste das Problem so gut sie konnte: Im menschlichen Körper gibt es einen anderen Mechanismus zur Identifizierung von Fremden:
Antikörper . Dies sind spezielle Proteine, die von einer anderen Klasse von Immunzellen ausgeschieden werden: B-Lymphozyten. B-Zellen haben im Gegensatz zu T-Zellen einen individuellen Ansatz für jeden „Kunden“.
Der Antikörper ist eine Proteinstruktur in Form des Buchstabens Y. An beiden Enden dieser „Gabel“ befinden sich Stellen, die an das Antigen binden. Diese Abschnitte können sich bei jeder nächsten Generation von Antikörpern ändern, um enger an das Antigen zu passen - wie bei der Auswahl der Puzzleteile. Wenn ein fremdes Antigen nachgewiesen wird, sezernieren B-Zellen Milliarden von Antikörpern, unter denen die genaueste Übereinstimmung mit dem Antigen ausgewählt wird. Das Ergebnis ist ein Referenzantikörper, der speziell für die sehr genaue Erkennung eines bestimmten „Alien“ -Antigens „trainiert“ wurde.
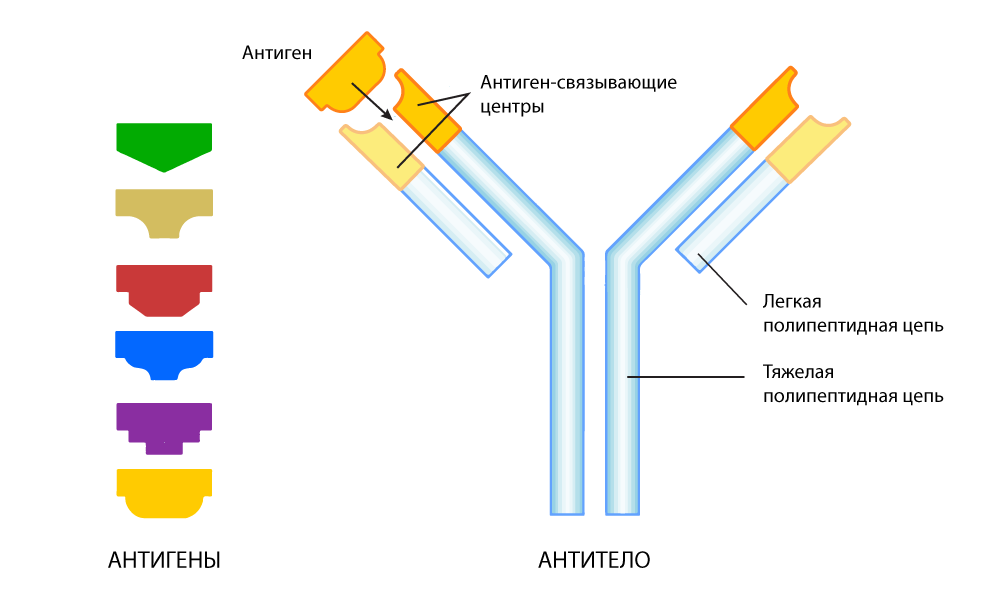 Ein Antikörper, der angepasst ist, um ein spezifisches Antigen zu finden
Ein Antikörper, der angepasst ist, um ein spezifisches Antigen zu findenErkennen bedeutet jedoch nicht immer Neutralisieren. Antikörper haben damit Schwierigkeiten - allein können sie keineswegs den gesamten „Feind“ zerstören.
1989 entwickelte ein israelischer Chemiker und Immunologe, Zelig Ashkhar,
eine Kombination aus der tödlichen Kraft der T-Zellen mit blinden Augen und dem Scharfschützenziel von Antikörpern. Er isolierte die terminalen Abschnitte von Proteinantikörpern, die fest an das Antigen bestimmter Krebszellen binden können, und "transplantierte" sie in die T-Zelle - sie ersetzten den Teil des TCR, der für die Erkennung von Antigenen verantwortlich ist.
Anschließend begann er mit einem amerikanischen Kollegen, Stephen Rosenberg, zusammenzuarbeiten. Es gelang ihnen, den chimären Rezeptor effizienter und selektiver zu gestalten.
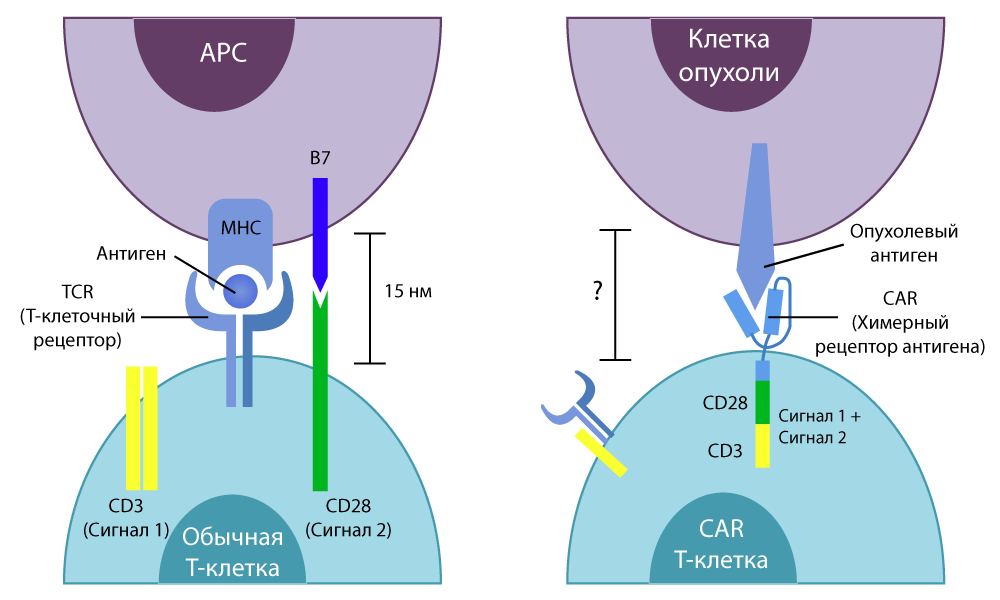 Der Unterschied zwischen herkömmlichen T-Zellen und CAR-T-Zellen
Der Unterschied zwischen herkömmlichen T-Zellen und CAR-T-ZellenIn-vitro-Studien haben gute Ergebnisse gezeigt. Dann behandelten die Wissenschaftler die Mäuse erneut und übertrugen die Technik sorgfältig auf den Menschen.
Im Laufe der Zeit hat die CAR-T-Therapie zu einem modernen Aussehen geführt.
- Zunächst werden mit Hilfe molekularmolekularer Tests spezifische Mutationen in menschlichen Tumorzellen bestimmt, auf die Antikörper „abgestimmt“ werden können.
- Dann nimmt eine Person ihre eigenen T-Zellen, verändert sich unter Verwendung von Bioengineering-Methoden, anstatt TCR CAR zu "transplantieren", abgestimmt auf die identifizierten Mutationen.
- Dann vermehren sich modifizierte CAR-T-Zellen in vitro und werden zurück in den menschlichen Körper eingeführt, wo sie Krebszellen erfolgreich erkennen und abtöten.
In den 2010 begonnenen klinischen Studien wurden sofort ermutigende Ergebnisse erzielt: Bei der Behandlung von Lymphomen zeigten 12 von 13 Patienten eine Besserung und 4 begannen mit der Remission. Bei der Behandlung von Leukämie trat bei 17 von 33 Personen eine Remission auf.
Im Jahr 2018 erschien in Nature Medicine
ein Artikel amerikanischer Onkologen, in dem berichtet wurde, dass sie seit zwei Jahren einen Patienten beobachten, der nach einer CAR-T-Therapie völlig gesund ist. Sie wurde von metastasiertem Brustkrebs mit Metastasen geheilt. Dieses Foto von ihr im Kajak ist am Anfang des Artikels zu sehen: Nach der Behandlung kehrte sie zur Arbeit zurück und ging zelten.
Neue Hoffnung. Wird die Immuntherapie ein Allheilmittel sein?Wie andere Krebsbehandlungen hat auch die Immuntherapie ihre Grenzen. Trotz der Tatsache, dass Patienten in einigen Fällen sehr gut auf die Therapie mit Inhibitoren des Immunkontrollpunkts ansprechen, entwickelt sich in 60% der Fälle entweder eine erworbene oder eine primäre Resistenz gegen Anti-PD-1- oder Anti-CTLA-4-Medikamente: Der Tumor spricht einfach nicht an zur Behandlung oder passt sich schnell an und lernt, es zu "umgehen".
Neben PD-1, PD-L1 / 2, CTLA-4, CD28 und B7 gibt es viele andere Co-Rezeptoren auf den Oberflächen von T-Zellen und Tumorzellen, deren Auswirkungen noch nicht untersucht wurden, sowie die Arbeit von Kontrollpunkten, aber sie beeinflussen auch auf die Immunantwort. Einer der Arbeitsbereiche ist die Wirkung auf diese Co-Rezeptoren.
Darüber hinaus wird die IKT-Therapie durch die Einführung von Impfstoffen, Zytokinen und Betablockern ergänzt - und dieser Ansatz funktioniert in
einigen Fällen auch gut.
Die CAR-T-Therapie ist immer noch extrem teuer und befindet sich noch im Stadium der kommerziellen Nutzung: In den wissenschaftlichen Gruppen von Eshhar und Rosenberg, anderen Forschern, sind Entwicklungen im Gange - jede der Gruppen entwickelt spezielle Arten von CAR-T mit einer gezielten Wirkung gegen eine bestimmte Krebsart. Bisher handelt es sich jedoch nur um Forschung, Prüfung und Erprobung. Es wird einige Jahre dauern, bis sich daraus eine etablierte Massenbehandlungsmethode entwickelt - aber selbst dann ist es nicht möglich, 100% ige Garantien zu geben.
Während Wissenschaftler forschen, führen Ärzte experimentelle Behandlungsschemata ein, die die bereits vorhandenen Errungenschaften nutzen. Der auffälligste Effekt ist die Kombination der Immuntherapie mit den klassischen „drei Säulen“ der Onkologie: Bestrahlung und Chemotherapie, Chirurgie. Durch die Kombination dieser Methoden werden immer Synergien erzielt: Gemeinsam arbeiten sie effizienter als wiederum.
Wenn bis jetzt Standard-Immuntherapeutika in die dritte, fünfte Zeile (dh die Wende) der Therapie aufgenommen wurden, verschreiben die Ärzte diese jetzt sofort zusammen mit einer Chemotherapie und einer Therapie mit gezielten monoklonalen Antikörpern: Solche Patienten zeigen häufig eine bessere Dynamik und am Ende länger leben.In Russland wurden bereits alle wichtigen Immunpräparate registriert. Das Problem ist jedoch, dass das Gesundheitsministerium für jeden von ihnen Beweise separat festlegt. Das heißt, in den ursprünglichen Anweisungen für das Medikament können beispielsweise neun verschiedene Krebsarten verschrieben werden, bei denen das Medikament verschrieben werden kann, und in unserem Land ist es nur für sechs von ihnen registriert. Und so mit jeder Droge. Infolgedessen sind etwa 50% der Tumoren noch nicht in dieser Liste enthalten. Dementsprechend kann ein Arzt im Rahmen der Behandlung der obligatorischen Krankenversicherung diese Medikamente möglicherweise nicht allen Patienten verschreiben.Darüber hinaus sind Ärzte staatlicher Haushaltskliniken streng auf Behandlungsprotokolle beschränkt. Und wenn im Protokoll die Kontrollpunktinhibitoren nur in drei Zeilen verschrieben werden, an dritter Stelle nach zwei Zeilen Standard- „Chemie“, dann hat der Arzt einfach nicht das Recht, sie zu verschreiben, selbst wenn er glaubt, dass dies dem Patienten hilft.Ein häufiges Problem ist der Mangel an Qualifikationen. Obwohl sich die Methode bewährt hat, ist sie für viele Ärzte im Land noch neu. Die Medikamente sind alle westlich und erreichen uns mit einer Verzögerung von 2-3 Jahren. Und da die Immuntherapie erst seit wenigen Jahren aktiv eingesetzt wird, haben viele noch keine Erfahrung mit ihnen. Darüber hinaus erfordert der Einsatz der Immuntherapie spezifische Kenntnisse.In der Privatmedizin sind wir nicht an das Budget gebunden. Wenn in "Medizin 24/7"Der Patient bezieht sich auf einen Tumor, für den noch kein Immuntherapeutikum registriert wurde. Wir schlagen vor, dass er sich einer molekulargenetischen Studie unterzieht. Den Ergebnissen zufolge wird klar, ob sein Tumor auf die Immuntherapie anspricht. In diesem Fall hat der Arzt das Recht, es zu verschreiben. Daher verwenden wir in unserem Krankenhaus eine Immuntherapie für fast alle Arten von Krebs - sie liefert sehr gute Ergebnisse. Sogar Patienten im Stadium III-IV zeigen eine Verbesserung. Immunpräparate geben uns die Möglichkeit, das Leben der Menschen zu verlängern, auch in Fällen, die als hoffnungslos galten.Sowohl in privaten als auch in öffentlichen Kliniken sind die Patienten selbst üblich. Sie verstehen nicht immer gut, was für eine Methode das ist, wie es funktioniert, daher das Misstrauen. Wir hoffen, dass dieser Artikel dazu beigetragen hat, zu verstehen und zu verstehen, dass die Immuntherapie heute zu Recht im Mittelpunkt der Aufmerksamkeit der Onkologen steht. Nach den Ergebnissen zu urteilen, ist sie bereits bereit, mit klassischen Methoden auf einer Ebene zu stehen. Die schreckliche Krankheit wird einen Schritt weiter zurückgehen.