Mitte 2018 wurde die
Arbeit zur Elektrophysiologie des Gehirns von Ratten
veröffentlicht , zusammen mit einem
einzigen Datensatz, der öffentlich zugänglich gemacht wurde. Der Datensatz ist insofern einzigartig, als er simultane Aufzeichnungen des lokalen Feldpotentials unter Verwendung einer neuen
Neuropixel- Elektrode mit hoher Dichte (Sonde oder Sonde) und einer Patch-Elektrode aus einer Zelle in der Nähe der Probe enthält. Das Interesse an solchen Aufzeichnungen ist nicht nur grundlegend, sondern wird auch angewendet, da Sie damit Modelle für die Analyse der von modernen Proben aufgezeichneten neuronalen Aktivität validieren können. Dies steht wiederum in direktem Zusammenhang mit der Entwicklung neuer Neuroprothesen. Was ist die grundlegende Neuheit und warum dieser Datensatz so wichtig ist - ich werde es Ihnen unter dem Strich sagen.
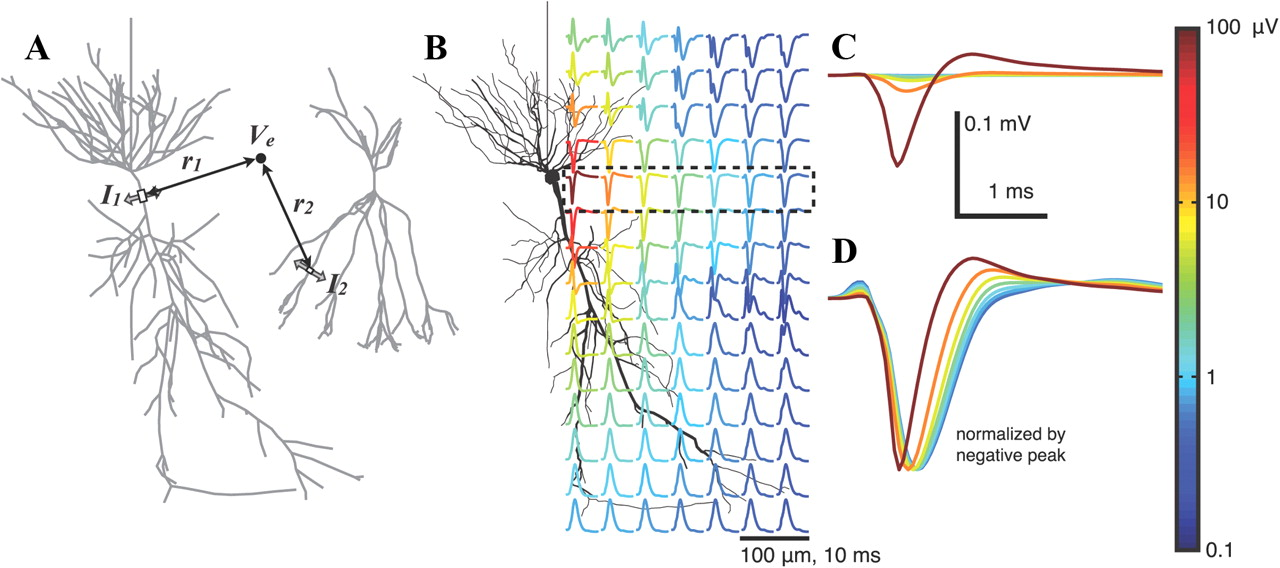 KDPV: Das Ergebnis der Modellierung des extrazellulären Potentials in der Nähe eines Neurons während der Erzeugung des Aktionspotentials ( Quelle ). Die Farbe gibt die Amplitude des Potentials an. Diese Abbildung ist wichtig für das weitere Verständnis.Elektrophysiologische Methoden zur Untersuchung des
KDPV: Das Ergebnis der Modellierung des extrazellulären Potentials in der Nähe eines Neurons während der Erzeugung des Aktionspotentials ( Quelle ). Die Farbe gibt die Amplitude des Potentials an. Diese Abbildung ist wichtig für das weitere Verständnis.Elektrophysiologische Methoden zur Untersuchung des Gehirns basieren auf der Erfassung des elektrischen Potentials des Gehirns. Sie können in nicht-invasive - hauptsächlich Elektroenzephalographie (EEG) - und invasive unterteilt werden, z. B. Elektrokortikographie (EKG), Patch-Clamp (Patch-Clamp) oder Registrierung des lokalen Feldpotentials (LPP = Local Field Potentials, LFP). . Für letztere wird eine kleine Elektrode mit einer Größe von 10 bis 100 Mikrometern direkt in das Gehirn injiziert und ihr Potential aufgezeichnet. Um die Aktivität des Gehirns von Säugetieren auf zellulärer Ebene zu untersuchen, d. H. Um die Aktivität einzelner Zellen zu messen, können die verfügbaren nicht-invasiven Methoden nicht angewendet werden, da das Potential einer Zelle im Weltraum sehr schnell abfällt, buchstäblich für 100 μm (siehe KDPV). Daher liefern nicht-invasive Methoden in jedem Tiermodell sowie beim Menschen nur Informationen über die kollektive Aktivität von Neuronen und arbeiten höchstwahrscheinlich auf Gewebeebene, nicht jedoch auf einzelnen Neuronen.
Aber mit invasiven Methoden ist das nicht so einfach. Um die Aktivität eines Neurons zu registrieren, ist es notwendig, die Elektrode sehr nahe an das Neuron heranzuführen, sie idealerweise in der Zelle zu platzieren, wie dies in der Patch-Klemme geschieht, oder
scharfe Elektroden zu verwenden , was in der Praxis schwierig und sehr schwierig ist. Andererseits zeichnet jede extrazelluläre Elektrode mit einer Größe von ~ 10 μm aufgrund der hohen Dichte von Neuronen und der hohen Ionenleitfähigkeit der extrazellulären Lösung Aktionspotentiale von 5 bis 10 Zellen auf. Daher wird die Aufgabe der Registrierung einzelner Zellen technisch gelöst, indem die Dichte der in der Nähe der Zelle befindlichen Elektroden erhöht wird. In dieser Hinsicht bewegt sich die moderne Elektrophysiologie in Richtung einer Zunahme der Elektrodendichte, einer Zunahme ihrer Anzahl und einer Abnahme der Größe. Unter den Anforderungen besteht die Notwendigkeit, das Signal näher an der Registrierungsstelle zu verstärken, um das Rauschen zu verringern, und einen Multiplexer zu platzieren, um die Größe zu verringern. So wurde es 2016 in einem Preprint angekündigt und 2017 in Nature veröffentlicht. 2018 erschien bereits eine neue hochdichte Neuropixel-Probe mit CMOS-Technologie auf 960 Elektroden, von denen 384 für die gleichzeitige Aufzeichnung verfügbar sind. Die Größe einer Registrierungsstelle beträgt 12 Mikrometer. Die Dicke der Probe beträgt 24 Mikrometer. Darüber hinaus begannen die Menschen mit hochdichten Elektroden sowie mit aktiver Verstärkung lange Zeit zu arbeiten, aber Neuropixel waren die ersten, die Produktion und Vertrieb erreichten, so dass dieser spezielle Test in Artikeln in naher Zukunft immer mehr zu finden sein wird.
 Abb. Neuropixel-Schema. Auf einem monolithischen Siliziumsubstrat befinden sich 960 Stellen sowie ein vollständiger Multiplexer und eine AD-Schnittstelle für 384 Kanäle.
Abb. Neuropixel-Schema. Auf einem monolithischen Siliziumsubstrat befinden sich 960 Stellen sowie ein vollständiger Multiplexer und eine AD-Schnittstelle für 384 Kanäle.Datenstruktur
Neben den klassischen
Aktivitätsrhythmen (Alpha, Beta, Gamma usw.), die für die Gruppensynchronisation verantwortlich sind, enthalten die mit solchen Proben erhaltenen Daten auch die Aktionspotentiale einzelner Zellen (AP = Aktionspotentiale, AP, Spikes, Adhäsionen). , die in der Aufzeichnung wie kurze Spitzen mit einer Dauer von ~ 1 ms aussehen.
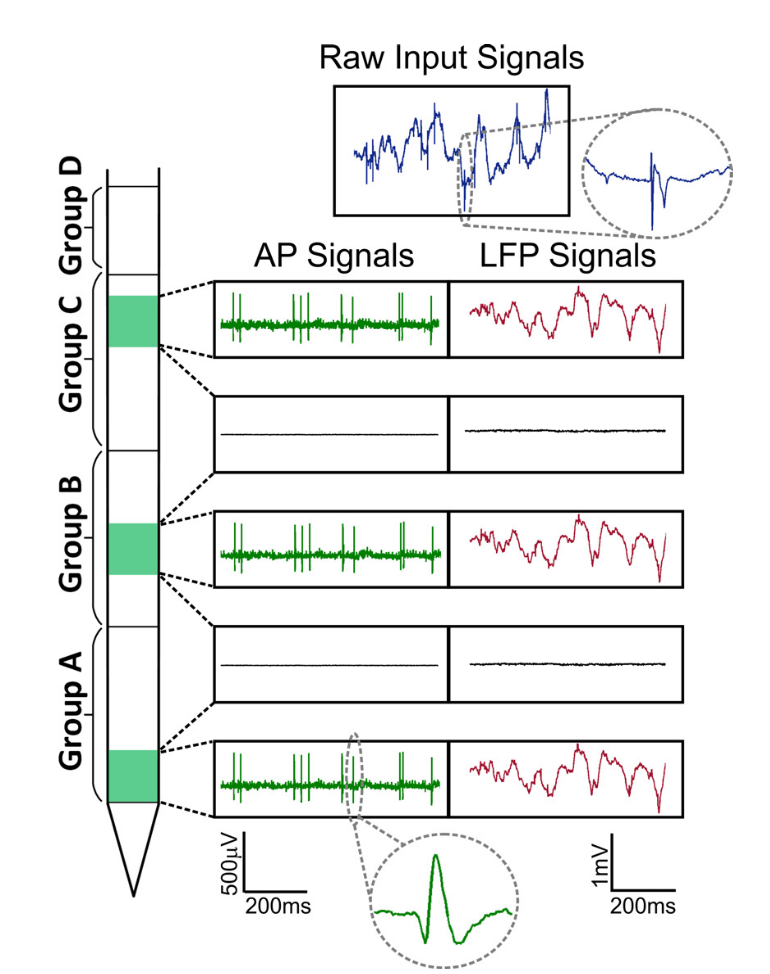 Abb. Signale Neuropixel. Es werden zwei Teile des Signals unterschieden: lokales Feldpotential (LFP, bis ~ 300 Hz) und zelluläre Aktivität (AP, ab 300 Hz).
Abb. Signale Neuropixel. Es werden zwei Teile des Signals unterschieden: lokales Feldpotential (LFP, bis ~ 300 Hz) und zelluläre Aktivität (AP, ab 300 Hz).Wenn gleichzeitig das niederfrequente lokale Feldpotential üblicherweise im Rahmen von Schwingungen analysiert wird und die Spektral- oder Wavelet-Analyse wie im EEG verwendet wird, enthält die zelluläre Aktivität die Aktionspotentiale einzelner Zellen, sie besteht aus diskreten Ereignissen vor dem Hintergrund von Rauschen. Die Aufgabe, die Aktivität einzelner Zellen formal zu isolieren, reduziert sich auf die Aufgabe eines Cocktailparty-Problems, wenn ein separater Sprecher von der Gruppe der Sprecher unterschieden werden soll. Big Data wird angezeigt, wenn wir den Datenfluss aus einer solchen Stichprobe bewerten. Zur Analyse von Spitzen wird die Abtastung bei 30–40 kHz mit Digitalisierung von 16 Bit pro Punkt (uint16) durchgeführt, sodass das Aufzeichnen von bereits 100 Elektroden innerhalb von 1 Sekunde ab 8 MB wiegt. Gleichzeitig dauern Experimente normalerweise Stunden, was Hunderten von Gigabyte von nur einem Arbeitstag entspricht, und für eine vollständige Studie, beispielsweise von 10 solchen Aufzeichnungen. Daher hängt das Potenzial dieser Stichprobe auch stark von Algorithmen für maschinelles Lernen ab, die für die Datenanalyse verwendet werden.
Maschinelles Lernen und zelluläre Aktivität
Typischerweise besteht eine Pipline für die Analyse der Zellaktivität aus Vorverarbeitung, Spike-Segmentierung und Clustering. Dieser Teil der Forschung wird allgemein als Clusteranalyse oder Spike-Sortierung bezeichnet. Als Vorverarbeitung wird normalerweise eine Tiefpassfilterung (> 300 Hz) verwendet, da angenommen wird, dass es keine anderen physiologischen Rhythmen über 300 Hz gibt und nur Informationen über die individuelle Zellaktivität übrig bleiben. Während der Vorverarbeitung in dichten Proben ist es auch möglich, das korrelierte Rauschen zu reduzieren, beispielsweise bei Tonabnehmern mit 50 Hz. Die Segmentierung wird meistens als einfacher Schwellenwert angesehen. Beispielsweise kann alles über 5 Standard-Rauschabweichungen als Ereignis betrachtet werden. Es kommt vor, dass die Segmentierung mit zwei Schwellenwerten mit einem weichen und einem harten Schwellenwert verwendet wird, um verwandte Ereignisse in Raum und Zeit zu unterscheiden, wie beim Algorithmus zur
Segmentierung von Wassereinzugsgebieten. Nur beim Cluster-Clustering berücksichtigt die Verteilung der Marker die Probentopologie. Nach der Segmentierung wird ein Fenster mit einer Dauer von 1 bis 2 ms nahe der Mitte jedes Ereignisses aufgenommen, und das Signal in diesem Fenster, das von allen Kanälen gesammelt wird, wird zu einer Probe für die weitere Clusterbildung. Dieses Beispiel wird als Spike-Wellenform bezeichnet. Unterschiedliche Zellen und ihre unterschiedliche Entfernung von der Registrierungsstelle führen dazu, dass ihre Wellenformen variieren (siehe KDPV). Der Wellenform-Clustering-Algorithmus selbst verwendet EM, Template-Match-Suche, Deep Learning und viele Variationen (
Thema auf Github ). Die einzige Voraussetzung ist eine Ausbildung ohne Lehrer. Es gibt jedoch ein Problem. Niemand weiß genau, welche Parameter Sie für Ihre Pipeline verwenden müssen, damit die Analyse am effektivsten ist. Normalerweise geht der Analyst nach dem Clustering die Ergebnisse manuell durch und nimmt nach eigenem Ermessen Änderungen vor. Somit können die Ergebnisse der Analyse sowohl Algorithmusfehler als auch menschliche Fehler enthalten. Und sie sind möglicherweise nicht, daher bleibt die Frage der objektiven Validierung offen.
Es gibt verschiedene Möglichkeiten, eine Pipeline zu validieren. Erstens, Änderung der äußeren Bedingungen für das Untersuchungsobjekt. Wenn Sie beispielsweise während eines Experiments die visuellen Teile des Kortex untersuchen, können Sie die Textur, Farbe und Helligkeit des Bildes ändern. Wenn es in der Analyse eine Zelle gibt, die ihre Aktivität abhängig vom Stimulus ändert, haben Sie Glück. Zweitens können Sie die Aktivität eines bestimmten Zelltyps pharmakologisch steigern oder verringern, beispielsweise mithilfe bestimmter Kanalblocker. Dann nimmt die Aktivität Ihrer Zelle zu / ab und Sie sehen den Unterschied in der Clusterbildung. Eine solche Modulation der Aktivität führt jedoch auch zu Änderungen der Wellenformen, da das Profil des zeitlichen Aktionspotentials vollständig durch die Kinetik der Ionenkanäle bestimmt wird. Drittens können Sie die Aktivität bestimmter Zellen optogenetisch oder mithilfe einer Patch-Pipette wie in diesem Datensatz messen oder induzieren. Aufgrund des großen Signal-Rausch-Verhältnisses und der Stabilität der Patch-Elektrode können Sie sich auf die Aktivität einer einzelnen Zelle verlassen. Konzeptionell war die Veröffentlichung der Zusammenstellung eines validierenden Datensatzes unter Verwendung einer Patch-Klemme gewidmet.
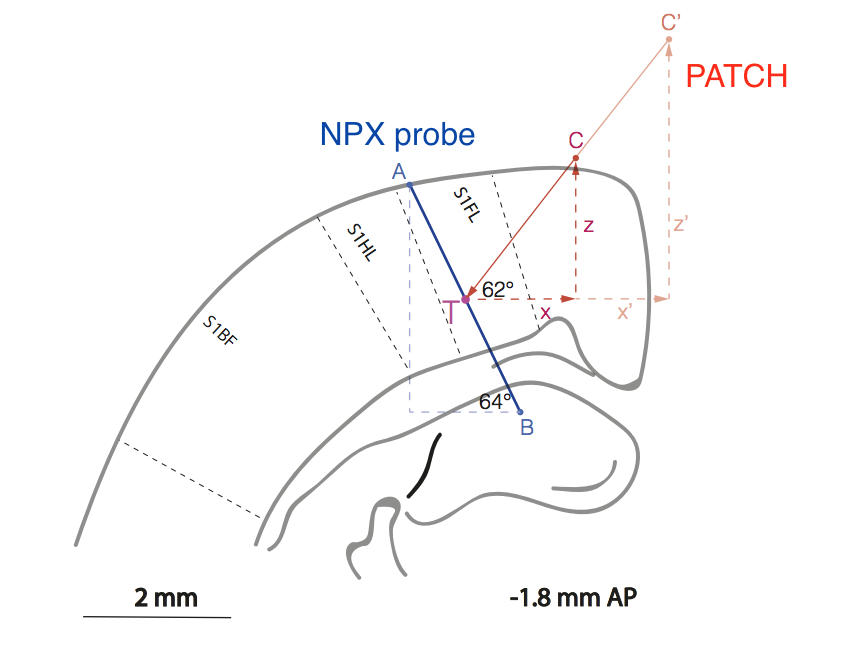 Abb. Schematische Darstellung der relativen Position der Probe (Linie AB) und der Patch-Pipette (Linie C'CT) in der Rattenkortexregion, die für die Verarbeitung sensorischer Informationen aus der Vorderpfote verantwortlich ist (S1FL = sensorisches Kortex 1 Vorderbein).
Abb. Schematische Darstellung der relativen Position der Probe (Linie AB) und der Patch-Pipette (Linie C'CT) in der Rattenkortexregion, die für die Verarbeitung sensorischer Informationen aus der Vorderpfote verantwortlich ist (S1FL = sensorisches Kortex 1 Vorderbein).Die methodische Arbeit ist natürlich äußerst schwierig, da die Experimentatoren eine Methode zur gegenseitigen Anordnung von zwei Elektroden in der Großhirnrinde ohne visuelle Kontrolle mit einer Genauigkeit von ~ 10 μm entwickeln mussten.
Die Auswirkung der Elektrodendichte auf die Spike-Clusterbildung
Warum ist es so wichtig, die Dichte der Registrierungsseiten zu erhöhen? Für eine Analogie nehmen wir die unter EEG-Forschern bekannte Tatsache an, dass ab einem bestimmten Schwellenwert eine Zunahme der Anzahl von Elektroden in der Kappe nicht zu einer merklichen Zunahme der empfangenen Informationen führt, d. H. Das Signal von der Elektrode unterscheidet sich geringfügig von der linearen Interpolation von Signalen von benachbarten Elektroden. Jemand sagt, dass diese Schwelle bereits bei 30 erreicht ist, jemand bei 50, jemand bei 100 Elektroden. Wer im Detail mit EEG arbeitet, kann korrigiert werden. Im Falle der Zellaktivität ist der Schwellenwert für die Dichte der Registrierungsstellen auf einer Probe jedoch noch nicht bekannt, so dass die Rasse der Proben mit hoher Dichte weitergeht. Zu diesem Zweck arbeitet das Kampff Lab-Team weiterhin mit einer Probe mit einer
5 ×
5 μm
2- Stelle, für die
vorläufige Daten veröffentlicht wurden. Spezialisten, die mit dichten Elektroden arbeiten, teilen ihre Erfahrung mit, dass unerwarteterweise die spezifische Anzahl einzelner Zellen, die aus Proben desselben Bereichs isoliert werden können, höher ist, wenn die Dichte der Registrierungsstellen höher ist. Dieser Effekt wird in einer
anderen Studie derselben Co-Autoren gut veranschaulicht, die nur einen Teil der Stellen aus einer dichten Probe künstlich auswählten und die Qualität der resultierenden Cluster nach tSNE-Umwandlung in PCA-Werte aus Wellenformspitzen visuell bewerteten. Dies ist kein Kanon für Clustering, aber gut zur Veranschaulichung von Abhängigkeiten. Als Test wirkte Neuroseeker auf 128 Kanäle mit einer Gesamtgröße von 700 × 70 & mgr; m
2 mit einer Stelle von 20 × 20 & mgr; m
2 .
 Abb. TSNE über PCA-Diagramme auf Rohwellenformen, während die Dichte der Stellen auf der Probe künstlich reduziert wird. Die Arbeitsstätten werden schematisch über jedem Diagramm angezeigt. Es wird deutlich gezeigt, wie genau die Anzahl der getrennten Cluster mit zunehmender Standortdichte wächst. A ist das Beste, F ist das Schlechteste.
Abb. TSNE über PCA-Diagramme auf Rohwellenformen, während die Dichte der Stellen auf der Probe künstlich reduziert wird. Die Arbeitsstätten werden schematisch über jedem Diagramm angezeigt. Es wird deutlich gezeigt, wie genau die Anzahl der getrennten Cluster mit zunehmender Standortdichte wächst. A ist das Beste, F ist das Schlechteste.Was ist das Wesentliche der Arbeit?
In den Daten von Marques-Smith et al. Es erfolgt die gleichzeitige Aufzeichnung der Patchklemme und der Proben. Mithilfe von Patchclamp-Daten fanden Wissenschaftler Momente mit Aktionspotentialen und verwendeten diese Momente, um bereits auf der Probe vorhandene Wellenformen zu segmentieren und zu mitteln. Infolgedessen konnten sie zeitlich und räumlich sehr hochwertige Verteilungen des Aktionspotentials über den gesamten Probenbereich erstellen.
 Abb. Links werden Spuren der Zellaktivität gleichzeitig im Patch-Clip (schwarz) und auf dem nächsten Neuropixel-Kanal (blau) angezeigt. In der Mitte - 500 Einzelproben und deren Mittelung. Rechts ist die Verteilung des Aktionspotentials im Raum über den Probenbereich und in der Zeit.
Abb. Links werden Spuren der Zellaktivität gleichzeitig im Patch-Clip (schwarz) und auf dem nächsten Neuropixel-Kanal (blau) angezeigt. In der Mitte - 500 Einzelproben und deren Mittelung. Rechts ist die Verteilung des Aktionspotentials im Raum über den Probenbereich und in der Zeit.Als nächstes wird die Frage nach der Variation der extrazellulären Wellenform von Spitze zu Spitze aufgeworfen - ja, sie ist fühlbar und muss berücksichtigt werden. Dann zeigen sie, dass es grundsätzlich möglich ist, die Verteilung des Aktionspotentials entlang der Zellmembran mit ihren dichten Elektroden zu verfolgen, aber dies wurde bereits früher in der Arbeit anderer Gruppen gezeigt. Zusammenfassend bieten sie potenziellen Mitarbeitern einige grundlegende Fragen aus der Neurophysiologie, die Sie mithilfe ihres Datensatzes beantworten können, und bieten an, den Datensatz zur Validierung der Pipelines für die Clusterbildung von Zellaktivität zu verwenden. Letzteres klingt nach einer gewagten Herausforderung, da es derzeit viele Clustering-Algorithmen gibt und die Konkurrenz zwischen den Methoden sehr groß ist. Zum einen funktioniert nicht jede Methode mit einer so großen Anzahl von Kanälen, und zum anderen kann nicht jeder objektiv qualitativ hochwertige Clustering durchführen.
Was weiter
Erstens
nähert sich eine neue Version von
Neuroseeker auf 1300 Kanälen, die ebenfalls CMOS-Technologien verwendet. Vorläufige Daten sind
bereits verfügbar .
Zweitens warten wir auf einen weiteren Datensatz, der bereits vom Allen Institute for Brain Science stammt und auf der FENS-Konferenz 2018 angekündigt wurde. Gleichzeitig werden 4 (!) Neuropixel-Proben verwendet, um die visuellen Abschnitte der Mausrinde mit verschiedenen visuellen Reizen zu untersuchen. Sie versprachen, Ende 2018
hier neben den Biphotonendaten (ebenfalls ein sehr leistungsfähiger Datensatz) zu veröffentlichen, aber bisher nichts.
Drittens erscheint mir die Aufgabe, Zellen aus der Erfassung des extrazellulären Potentials zu gruppieren, ästhetisch schön. Es konvergiert die Methoden der Mikroelektronik, Neurophysiologie und des maschinellen Lernens. Darüber hinaus hat es einen großen fundamentalen und angewandten Wert. Ich nehme an, dass das Publikum des Habr daran interessiert sein wird, etwas über die technische Küche der Elektrophysiologie zu lernen, nämlich über Clustering-Algorithmen, da in diesem Bereich bereits ein eigener Zoo entwickelt wurde. Ich habe wiederum mehrere Fragen zu diesen Algorithmen gesammelt, und ein solcher Datensatz kann nicht übersprungen werden. Daher werden wir im nächsten Teil mit der Analyse einiger Algorithmen fortfahren, beginnend mit dem kanonischen Klustakwik, weiter mit den Vorlagenmethoden Kilosort oder Spyking Circus und dann YASS, das sich sehr stark als schneller und besser als alle anderen
deklariert , weil DL und weil es kann. Thema auf Github mit einer Liste einiger Clusterer
hier . Da ich einige Fragen vorwegnehme, sehe ich keinen Sinn darin, meinen eigenen Algorithmus zu entwickeln, da die Konkurrenz bereits sehr groß ist und viele Ideen bereits von anderen umgesetzt und getestet wurden. Aber wenn es Draufgänger gibt, werde ich gerne dazu beitragen.
Vorschläge und Wünsche werden akzeptiert. Vielen Dank für Ihre Aufmerksamkeit!