Der Einsatz künstlicher Intelligenz bei Diagnosen steht vor der Tür. Und noch näher als es klingt. Tatsächlich gelang es sofort zwei Forschungsteams auf beiden Seiten des Atlantiks, das Problem der „Black Box“ der KI in der Medizin zu lösen.
Das Problem mit der Black Box besteht darin, dass das KI-System bei der Übermittlung der Ergebnisse und in der Medizin die Diagnose und Empfehlung einer weiteren Therapie nicht die Begründung liefert, die insbesondere die US-amerikanische Food and Drug Administration (FDA) erfordert. .
Im Dezember letzten Jahres berichtete das Massachusetts General Hospital (Massachusetts General Hospital), dass es AI beibringen könne, die Diagnose intrakranieller Blutungen zu "erklären". Fünf Monate zuvor hatte das britische Unternehmen DeepMind, das 2014 von Google übernommen wurde, einen ähnlichen Durchbruch bei der Diagnose von Augenkrankheiten angekündigt.
Die Hauptaufgabe beider Teams bestand darin, dem System beizubringen, die Bilder von Scannern auszuwerten und Entscheidungen zu treffen, wie es ein Facharzt tut.
Atlas der Zeichen
Ärzte der Radiologie-Abteilung des Massachusetts Hospital entwickelten zusammen mit Doktoranden von Harvard Engineering and Applied Sciences ein KI-Modell, mit dem intrakranielle Blutungen klassifiziert werden können. Dies geht aus einer Pressemitteilung auf der Website des Krankenhauses hervor. Um das System zu trainieren, verwendete das Team 904 CT-Scans (Computertomographie), von denen jedes etwa 40 Einzelbilder enthielt. Ein Team von fünf Neuroradiologen markierte jedes der Bilder auf das Vorhandensein eines von fünf Subtypen von Blutungen, basierend auf dem Ort sowie das Fehlen von Blutungen an sich. Um die Genauigkeit dieses Deep-Learning-Systems zu verbessern, hat das Team Aktionen integriert, die den Prozess der Bildanalyse durch einen Radiologen nachahmen. Dazu gehören das Anpassen von Parametern wie Kontrast und Helligkeit, um verborgene Unterschiede aufzudecken, und das Scrollen benachbarter Abschnitte des CT-Scans, um festzustellen, ob tatsächlich etwas aufgetreten ist spiegelt in einem Bild ein echtes Problem wider oder spricht es nicht von Verzerrungen.
Unmittelbar nach der Erstellung des Systemmodells testeten die Forscher es mit zwei getrennten Sätzen von CT-Scans: 100 Scans mit intrakranieller Blutung und 100 ohne, die vor der Entwicklung des Systems durchgeführt wurden, und 79 Scans mit Blutung und 117 ohne es, die nach der Erstellung des Modells erstellt wurden. Im Fall des ersten zuvor aufgenommenen Datensatzes war das Modell bei der Bestimmung und Klassifizierung von intrakraniellen Blutungen auf der vom Radiologen durchgeführten Analyseebene genau. Bei der Analyse des zweiten Satzes hat sie bewiesen, dass er sogar besser sein kann als eine Person, die kein Experte auf diesem Gebiet ist.
Um das „Black-Box“ -Problem zu lösen, ließ das Team das System die Bilder überprüfen und aus dem Trainingsdatensatz speichern, die die charakteristischen Symptome für jeden der fünf Subtypen von Blutungen am deutlichsten darstellen. Unter Verwendung dieses Atlas von Unterscheidungsmerkmalen kann das System eine Gruppe von Bildern darstellen, die der bei der Analyse von CT-Scans verwendeten ähnlich sind, um zu erklären, aus welchen Gründen Entscheidungen getroffen wurden.
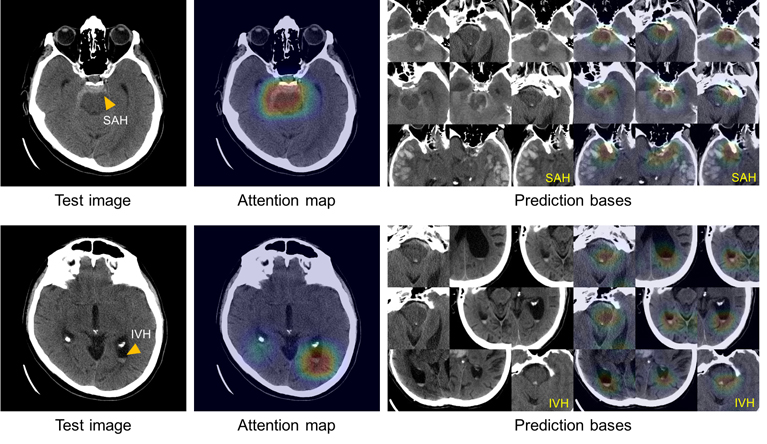
Diese Abbildung zeigt die Fähigkeit des Systems, die Diagnose von Subarachnoidalblutungen (oben links) und intraventrikulären (unten links) zu erklären, und zeigt Bilder mit ähnlichen Symptomen (rechts) aus dem Atlas der Bilder, die zum Trainieren des Systems verwendet wurden.
"Die schnelle Erkennung einer intrakraniellen Blutung, gefolgt von einer sofortigen angemessenen Behandlung von Patienten mit Symptomen eines akuten Schlaganfalls, kann schwerwiegende gesundheitliche Auswirkungen minimieren und den Tod verhindern", sagte der Mitautor der Studie, der Radiologe Michael Leo. - In vielen Labors gibt es keine speziell ausgebildeten Neuroradiologen, insbesondere nachts oder am Wochenende. Daher müssen Nichtfachleute entscheiden, ob die Symptome des Patienten durch Blutungen verursacht werden oder nicht. Die Verfügbarkeit einer zuverlässigen „virtuellen Zweitmeinung“, die von Neuroradiologen geschult wurde, könnte die Ergebnisse von Nichtfachleuten verbessern und dazu beitragen, dass die Patienten die richtige Behandlung erhalten. “
Gewebesegmentierungskarte
Im August 2018 veröffentlichte das britische Unternehmen DeepMind eine Studie über die Naturmedizin-Ressource, in der es erklärte, das „Black-Box“ -Problem durch die Entwicklung eines KI-Modells gelöst zu haben, das auf professioneller medizinischer Ebene funktionieren könnte, das jedoch Menschen nicht vom Behandlungsprozess ausschließt, sondern im Gegenteil hilft Ärzten, effektiver zu sein, wie im oben beschriebenen Fall.
Einer veröffentlichten Studie zufolge arbeitete das DeepMind-Team im Bereich der Augenkrankheiten in Zusammenarbeit mit dem Moorfields Eye Hospital im Zentrum für die Bekämpfung von Augenkrankheiten und entwickelte ein Modell für die Diagnose von 3D-Bildern der optischen kohärenten Tomographie (OCT). Es war möglich, die „Black Box“ zu öffnen, indem zwei separate neuronale Netze erstellt wurden, die zusammenarbeiten. Die erste, die Segmentierung unter Verwendung der dreidimensionalen Faltungsarchitektur (U-Net), transformiert die rohen OCT-Scans in eine Segmentierungskarte des Augengewebes. Für das Training wurden 877 klinische OCT-Scans verwendet, von denen jeder 128 Abschnitte aufwies. Nur drei Vertreter wurden manuell segmentiert. Das Segmentierungsnetzwerk findet verschiedene Symptome (Blutungen, fokale Läsionen usw.) und erstellt eine Karte. Laut Mustafa Suleiman, Leiter Applied AI, auf dem Blog des Unternehmens, können Optiker auf diese Weise darauf zugreifen, wie das System „denkt“.
Das zweite neuronale Netzwerk, das klassifiziert, die vorgeschlagene Karte analysiert und dem behandelnden Personal Diagnosen und Behandlungsempfehlungen bereitstellt. Die Entwickler halten es für grundlegend wichtig, dass das Netzwerk Empfehlungen als Prozentsätze anzeigt, damit Ärzte das "Vertrauen" des Systems in seine Analyse bewerten können. „Diese Funktion ist von entscheidender Bedeutung, da Augenoptiker eine Schlüsselrolle bei der Entscheidung über die Behandlung spielen, die Patienten erhalten“, sagt Mustafa Suleiman. Ihm zufolge ist das Hauptmerkmal des Systems, das es in der Praxis nützlich macht, die Möglichkeit für Ärzte, die Empfehlungen der KI sorgfältig zu studieren. Das System soll dazu beitragen, einen vollständigen Verlust des Sehvermögens zu verhindern, indem die Diagnose von Krankheiten wie diabetischer Retinopathie, altersbedingter Makuladegeneration und mehreren Dutzend anderer Krankheiten beschleunigt wird.

Beschreibung der Abbildung. Abrufen von Berechnungen mithilfe eines Komplexes aus Segmentierung und Klassifizierung von Netzwerken. Die Abbildung zeigt, wie ein Komplex aus 5 Stichproben eines segmentierten Netzwerks und 5 Stichproben eines Klassifizierungsnetzwerks zusammen verwendet wird, um 25 Vorhersagen für einen Scan zu erstellen. Jedes segmentierte Beispielnetzwerk liefert zunächst eine segmentierte Karte von Annahmen, die auf dem untersuchten ÜLG basieren. Für jede der fünf Annahmen geben die Muster des Klassifizierungsnetzwerks die Wahrscheinlichkeit für jeden Marker an. Hier wird der Marker für den Ort der Atrophie detailliert dargestellt.
Beide Forschungsteams äußern die Hoffnung, dass die von ihnen entwickelten Systeme Ärzte nicht ersetzen, sondern ihnen helfen, Entscheidungen effektiver zu treffen, was bedeutet, dass sie in kurzer Zeit mehr Patienten helfen werden. Der nächste Schritt besteht darin, Entwicklungen direkt in Krankenhausscannern zu verwenden.