
Es war einmal ein Großvater und eine Frau. Und sie hatten ein Ryaba-Huhn. Das Huhn legte einen Hoden, aber keinen einfachen, sondern einen gentechnisch veränderten. Eine unerwartete Wendung, richtig? Aber genau das wird heute diskutiert. Arzneimittel haben sich in den letzten zehn oder sogar Hunderten von Jahren stark verändert. Wir verwenden keine Blutegel mehr und betrachten die Lobotomie nicht als hervorragendes Mittel gegen Migräne. Jetzt gibt es sehr viele Medikamente, die eine Vielzahl von Krankheiten heilen können. Die Basis dieser Medikamente sind natürlich bestimmte chemische Verbindungen, deren Herstellung manchmal mit großen Schwierigkeiten verbunden ist. Und dann kamen die Wissenschaftler auf eine brillante Idee - warum brauchen wir all diese komplexen Bio-Generatoren, wenn Sie Hühner verwenden können. Ja, Sie haben richtig gehört, es sind die Hühner, die die Eier tragen, die die notwendigen chemischen Verbindungen wie Proteine enthalten. Wie Wissenschaftler Hühner verändert haben, um diese Ziele zu erreichen, was daraus wurde und ob wir keine Angst haben sollten, den Planeten mit zwei Meter langen fleischfressenden gentechnisch veränderten Hühnern zu erobern, erfahren wir aus dem Bericht der Forschungsgruppe. Lass uns gehen.
StudienbasisEs lohnt sich, damit zu beginnen, dass die Verwendung von Tieren als Bioreaktoren nichts Revolutionäres ist. Zum Beispiel wurde Antithrombin III - ein Medikament, das aus Milch gentechnisch veränderter (GM) Ziegen gewonnen wurde, 2006 zur Verwendung zugelassen. Mit anderen Worten, die Ziegen fungierten als "Labor", das Milch produzierte, einschließlich der in der Zubereitung verwendeten chemischen Verbindung.
Laut Wissenschaftlern ist die Verwendung von Großtieren für solche Zwecke jedoch angesichts der geringen Anzahl von Nachkommen, einer langen Tragzeit und des anschließenden Erwachsenwerdens usw. recht kostspielig. Deshalb haben sie ihre Aufmerksamkeit auf Hühner gerichtet und auch darauf, dass Hühnereier eine ausreichende Menge an Protein enthalten. Das durchschnittliche 60 g Hühnerei enthält ungefähr 3,5 Gramm Protein. In einem Jahr kann eine Henne etwa 300 Eier legen. Fügen Sie die billige Haltung von Hühnern und das schnelle Wachstum der Anzahl unter normalen Bedingungen hinzu.
Neben wirtschaftlichen Vorteilen stellen Wissenschaftler auch wissenschaftlichere fest. Bei Hühnern und Menschen sind die Glykosylierungsmuster, der Prozess der Zugabe von Zucker zu organischen Molekülen, sehr eng. Dies bedeutet, dass Eiproteinpräparate, deren Aktivierung eine Glykosylierung erfordert, eine geringe Immunogenität aufweisen.
All dies klingt sehr, sehr interessant, aber wir wissen, dass Hühnereier bisher eher für Omeletts als als Quelle für medizinische Grundlagen verwendet werden. Das heißt, die Hühner in dieser Studie sind nicht einfach (nein, nicht Gold, obwohl es aus finanzieller Sicht sein kann) und genetisch verändert.
Wissenschaftler stellen fest, dass früher Lentiviren verwendet wurden, um Modifikationen von Hühnergenen durchzuführen, da sie genetische Informationen perfekt auf die Wirtszelle übertragen. Die Transgenexpression kann im Eileiter unter Verwendung der Ovalbumin-Gensequenz (Eialbuminalbumin) begrenzt werden. Dieses Verfahren ermöglichte die Erzeugung von zwei biologisch aktiven Proteinen in Eiprotein, jedoch lag das Expressionsniveau signifikant unter 1 g / l. Und dies reicht nicht aus, um eine solche Technik aus kommerzieller und industrieller Sicht attraktiv zu machen.
In dieser Studie beschlossen die Wissenschaftler, eine fortschrittlichere Methode zur Herstellung von zwei neuen Proteinen, einschließlich eines Cytokin-Dimers, sowie eine verbesserte Reinigungsmethode zu implementieren. Als Modell wurde Interferon α2a verwendet, ein patentiertes biologisches Präparat zur Behandlung bestimmter Formen von Krebs und Hepatitis (bereits veraltet).
Der Hauptteilnehmer an der Studie war der Makrophagenkolonie-stimulierende Faktor (CSF1), der ein 4-helikales Bündel ist, d. H. Er ist strukturell vielen Zytokinen ähnlich, einschließlich Insulin, Wachstumshormon, Plazenta-Laktogen usw. Nun, der Hauptproduzent in der Studie sind Hühner. Welche Ergebnisse durch Experimente gezeigt wurden, werden wir weiter betrachten.
Forschungsergebnisse Bild Nr. 1
Bild Nr. 10,5 TPN (tausend Paare von Nukleotiden / tausend gepaarte Basen) der codierenden Sequenz von Interferon & agr; 2a wurden synthetisiert und mit dem EREOVA-Promotor in den lentiviralen Vektor eines replikationsdefekten infektiösen Anämievirus eines Pferdes kloniert.
Um den Expressionsgrad zu erhöhen, wurden 0,9 TPN der Ovalbumin-Promotorsequenz zwischen dem Östrogen-Antwortelement und dem steroidabhängigen regulatorischen Element hinzugefügt (
1a ). Es war dieser lentivirale Vektor, der es ermöglichte, transgene Vögel zu erhalten, unter denen ein Männchen (G1) entdeckt wurde, das Träger eines intakten (ganzen / intakten) Transgens ist. Dementsprechend ging von diesem Männchen die Linie der transgenen Vögel (Nachkommen).
Durch die Verwendung von Antikörpern, die auf menschliches Interferon α reagieren, wurde das Vorhandensein von Interferon α2a im Eiprotein von Testhühnern (
1b ) unter Verwendung eines Proteinimmunoblots nachgewiesen.
Der Proteinimmunoblot * ist eine Analysemethode zur Bestimmung des Vorhandenseins von Proteinen in einer Probe.
Quantitativ wurde α2a unter Verwendung eines enzymgebundenen Immunosorbens-Assays beschrieben, wenn Antikörper an spezifische Antigene binden, was es ermöglicht, ihre Menge zu bestimmen.
Um die biologische Aktivität zu bestätigen, platzierten die Wissenschaftler vor dem Reinigungsprozess das verdünnte Eiweiß auf einem Zelltransfektor mit dem Reportergen des Interferon-stimulierten Antwortelements, das die Luciferase-Expression steuert (
1c ).
Reportergen * - verbindet die regulatorischen Sequenzen anderer Gene, um die Manifestationen von Genen in Zellkulturen zu untersuchen.
Luciferase * - oxidative Enzyme, die eine Reaktion auslösen, deren eines der Merkmale die Biolumineszenz ist.
Nach allen Überprüfungen wurde der Reinigungsprozess gestartet, der bestand aus:
- Klärung von Ovomucin (Glykoprotein in Eiprotein) durch Senkung des pH-Wertes;
- Entfernung von Ovomucin unter Verwendung einer Zentrifuge;
- Reinigung von Interferon α2a mittels Capture HiTrap Blue und weiterer Größenausschlusschromatographie.
Der Reinigungsgrad (> 95%) wurde durch Proteinelektrophorese in Polyacrylamidgel (
1d ) bestätigt.
Es war möglich, 15 mg Interferon & agr; 2a aus 100 ml Eiweiß zu erhalten, und dies entspricht etwa 60% des Volumens von Interferon & agr; 2a (25 mg), das durch einen Enzymimmunoassay (
1e ) nachgewiesen wurde.
Sie haben vielleicht eine Frage - aber was ist mit Krankheiten, die mit diesem Interferon α2a von Hühnern auf Menschen übergehen können? Wissenschaftler haben dies und genauer die antiviralen Eigenschaften von α2a überprüft, indem sie das Typ A H1N1-Virus in Zellen eingeführt haben, die zuvor mit α2a behandelt wurden. Die Ergebnisse dieser Analyse waren mehr als positiv (
1f ) - die antivirale Aktivität von Interferon aus Eiprotein betrug 1 × 10
9 U / mg, was eine Größenordnung höher ist als die von Proteinen, die aufgrund von Bakterien produziert wurden.
 Bild Nr. 2
Bild Nr. 2Eines der wichtigsten Proteine bei der Differenzierung, Proliferation und Funktion von Makrophagen ist CSF1.
Die mit F
c kombinierte CSF1-Codierungssequenz des Schweins wurde synthetisiert (pCSF1-F
c ) und in den lentiviralen Vektor pLenti6 (isoliert aus HIV) zwischen dem EREOVA2-Promotor und dem posttranskriptionellen regulatorischen Element des Woodchuck-Hepatitis-Virus (
2a ) kloniert.
F c * (kristallisierendes Fragment von Immunglobulin) ist ein Teil eines Immunglobulinmoleküls, das mit dem F c -Rezeptor auf der Zelloberfläche und mit einigen Proteinen interagiert.
Nach der Entfernung des Männchens (G0), das die Grundlage für eine neue Linie von Nachkommen wurde, unter denen ein intaktes Transgen bei zwei Weibchen und einem Männchen nachgewiesen wurde. Diese Individuen nahmen anschließend an der Zucht der Nachkommen der nächsten Generation (G2) teil. Die Polyacrylamid-Gelproteinelektrophorese bestätigte das Vorhandensein von pCSF1-F
c im Eiprotein (
2b ).
Schweine-CSF1 wurde in Ba / F3-Zellen exprimiert. Dies führte zu der Tatsache, dass die Existenz dieser Zellen von CSF1-F
c abhing. Somit war es möglich, die Lebensfähigkeit der Zellen des Test-Ei-Proteins zu bewerten, das im Vergleich zur Kontrollgruppe (Protein aus gewöhnlichen Eiern), bei der die Überlebensrate nahezu Null war (
2c ), ziemlich hoch war.
Als nächstes wurde das Eiprotein aus pCSF1-F
aus den Eiern aus Ovomucin gereinigt und in den Überstandszustand (Überstand, Flüssigkeit über dem trockenen Rückstand) überführt, wie in Abbildung
2d gezeigt .
Die aktive dimere Form von pCSF1-F
c wurde durch Aufnahme von MabSelect SuRe und weiteres Polieren unter Verwendung von Größenausschlusschromatographie (
2e ) gereinigt. Die Reinheitsrate betrug mehr als 97%.
Als Ergebnis betrug das durchschnittliche Molekulargewicht etwa 95,1 kDa (Kilodalton), die Monodispersität des Proteins war ebenfalls zufriedenstellend - Mw / Mn = 1,011 (Mw ist das Gewichtsmittel des Molekulargewichts, Mn ist das Zahlenmittel des Molekulargewichts). Die Analyse des Copolymermodells zeigte das Vorhandensein von 85,6 kDa Protein und 9,5 kDa Oligosaccharid.
Die Lebensfähigkeit der Zellen wurde ebenfalls getestet - einige der Eier wurden 1 Monat lang bei -20 ° C in einen Kühlschrank gestellt und ein Teil für den gleichen Zeitraum, jedoch bei -80 ° C. In beiden Fällen überlebten die Zellen (2
g ), was auf die Möglichkeit einer Langzeitlagerung und deren weitere Verwendung bereits vor der Reinigung ohne Aktivitätsverlust hinweist.
Es wurde auch eine Analyse der Fähigkeit von gereinigtem Protein durchgeführt, mit dem CSF1-Rezeptor zu interagieren. Dies wurde unter Verwendung von Knochenmarkzellen der Maus durchgeführt, und die Ergebnisse waren zufriedenstellend (
2 Stunden ).
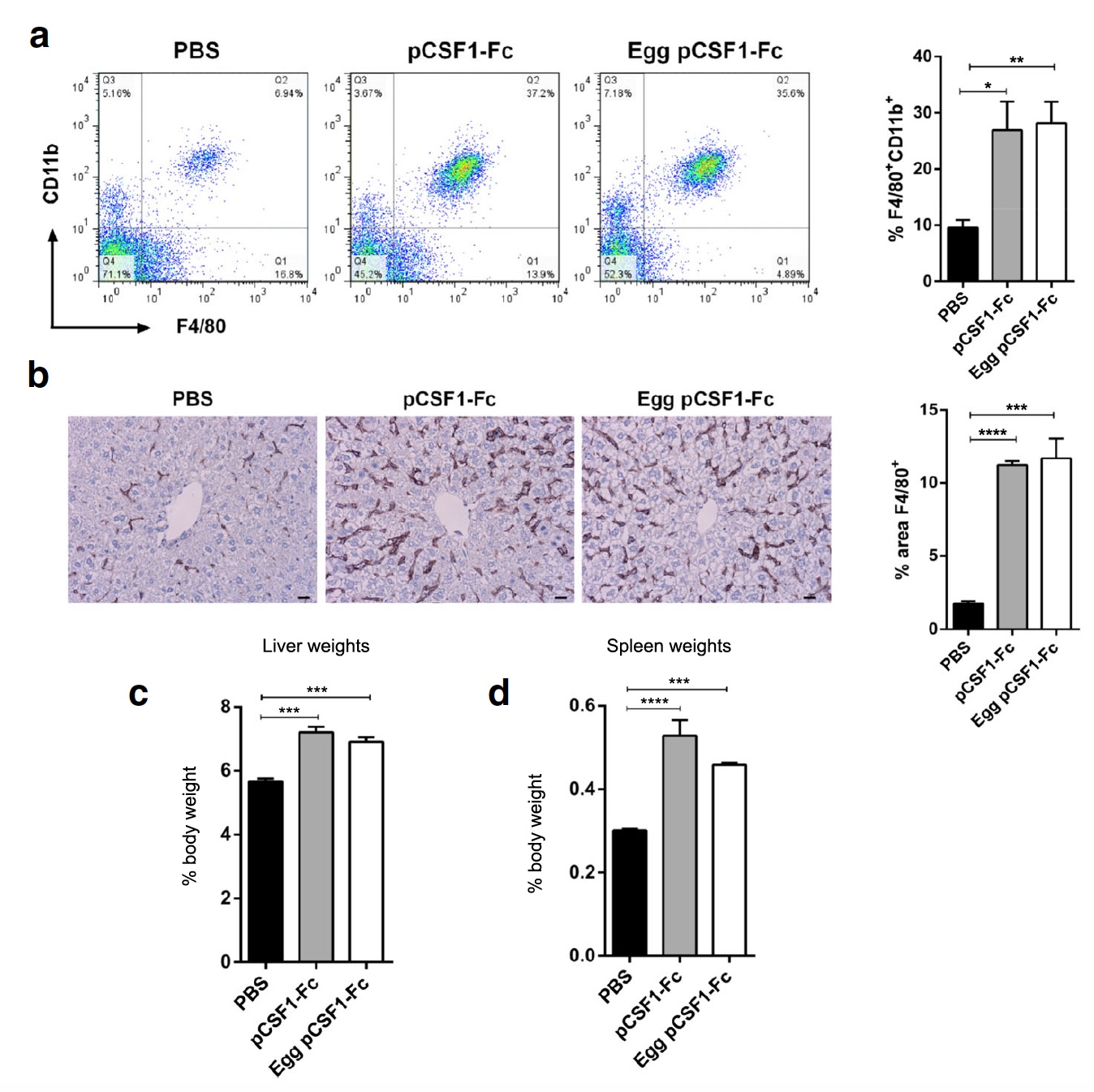 Bild Nr. 3
Bild Nr. 3Als nächstes beschlossen die Wissenschaftler, die Aktivität von pCSF1-F
c aus Eiprotein unter Feldbedingungen zu testen, dh bei Laborratten, denen 1 μg / g Kontrollprotein oder gereinigtes pCSF1-F
c -Protein injiziert wurde. Danach wurden das Gewicht und die Histologie von Leber, Milz und Blut von Ratten überprüft. Beide Varianten von pCSF1-F
c führten zu einem Anstieg der Anzahl von F4 / 80
+ CD11b
+ -Zellen im Blut (
3a ) und der Makrophagen von F4 / 80
+ -Gewebe in der Leber (
3b ). Eine signifikante Gewichtszunahme von Leber und Milz wurde ebenfalls beobachtet (
3c und
3d ).
 Bild Nr. 4
Bild Nr. 4Die obigen Tests, Analysen und Experimente zeigten sehr gute Ergebnisse. Jetzt muss nur noch bewiesen werden, dass solche Methoden die Produktion eines menschlichen Zytokins ermöglichen können, das in Arzneimitteln verwendet werden kann.
Wissenschaftler stellen fest, dass pCSF1-F
c in menschlichen Zellen eine gute Aktivität zeigt und immunogen sein kann. Um dies zu bestätigen, wurden Laborratten mit CSF1-F
c -Protein immunisiert, um monoklonale Antikörper zu produzieren, die mit menschlichem CSF1 kreuzreagieren.
Vor der Durchführung tatsächlicher Tests und der Analyse ihrer Ergebnisse bereiteten die Wissenschaftler Hühner vor, die menschliches CSF1-F
c -Protein (hCSF1-F
c ) exprimieren. Dazu haben wir die zuvor beschriebene Technik und das Vektorsystem verwendet. Bei zwei Hühnern wurde ein intaktes Transgen entdeckt, das die notwendige Proteinexpression von 1 mg / ml zeigte (
4a ). Gefolgt von dem obigen Reinigungsprozess (
4b ). Die Überlebensrate von gereinigtem hCSF1-F
c war auch nach Vakuumtrocknung und Reduktion hoch (
4c ).
Um die Nuancen der Studie genauer kennenzulernen, empfehle ich dringend, dass Sie sich den
Bericht von Wissenschaftlern ansehen.
NachwortDas Ergebnis dieser Studie ist die Bestätigung, dass Interferon α2a und CSF1-F
c als Bestandteile von normalem Eiweiß perfekt synthetisiert werden. Die Extraktion dieser Proteine erfordert ebenfalls keine besonderen Anstrengungen, sondern nur Standardchromatographietechniken. Die erhaltenen Proteine sind sowohl im Labor als auch im Körper eines lebenden Subjekts (Ratten) aktiv.
Viele stehen genetischen Veränderungen sehr skeptisch gegenüber. Einige haben sogar Angst vor diesem Satz und allem, was damit verbunden werden kann. Es lohnt sich jedoch nur ein wenig zu verstehen, welche Perspektiven menschliche Genmodifikationen bieten können, wie Ängste und veraltete Dogmen beseitigt werden. In diesem speziellen Fall untersuchten wir eine Studie, in der Wissenschaftler Hühner buchstäblich dazu zwangen, Eier mit menschlichen Proteinen zu legen, mit denen die zur Herstellung von Arzneimitteln erforderlichen Komponenten kostengünstig, effizient und schnell hergestellt werden können. Vielleicht tragen diese Hühner keine goldenen Eier, aber ihr Wert ist viel höher.
Und natürlich Freitag offtopic:
Etwas Musik vor dem Wochenende :)
Danke fürs Zuschauen, bleibt neugierig und habt ein tolles Wochenende euch allen, Jungs.
Vielen Dank für Ihren Aufenthalt bei uns. Gefällt dir unser Artikel? Möchten Sie weitere interessante Materialien sehen? Unterstützen Sie uns, indem Sie eine Bestellung
aufgeben oder Ihren Freunden empfehlen, einen
Rabatt von 30% für Habr-Benutzer auf ein einzigartiges Analogon von Einstiegsservern, das wir für Sie erfunden haben: Die ganze Wahrheit über VPS (KVM) E5-2650 v4 (6 Kerne) 10 GB DDR4 240 GB SSD 1 Gbit / s von $ 20 oder wie teilt man den Server? (Optionen sind mit RAID1 und RAID10, bis zu 24 Kernen und bis zu 40 GB DDR4 verfügbar).
VPS (KVM) E5-2650 v4 (6 Kerne) 10 GB DDR4 240 GB SSD 1 Gbit / s bis zum Frühjahr kostenlos, wenn Sie ein halbes Jahr bezahlen, können Sie
hier bestellen.
Dell R730xd 2 mal günstiger? Nur wir haben
2 x Intel Dodeca-Core Xeon E5-2650v4 128 GB DDR4 6 x 480 GB SSD 1 Gbit / s 100 TV von 249 US-Dollar in den Niederlanden und den USA! Lesen Sie mehr über
den Aufbau eines Infrastrukturgebäudes. Klasse mit Dell R730xd E5-2650 v4 Servern für 9.000 Euro für einen Cent?