Wir haben Ihnen bereits von zirkulierender microRNA
erzählt , aber es gibt noch eine andere ebenso coole Sache - extrazelluläre zirkulierende DNA (englische zellfreie DNA, zirkulierende DNA). Es wurde 1948 eröffnet. Jetzt hat das Interesse an ihr zugenommen, und das ist in der Tat die Sache.
Extrazelluläre DNA (cfDNA) kommt in verschiedenen Körperflüssigkeiten vor: in Plasma und Serum, Urin, Speichel, Synovial-, Peritoneal- und Cerebrospinalflüssigkeit.
Wir werden die Merkmale von cfDNA in zwei Flüssigkeiten betrachten: Blut und Urin. Es ist klar, dass es für die Diagnose bequemer ist.
Quellen der cfDNA im Körper
Wie bekannt wurde, zirkuliert cfDNA im Blut als Teil von apoptotischen Körpern, Mikrovesikeln, Nukleosomen, Exosomen, Nukleoproteinkomplexen mit Blutproteinen und vermutlich in freier Form.
Es wird angenommen, dass die Ursachen für cfDNA im Blut die Prozesse des Zelltods, die Reifung der roten Blutkörperchen, die Sekretion von DNA durch Zellen sowie Bakterien und Viren sind. Wir stellen sofort fest, dass die letzte Quelle, die DNA von Bakterien und Viren, einen sehr unbedeutenden Beitrag zum gesamten Pool zirkulierender DNA leistet und der Gehalt an exogener DNA während Infektionen mehrere zehn pkg / ml nicht überschreitet. Während nach modernen Daten der normale cfDNA-Spiegel in einem gesunden Körper 3-44 ng / ml im Plasma und 50-100 ng / ml im Blutserum beträgt.
Ein signifikanter Teil der cfDNA im Körper ist wahrscheinlich auf den Zelltod während Apoptose, Nekrose und Netose zurückzuführen. Täglich sterben bei einem Erwachsenen etwa hundert Milliarden Zellen durch programmierten Zelltod (Apoptose) ab, wodurch pro Tag etwa 1 g DNA abgebaut wird.
Bei der Apoptose wird die Kern-DNA durch ein spezielles Enzym, DNase, gespalten. Danach erscheinen DNA-Fragmente mit einer Länge von mehreren Nukleosomen (180-200 bp, bp - Nukleotidpaare), die von Makrophagen als Teil apoptotischer Körper entsorgt werden sollten (spezielle Verpackung nach Apoptose). Jeder weiß, dass die Nukleotidpaare (Adenin-Thymin und Guanin-Cytosin) in unserer DNA drei Milliarden Mal wiederholt werden. Nukleosomen sind spezielle Strukturen im Chromatin, die aus Histonproteinen bestehen, auf denen ein DNA-Strang eineinhalb Umdrehungen gewickelt ist.
Dann passiert das Seltsame. Aus unbekannten Gründen vermeidet ein Teil der DNA toter Zellen die Begegnung mit Makrophagen und gelangt in den Blutkreislauf. Zu verschiedenen Zeiten wurden Experimente durchgeführt, die die apoptotische Natur der cfDNA bestätigten [1,2].
Wenn die cfDNA gesunder Spender durch Gelelektrophorese getrennt wird, werden Banden nachgewiesen, die Fragmentlängen von 180-200 bp entsprechen. und Längen, die ein Vielfaches dieser Zahl sind, was einer Internukleosomenspaltung von Chromatin während der Apoptose entspricht. Der Nachweis von fötaler DNA im Blut der Mutter spricht auch für Apoptose als Quelle für cfDNA [3].
Normalerweise leistet Nekrose einen weniger signifikanten Beitrag zum Auftreten von cfDNA und erhöht deren Anzahl bei schweren Verletzungen. Nekrotische cfDNA im Plasma wird in Form längerer Fragmente nachgewiesen - mit einer Länge von über 10 000 bp. Mittels PCR (Polymerasekettenreaktion) kann zwischen langen Fragmenten der cfDNA, die aus Nekrose resultieren, und kürzeren Fragmenten aufgrund von Apoptose unterschieden werden.
Neben Apoptose und Nekrose gibt es eine weitere wenig bekannte Art des Zelltods, die eine Quelle für cfDNA darstellt - die Netosis (NETosis).
Bei der Netose stoßen neutrophile Zellen spezielle netzwerkartige Strukturen aus, extrazelluläre neutrophile Fallen (NET, Neutrophil Extracellular Trap), deren Aufgabe es ist, den in den Körper eingedrungenen Erreger zu deaktivieren: Viren, Pilze und Bakterien. In diesem Fall stirbt der Neutrophile und wirft DNA, Histone, verschiedene Proteine und Enzyme in den extrazellulären Raum. Es ist bekannt, dass der NET-Prozess manchmal pathologischer Natur ist und zur Entwicklung von Thrombosen, Herz-Kreislauf- und Autoimmunerkrankungen sowie Krebs beiträgt.
Kürzlich, im Jahr 2018, wurde entdeckt, dass im Falle einer HIV-Infektion überaktive Neutrophile, der NET-Mechanismus und Netosis auftreten. Infolgedessen kam es zu einem umfassenden Tod von Immunzellen, die durch Netzwerke von Neutrophilen, CD4 + - und CD8 + -T-Zellen, B-Zellen und Monozyten eingefangen wurden, und zur Entwicklung von begleitenden kardiovaskulären Pathologien [4].
Eine weitere mögliche Quelle für cfDNA ist die DNA-Sekretion durch normale Zellen und Tumorzellen. Bereits 1972 wurde die aktive Freisetzung von DNA durch Lymphozyten in das extrazelluläre Medium nachgewiesen [5].
Das Vorhandensein eines solchen Phänomens wie der Freisetzung von DNA durch Zellen in das extrazelluläre Medium legt die Existenz spezieller Mechanismen für den Transfer von DNA durch die Zellmembran nahe. Im Verlauf von Studien wurde festgestellt, dass die Freisetzung von DNA aus Lymphozyten unter aktiver Wirkung von Trypsin, Pronase und Plasmin vor dem Hintergrund eines Mangels an Ca2 + - und Mg2 + -Ionen erfolgt. Ein Überschuss an Calciumionen hemmt den Austritt von DNA aus der Zelle [6].
Laut russischen Biochemikern der Kazan State University kann eine weitere wahrscheinliche Quelle für cfDNA im Blut eine völlig unbekannte Form der zytoplasmatischen DNA sein, die sich von der nuklearen und mitochondrialen DNA unterscheidet - DNA, die mit der Membran menschlicher diploider Lymphozyten assoziiert ist (membranassoziierte DNA im Zytoplasma diploider menschlicher Lymphozyten) ) [7].
Trotz der Tatsache, dass diese Art von DNA 1971 entdeckt wurde, ist sie immer noch unerforscht, und es gibt nur wenige Werke derselben Autoren, obwohl in PNAS und Nature.
Nach der Annahme von Abramova Z.I. et al. kann ein Teil der cfDNA aus dieser cytoplasmatischen DNA gebildet werden, was durch die charakteristischen Merkmale einiger Fragmente der cfDNA angezeigt wird, die sich von nuklearen und mitochondrialen unterscheiden [6].
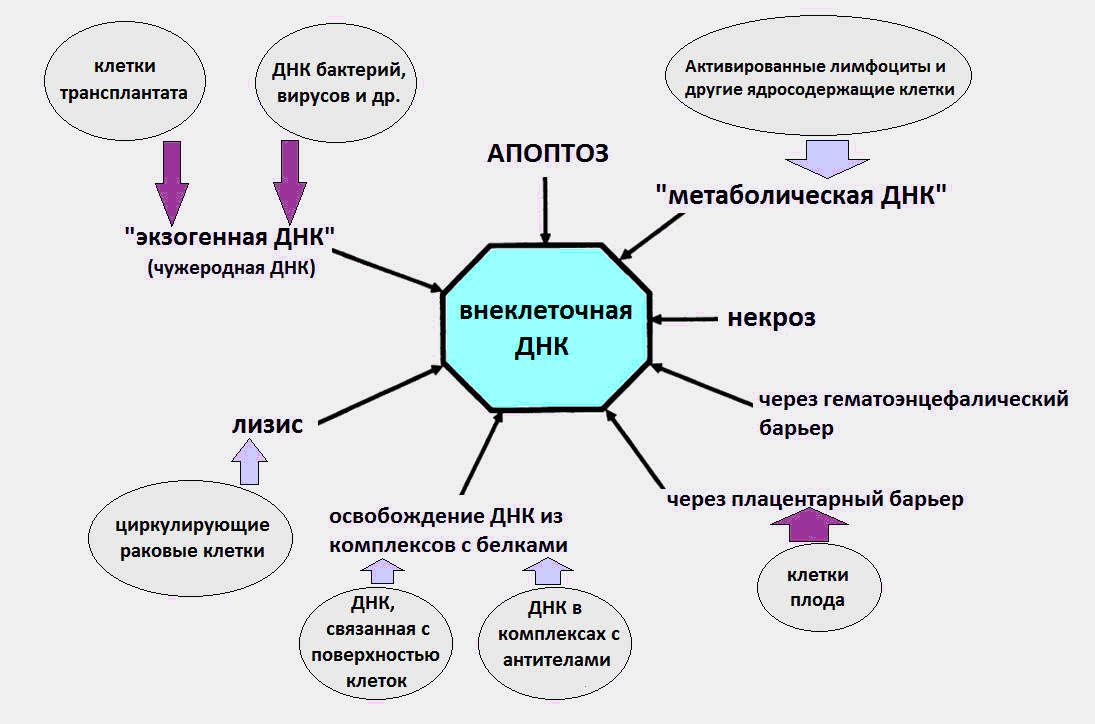 Fig. 1 Die verschiedenen Wege, auf denen cfDNA in den Kreislauf gelangt.
Fig. 1 Die verschiedenen Wege, auf denen cfDNA in den Kreislauf gelangt.Weitere Einzelheiten zu allen Aspekten der Biologie der cfDNA (immunmodulatorische Wirkungen, Empfang von cfDNA auf der Zelloberfläche usw.) finden sich in einer detaillierten Übersicht von Professor Kozlov V.A. (Forschungsinstitut für klinische Immunologie SB RAMS) [8].
Extrazelluläre DNA als Biomarker für verschiedene Pathologien
Die Logik legt nahe, dass sich die cfDNA-Spiegel mit den Pathologien ändern sollten, die mit dem Massenzelltod einhergehen. Eine Reihe von Studien hat einen signifikanten Anstieg der cfDNA-Spiegel mit der Entwicklung von Autoimmunerkrankungen (systemischer Lupus erythematodes, systemische Sklerodermie, rheumatoide Arthritis usw.) gezeigt und gezeigt, dass es charakteristische Merkmale der cfDNA gibt, die für eine bestimmte Autoimmunpathologie typisch sind [8-10].
Es ist auch bekannt, dass bei einem akuten Myokardinfarkt, der mit dem Tod von Herzzellen durch die Art von Nekrose und Apoptose einhergeht, auch die cfDNA-Spiegel ansteigen. Dies war von potenziellem diagnostischem Wert, da Patienten, bei denen Komplikationen auftraten, höhere Werte aufwiesen als Patienten, die sich besser erholten [11].
Bei Patienten mit akutem Schlaganfall korreliert die innerhalb von 24 Stunden gemessene Konzentration von cfDNA im Blutplasma mit der Schwere des Schlaganfalls und kann als Prädiktor für die Mortalität und den Schweregrad des Ergebnisses dienen, selbst bei Patienten, bei denen keine sichtbaren Veränderungen durch bildgebende Verfahren festgestellt wurden [12, 13]. .
Es ist bekannt, dass cfDNA durch das Vorhandensein einer großen Anzahl von Guanin-Cytosin (GC) -Sequenzen gekennzeichnet ist, die gegenüber der Zerstörung durch Nukleasen resistenter sind als Adenin-Thymin-DNA-Fragmente. Somit ist der Gehalt einer spezifischen GC-angereicherten Sequenz des Genoms - der transkribierten Region der ribosomalen Wiederholung - in der cfDNA um ein Vielfaches höher als der Gehalt dieser Wiederholung in der Kern-DNA [14].
Und bei chronischen Pathologien, die mit einer Aktivierung des Zelltods einhergehen (koronare Herzkrankheit, arterielle Hypertonie, Autoimmunpathologien), steigt der Gehalt dieser GC-reichen Markersequenzen in der Blut-fcDNA um das 10-fache oder mehr [15]. Dies ermöglicht es, die Parameter der GC-angereicherten ribosomalen DNA als Teil der cfDNA als Biomarker für einen chronisch auftretenden pathologischen Prozess zu verwenden.
Im Kampf gegen Krebs besteht die Aufgabe darin, einen Tumor zum frühestmöglichen Zeitpunkt zu erkennen. Hier ist cfDNA als Biomarker der Tumorentstehung von extremem Interesse.
Punktmutationen in der Tumor-fcDNA wurden lange vor Diagnosestellung im Blut von Patienten nachgewiesen [16].
Informationen zu cfDNA-Spiegeln in der Onkologie, Suche nach ccDNA-spezifischen Mutationen in der Karzinogenese, wie Onkogenen KRAS, HER2, BRCA1, APC, PIK3CA, BRAF usw., unter Verwendung mitochondrialer DNA als Marker in ccDNA, Untersuchung charakteristischer genetischer und epigenetischer Veränderungen cfDNAs wie die Hypomethylierung von Alu-beweglichen Elementen bei Tumoren, die Verwendung des cfDNA-Integritätsindex und andere Aspekte finden sich in den Arbeiten von Vasilieva et al., Gonzalez-Masia et al. [17, 18].
Es wurde festgestellt, dass cfDNA durch einen viel stärkeren Oxidationszustand unter dem Einfluss reaktiver Sauerstoffspezies (ROS) gekennzeichnet ist als Kern-DNA.
Daher variiert der Gehalt des bekannten DNA-Oxidationsmarkers 8-ohodG in der Zusammensetzung der Kern-DNA normalerweise und für verschiedene Pathologien zwischen 1 und 10 pro Million Nukleotide, und der Gehalt dieses Markers in der cfDNA beträgt 300 oder mehr pro Million Nukleotide [19].
Ein starker Anstieg des Gehalts an 8-ohdG in der cfDNA wurde in der Onkologie und bei Herz-Kreislauf-Erkrankungen festgestellt, die mit oxidativem Stress einhergehen und Werte von 3000 8-OxodG pro Million Nukleotide erreichen können [20].
Im Allgemeinen wird angenommen, dass die 8-ohdG-Spiegel in der cfDNA ein empfindlicher Marker für den gesamten oxidativen Stress im Körper sind.
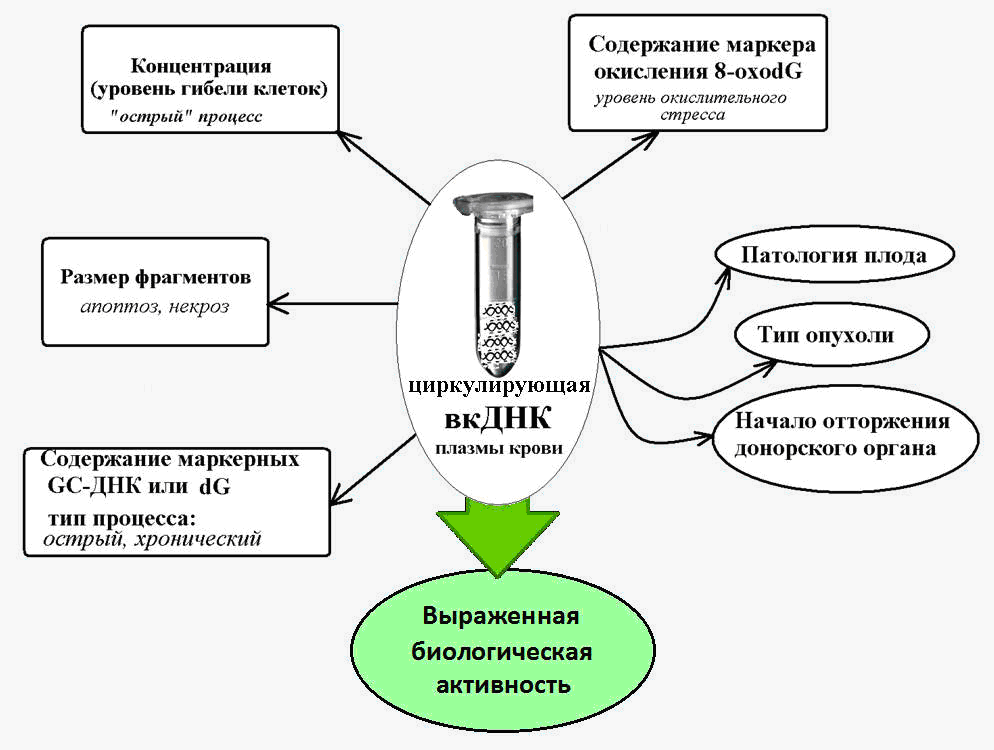 Abb. 2. Zirkulierende extrazelluläre DNA - ein Marker unter verschiedenen pathologischen Bedingungen, begleitet von einem erhöhten Zelltod.
Abb. 2. Zirkulierende extrazelluläre DNA - ein Marker unter verschiedenen pathologischen Bedingungen, begleitet von einem erhöhten Zelltod.Extrazelluläre DNA als mobiles Element
Ein wichtiger und sehr wichtiger Durchbruch in Studien zur Rolle von cfDNA in internen Prozessen erfolgte vor 3 Jahren. Im Jahr 2015 machte eine Gruppe von Forschern eine aufregende Entdeckung, die zeigte, dass cfDNA wie mobile genetische Elemente in die Kern-DNA eindringen und Mutationen im Genom verursachen kann [21]. Das alles ist sehr überraschend.
In früheren Arbeiten wurde bereits gezeigt, dass Tumor-DNA aus dem Blut die Fähigkeit besitzt, sich in Kern-DNA zu integrieren. Mausfibroblasten wurden in Plasma von Patienten mit Dickdarmkrebs gegeben, wonach K-ras-Onkogene und Gene des an der Apoptose beteiligten p53-Proteins in der DNA von Mauszellen nachgewiesen wurden und die Zellen selbst onkogen transformiert wurden (Krebs bei gesunden Mäusen verursachten) [22 ]. Dies zeigt an, dass DNA aus dem Plasma von den darin platzierten Zellen absorbiert und integriert wurde. Dieses angebliche Phänomen - die Aufnahme von Onkogenen aus der im Blut zirkulierenden vcDNA durch gesunde Zellen - könnte für den Metastasierungsprozess verantwortlich sein und wird als „Genomeastase“ bezeichnet.
In einer anderen Arbeit wurden Daten zur Absorption und Integration von Fragmenten des für das Y-Chromosom spezifischen DYS14-Gens im Gehirn einer Frau mit einem männlichen Fötus bereitgestellt [23].
In einer Studie von 2015 verfolgten Wissenschaftler, wie fluoreszenzmarkierte cfDNAs von Krebspatienten und gesunden Menschen in In-vitro-Experimenten (d. H. Außerhalb eines lebenden Organismus in Zellkulturen) leicht in die Kern-DNA von Mausfibroblasten eingefügt werden konnten. Darüber hinaus war humane cfDNA mehrere Minuten lang in den Kernen von Mauszellen lokalisiert, und fast 100% der Kerne von Mauszellen zeigten 30 Minuten lang Fluoreszenzsignale.
Die Sequenzierung des gesamten Genoms von Mauszellen zeigte das Vorhandensein menschlicher DNA-Fragmente darin, einschließlich der charakteristischen mobilen Elemente von Alu. Darüber hinaus fanden die Autoren die Induktion von γ-H2AX-Foki aufgrund von DNA-Schäden sowie eine Erhöhung der Caspase-3-Aktivität und der Expression der Gene ATM, p53, p21, GADD-34 und DNA-Ligase. Was alles zusammen auf eine erhöhte Instabilität des Genoms, eine Aktivierung der Reaktion auf DNA-Schäden und Apoptose hinweist.
Die Autoren testeten dann die Wirkung von fremder vcDNA in vivo auf einen lebenden Organismus. Mäusen wurde intravenös humane cfDNA injiziert, von denen dann Fragmente in Herz, Lunge, Leber und Gehirn von Mäusen gefunden wurden, die 7 Tage nach der Injektion getötet wurden.
Darüber hinaus konnten die Partikel menschlicher DNA, die Mäusen verabreicht wurden, die Blut-Hirn-Schranke passieren und das Gehirn durchdringen. Wie im Fall von Zellen in Kultur verursachte die intravenöse Verabreichung von cfDNA die Induktion von γ-H2AX, proapoptotischer Caspase-3 und die Aktivierung der Reaktion auf DNA-Schäden. Und es ist laut Wissenschaftlern die Reaktion auf DNA-Schäden, die eine zentrale Rolle bei der Integration von cfDNA in den Kern spielt.
Die nukleare DNA nimmt die Einführung von extrazellulärem Material als doppelsträngigen Bruch wahr und beginnt, sich selbst zu „patchen“, wobei die zirkulierende DNA in ihre Zusammensetzung einbezogen wird: „Die Aktivierung der Reaktion auf DNA-Schäden kombiniert mehrere heterogene cfDNAs und fragmentiertes Chromatin zu langen Concatemeren durch nicht homologe Verbindung der Enden als Teil des Wiederherstellungsprozesses.“
Infolgedessen kommen die Autoren zu dem paradoxen Schluss: „Da die durch extrazelluläre zirkulierende DNA verursachte Schädigung der Kern-DNA allgegenwärtig ist und ständig auftritt, kann sie die Hauptursache für das Altern sein, das mit Alterungsstörungen und dem endgültigen Tod des Körpers verbunden ist. Daher spielt die DNA vielleicht eine paradoxe Rolle als Bewahrer der Grundlagen des Lebens und als Zerstörer des Lebens selbst. “
Unnötig zu erwähnen, dass diese Schlussfolgerung allen heutigen Vorstellungen über das Altern sehr widerspricht.
Die Logik legt nahe, dass diese Hypothese der folgenden Abhängigkeit entspricht: Je länger das Leben einer Art ist, desto weniger ist das Individuum dieser DNA-Form und / oder es ist weniger gefährlich für diese Art.
Bis zum Abschluss einer solchen Vergleichsstudie bleibt jedoch davon auszugehen, dass bei langlebigen Spezies (Menschen) und kurzlebigen (Mäusen) cfDNAs vermutlich in relativ vergleichbaren Mengen produziert werden. Und die Entdeckung erhöhter Konzentrationen dieser Moleküle bei älteren Menschen kann im Gegenteil eine Folge des Alterungsprozesses sein und nicht dessen Ursache.
Dies ist zwar eine Konsequenz, die die Ursache stärken kann. Lesen Sie den Artikel von Belikov.
Darüber hinaus schlagen die Autoren der Entdeckung vor, cfDNA einer anderen Klasse mobiler genetischer Elemente zuzuordnen. Und dann wird vielleicht eine breite Beteiligung an der Entwicklung eines solchen Prozesses wie des horizontalen Gentransfers sowohl bei Wirbellosen als auch bei Wirbeltiervertretern der Tierwelt erklärt. Dank dessen konnte das menschliche Genom nach einer der neuesten Daten mehrere zehn Gene von anderen Arten ausleihen [24]
Eine sehr wichtige Frage bleibt offen: Wie genau gelangen cfDNAs in die Zelle? Bestehende Hypothesen beinhalten den Vorschlag, dass Partikel, die DNA enthalten, Zellen durch Poren in der Membran sowie durch verschiedene Arten von Endozytose, Proteoglycan-abhängiger Makropinozytose oder bei Wechselwirkung mit Membranproteinen durchdringen können.
Extrazelluläre DNA gegen Fettleibigkeit, Entzündungen, Röntgenstrahlen und Stress verschiedener Art
Eine weitere interessante Entdeckung wurde ein Jahr später von japanischen Forschern gemacht. Sie konnten die aktive Beteiligung von cfDNA, die im Blut infolge des Todes von Adipozyten bei adipösen Menschen auftrat, an der Entwicklung von Entzündungen und Insulinresistenz beschreiben. Der Schlüsselfaktor, der bei diesen Prozessen mit cfDNA interagiert, war das angeborene Immunmolekül Toll-like Rezeptor 9 (TLR9) [25].
Nicht ohne Intrigen russischer Wissenschaftler des Instituts für Theoretische und Experimentelle Biophysik der Russischen Akademie der Wissenschaften. Sie fanden heraus, dass Röntgenbestrahlung und das Antidiabetikum Metformin bei Ratten eine erhöhte Ausscheidung von cfDNA (nuklear und mitochondrial) im Urin verursachen.
Ihre Daten zeigten, dass vor den Experimenten die Menge an nuklearer cfDNA 40% höher und die Menge an mitochondrialer fcDNA im Urin älterer Ratten 50% höher war als bei jungen Ratten.
12 Stunden nach der Bestrahlung stieg der Gehalt an i-fccDNA und mt-fcDNA im Urin junger Ratten im Vergleich zur Kontrolle um 200% bzw. 460%, während er im Urin älterer Ratten um 250% bzw. 720% zunahm.
6 Stunden nach der Verabreichung von Metformin an andere Ratten war die Menge an i-cfDNA und mt-fcDNA im Urin junger Ratten um 25% und 55% und im Urin älterer Ratten um 50% und 160% erhöht.
Laut den Autoren legen diese Daten nahe, dass Röntgenstrahlen und Metformin einen signifikanten Anstieg der cfDNA im Rattenurin (insbesondere in alten) verursachen, der durch aktiven Zelltod in Geweben verursacht wird. Diese Ergebnisse legen auch nahe, dass Metformin als Senolytikum wirken und den Tod alter Zellen mit strukturellen und funktionellen Störungen auslösen kann [26].
Im Oktober letzten Jahres verfolgten Wissenschaftler die Beziehung der cfDNA-Spiegel zu psychischem Stress und körperlicher Aktivität bei jungen Menschen im Alter von 18 bis 36 Jahren. Die Ergebnisse zeigten einen zweifachen Anstieg der cfDNA nach akutem psychosozialem Laborstress (TSST) und einen fünffachen Anstieg der cfDNA nach dem Training auf dem Laufband (mit Erreichen der Erschöpfung des Laufbandes).
Eine erhöhte Menge kürzerer cfDNA-Fragmente, die für Apoptose charakteristisch sind, im Blut nach körperlicher Erschöpfung wurde ebenfalls aufgezeichnet.
Extrazelluläre mitochondriale DNA zeigte nach beiden Belastungen den gleichen Anstieg. Darüber hinaus waren die in dieser Arbeit als Marker für verschiedene zelluläre Ursprünge verwendeten cfDNA-Methylierungsprofile für verschiedene Stresstests signifikant unterschiedlich.
HOXA5 - . , , , , .
HOXA5 , , , . [27].
. .
, , 2011–13 . 90 , Vitality 90+, ( 22–37 ) .
, , . : , — , .
, ( - , (SAA) .) 90 . , (frailty) [28-30].
.
, LINE-1 Alu , 23 61 .
LINE-1 6 ..., , , 10 ...
LINE-1 , .. , , . LINE-1 — , . , : LINE-1 — .
, Alu, LINE-1 ( . “
: « » ”).
, LINE-1 Alu, .
, LINE-1 Alu, , . 100 LINE-1 (), , LINE-1, - [31].
LINE-1 Alu . , 4 ( 100, 100 , (71 ) (25 )) :
« , , , . , , , ». [32].
, , : , .
, , , , .
, , - , , ( ), , .
, , , .
.
:- Jahr S, Hentze H, Englisch S, Hardt D, Fackelmayer FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15;61(4):1659-65.
- Deligezer U1, Yaman F, Erten N, Dalay N. Frequent copresence of methylated DNA and fragmented nucleosomal DNA in plasma of lymphoma patients. Clin Chim Acta. 2003 Sep;335(1-2):89-94.
- Bishoff FZ, Dang D., Horne C., Marquez-Do D., Brincley WR, Levis DE Fetal DNA in maternal plasma circulates as apoptotic bodies: elucidations of structural nature of fetal DNA for non-invasive prenatal genetic diagnosis // Am. J. Hum. Genet. 2003. V. 73. P. 189.
- Sivanandham R, Brocca-Cofano E, Krampe N, Falwell E, Venkatraman SMK, Ribeiro RM, Apetrei C, Pandrea. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. J Clin Invest. 2018 Nov 1;128(11):5178-5183.
- Rogers JC, Boldt D., Kornfeld S. Excretion of deoxyribonuclein acid by lymphocytes stimulated with phytohemagglutinin or antigen // Proc. Nat. Acad. Sci. USA 1972. V. 69, No 7. P. 1685–1689.
- ., .. . 2007. . .149, .23-32.
- Lerner RA, Meinke W., Goldstein DA Membrane-associated DNA in the cytoplasm of diploid human lymphocytes // Proc. Nat. Acad. Sci. USA 1971. V. 68, No 6. P. 1212–1216.
- .. . . 2013;15(5):399-412.
- Galeazzi M, Morozzi G, Piccini M, Chen J, Bellisai F, Fineschi S, Marcolongo R. Dosage and characterization of circulating DNA: present usage and possible applications in systemic autoimmune disorders. Autoimmun Rev 2003;2:50-5.
- Leon SA, Revach M, Ehrlich GE, Adler R, Petersen V, Shapiro B. DNA in synovial fluid and the circulation of patients with arthritis. Arthritis Rheum 1981;24:1142-50.
- Destouni A, Vrettou C, Antonatos D, Chouliaras G, Traeger-Synodinos J, Patsilinakos S, et al. Cell-free DNA levels in acute myocardial infarction patients during hospitalization. Acta Cardiol 2009;64:51-7.
- Rainer TH, Wong LKS, Lam W, Yuen E, Lam NYL, Metreweli C, Lo YMD. Prognostic Use of Circulating Plasma Nucleic Acid Concentrations in Patients with Acute Stroke. Clin Chem 2003; 49:562-9.
- Lam NY, Rainer TH, Wong LK, Lam W, Lo YM. Plasma DNA as a prognostic marker for stroke patients with negative neuroimaging within the first 24 h of symptom onset. Resuscitation 2006; 68:71-8.
- .., .., .., .., .., .., .., .., .., .., — , , 2008, : 54(1), 78-93.
- Bulicheva, N. et al. Effect of cell-free DNA of patients with cardiomyopathy and rDNA on the frequency of contraction of electrically paced neonatal rat ventricular myocytes in culture. Ann NY Acad Sci. 2008. V. 1137. P. 273-277.
- Lecomte, T. Circulating free tumor DNA and colorectal cancer/ T. Lecomte, N. Ceze, E.
- Dorval, P. Laurent-Puig // Gastroenterol Clin Biol. 2010. V. 34. № 12. P. 662- 681.
- ., .. . . 2013.-N 6.-.673-681
- Gonzalez-Masia, JA et al. Circulating nucleic acids in plasma and serum (CNAPS): applications in oncology. Onco Targets Ther. 2013. V. 8. № 6. P. 819-32.
- Ermakov, AV et al. Oxidized extracellular DNA as a stress signal in human cells. Oxid Med Cell Longev. 2013. V. 2013. P. 649-747.
- Loseva, P. et al. Extracellular DNA oxidation stimulates activation of NRF2 and reduces the
- production of ROS in human mesenchymal stem cells. Expert Opin. Biol. Th. 2012. V.12. № 1. P. 85-97.
- Mittra I, Khare NK, Raghuram GV, et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes. J Biosci. 2015;40(1):91–111.
- Garcia‐Olmo DC, Dominguez C, Garcia‐Arranz M, Anker P, Stroun M, Garcia‐Verdugo JM, Garcia‐Olmo D (2010) Cell‐free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res. 70, 560–567
- Chan W, Gurnot C, Montine TJ, Sonnen JA, Guthrie KA, Lee Nelson J (2012) Male Microchimerism in the Human Female Brain. PLoS ONE 7, e45592.
- Crisp A, Boschetti C, Perry M, et al.: Expression of multiple horizontally acquired genes is a hallmark of both vertebrate and invertebrate genomes. Genome Biol. 2015;16:50. 10.1186/s13059-015-0607-3
- Sachiko Nishimoto, Daiju Fukuda et al. Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Sci Adv. 2016 Mar; 2(3): e1501332.
- Gaziev A, Abdullaev S, Minkabirova G, Kamenskikh K. X-rays and metformin cause increased urinary excretion of cell-free nuclear and mitochondrial DNA in aged rats. J Circ Biomark. 2016 Oct 25; 5:1849454416670782.
- Hummel EM, Hessas E, Müller S, Beiter T, Fisch M, Eibl A, Wolf OT, Giebel B, Platen P, Kumsta R, Moser DA Transl Psychiatry. 2018 Oct 29;8(1):236.
- Jylhävä J1, Kotipelto T, Raitala A, Jylhä M, Hervonen A, Hurme M. Aging is associated with quantitative and qualitative changes in circulating cell-free DNA: the Vitality 90+ study.
- Mech Ageing Dev. 2011 Jan-Feb;132(1-2):20-6.
- Jylhävä J1, Jylhä M, Lehtimäki T, Hervonen A, Hurme M. Circulating cell-free DNA is associated with mortality and inflammatory markers in nonagenarians: the Vitality 90+ Study. Exp Gerontol. 2012 May;47(5):372-8.
- Jylhävä J1, Nevalainen T, Marttila S, Jylhä M, Hervonen A, Hurme M. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty. Aging Cell. 2013 Jun;12(3):388-97.
- Lars Erichsen,a Agnes Beermann et al. Genome-wide hypomethylation of LINE-1 and Alu retroelements in cell-free DNA of blood is an epigenetic biomarker of human aging. Saudi J Biol Sci. 2018 Sep; 25(6): 1220–1226.
- Teo YV, Capri M, Morsiani C, Pizza G, Faria AMC, Franceschi C, Neretti N. Cell-free DNA as a biomarker of aging. Aging Cell. 2019 Feb;18(1):e12890.