Das Thema Bildverarbeitungsgeräte spielt in der Neurobiologie eine wichtige Rolle. Riesige Literaturmengen und vier Nobelpreise sind diesem Thema gewidmet, aber in dieser Situation kann man nur feststellen, dass das in den Lehrbüchern beschriebene Sehgerät für Säugetiere die Aufgabe nicht erfüllt. Der Zweck dieses Aufsatzes ist es, eine Reihe von Gründen aufzuzeigen, warum Sie dies nicht ignorieren sollten. Tatsächlich wird ein Porträt des Geheimnisses des Sehens präsentiert, das von einer Vielzahl kleiner Details zu Beginn des Flusses visueller Informationen bei Säugetieren über die Gefahr, sie zu ignorieren, bis hin zu einer Reihe von Problemen beim Verständnis der Gehirnverarbeitung am Ende des Pfades reicht.
Vision System Gerät
In den Augen eines Lehrbuchs über das Sehen sehen wir in drei Stufen. Die erste Stufe: Licht tritt in die Netzhaut ein und wird in die nervöse Erregung von Photorezeptoren - sensorischen Neuronen der Netzhaut - umgewandelt. Darüber hinaus normalisiert das Auge Kontrast und Helligkeit, fokussiert das Bild.
Die zweite Stufe: der Prozess in der Netzhaut, bei dem die Karte der Nervenanregungen von Photorezeptoren in einen parallelen Informationsstrom umgewandelt wird, von dem jedes Element seinen eigenen Aspekt der visuellen Information codiert. Die Ganglienzellen, deren Axone den Sehnerv bilden, in der Netzhaut sind viel kleiner als die Photorezeptoren, die erste Komprimierung von Informationen erfolgt. Eine Ganglienzelle kann für die Codierung eines Signals von mehreren in der Mitte zu Hunderten und Tausenden von Photorezeptoren an der Peripherie der Netzhaut verantwortlich sein. (Abbildung 1) Ganglienzellen werden in zwei Haupttypen unterteilt, je nachdem, auf welchem Weg vom Sehnerv das Signal in die Hirnrinde der Gehirnhälften gelangt. Ein quantitativ vorherrschender Typ (80% bei Menschen) bietet eine hohe Sehschärfe und Farbwahrnehmung, ein stabiler Bildkontrast ist für sie wichtig. Aus historischen Gründen werden sie PC-Zellen oder Zwergzellen genannt, da das Signal von ihnen durch die parvozellulären (kleinzelligen) Schichten der seitlich gekröpften Körper fließt. Bei der zweiten Art von MC-Zellen geht ihr Signal durch die magnozellulären Schichten (große Zellen) der seitlich gekröpften Körper. Sie sind für die Wahrnehmung von Bewegung verantwortlich, da sie eine erhöhte Empfindlichkeit für Bilder haben, die blinken oder sich bewegen.


 Abbildung 1. Messung der Eigenschaften von Empfangsfeldern. (A) Die Reaktion eines Neurons (eine Folge von Aktionspotentialen oder "Adhäsionen") wird durch extrazelluläre Aufzeichnung eines anästhesierten Tieres durch die Elektrode im Kurbelwellen-Zwischenkörper (LGN) gesteuert. Stimuli werden an den Teil des Gesichtsfeldes abgegeben, der dem Neuron entspricht. (B) Tabelle der bedingten Reaktionen verschiedener Arten von Neuronen. Jede Spalte zeigt die Antwort eines Neuronentyps. Jede Zeile zeigt Antworten auf eine Art von Stimulus. Beispielsweise reagiert ein in Bewegungsrichtung selektives Neuron (zweite Spalte) nur, wenn sich der Reiz von links nach rechts durch das Empfangsfeld bewegt. Neuronen mit Standardrezeptorfeldern "Zentrum / Umgebung" sind tolerant gegenüber der Größe und Motilität des Stimulus. Nicht standardmäßige Arten von Neuronen weisen viel kompromisslosere Reizanforderungen auf.
Abbildung 1. Messung der Eigenschaften von Empfangsfeldern. (A) Die Reaktion eines Neurons (eine Folge von Aktionspotentialen oder "Adhäsionen") wird durch extrazelluläre Aufzeichnung eines anästhesierten Tieres durch die Elektrode im Kurbelwellen-Zwischenkörper (LGN) gesteuert. Stimuli werden an den Teil des Gesichtsfeldes abgegeben, der dem Neuron entspricht. (B) Tabelle der bedingten Reaktionen verschiedener Arten von Neuronen. Jede Spalte zeigt die Antwort eines Neuronentyps. Jede Zeile zeigt Antworten auf eine Art von Stimulus. Beispielsweise reagiert ein in Bewegungsrichtung selektives Neuron (zweite Spalte) nur, wenn sich der Reiz von links nach rechts durch das Empfangsfeld bewegt. Neuronen mit Standardrezeptorfeldern "Zentrum / Umgebung" sind tolerant gegenüber der Größe und Motilität des Stimulus. Nicht standardmäßige Arten von Neuronen weisen viel kompromisslosere Reizanforderungen auf.Beide Arten dieser Zellen haben eine Organisation vom Typ Zentrum / Umgebung: eine angeblich universelle Codierungsstrategie für visuelle Informationen. (Abbildung 2) Der beste Stimulus für die energetischste Reaktion von Ganglienzellen ist ein mehr oder weniger rundlicher und kleiner Fleck auf der Netzhaut. Je intensiver er sich vom umgebenden Hintergrund abhebt (heller oder dunkler Fleck), desto energischer ist die Zellreaktion.
Dritte Stufe: Das Signal wird im Gehirn verarbeitet. Aus allgemein anerkannter Sicht beginnen die Hauptprozesse der Gehirnverarbeitung im primären visuellen Kortex. Eine weitere signifikante Rekodierung findet statt: Neuronen reagieren nicht nur auf dunkle und helle Flecken auf der Oberfläche der Netzhaut, sondern reagieren auch selektiv auf orientierte kontrastierende Grenzen, orientierte Linienabschnitte und deren Enden. Es gibt komplexere Stimuluskonfigurationen, bei denen Neuronen unabhängig von ihrer Position genau auf die Kontrastgrenze reagieren, wenn sie sich nur in der Verantwortungszone der Zelle befinden. Diese „komplexe“ Verarbeitung im visuellen Kortex wird als zweite Abstraktionsebene bei der Wahrnehmung eines statischen Bildes verwendet, bei der die Erkennung unabhängig von ihrer Position eine neue allgemeinere Wahrnehmungsebene für Grenzen erreicht hat. Als Ergebnis: Erstens überträgt die Netzhaut einfache Signale an die Großhirnrinde; zweitens verwenden Neuronen des primären visuellen Kortex diese einfachen Signale, um kontrastierende Grenzen und Linien zu erkennen; und drittens werden diese grundlegenden Bausteine verwendet, um die Grenzen ganzer Objekte zu definieren und eine visuelle Wahrnehmung zu erzeugen.
Wahrscheinlich nahm niemand an, dass sich dieser Standpunkt in ein grundlegendes Dogma aus Granit verwandeln würde. Die Kantenerkennung hat sich als die einzige Möglichkeit für Säugetiere erwiesen, zu sehen, wie die Evolution die perfekte Lösung für das Problem der effektiven Bildwahrnehmung gefunden hat. In diesem Aufsatz wird dieser Standpunkt in Frage gestellt und unangenehme Fragen zur Natur des Sehens gestellt. Sie wurden bereits mehr als einmal in der Geschichte des Studiums des Sehens angesprochen und schlagen keine einfachen Antworten vor. Die Hauptaufgabe besteht nun darin, sich auf diese Themen zu konzentrieren und die Gründe für Zweifel am modernen Verständnis des Sehvermögens zusammenzuführen.
Die Netzhaut aller Säugetiere sendet nicht standardmäßige Signale an das Gehirn
Eine gründliche Untersuchung des Weges des visuellen Flusses von den Augen zur Großhirnrinde bei Primaten bestätigt kategorisch, dass wie bei anderen Säugetierarten viele parallele Kanäle einen funktionellen Beitrag zum visuellen Fluss von Primaten leisten [1–4]. (Abbildung 2) Einige dieser Kanäle ignorieren sogar den primären visuellen Kortex und gehen sofort zu Abteilungen mit höherer Hierarchie [5]. Vieles davon wurde in klassischen Studien zur Anatomie von Katzen und Affen erwähnt [6–10], wurde jedoch von Pionieren der Neurobiologie bei der Untersuchung des visuellen Kortex ignoriert. Die aggressive Anwendung des Occam-Rasiererprinzips ermöglichte es, den Eigenschaften kortikaler Neuronen eine Bedeutung zu verleihen, da sie ihre Funktion zum Erkennen von Linien oder Grenzen ausschließlich auf der Grundlage von Eingaben von Ganglienzellen mit der Organisation „Zentrum / Umwelt“ aufbauen [11]. Ganglienzellen mit einer nicht standardmäßigen Organisation wurden verworfen, mit einer relativ geringen Anzahl von Primaten in der Netzhaut. Welche Rolle sie bei der visuellen Wahrnehmung spielen, wird im Folgenden beschrieben. Aus Sicht der Neurobiologen ist es erwähnenswert, dass mit der willkürlichen Einführung einer Elektrode in den Sehnerv die Wahrscheinlichkeit, auf ein Axon einer nicht standardmäßigen Ganglienzelle zu stoßen, recht gering ist. Da nicht standardisierte Zellen selten sind, entschieden sich die meisten Experimentatoren für den Weg des geringsten Widerstands und entwickelten Methoden zur Projektion visueller Reize auf die Netzhaut, die am besten für die Untersuchung von Zellen in der Mitte / Umgebung geeignet sind. Dadurch wurden nicht standardmäßige Zellen zu einem statistischen „Burst“ in experimentellen Daten.
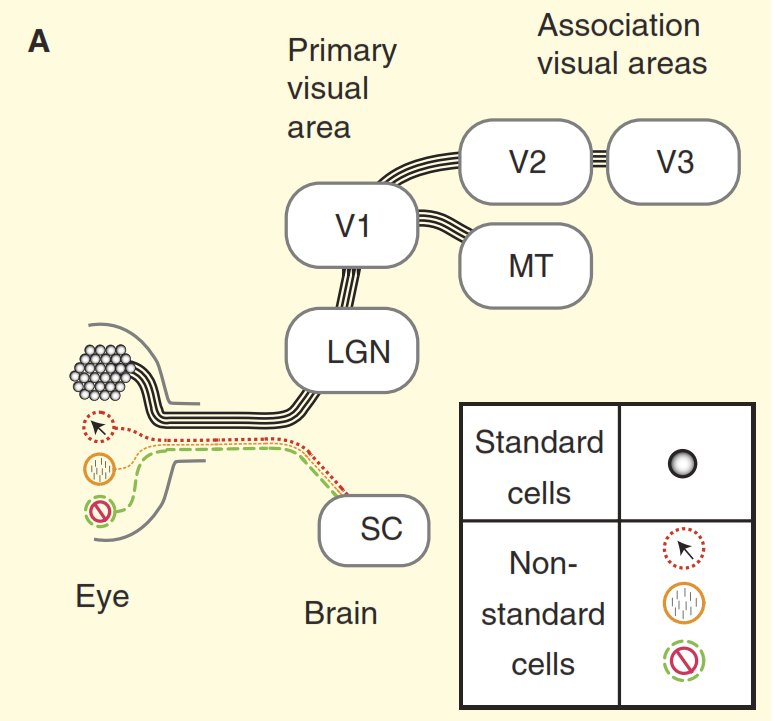
 Abbildung 2. Wahrnehmung des visuellen Systems.
Abbildung 2. Wahrnehmung des visuellen Systems.
(A) Der Standpunkt aus Lehrbüchern zur Gestaltung des visuellen Systems von Primaten am Beispiel des Makaken. Die Netzhaut ist mit einer großen Anzahl von Standardganglienzellen gefüllt, deren Axone den Sehnerv bilden. Die Netzhaut enthält auch eine kleine Anzahl von nicht standardmäßigen Ganglienzellen, die auf andere Weise auf Licht reagieren. Es wird jedoch traditionell angenommen, dass sie nur in die autonomen Zentren des Mittelhirns projiziert werden, nämlich in die obere Dicollis (SC). Konzentrische Zellen ragen in den Relaiskern des Thalamus hinein, des intermediären Kurbelkörpers (LGN), der wiederum Signale an den primären visuellen Kortex (V1) überträgt. Und Standardzellen über den LGN (Intermediate Cranked Body) senden ein Signal an den primären visuellen Kortex (V1) und dann an die höheren Abschnitte des visuellen Kortex (V2, V3, MT).
(B) Eine realistischere Ansicht des visuellen Systems der Primaten. Einige der nicht standardmäßigen Ganglienzellen vergiften das Signal direkt an den LGN (Intermediate Cranked Body) und dann an den primären visuellen Kortex. Außerdem ist die obere Diode keine Sackgasse, von dort geht das Signal zum Zwischenkurbelkörper (LGN) und darüber hinaus. Aber das ist noch nicht alles, beginnend mit dem LGN (Intermediate Cranked Body), der visuelle Fluss hört auf, unidirektional zu sein, und seine umgekehrte Komponente ist stärker als die direkte.Das zweite Problem ist in Abbildung 3 dargestellt. Das obere Diagramm der Abbildung zeigt die Reaktion der Zelle „Zentrum / Umgebung“. Das grundlegende Reaktionsschema ist den Vision-Neurobiologen sehr vertraut: Standard-Ganglienzellen des Zentrums / der Umgebung zeigen eine Kurve der Antwortlinie zur Ortsfrequenz - die maximale Antwort tritt auf, wenn das Gitterband in der Breite genau mit dem Mittelabschnitt des Empfangsfelds des Zentrums / der Zelle übereinstimmt Umwelt. " Betrachten Sie nun die Reaktion einer der nicht standardmäßigen Zellen im Sehnerv, die im selben Experiment erhalten wurden (Abbildung 3 b). Diesmal gehört die Zelle zum sogenannten koniozellulären Typ von Ganglienzellen, einem zusammengesetzten Satz von nicht standardmäßigen Zelltypen, der normalerweise, wenn überhaupt, verallgemeinert wird und als „blauer Weg“ bezeichnet wird. Diese Zelle hat eine Organisation vom Typ "Unterdrückung durch Kontrast" [6,7,12,13], in diesem Experiment ist ihre Reaktion der Reaktion einer Standardzelle "Zentrum / Umgebung" fast vollständig entgegengesetzt. Berücksichtigt man den Unterschied in der Sehschärfe von Affen und Katzen, verhalten sich Ganglienzellen mit „Unterdrückung durch Kontrast“ identisch [12, 13].
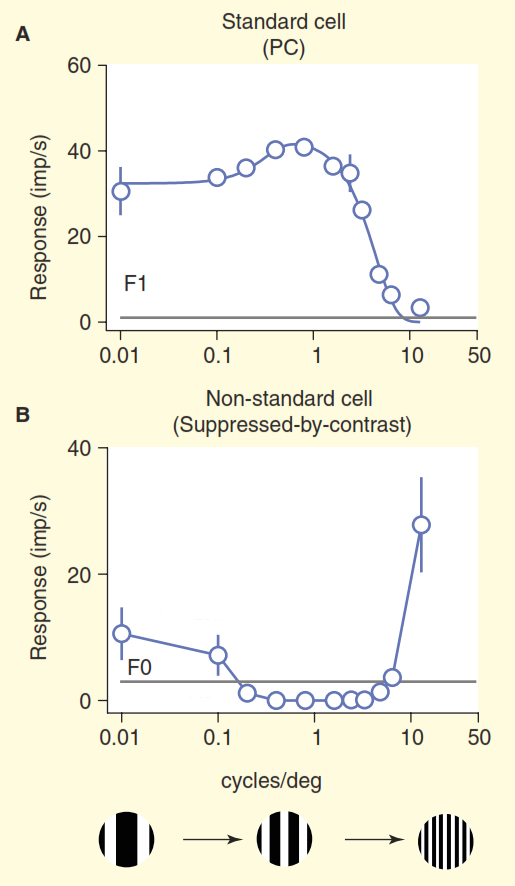 Abbildung 3. Vergleich von Standard- und Nicht-Standard-Empfangsfeldern. Die Zellen wurden durch ein driftendes Gitter mit einer variablen räumlichen Frequenz stimuliert (die Frequenz wird hier als die Gesamtbreite von zwei Schwarz-Weiß-Bändern im Gitter pro Grad des Betrachtungswinkels ausgedrückt). Die Standard-Ganglienzelle „Zentrum / Umgebung“ (A) verhält sich wie erwartet: Wenn die Breite des Gitterbandes nahe an der Breite des Zentrums des Empfangsfelds liegt, reagiert die Zelle stark. Eine nicht standardmäßige Zelle mit „Kontrastunterdrückung“ (B) ist still statt erregt, solange sie zwischen schwarzen und weißen Streifen unterscheiden kann.
Abbildung 3. Vergleich von Standard- und Nicht-Standard-Empfangsfeldern. Die Zellen wurden durch ein driftendes Gitter mit einer variablen räumlichen Frequenz stimuliert (die Frequenz wird hier als die Gesamtbreite von zwei Schwarz-Weiß-Bändern im Gitter pro Grad des Betrachtungswinkels ausgedrückt). Die Standard-Ganglienzelle „Zentrum / Umgebung“ (A) verhält sich wie erwartet: Wenn die Breite des Gitterbandes nahe an der Breite des Zentrums des Empfangsfelds liegt, reagiert die Zelle stark. Eine nicht standardmäßige Zelle mit „Kontrastunterdrückung“ (B) ist still statt erregt, solange sie zwischen schwarzen und weißen Streifen unterscheiden kann.Wir können nur annehmen, dass diese Zellen eine monotone Füllung in ihrem Verantwortungsbereich erkennen, beispielsweise einen klaren blauen Himmel, da sie, wenn die Breite der weißen und schwarzen Balken des Gitters unter die Auflösung des menschlichen Auges abnimmt, zu einem festen Grau verschmelzen. Ein echtes Verständnis der Kodierung visueller Informationen für diese Zellen wird im Standard-Visionsmodell nicht dargestellt.
Alle Nicht-Primaten sehen gut mit Nicht-Standard-Zellen
Befürworter des akzeptierten Sehmodells bei der Betrachtung von Primaten beziehen sich möglicherweise auf eine relativ kleine Anzahl von Nicht-Standardzellen, dies gilt jedoch nicht für die Netzhaut von Kaninchen, Katzen, Ratten und Mäusen [7,8,14–16]. Darüber hinaus liegt die Anzahl der nicht standardmäßigen Zellen in der Netzhaut von Primaten in absoluten Zahlen (etwa 100.000) nahe an der Gesamtzahl der Zellen in der Netzhaut einer Ratte oder Katze [17]. Die Sehschärfe bei Katzen, Kaninchen, Ratten und Mäusen ist geringer als bei Primaten, aber das ist noch nicht alles. Die Vision all dieser Kreaturen ermöglicht es Ihnen, das Überleben in freier Wildbahn erfolgreich zu bewältigen. Jeder, der dies bezweifelt, ist eingeladen, sich an ein Kaninchen auf dem Feld zu schleichen oder eine Maus zu fangen, ohne eine Mausefalle zu benutzen (eine einfache Aufgabe für eine gewöhnliche Katze).
 Abbildung 4. Visuelle Wahrnehmung mit geringen Details.
Abbildung 4. Visuelle Wahrnehmung mit geringen Details.
Beobachter, die mit den Personen auf dem Bild vertraut sind, erkennen sie trotz der geringen Detailgenauigkeit. Wenn ein Bild unscharf wird, bleiben für eine Person genügend nützliche visuelle Informationen übrig. Von links nach rechts: Prinz Charles, Woody Allen, Bill Clinton, Saddam Hussein, Richard Nixon, Prinzessin Diana.Es ist schon aus medizinischen Gründen klar, warum sich Neurowissenschaftler auf die Netzhaut von Primaten konzentriert haben. Eine solche selektive Konzentration beim Versuch, die Vision zu verstehen, führt jedoch dazu, dass die Experimentatoren die Ergebnisse der Selbstwahrnehmung in die Interpretation der Forschungsergebnisse einbringen und übertragen. Die dichte Packung von Ganglienzellen von Primaten eignet sich gut zum Nachweis essbarer Früchte an einem Baum oder zum Lesen der neuesten Ausgabe der New York Times. Es gibt jedoch keinen besonderen Grund, Aufgaben wie Summum Bonum (lat .: Das höchste Gut) des Sehens in Betracht zu ziehen. Im allgemeinen Evolutionsbild kann diese extrem hohe Sehschärfe als spezifische Nischenanpassung für die Erkennung kontrastreicher Objekte aus großer Entfernung angesehen werden. Die meisten Säugetiere in der Netzhaut haben keine Fovea (die zentrale Fossa in der Netzhaut) - ein spezialisiertes Gebiet mit hoher Sehschärfe bei Primaten -, aber das Sehen ohne eine Million dicht gepackter Ganglienzellen bleibt voll funktionsfähig. Der Beweis ist in Abbildung 4 dargestellt. Menschen sind ohne die übliche Sehschärfe leicht zu erkennen [18]. Bei Nicht-Primaten-Säugetieren wurde die Kodierung visueller Reize bei Kaninchen besonders gut untersucht [19–23]. Kaninchen haben große Augen und das optische System ist besser als viele Arten von Primaten, und sie haben auch Standard-Ganglienzellen in der Mitte / Umgebung in ihrer Netzhaut. Diese Standardzellen machen jedoch nur ein Viertel der gesamten Population von Ganglienzellen der Netzhaut aus, die durch etwa zwölf funktionelle und anatomische Typen repräsentiert werden [14, 21]. Es ist klar, dass jeder dieser zwölf Zelltypen durch die Evolution unter seinen eigenen visuellen Reizen gefangen gehalten wird. Die Bedeutung dieser Tatsache liegt jedoch in der Tatsache, dass Kanäle von nicht standardmäßigen Ganglienzellen im visuellen Fluss, der in das Gehirn des Kaninchens fließt, überwiegen. Diese Informationen sind nicht neu: Die Innovation ist der Beweis dafür, dass die Netzhaut aller Säugetiere eine Vielzahl von codierenden visuellen Kanälen an das Gehirn überträgt [4, 13, 24, 25] und dass diese Vielfalt in jede realistische Ansicht des visuellen Geräts einbezogen werden sollte.
Ein bekanntes Beispiel sind Zellen, die selektiv auf die Bewegungsrichtung des Stimulus reagieren. Ein Typ von ihnen sendet direkt ein Signal an die mit der Augenbewegung verbundenen Hirnstammkerne [26]. Ein anderer Typ dieser Zellen ist jedoch nicht so bekannt, dessen Signal nicht nur zum Mittelhirn, sondern auch über die seitlich gekröpften Körper zum primären visuellen Kortex gelangt [19]. Solche Zellen sind nicht so selten, werden aber in Lehrbüchern bei der Beschreibung des Sehgeräts nicht erwähnt. Das Signal von nicht standardmäßigen Ganglienzellen erreicht eindeutig den visuellen Kortex, aber wie wird es verwendet?
Der zweite nicht standardmäßige Zelltyp (identifiziert bei Kaninchen, Katzen und Mäusen) ist der sogenannte lokale Kantendetektor. Wie Zellen, die selektiv auf die Bewegungsrichtung reagieren, wurden sie früher auch als seltene Ganglienzellen angesehen, aber jetzt wissen wir, dass dies auf einen Fehler bei der Verwendung von Elektroden zurückzuführen ist: Sie machen wahrscheinlich etwa 15% aller Ganglienzellen aus [23]. Die Signale dieser Zellen erreichen auch den primären visuellen Kortex, aber ihre Antworten liegen weit über den visuellen Standardantworten [8, 22, 23]. Diese Zellen reagieren am besten auf kleine, sich langsam bewegende Ziele wie ein Raubtier oder ein Raubtier, die sich in großer Entfernung bewegen. Wenn sich jedoch viele kleine Objekte befinden, z. B. in einem strukturierten Feld, reagieren die Zellen nicht mehr. Mit anderen Worten, Zellen reagieren auf ein kleines sich bewegendes Objekt, aber nur, wenn es alleine ist.
Der lokale Kantendetektor ist anscheinend der zahlreichste Typ von Ganglienzellen der Netzhaut bei einem Kaninchen, wurde jedoch nicht in das Standard-Visionsmodell aufgenommen. Können diese Zellen in entfernten Entfernungen ein Bewegungsanalysesystem bilden? Wie verarbeitet der visuelle Kortex Signale von diesen Zellen? Wie nehmen andere Säugetierarten die Welt mit Standard-Ganglienzellen und lokalen Kantendetektoren wahr - oder sogar mit Zellen mit einer weiteren Komprimierung visueller Informationen, die noch entdeckt werden muss?
Der visuelle Kortex ist schlauer als Lehrbücher erkennen
Selbst wenn wir davon ausgehen, dass der gesamte visuelle Fluss nur von Standard-Netzhautzellen codiert wird, ist zu diesem Zeitpunkt bekannt, dass die Verarbeitung im primären visuellen Kortex nicht ausschließlich nach der ursprünglich vorgeschlagenen Methode unter Verwendung von „einfachen“, „komplexen“, „hyperkomplexen“ Neuronen erfolgt, sondern auch Neuronen "mit terminaler Hemmung". Die Diskussion dieser Tatsache hat in der Fachliteratur viel Raum erhalten [27–30].
Die Probleme beginnen mit einer weiteren offensichtlichen Tatsache, dass fast alle Neuronen in der Großhirnrinde nichtlinear sind, was Zweifel an der Nützlichkeit hierarchischer Schemata mit linearen Annahmen bei der Interpretation ihrer Funktion aufkommen lässt [31, 32].
Zweitens ist die Idee von drei Grundtypen von Zellen - „einfach“, „komplex“ und „hyperkomplex“ - eine grobe Abstraktion der vielfältigen Zelltypen des primären visuellen Kortex, die mit anatomischen Methoden identifiziert wurden [33, 34]. Drittens hängen Neuronen des visuellen Kortex nicht nur vom eingehenden visuellen Fluss ab, sondern auch von verschiedenen Kontextsignalen ihrer Nachbarn, so dass die Reaktion auf dieselben Reize, die Teil des Alltagsbildes sind und von Experimentatoren künstlich erzeugt werden, variieren kann [27, 35]. : , , [36].
. 10% [37], , , .
Somit wird deutlich, dass eine Standardansicht des Sehgeräts in einem Sumpf von Dogmen steckt. Welche Schritte sollten unternommen werden, um daraus herauszukommen?Schritt 1: Überprüfen Sie die Grundlagen
, 5 , . , « », [15,16]. ( [24]). .
, , , . . , , , .
, , , 1970- [38]. , , , — — .
Warum ist nach mehr als einem halben Jahrhundert Forschung das Wissen über die Physiologie des Sehens so weit hinter dem Wissen über die Anatomie zurück und was kann getan werden, um die Situation zu verbessern? Abgesehen von dem Problem der Selektivität der Forschung mit einer Elektrode bleibt das Hauptproblem die Wahl der Methoden zur Suche nach dem richtigen Stimulus., – – , . , . , . [38,39], , , . [40], .
[41–43], , . , , . , - . , , «»: - . , «/», ( ) .
. , [27,44]. , , . , , , .
?
, . ? , . , . , , . : , « » «» , .
? . , , , [27,38,45]. , , [46,47]. , [46,48–50]. , – . «» ?
References1. Casagrande VA (1994). A third parallel visual pathway to primate area V1. Trends Neurosci. 17, 305–310.
2. Hendry SHC, and Reid RC (2000). The koniocellular pathway in primate vision. Ann. Rev. Neurosci. 23, 127–153.
3. White AJR, Solomon SG, and Martin PR (2001). Spatial properties of koniocellular cells in the lateral geniculate nucleus of the marmoset Callithrix jacchus. J. Physiol. 533, 519–535.
4. Dacey DM, Peterson BB, Robinson FR, and Gamlin PD (2003). Fireworks in the primate retina: in vitro photodynamics reveals diverse LGN-projecting ganglion cell types. Neuron 37, 15–27.
5. Sincich LC, Park KF, Wohlgemuth MJ, and Horton JC (2004). Bypassing V1: a direct geniculate input to area MT. Nat. Neurosci. 7, 1123–1128.
6. Rodieck RW (1967). Receptive fields in the cat retina: a new type. Science 157, 90–92.
7. Stone J. and Hoffmann K.-P. (1972). Very slow-conducting ganglion cells in the cat's retina: a major, new functional type? Brain Res. 43, 610–616.
8. Cleland BG, Levick WR, Morstyn R., and Wagner HG (1976). Lateral geniculate relay of slowly-conducting retinal afferents to cat visual cortex. J. Physiol. 255, 299–320.
9. DeMonasterio FM (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
10. Yukie M., and Iwai E. (1981). Direct projection from the dorsal lateral geniculate nucleus to the prestriate cortex in macaque monkeys. J. Comp. Neurol. 201, 81–97.
11. Hubel DH, and Wiesel TN (1977). Ferrier lecture. Functional architecture of macaque monkey visual cortex. Proc. R. Soc. Lond. Ser. B Biol. Sci. 198, 1–59.
12. Troy JB, Einstein G., Schuurmans RP, Robson JG, and Enroth-Cugell CH (1989). Responses to sinusoidal gratings of two types of very nonlinear retinal ganglion cells of cat. Visual Neurosci. 3, 213–223.
13. Tailby C., Solomon SG, Dhruv NT, Majaj NJ, Sokol SH, and Lennie P. (2007). A new code for contrast in the primate visual pathway. J. Neurosci. 27, 3904–3909.
14. Rockhill RL, Daly FJ, MacNeil MA, Brown SP, and Masland RH (2002). The Diversity of ganglion cells in a mammalian retina. J. Neurosci. 22, 3831–3843.
15. Badea TC, and Nathans J. (2004). Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J. Comp. Neurol. 480, 331–351.
16. Kong JH, Fish DR, Rockhill RL, and Masland RH (2005). Diversity of ganglion cells in the mouse retina: Unsupervised morphological classification and its limits. J. Comp. Neurol. 489, 293–310.
17. Wassle H. (2004). Parallel processing in the mammalian retina. Nat. Rev. Neurosci. 5, 747–757.
18. Sinha P. (2002). Recognizing complex patterns. Nat. Neurosci. 5 Suppl, 1093–1097.
19. Levick WR, Oyster CW, and Takahashi E. (1969). Rabbit lateral geniculate nucleus: sharpener of directional information. Science 165, 712–714.
20. DeVries SH, and Baylor DA (1997). Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J. Neurophysiol. 78, 2048–2060.
21. Roska B., and Werblin F. (2001). Vertical interactions across ten parallel, stacked representations in the mammalian retina. Nature 410, 583–587.
22. Zeck GM, Xiao Q., and Masland RH (2005). The spatial filtering properties of local edge detectors and brisk-sustained retinal ganglion cells. Eur. J. Neurosci. 22, 2016–2026.
23. van Wyk M., Taylor WR, and Vaney DI (2006). Local edge detectors: a substrate for fine spatial vision at low temporal frequencies in rabbit retina. J. Neurosci. 26, 13250–13263.
24. Masland RH (2001). Neuronal diversity in the retina. Curr. Opin. Neurobiol. 11, 431–436.
25. Dacey DM, Liao HW, Peterson BB, Robinson FR, Smith VC, Pokorny J., Yau KW, and Gamlin PD (2005). Melanopsinexpressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature 433, 749–754.
26. Simpson JI (1984). The accessory optic system. Ann. Rev. Neurosci. 7, 13–41.
27. Carandini M., Demb JB, Mante V., Tolhurst DJ, Dan Y., Olshausen BA, Gallant JL, and Rust NC (2005). Do we know what the early visual system does? J. Neurosci. 25, 10577–10597.
28. Olshausen BA, and Field DJ (2004). Sparse coding of sensory inputs. Curr. Opin Neurobiol. 14, 481–487.
29. Simoncelli EP, and Olshausen BA (2001). Natural image statistics and neural representation. Ann. Rev. Neurosci. 24, 1193–1216.
30. Olshausen BA, and Field DJ (2005). How close are we to understanding v1? Neural. Comput. 17, 1665–1699.
31. Ferster D., and Miller KD (2000). Neural mechanisms of orientation selectivity in the visual cortex. Ann. Rev. Neurosci. 23, 441–471.
32. Anderson JS, Lampl I., Gillespie DC, and Ferster D. (2001). Membrane potential and conductance changes underlying length tuning of cells in cat primary visual cortex. J. Neurosci. 21, 2104–2112.
33. Lund JS, and Yoshioka T. (1991). Local circuit neurons of macaque monkey striate cortex: III. Neurons of laminae 4B, 4A, and 3B. J. Comp. Neurol. 311, 234–258.
34. Cauli B., Audinat E., Lambolez B., Angulo MC, Ropert N., Tsuzuki K., Hestrin S., and Rossier J. (1997). Molecular and physiological diversity of cortical nonpyramidal cells. J. Neurosci. 17, 3894–3906.
35. Zipser K., Lamme VA, and Schiller PH (1996). Contextual modulation in primary visual cortex. J. Neurosci. 16, 7376-7389.
36. Gilbert CD, Sigman M., and Crist RE (2001). The neural basis of perceptual learning. Neuron 31, 681–697.
37. Douglas RJ, and Martin KA (2004). Neuronal circuits of the neocortex. Ann. Rev. Neurosci. 27, 419–451.
38. Troy JB, and Shou T. (2002). The receptive fields of cat retinal ganglion cells in physiological and pathological states: where we are after half a century of research. Prog. Ret. Eye Res. 21, 263–302.
39. Lennie P., and Movshon JA (2005). Coding of color and form in the geniculostriate visual pathway. J. Opt. Soc. Am. 22, 2013–2033.
40. Victor JD (2005). Analyzing receptive fields, classification images and functional images: challenges with opportunities for synergy. Nat. Neurosci. 8, 1651–1656.
41. Srinivasan MV, Jin ZF, Stange G., and Ibbotson MR (1993). 'Vector white noise': a technique for mapping the motion receptive fields of direction-selective visual neurons. Biol. Cybern. 68, 199–207.
42. Meister M., and Berry MJ (1999). The neural code of the retina. Neuron 22, 435–450.
43. Kara P., Reinagel P., and Reid RC (2000). Low response variability in simultaneously recorded retinal, thalamic, and cortical neurons. Neuron 27, 635–646.
44. Ringach DL, Hawken MJ, and Shapley R. (2002). Receptive field structure of neurons in monkey primary visual cortex revealed by stimulation with natural image sequences. J. Vision 2, 12–24.
45. Schwartz O., and Simoncelli EP (2001). Natural signal statistics and sensory gain control. Nat. Neurosci. 4, 819–825.
46. Horridge A. (2000). Seven experiments on pattern vision of the honeybee, with a model. Vision Res. 40, 2589-2603.
47. Srinivasan MV (2006). Honeybee vision: in good shape for shape recognition. Curr. Biol. 16, R58–60.
48. Marr D. (1982). Vision: A Computational Investigation in the Human Representation and Processing of Visual Information (New York: WH Freeman).
49. Barlow HB (1997). The knowledge used in vision and where it comes from. Phil.Trans. Roy. Soc. Lond. B 352, 1141–1147.
50. Riesenhuber M., and Poggio T. (2000). Models of object recognition. Nat. Neurosci. 3, 1199–1204.