Das Altern des Menschen wird derzeit als physiologische Abnahme der biologischen Funktionen im Körper mit ständiger Anpassung an innere und äußere Schäden definiert. Das endokrine System spielt eine wichtige Rolle bei der Organisation von Zellinteraktionen, Stoffwechsel, Wachstum und Alterung. Mehrere Studien, von Würmern bis zu Mischas, haben gezeigt, dass die Unterdrückung der Aktivität des Wachstumshormon / Insulin-ähnlichen Wachstumsfaktors 1 / Insulin (GH / IGF-1 / Insulin) zur Verlängerung der Lebensdauer des Menschen nützlich sein kann, während die Ergebnisse beim Menschen widersprüchlich sind. In diesem Aufsatz diskutieren wir die mögliche Rolle des IGF-1-Systems bei der Modulation der Langlebigkeit und stellen die Hypothese auf, dass die bei Hundertjährigen und Säugetieren mit Kalorieneinschränkung beobachtete endokrine und metabolische Anpassung eine physiologische Strategie zur Erhöhung der Lebenserwartung aufgrund eines langsameren Zellwachstums sein könnte / Stoffwechsel, bessere Nutzung physiologischer Reserven, Verschiebung des Zellstoffwechsels von der Zellproliferation zu regenerativen Wirkungen und Verringerung der Akkumulation alternder Zellen.
Eintrag.Altern ist definiert als eine physiologische Abnahme der biologischen Funktionen im Körper mit einer fortschreitenden Abnahme oder einem Verlust der Anpassung an innere und äußere Schäden. Beim Menschen ist der Phänotyp des Alterns äußerst heterogen und kann als komplexes Mosaik beschrieben werden, das aus der Wechselwirkung mehrerer zufälliger Ereignisse und Umweltereignisse sowie genetischer und epigenetischer Veränderungen resultiert, die sich im Laufe des Lebens angesammelt haben. Trotz seiner enormen Komplexität wird die molekulare Basis des Alterns durch die wenigen hoch evolutionär konservativen biologischen Mechanismen begrenzt, die für die Erhaltung und Wiederherstellung des Körpers verantwortlich sind (1).
In den letzten drei Jahrzehnten war eines der am meisten diskutierten Themen in der Gerontologie die Rolle des Wachstumshormons (GH) / Insulin-ähnlichen Wachstumsfaktors 1 (IGF-1) / Insulinsystems bei der Regulierung der Langlebigkeit. Die gesammelten Daten zeigen, dass dieser Weg eine wichtige Rolle bei der Pathogenese einer Reihe von altersbedingten Krankheiten spielt, darunter Krebs, Demenz, Herz-Kreislauf- und Stoffwechselerkrankungen (2 - 4).
In Tiermodellen wurde gezeigt, dass die Hemmung des GH / IGF-1 / Insulinsystems die Lebensdauer signifikant verlängert. Beim Menschen sind die Daten jedoch widersprüchlich (5, 6).
Diese Übersicht beschreibt die neuesten Fortschritte bei der Untersuchung des IGF-1-Systems und der Modulation der Langlebigkeit. Es wird die Hypothese aufgestellt, dass die bei Hundertjährigen und Säugetieren während der Kalorienreduktion beobachtete endokrine und metabolische Anpassung eine physiologische Strategie zur Erhöhung der Lebenserwartung aufgrund einer langsameren sein kann Zellwachstum / -stoffwechsel, bessere Kontrolle der Signalübertragung und der physiologischen Reservekapazitäten sowie verringerte Akkumulation alternder Zellen.
IGF-1-System und Haltbarkeit in Tiermodellen
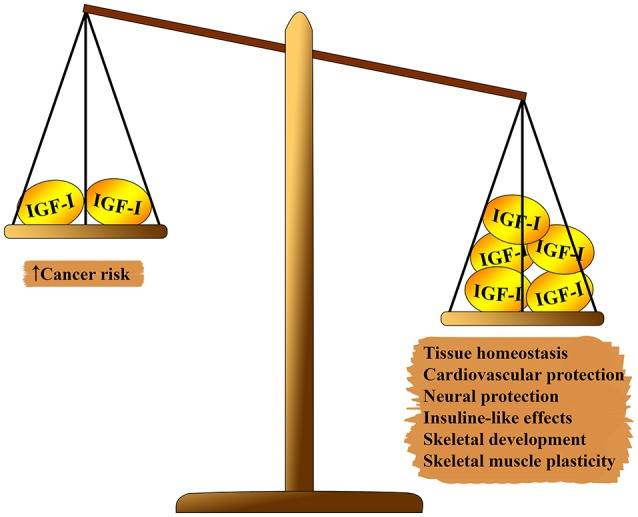 1 Pleiotrope Wirkung von IGF-1 auf den Körper. Auf einer Seite der Skala, die überwiegt: Gewebehomöostase, kardioprotektive und neuroprotektive Effekte, insulinähnliche Effekte, Beteiligung an der Bildung des Skeletts und Muskelregeneration. Auf der zweiten Seite des Gleichgewichts: das Risiko der Karzinogenese.
1 Pleiotrope Wirkung von IGF-1 auf den Körper. Auf einer Seite der Skala, die überwiegt: Gewebehomöostase, kardioprotektive und neuroprotektive Effekte, insulinähnliche Effekte, Beteiligung an der Bildung des Skeletts und Muskelregeneration. Auf der zweiten Seite des Gleichgewichts: das Risiko der Karzinogenese.Das IGF-1-System hat mehrere pleiotrope Auswirkungen auf die biologische Alterung (siehe Abbildung 1). IGF-1 spielt eine wichtige Rolle bei der Entwicklung des Fötus, seinem Wachstum im Kindes- und Jugendalter und der Homöostase des adulten Gewebes. Darüber hinaus hat IGF-1 offenbar eine atheroprotektive Wirkung, eine neurale Schutz- und Insulin-ähnliche Wirkung (in hohen Konzentrationen) und reguliert den Knochenstoffwechsel und die Muskelregeneration. Trotzdem ist IGF-1 aufgrund seiner starken proliferativen Aktivität, hauptsächlich aufgrund von Zellzyklusmodulation, Apoptose und Zellüberleben, ein Hauptrisikofaktor bei der Entwicklung verschiedener Arten von Tumoren (7 - 9). Die meisten dieser Effekte werden durch Wechselwirkung mit dem Insulinrezeptorsubstrat (IRS) -1 und -2 und Modulation des PI3K / AKT / Säuger-Rapamycin-Zielweges (mTOR) vermittelt (siehe 2).
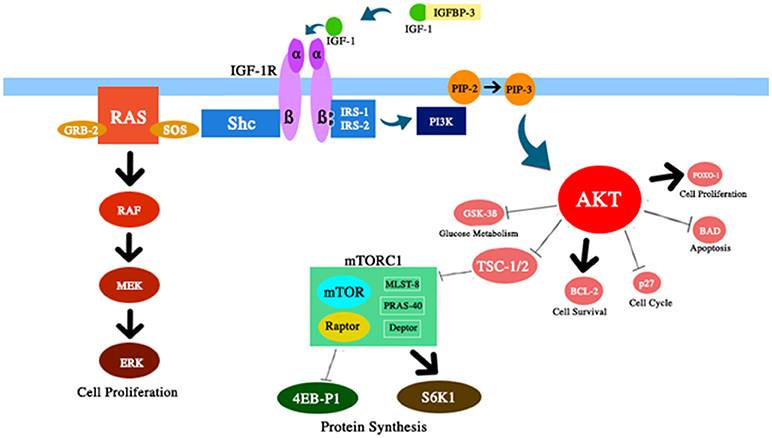 Abbildung 2 Schematische Darstellung mehrerer Komponenten des in dieser Übersicht diskutierten IGF-1 / PI3K / AKT / mTOR-Pfads. IGF-1 erhöht die AKT-Aktivität mit entsprechenden Auswirkungen auf das Überleben und die Proliferation der Zellen, den Glukosestoffwechsel und die Proteinsynthese.
Abbildung 2 Schematische Darstellung mehrerer Komponenten des in dieser Übersicht diskutierten IGF-1 / PI3K / AKT / mTOR-Pfads. IGF-1 erhöht die AKT-Aktivität mit entsprechenden Auswirkungen auf das Überleben und die Proliferation der Zellen, den Glukosestoffwechsel und die Proteinsynthese.
Mehrere präklinische Studien haben berichtet, dass Mutationen in Genen, die den GH / IGF-1 / Insulin-Signalweg steuern, die Lebensdauer sowohl in Tiermodellen für Wirbellose als auch für Wirbeltiere signifikant verlängern können (5, 6).
Wirbellose Modelle.Bei Wirbellosen wird die Insulin / IGF-ähnliche Kaskade durch mehrere Peptide reguliert, die mit einem gemeinsamen Insulin / IGF-1-ähnlichen Rezeptor interagieren können.
Beim Nematoden Caenorhabditis elegans besteht der Insulin / IGF-ähnliche Weg aus mehreren Proteinen, die von den daf-2-Genen im Alter von 1 (kodierend für die katalytische Untereinheit PI3K), akt-1, akt-2, pdk-1, sgk-1 (Serin-Threonin-Kinasen) kodiert werden ), daf-16, skn-1 und daf-18 (PTEN, Phosphatase, die an der Hemmung des AKT-Signalwegs beteiligt ist). Es wurde gezeigt, dass eine verringerte Aktivität der Gene daf-2, age-1, akt-1, akt-2, pdk-1, sgk-1 diesen Weg unterdrückt, und es wurde berichtet, dass Tiere mit diesen Mutationen langsamer altern und eine verlängerte Lebensdauer haben bis zu 300%. Im Gegensatz dazu verkürzt die Stimulation des Insulin / IGF-ähnlichen Signalwegs die Lebensdauer der Nematoden (10, 11).
In der Fruchtfliege Drosophila melanogaster besteht die Insulin / IGF-ähnliche Signalübertragung aus dINR (Insulinrezeptor-ähnliches Protein / IGF-1), CHICO-Insulinrezeptorsubstrat, PI3K Dp110 / p60 und PK3 PI3K-Ziel. Es wurde berichtet, dass Fliegen mit einer Mutation in diesen Genen die Lebenserwartung signifikant erhöhten (12, 13).
Überraschenderweise beeinflussen dieselben molekularen Mechanismen in verschiedenen Geweben das Altern nicht in gleicher Weise. Mehrere Studien an Nematoden und Fruchtfliegen haben gezeigt, dass eine Abnahme der Insulin / IGF-ähnlichen Signalübertragung in Nerven- und Fettgewebe eine wichtige Rolle bei der Regulierung der Langlebigkeit spielt (14, 15). Obwohl in Wirbellosen-Modellen gezeigt wurde, dass diese Kaskade für die Modulation der Lebensdauer wichtig ist, sind die Auswirkungen von Insulin / IGF-ähnlichen Signalen auf die Lebensdauer bei Wirbeltieren viel komplexer, da sie funktionell spezifische Insulin- und IGF-Moleküle, IGF-bindende Proteine (IGFBPs) aufweisen ), IGFBP, GH-Proteasen, mehrere Rezeptoren und verschiedene Mechanismen der intrazellulären Signalübertragung mit unterschiedlicher gewebespezifischer Expression (16).
WirbeltiermodelleMehrere mutierte GH / IGF-1-Mäuse wurden mit unterschiedlichen Zielen entworfen. Die aktuellsten Modelle werden unten beschrieben.
Mäuse Snell und Ames.Die Snell- und Ames-Mäuse sind zwei Mausstämme mit Mutationen in den PIT-1- bzw. PROP-1-Genen (17, 18). Da beide Proteine PIT-1 und PROP-1 für die Differenzierung von Hypophysenzellen erforderlich sind, die GH, Prolaktin und Schilddrüsen-stimulierendes Hormon produzieren, fehlen beiden Arten von homozygoten mutierten Mäusen alle drei Hormone (18). Diese Modelle zeigten einen signifikanten Anstieg der Lebenserwartung (42–70% mehr als bei Wildtyp-Mäusen), eine erhöhte Insulinsensitivität und eine niedrigere Tumorfrequenz (19, 20). Wenn Ames-Mäuse kalorienreduziert waren, erhöhte sich ihre Lebensdauer noch mehr (21). Obwohl diesen Tieren drei Hormone fehlen, wurde gezeigt, dass eine zunehmende Lebenserwartung hauptsächlich vom GH-Mangel abhängt (22).
Beleuchtete / beleuchtete MausLit / lit-Mäuse haben einen GH-Mangel und eine Mutation im Gen, das den GH-Releasing-Hormonrezeptor (GHRHR) codiert. Diese Tiere waren Zwerge, hatten ein erhöhtes Fettgewebe, niedrigere Tumorraten und eine um 23–25% erhöhte Lebenserwartung (19).
GH-Releasing Hormone-Knockout (GHRH-KO) -Maus.Knockout-Mäuse GH-Releasing-Hormon (GHRH-KO) leben 43% (bei Frauen) und 51% (bei Männern) länger als Wildtyp-Tiere und weisen viele phänotypische Merkmale von Ames-Mäusen auf, wie z. B. Überempfindlichkeit gegen Insulin, eine Abnahme der Plasmatriglycerid- und Cholesterinspiegel, eine Zunahme des Fettgewebes, erhöhte Plasma-Leptin- und Adiponektinspiegel (23).
GH-Rezeptor-Knockout-Mäuse (GHR-KO)GH-Rezeptor-Knockout-Mäuse (GHR-KO) haben erhöhte GH-Spiegel im Serum und sehr niedrige IGF-1-Spiegel. Es wurde auch berichtet, dass dieser Mäusestamm 38–55% länger lebte als der Wildtyp (24) und eine Verringerung des oxidativen Stresses sowie ein geringeres und verzögertes Auftreten tödlicher Tumoren zeigte (25). Ähnliche Ergebnisse wurden bei df / KO-Mäusen beobachtet, die zwei Mischa-Stränge, GHR-KO- und Ames-Zwerge, kreuzten, denen der GH- und GH-Rezeptor fehlte und die Lebenserwartung weiter erhöhten (26). Im Gegensatz zu wilden Ames-Geschwistern und Zwergmäusen verlängerte die Kalorieneinschränkung die Lebensdauer von GHR-KO-Mäusen nicht, was darauf hindeutet, dass die GH / IGF-1-Achse und die Kalorieneinschränkung ähnliche oder teilweise überlappende Mechanismen zur Verlängerung der Lebensdauer aufweisen können (27). .
GH-Rezeptorantagonismus (GHA)Nicht alle Tiermodelle mit Unterdrückung des GH / IGF-1-Systems zeigen eine Erhöhung der Lebenserwartung. Der GHA-Stamm von Mäusen ist ein solches Beispiel. GHA, das durch Ersetzen einer Aminosäure erzeugt wird, kann den GH-Rezeptor mit der gleichen Affinität wie GH binden, verursacht jedoch keine intrazelluläre Signalübertragung. Die Lebenserwartung von GHA-Mäusen stieg nicht signifikant an (28).
IGF-1R +/– MäuseWährend die meisten Mäuse mit einem inaktiven IGF-1-Rezeptor (IGF-1R - / -) bei der Geburt sterben, zeigten Tiere, die heterozygot für das mutierte Allel des IGF-1-Rezeptors (IGF-1R ±) waren, sehr niedrige Serum-IGF-1-Spiegel , etwa 10% geringere und 33% längere Lebenserwartung bei Frauen und 16% bei Männern. In dieser Studie überlebten Wildtyp-Kontrollen jedoch bis zu 19 Monate, was die Interpretation der Ergebnisse gefährdete (29). Neuere Studien zur Bewertung der Lebenserwartung in einer anderen IGF-1R ± -Linie zeigten einen leichten Anstieg der Lebenserwartung um 5–10%, jedoch nur bei Frauen (30, 31). Darüber hinaus scheint die Haupthintergrundbelastung den Grad der Lebensverlängerung in mehreren Mausmodellen zu beeinflussen (32).
Ein gehirnspezifischer IGF1-R +/–Eine gehirnspezifische IGF1-R +/– -Mutante lebte 9% länger als der Wildtyp, was die entsprechende Rolle des Nervensystems bei der Modulation der Langlebigkeit unterstreicht (33).
Leberspezifische Mäuse mit IGF-1-Störung (LI-IGF-1 - / -).Mäuse mit beeinträchtigter IGF-1-Produktion (LI-IGF-1 - / -) weisen aufgrund der Inaktivierung des IGF-1-Gens sehr niedrige IGF-1-Serumspiegel und hohe GH-Serumspiegel auf. LI-IGF-1 - / - Mäuse hatten eine deutlich verringerte Fettleibigkeit und infolgedessen war das Gewicht 25% niedriger als das von Wildtyp-Mäusen. Nur weibliche LI-IGF-1 - / - Mäuse zeigten im Vergleich zu Kontrollmäusen einen Anstieg der Lebenserwartung um 16% (34).
Pappa - / - Mäuse.Pappa - / - Mäuse haben ein Knockout des Gens für schwangerschaftsassoziiertes Plasmaprotein A, PAPP-A, PAPPA, eine spezifische Protease für IGF-Bindungsproteine. Die durchschnittliche Lebensdauer dieses Mausstamms war im Vergleich zu Wildtyp-Kontrollen um 38% länger. Pappa - / - Mäuse waren Zwerge, aber ihre Serumglukose-, Insulin-, IGF-1- und GH-Spiegel unterschieden sich nicht von denen der Wildtyp-Kontrollen, was darauf hindeutet, dass PAPPA hauptsächlich auf autokriner oder parakriner Ebene wirkt. Neben der Erhöhung der Lebenserwartung zeigten Pappa - / - Mäuse eine geringere Inzidenz von Tumoren sowie altersbedingte degenerative Läsionen (35, 36).
IRS gestörte (IRS1 - / -) Maus.IRS-1 und -2 sind wichtige Mediatoren für Insulin sowie für die IGF-1-Signalübertragung. IRS1 - / - Mäuse waren insulinresistent, mit einem Defekt in der Übertragung von Insulinsignalen hauptsächlich im Muskelgewebe, der etwa 30% kürzer als der Wildtyp war, und nur Frauen hatten eine um 18% längere Lebenserwartung im Vergleich zu Wildtyp-Tieren (37) ) )
IRS2 - / - Mäuse waren ebenfalls insulinresistent, zeigten jedoch im Gegensatz zu IRS1 - / - Mäusen Insulinsignaldefekte in mehr Geweben, einschließlich Leber, Fettgewebe und Skelettmuskel. Diese Mäuse entwickelten Diabetes und ihre Lebensdauer war viel kürzer als die von Wildtyp-Mäusen und IRS2 ± -Mäusen. IRS2 +/– Mäuse hatten im Vergleich zu Wildtyp-Mäusen eine verbesserte Insulinsensitivität und eine erhöhte Lebenserwartung (+ 18%). Darüber hinaus wurde berichtet, dass gehirnspezifische Mäuse IRS2 ± und IRS2 - / - insulinresistent sind und 18 bzw. 14% länger leben als Wildtyp-Kontrollen (38).
KLOTHO modifizierte Mäuse.Das KLOTHO-Protein hemmt die Insulin- und IGF-1-Signalübertragung, möglicherweise durch Unterbrechung der Rezeptor / Ligand-Wechselwirkung. Es wurde berichtet, dass KLOTHO-Überexpressionsmäuse von normaler Größe waren und sich bei Männern eine Insulinresistenz entwickelte und die Lebenserwartung sowohl bei Männern als auch bei Frauen signifikant erhöht war (+18 bzw. + 30%) (39, 40).
P66shc gestörte Maus (P66shc - / -).P66shc ist ein Protein, das die IGF-1-Signalübertragung nach dem Rezeptor durch Aktivierung des MAPK-Signalwegs vermittelt. P66shc - / - Mäuse hatten einen normalen Phänotyp, lebten jedoch 28% länger als Wildtyp-Kontrollen (41). Diese Daten wurden jedoch in einer kürzlich durchgeführten Studie nicht bestätigt (42).
Die Rolle der GH / IGF-1 / Insulinsignalisierung für Alterung und Langlebigkeit wurde in all diesen Tiermodellen eingehend untersucht. Während wirbellose Tiere den Effekt der Unterdrückung des IGF-1 / Insulin-Signalwegs auf die Lebenserwartung offensichtlich und signifikant zeigten, war dieser Effekt in Mausmodellen geschwächt und in einigen Fällen nicht reproduzierbar, wie beispielsweise in den Linien IGF-1R ± und P66shc - / - Mäuse. Die meisten dieser Modelle zeigten jedoch einige Gemeinsamkeiten bei langlebigen Mäusen, wie z. B. verringerte Spiegel an zirkulierendem IGF-1 und Insulin sowie eine erhöhte Insulinsensitivität, die wahrscheinlich die Krebsinzidenz verringern, die Stressresistenz verbessern und das Leben verlängern. . Genetische Veränderungen, die das IGF-1-System stören können, können Tiere länger gesund halten und einige altersbedingte Krankheiten verzögern oder lindern. Dabei spielen das Nerven- und Fettgewebe eine wichtige Rolle.
Darüber hinaus werden zusätzliche Daten benötigt, um den besten Zeitpunkt während der Lebensdauer zu bestimmen, um in die Unterdrückung des IGF-1-Systems einzugreifen und einen positiven Effekt auf die Lebensdauer zu erzielen. Bei igf f / f C57B l / 6-Mäusen erhöhte ein Mangel an zirkulierendem IGF-1 ab einem Alter von 5 Monaten oder früher die Lebenserwartung nur bei Frauen um 15%, wobei die Anzahl der Organe mit Pathologie am Lebensende im Vergleich zur Kontrollgruppe abnahm . Darüber hinaus verringerte ein später IGF-1-Mangel (15 Monate) das Krebsrisiko, hatte jedoch keinen positiven Einfluss auf die Lebenserwartung (43). Diese Daten unterstreichen die Bedeutung eines IGF-1-Mangels in einem frühen Alter für die Erhöhung der Lebenserwartung. Auf der anderen Seite haben Mao et al. (44) berichteten kürzlich, dass die späte Verabreichung eines gegen den IGF-1-Rezeptor gerichteten monoklonalen Antikörpers an 18 Monate alte CB6F1-Mäuse die Lebenserwartung von Frauen um 9% verlängerte und einige Aspekte der Gesundheit verbesserte.
IGF-1-System bei langlebigen Menschen
Hundertjährige Hundertjährige gelten als das beste menschliche Modell zur Untersuchung der biologischen Determinanten der Langlebigkeit, die die extremsten Werte der menschlichen Lebenserwartung erreicht haben (45).
In mehreren Studien wurden die Insulin- und IGF-1-Spiegel im Blutkreislauf in Langlebern mit denen in jüngeren Kontrollen verglichen (46).
Der metabolische altersbedingte Umbau ist ein physiologischer Prozess, der in der gesamten Bevölkerung stattfindet. Altern ist häufig mit einer Abnahme der Glukosetoleranz verbunden, die mit einer erhöhten Insulinresistenz verbunden ist (47), aber langlebige Menschen haben eine Ausnahme. Es wurde festgestellt (48), dass die Insulinresistenz bei Menschen über 90 Jahren in Süditalien mit dem Alter zunimmt und abnimmt. In der Tat zeigten langlebige Probanden eine höhere Insulinsensitivität und eine bessere Betazellfunktion als jüngere Probanden. Dieser Unterschied hing auch nicht von den wichtigsten anthropometrischen und metabolischen Faktoren ab. Bei 100-jährigen Patienten war die Plasmaglukosekonzentration 2 Stunden lang niedriger als bei älteren Patienten (Durchschnittsalter 78 Jahre). Bei Langlebern war die Insulin-vermittelte Glukoseaufnahme während der euglykämischen Glukoseaufnahme höher als bei älteren Kontrollpersonen, wodurch die erhaltene Glukosetoleranz und Insulinwirkung in dieser langlebigen Gruppe erhalten blieb (49, 50). Ähnliche Ergebnisse, die die beste Empfindlichkeit gegenüber Insulin bestätigen, wurden in anderen Populationen von Langlebern beobachtet (51, 52).
Darüber hinaus zeigten Langleber die konservierte Wirkung von Insulin nicht nur auf den Glukosestoffwechsel, sondern auch auf das Fettgewebe. Tatsächlich ist eine Insulininfusion gewöhnlich mit einer Hemmung der Lipolyse und damit mit einer signifikanten Abnahme der Konzentration an freien Fettsäuren und Triglyceriden im Plasma verbunden. Bei Langlebern war die Hemmaktivität von Insulin während der Lipolyse höher als bei den Kontrollpersonen (Durchschnittsalter 78 Jahre) (50).
Es sollte beachtet werden, dass Hundertjährige im Vergleich zu Kontrollen bei Erwachsenen auch einen geringeren sympathischen Ton haben, was mit einer besseren Insulinwirkung und daher mit einem niedrigen Nüchternplasmainsulinspiegel verbunden sein kann (53, 54).Die Daten zum IGF-1-System zur Lebenserwartung sind bei langlebigen Probanden immer noch widersprüchlich (46). Paolisso et al. (55) beschrieben ein erhöhtes Plasma-IGF-1 / IGFBP-3-Verhältnis bei gesunden Langlebern im Vergleich zu älteren Menschen. Sie schlugen vor, dass dieses erhöhte Verhältnis auf eine höhere Bioverfügbarkeit von IGF-1 hinweist, was zu einer Verbesserung der Insulinwirkung in Langlebern beiträgt. Bonafè et al. (56) berichteten, dass Probanden mit mindestens dem A-Allel des IGF-1-Rezeptor-Gens (G / A, Codon 1013) niedrige Plasmaspiegel an freiem IGF-1 aufwiesen und bei langlebigen Menschen häufiger auftraten. Arai et al. (57) beschrieben relativ niedrige Serum-IGF-1-Spiegel in der japanischen Langleberpopulation. In dieser Population waren die niedrigsten Raten von IGF-1 und IGFBP-3 mit einer erhöhten Mortalität verbunden (58).Diese widersprüchlichen Ergebnisse spiegeln wahrscheinlich die Komplexität des IGF-Systems und ethnische Unterschiede in der registrierten Bevölkerung wider. Darüber hinaus wurden Hundertjährige häufig mit einer Kontrollgruppe jüngerer Probanden verglichen. Daher war es in den meisten dieser Studien unmöglich zu schließen, ob die Unterschiede zwischen IGF-1 in beiden Gruppen mit unterschiedlicher Lebenserwartung verbunden waren oder eine physiologisch altersabhängige Abnahme von IGF-1 widerspiegelten. In der Tat gibt es mehrere Einschränkungen für die Untersuchung von Langlebern: (1) niedrige Prävalenz (1 Jahrhundert pro 5-10.000 Einwohner), (2) Schwäche aufgrund extremen Alters (fast 95% der Langleber haben mindestens 1 Astheniekriterium), (3 ) das Fehlen einer gleichaltrigen Kontrollgruppe (45, 59). Aufgrund dieser Einschränkungen eignet sich dieses menschliche Modell nicht zur Untersuchung altersbedingter Variablen.die an der Modulation der Lebenserwartung beteiligt sein können.Die Nachkommen von Hundertjährigen sind ein weiteres interessantes Modell zur Bestimmung der relevanten Faktoren, die mit der Langlebigkeit des Menschen und dem gesunden Altern verbunden sind. Eine konsistente Reihe von Beobachtungen in verschiedenen Ländern legt nahe, dass die Nachkommen von Langlebern gesünder sind als Vertreter derselben Bevölkerungsgruppe (51, 60, 61) und biologisch (epigenetisch) jünger als ihr chronologisches Alter (62). Im Allgemeinen zeigen diese Studien, dass Angehörige von Hundertjährigen eher länger leben und gesund sind (60, 63). Darüber hinaus hat die Untersuchung der Nachkommen von Langlebern den Vorteil, eine geeignete demografisch ausgewählte Kontrollgruppe zu haben, die aus Nachkommen vergleichbaren Alters besteht, bei denen beide Elternteile in derselben Kohorte von Hundertjährigen geboren wurden, jedoch vor dem Schwellenalter starben.Danach werden die Menschen als „Hundertjährige“ eingestuft. Diese Strategie ist entscheidend, um Kohorteneffekte zu verhindern. Somit kann das Modell der Nachkommen von Langlebern einige der Einschränkungen überwinden, die bei der Untersuchung von Langlebern zu finden sind (Seltenheit, Schwäche und mangelnde Kontrolle) (60).In mehreren Studien wurde das IGF-1 / Insulinsystem bei Nachkommen von Langlebern und in der entsprechenden Kontrollgruppe charakterisiert.Wir bewerteten die zirkulierende Bioaktivität von IGF-1, gemessen unter Verwendung eines innovativen Kinase-Rezeptor-Aktivierungsassays (KIRA), der an Langlebern, Langlebern-Nachkommen und vergleichbaren Kontrollnachkommen durchgeführt wurde. Die Nachkommen von Langlebern und Langlebern hatten im Vergleich zur Kontrollgruppe eine relativ geringere zirkulierende biologische Aktivität von IGF-1. Interessanterweise war die biologische Aktivität von IGF-1 bei Nachkommen von Langlebern umgekehrt proportional zur Insulinsensitivität (51).Suh et al. (64) untersuchten die IGF-1-Serumspiegel bei Nachkommen jüdischer aschkenasischer Hundertjähriger und bei altersvergleichenden Kontrollen. Bei weiblichen langlebigen Kindern war der Serum-IGF-1 um 35% höher als bei Kontrollpersonen. Dieser Unterschied kann eine kompensatorische Reaktion auf eine Abnahme der IGF-1-Rezeptorsignalisierung darstellen. Darüber hinaus beschrieb das jüdische Vorhandensein von aschkenasischen Hundertjährigen das übermäßige Vorhandensein heterozygoter Mutationen im IGF-1-Rezeptorgen zusammen mit relativ hohen IGF-1-Serumspiegeln und einer verringerten IGF-1-Rezeptoraktivität im Vergleich zur Kontrollgruppe ohne Familienlebensdauer.Um die Langlebigkeit zu untersuchen, untersuchten andere Autoren neunzigjährige Brüder und Schwestern und ihre Nachkommen. In der Leyden-Studie zur Langlebigkeit wurden 421 Familien ausgewählt, bestehend aus mindestens zwei Reportern, Brüdern und Schwestern, ihren Nachkommen und Partnern von Nachkommen als Kontrolle. In diesen Populationen waren Serumglukose, Insulin und Triglyceride der beste Biomarker für gesundes Altern (niedrige Glukose- und Insulinspiegel wurden als gesund angesehen) (65). Neunjährige Hundertjährige mit dem niedrigsten IGF-1 / IGFBP-3-Verhältnis im Blutkreislauf waren mit einem besseren Überleben assoziiert (66). Nachkommen von Neunjährigen zeigten im Vergleich zu ihren Partnern eine bessere Insulinsensitivität, während in beiden Fastengruppen ähnliche Spiegel an Fasten-Serum IGF-1 und IGFBP-3 beobachtet wurden (67). InteressantDie 24-Stunden-GH-Gesamtsekretion war bei den Nachkommen im Vergleich zur Kontrolle um 28% niedriger (68).Ein weiterer Ansatz zur Untersuchung der Langlebigkeit beim Menschen besteht darin, Familienkomponenten für außergewöhnliche Langlebigkeit und gesundes Altern anhand strenger Kriterien auszuwählen, wie beispielsweise die Long Life Family Study, ein Maß für die Familienlebensdauer. Diese Familien, die aufgrund ihrer außergewöhnlichen Lebenserwartung ausgewählt wurden, wurden mit einer Kontrollgruppe ohne Familienlebensdauer verglichen (69). In dieser Population erwiesen sich zirkulierende IGF-1-Spiegel als zuverlässiger altersbedingter Biomarker (70).Zur Unterstützung der möglichen Rolle des GH / IGF-1 / Insulinsystems für die Langlebigkeit des Menschen gibt es viele genetische Studien. In der Tat wurde festgestellt, dass mehrere genetische Loci mit zirkulierenden Spiegeln von IGF-1 und IGFBP-3 assoziiert sind und möglicherweise das Altern beeinflussen können (71). Eine genomweite Analyse der Assoziationen bei 90-Jährigen und Patientenpopulationen im Alter von <60 Jahren zeigte einen klaren Zusammenhang zwischen der genetischen Variation der am Insulin / IGF-1-Signalweg beteiligten Gene und der Lebensdauer des Menschen (72). In einer prospektiven Studie an älteren Menschen zeigten Frauen mit einem genetischen Profil, das auf eine Abnahme der Insulin / IGF-1-Signalaktivität hinweist, eine längere Lebensdauer (73).In vier unabhängigen Kohorten langlebiger Personen wurde kürzlich ein linearer Anstieg der Prävalenz der Homozygotie des exogenen 3 (G3R) GH-Rezeptors mit dem Alter beschrieben. Das Vorhandensein des Genotyps d3 / d3 erhöhte die Lebenserwartung um etwa 10 Jahre (74).IGF-1
Eine der überzeugendsten Beobachtungen in der Biologie des Alterns ist die Fähigkeit, Kalorien zu begrenzen, um einige altersbedingte Krankheiten zu verhindern oder zu verzögern und die Lebenserwartung von Säugetieren zu erhöhen (75 - 78). Die biologischen Mechanismen dieses Phänomens sind nicht ganz klar, aber es wurde ein Vorschlag über die mögliche Beteiligung entsprechender Veränderungen des Energiestoffwechsels, des endokrinen Systems und oxidativer Schäden gemacht.
Kalorienreduzierung verursacht zahlreiche hormonelle Veränderungen. Bei Nagetieren unterdrückte eine Kalorienrestriktion ohne Hunger die zirkulierenden Spiegel von IGF-1 und Insulin im Verhältnis zum Restriktionsgrad, erhöhte die Insulinsensitivität und -resistenz gegen Stress und Toxizität und verringerte das Krebsrisiko (79, 80). Interessanterweise ähneln die meisten dieser Merkmale, die bei Wildtyp-Mäusen während der Kalorienrestriktion beobachtet wurden, denen, die bei Mäusen berichtet wurden, die aufgrund einer genetischen Beeinträchtigung der GH / IGF-1 / Insulin-Signalübertragung, wie zuvor beschrieben, langlebig sind.
Randomisierte klinische Studien am Menschen haben gezeigt, dass die Kalorienrestriktion den Serum-IGF-1 nur dann reduziert, wenn die Proteinaufnahme reduziert ist (81, 82). Eine kürzlich durchgeführte Metaanalyse zur Bewertung der Auswirkung von Ernährungseinschränkungen auf die anerkannten Biomarker für gesundes Altern hat jedoch eine Abnahme der menschlichen IGF-1-Spiegel im Blut gezeigt (83).
Andere hormonelle Veränderungen, wie eine Abnahme des Insulinspiegels, der Schilddrüsenhormone und des Leptinspiegels sowie eine Zunahme der Adiponektin- und Insulinsensitivität, wurden während der Diätbeschränkung beobachtet (85, 86).
Diese hormonelle Anpassung kann eine wichtige Rolle bei der Verlängerung des Lebens durch verschiedene Mechanismen spielen:
1) Verminderte Stoffwechselrate, Zellproliferation und oxidativer Stress. Tatsächlich ist IGF-1 ein starker Wachstumsfaktor, und Schilddrüsenhormon ist ein starkes Stimulans für die Grundumsatzrate und den oxidativen Stoffwechsel. Darüber hinaus deuten Transkriptionsmuster darauf hin, dass eine chronisch moderate Kalorieneinschränkung bei Erwachsenen den Alterungsprozess verlangsamt und den Zellstoffwechsel von Wachstum auf Erhaltung und Erholung umstellt (84).
2) Verringerung der Ansammlung alternder Zellen. Es wurde gezeigt, dass die Zellalterung ein Schlüsselmediator des Alterns ist (87). Mit der Zeit nimmt die Proteinhomöostase ab und es kommt zu Schäden. Interessanterweise können einige altersbedingte Krankheiten verzögert werden, indem die Ansammlung alternder Zellen geschwächt wird (88, 89). Typischerweise wird der mTOR-Weg durch mehrere Signale aktiviert, einschließlich Nährstoffe, IGF-1 und Insulin (Abb. 2). Die Deregulierung dieses Signalwegs, über die nach Kalorieneinschränkung berichtet wurde, verlängerte die Lebensdauer einiger Organismen. Dieser Effekt ist anscheinend sekundär zu einer Zunahme der Autophagie, einem zytoprotektiven Verdauungsprozess. Tatsächlich ist Autophagie ein Zellverarbeitungsprozess, der alte oder beschädigte Zellbestandteile entfernen und die Ansammlung alternder Zellen verhindern kann (90, 91).
3) Entzündung entgegenwirken. Ernährungsinterventionen bei Tieren und Menschen können den Alterungsprozess verlangsamen und den Entzündungsstatus in schwachem Maße schwächen (83, 92). Die Mechanismen, die der entzündungshemmenden Aktivität der Ernährungseinschränkung zugrunde liegen, sind nicht klar definiert. Es wird angenommen, dass dieser Effekt auf eine Abnahme der Fettmasse und der proinflammatorischen Adipokine sowie auf eine Verbesserung der Integrität der Darmbarriere zurückzuführen ist, die während einer diätetischen Intervention beobachtet wurde (93, 94).
Es ist interessant festzustellen, dass das endokrine biochemische Profil, das bei Probanden während der Kalorienreduktion beobachtet wurde, mit dem bei Hundertjährigen vergleichbar ist, was die mögliche Rolle des endokrinen Systems bei der Modulation der Lebenserwartung bestätigt. Zusätzlich zur Erhöhung der Insulinsensitivität und zur Senkung der Plasma / Serum-IGF-1-Spiegel haben mehrere Studien bei langlebigen Menschen im Vergleich zu jüngeren Probanden erhöhte Spiegel an zirkulierendem Adiponektin und verringerte Spiegel an zirkulierendem Leptin und Schilddrüsenhormonen gezeigt.
Fettgewebe ist ein endokrines Organ, das mehrere Zytokine produziert, die an relevanten Prozessen wie dem Energiestoffwechsel, der Lipid- und Glukosehomöostase und der Modulation der Entzündungsreaktion beteiligt sind. Viszerales Fettgewebe spielt eine wichtige Rolle bei der Entwicklung von Stoffwechselerkrankungen (95). Altern ist mit einer Zunahme der Fettmasse und einer Umverteilung des Fettgewebes verbunden, die durch einen Verlust an peripherem subkutanem Fett und eine Ansammlung von viszeralem Fett gekennzeichnet ist. Bei älteren Menschen wurden Veränderungen in der Sekretion, Synthese und Funktion von Adipokinen beschrieben, wahrscheinlich aufgrund eines Ungleichgewichts in Funktion, Proliferation, Größe und Anzahl der Fettzellen (86). Adiponectin ist ein insulinsensibilisierendes, entzündungshemmendes und anti-atherogenes Zytokin. Adiponectin zirkuliert im Blut in verschiedenen Formen: Trimer, Hexamer, hochmolekulares Multimer (HMW) und globuläres Adiponectin (proteolytisch gespaltene Form). Es wird angenommen, dass das Multimer-HMW eine aktivere Form von Adiponectin zum Schutz vor Insulinresistenz und Diabetes ist (96). Das zirkulierende Adiponektin ist unabhängig und negativ mit Aspekten des metabolischen Syndroms verbunden, einschließlich Insulinresistenz, Körpergewicht, Blutdruck und Serumlipiden. Leptin wird hauptsächlich im subkutanen und in geringerem Maße im viszeralen weißen Fettgewebe produziert. Dieses Zytokin reguliert die Nahrungsaufnahme, den Energieverbrauch und die Atherogenese. Leptin fördert den Gewichtsverlust, indem es den Appetit reduziert und den Stoffwechsel anregt. Es hat entzündungsfördernde Eigenschaften (97).
Mehrere Studien haben berichtet, dass Langleber höhere Plasma-Adiponektinspiegel und niedrigere Leptinkonzentrationen aufweisen als jüngere Kontrollen (53, 98 - 102). Alle Formen von Adiponectin waren in Langlebern signifikant erhöht, aber das Multimer-HMW war signifikant höher (99). In Langlebern erwiesen sich hohe Adiponektinkonzentrationen als unabhängig vom BMI, der Nieren- oder Herz-Kreislauffunktion und waren mit einem günstigen metabolischen Phänotyp verbunden (höhere HDL-C-Spiegel, niedrigeres glykiertes Hämoglobin, Insulin, HOMA-IR und Triglyceride) (98, 99). Erhöhte Adiponektinspiegel wurden auch bei Nachkommen langlebiger Probanden (über 95 Jahre alt) gefunden (103).
Eine Abnahme des Schilddrüsenhormonspiegels ist offensichtlich charakteristisch für Langleber. Mariotti et al. (104) berichteten, dass gesunde Hundertjährige im Vergleich zu anderen Kontrollgruppen niedrigere TSH- und FT3-Serumspiegel und höhere rT3-Serumspiegel aufwiesen. In einer anderen italienischen Population von Langlebern lagen die T4-Gesamtwerte in 60% der untersuchten Fälle unter dem Normalbereich (105). Baranovskaya et al. berichteten, dass die Serum-T3-Spiegel bei Hundertjährigen niedriger waren als bei frühen älteren und jungen Frauen (52). Wir haben kürzlich das Schilddrüsenfunktionsprofil in einer italienischen Kohorte von 672 Patienten (52–113 Jahre) charakterisiert. Es wurde eine altersbedingte Abnahme des FT3-Spiegels und der FT3 / FT4-Verhältnisse festgestellt, während FT4 und TSH mit dem Alter zunehmen (106). In den Familien der chinesischen Hundertjährigen scheint eine Abnahme der Schilddrüsenfunktion (hohe TSH- und niedrige FT3-Konzentration) mit dem Alter in Zusammenhang zu stehen, und dieser Phänotyp ist erblich bedingt (107).
Corsonello et al. (108) stellten fest, dass begleitende Verwandte (Nachkommen oder Nichten / Neffen) niedrigere Begleiterkrankungen, FT3-, FT4- und TSH-Werte aufweisen als altersangepasste Kontrollen, die keine Verwandten von Langlebern waren. In einer anderen italienischen Bevölkerung wurde bei Nachkommen von Langlebern im Vergleich zu einer gleichaltrigen Kontrollgruppe ein niedrigerer FT4-Plasmaspiegel beobachtet (60).
Langleber sind im Allgemeinen dünn (109) und halten sich an gesunde Essgewohnheiten (110). Ähnlich wie bei Probanden während der Kalorienreduktion beobachteten Langleber ein langsameres Zellwachstum / -stoffwechsel, eine bessere Kontrolle der Signalübertragung und eine erhöhte Autophagie. Durch Analyse der DNA-Methylierung im gesamten Genom bei Hundertjährigen und ihren Nachkommen haben wir epigenetisch modulierte Gene und Wege identifiziert, die möglicherweise an Alterung und Langlebigkeit beteiligt sind. Unsere Ergebnisse zeigen, dass diese Populationen durch eine bessere Erhaltung des DNA-Methylierungsstatus, ein langsameres Zellwachstum / Metabolismus und eine bessere Kontrolle der Signalübertragung durch epigenetische Mechanismen gekennzeichnet waren (111). Langleber behielten ihre bioenergetische Funktion aufgrund der mitochondrialen Hypertrophie bei, die Funktionsstörungen ausgleichen kann (112). Darüber hinaus weisen gesunde Langleber ein hohes Maß an Autophagie auf, was durch höhere Beclin-1-Serumspiegel im Vergleich zu jungen Patienten mit Myokardinfarkt und gesunden Kontrollpersonen belegt wird (113). Eine Zunahme der autophagischen Aktivität wurde auch bei Personen beobachtet, die zu Familien mit außergewöhnlicher Langlebigkeit gehörten (114).
Das entsprechende Phänomen tritt in Bezug auf den Entzündungsstatus auf, der bei Probanden nach Kalorieneinschränkung schwächer wird (115, 116) und bei Langlebern hoch ist (117 - 119). Mit zunehmendem Alter kommt es zu einer leichten und chronischen entzündlichen Pathologie (altersbedingte Entzündung) und einer erhöhten Prävalenz einer Reihe von Krankheiten wie Herz-Kreislauf-Erkrankungen, Arteriosklerose, Tumoren, kognitiven Beeinträchtigungen, Arthrose und Diabetes (120, 121). Daher ist die Abschwächung des chronischen Entzündungsstatus nach Kalorieneinschränkung ein vorteilhafter Effekt. Hundertjährige Hundertjährige zeigen Anzeichen einer Entzündung, scheinen aber gleichzeitig ihre schädlichen Wirkungen verschont zu haben. Dieses offensichtliche Paradoxon kann durch die Tatsache erklärt werden, dass Langlebern ein komplexes und eigenartiges Gleichgewicht zwischen entzündungsfördernden und entzündungshemmenden Faktoren aufweisen, was zu einer langsameren, begrenzteren und ausgewogeneren Entwicklung von Entzündungen im Vergleich zu älteren Menschen führt, die durch eine ineffektive Reaktion auf die Bekämpfung chronischer Entzündungen gekennzeichnet sind (120) 121).
Diese Daten legen die allgemeinen Mechanismen zur Erhöhung der Lebenserwartung und zur Verzögerung altersbedingter Erkrankungen nahe, die bei Langlebern und Säugetieren während einer kalorienreduzierten Ernährung auftreten.
Meinung der Autoren.Präklinische Modelle haben anhand konsistenter Daten, die die Rolle des GH / IGF-1 / Insulinsystems bei der Modulation der Lebenserwartung berücksichtigen, einen tieferen Einblick in den Alterungsprozess gegeben. Obwohl bekannt ist, dass eine erhöhte Insulinsensitivität und niedrige Insulinspiegel mit einem verbesserten Überleben verbunden sind, gibt es einige Hinweise darauf, dass eine Schwächung der GH / IGF-1-Achse einen positiven Effekt auf die Erhöhung der Lebenserwartung beim Menschen haben kann. Es ist jedoch immer noch unbekannt, welche IGF-1-Spiegel während des gesamten Lebens optimal sind, um länger zu leben und gesünder zu sein. Darüber hinaus wurden die Empfindlichkeit des IGF-1-Rezeptors und die Aktivierung des Postrezeptorweges in den meisten Studien mit langlebigen Probanden nicht bewertet. Daher ist es nicht möglich, den tatsächlichen Zustand der IGF-1-Rezeptorsignalaktivierung durch eine einfache Dosis zirkulierender IGF-1-Spiegel zu bestimmen. Dies macht es schwierig, pharmakologische oder Umweltstrategien zu identifizieren, die auf dieses System abzielen, um die Langlebigkeit zu erhöhen und ein gesundes Altern zu fördern. Ein umfassendes Verständnis dieser Aspekte bleibt das Hauptproblem bei der Ermittlung von Maßnahmen zur Verlangsamung des Alterns des Menschen und zur Verwendung in der Rehabilitationsmedizin. Zukünftige Studien sollten den Funktionszustand der IGF-1-Rezeptorsignalisierung bewerten, unter anderem durch Transkriptionsprofilierung und Analyse funktioneller Netzwerke in Bezug auf IGF-1-regulierte Gene bei langlebigen Probanden.
SchlussfolgerungenAuffallende Ähnlichkeiten wurden in Bezug auf das endokrine Profil zwischen Langlebern und Probanden nach einer kalorienreduzierten Diät beschrieben. Die in beiden Modellen beobachtete endokrine und metabolische Anpassung kann eine physiologische Strategie zur Erhöhung der Lebenserwartung aufgrund eines langsameren Zellwachstums / -stoffwechsels, eines langsameren Verlusts der natürlichen physiologischen Reserve, des Übergangs des Zellstoffwechsels von der Zellproliferation zur regenerativen Aktivität und zur Verringerung der Akkumulation alternder Zellen sein. Offensichtlich werden diese Mechanismen zumindest teilweise durch Modulation des GH / IGF-1 / Insulinsystems vermittelt.
Referenzliste- Franceschi C., Valensin S., Bonafè M., Paolisso G., Yashin AI, Monti D. et al. Das Netzwerk und die Umgestaltungstheorien des Alterns: historischer Hintergrund und neue Perspektiven. Exp Gerontol. (2000) 35: 879–96. 10.1016 / S0531-5565 (00) 00172-8.
- Bartke A, Darcy J. GH und Altern: Fallstricke und neue Erkenntnisse. Best Practices Res Clin Endocrinol Metab. (2017) 31: 113–25. 10.1016 / j.beem.2017.02.005
- Vitale G, Salvioli S., Franceschi C. Oxidativer Stress und das alternde endokrine System. Nat Rev Endocrinol. (2013) 9: 228–40. 10.1038 / nrendo.2013.29
- Vitale G, Cesari M, Mari D. Alterung des endokrinen Systems und seine möglichen Auswirkungen auf die Sarkopenie. Eur J Intern Med. (2016) 35: 10 & ndash; 15. 10.1016 / j.ejim.2016.07.017
- Reddy SSK, Chaiban JT. Die Endokrinologie des Alterns: ein Schlüssel zur Langlebigkeit „Große Erwartungen“. Endocr Pract. (2017) 23: 1107–16. 10.4158 / EP171793.RA
- Junnila RK, Liste EO, Berryman DE, Murrey JW, Kopchick JJ. Die GH / IGF-1-Achse in Bezug auf Alterung und Langlebigkeit. Nat Rev Endocrinol. (2013) 9: 366–76. 10.1038 / nrendo.2013.67
- Yakar S, Adamo ML. Physiologie des insulinähnlichen Wachstumsfaktors 1: Lehren aus Mausmodellen. Endocrinol Metab Clin North Am. (2012) 41: 231–47. 10.1016 / j.ecl.2012.04.008 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Higashi Y, Sukhanov S., Anwar A., Shai SY, Delafontaine P. IGF-1, oxidativer Stress und Atheroprotektion. Trends Endocrinol Metab. (2010) 21: 245 & ndash; 54. 10.1016 / j.tem.2009.12.005 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Belfiore A., Malaguarnera R., Vella V., Lawrence MC, Sciacca L., Frasca F. et al. Insulinrezeptor-Isoformen in Physiologie und Krankheit: eine aktualisierte Ansicht. Endocr rev. (2017) 38: 379 & ndash; 431. 10.1210 / er.2017-00073 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang RAC ... elegans-Mutante, die doppelt so lange lebt wie der Wildtyp. Nature (1993) 366: 461 & ndash; 4. 10.1038 / 366461a0 [PubMed] [CrossRef] [Google Scholar]
- Kimura KD, Tissenbaum HA, Liu Y, Ruvkun G. Daf-2, ein Insulinrezeptor-ähnliches Gen, das die Langlebigkeit und Diapause bei Caenorhabditis elegans reguliert. Science (1997) 277: 942 & ndash; 6. 10.1126 / science.277.5328.942 [PubMed] [CrossRef] [Google Scholar]
- Tatar M., Kopelman A., Epstein D., Tu MP, Yin CM, Garofalo RS, et al. Ein mutiertes Drosophila-Insulinrezeptor-Homolog, das die Lebensdauer verlängert und die neuroendokrine Funktion beeinträchtigt. Science (2001) 292: 107 & ndash; 10. 10.1126 / science.1057987 [PubMed] [CrossRef] [Google Scholar]
- Clancy DJ, Gems D., Harshman LG, Oldham S., Stocker H., Hafen E. et al. Verlängerung der Lebensdauer durch Verlust von CHICO, einem Drosophila-Insulinrezeptor-Substratprotein. Science (2001) 292: 104 & ndash; 6. 10.1126 / science.1057991 [PubMed] [CrossRef] [Google Scholar]
- Libina N, Berman JR, Kenyon C. Gewebespezifische Aktivitäten von C. elegans DAF-16 bei der Regulierung der Lebensdauer. Cell (2003) 115: 489 & ndash; 502. 10.1016 / S0092-8674 (03) 00889-4 [PubMed] [CrossRef] [Google Scholar]
- Broughton S, Partridge L. Insulin / IGF-ähnliche Signale, das Zentralnervensystem und das Altern. Biochem J. (2009) 418: 1-12. 10.1042 / BJ20082102 [PubMed] [CrossRef] [Google Scholar]
- Reindl KM, Sheridan MA. Periphere Regulation des Wachstumshormon-Insulin-ähnlichen Wachstumsfaktorsystems bei Fischen und anderen Wirbeltieren. Comp Biochem Physiol A Mol Integr Physiol. (2012) 163: 231–45. 10.1016 / j.cbpa.2012 / 08 / 08.003 [PubMed] [CrossRef] [Google Scholar]
- Snell GD. Zwerg, ein neuer Mendelscher rezessiver Charakter der Hausmaus. Proc Natl Acad Sci USA. (1929) 15: 733–4. 10.1073 / pnas.15.9.733 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Berryman D, Christiansen JS, Johannsson G, Thorner MO, Kopchick JJ. Rolle der GH / IGF-1-Achse für Lebensdauer und Gesundheit: Lehren aus Tiermodellen. Wachstumshorm IGF Res. (2008) 18: 455–71. 10.1016 / j.ghir.2008.05.005 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Verlängerung der Lebensdauer und verzögerte Immun- und Kollagenalterung bei mutierten Mäusen mit Defekten in der Wachstumshormonproduktion. Proc Natl Acad Sci USA. (2001) 98: 6736–41. 10.1073 / pnas.111158898 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Brown-Borg HM, Borg KE, Meliska CJ, Bartke A. Zwergmäuse und der Alterungsprozess. Nature (1996) 384: 33. 10.1038 / 384033a0 [PubMed] [CrossRef] [Google Scholar]
- Bartke A, Wright JC, Mattison JA, Ingram DK, Miller RA, Roth GS. Verlängerung der Lebensdauer langlebiger Mäuse. Nature (2001) 414: 412. 10.1038 / 35106646 [PubMed] [CrossRef] [Google Scholar]
- Panici JA, Harper JM, Miller RA, Bartke A, Spong A, Masternak MM. Die Behandlung mit Wachstumshormonen im frühen Leben verkürzt die Langlebigkeit und verringert die zelluläre Stressresistenz bei langlebigen mutierten Mäusen. FASEB J. (2010) 24: 5073–9. 10.1096 / fj.10-163253 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Sun LY, Spong A, Swindell WR, Fang Y, Hill C, Huber JA et al. Die Störung des Wachstumshormon freisetzenden Hormons verlängert die Lebensdauer und reguliert die Reaktion auf Kalorieneinschränkungen bei Mäusen. Elife (2013) 2: e01098. 10.7554 / eLife.01098 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Clemmons D, Bellush LL, Kopchick JJ. Bewertung der Wachstumsparameter und der Lebensdauer von Mäusen mit GHR / BP-Genstörung. Endocrinology (2000) 141: 2608 & ndash; 13. 10.1210 / endo.141.7.7586 [PubMed] [CrossRef] [Google Scholar]
- Ikeno Y, Hubbard GB, Lee S., Cortez LA, Lew CM, Webb CR, et al. Reduzierte Inzidenz und verzögertes Auftreten tödlicher neoplastischer Erkrankungen bei Wachstumshormonrezeptor / Bindungsprotein-Knockout-Mäusen. J Gerontol A Biol Sci Med Sci. (2009) 64: 522–9. 10.1093 / gerona / glp017 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Gesing A, Wiesenborn D, Do A, Menon V, Schneider A, Victoria B ua Eine langlebige Maus, der sowohl Wachstumshormon als auch Wachstumshormonrezeptor fehlen: ein neues Tiermodell für Alterungsstudien. J Gerontol A Biol Sci Med Sci. (2017) 72: 1054–61. 10.1093 / gerona / glw193 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Bonkowski MS, Rocha JS, Masternak MM, Al Regaiey KA, Bartke A. Eine gezielte Störung des Wachstumshormonrezeptors beeinträchtigt die vorteilhaften Wirkungen der Kalorienrestriktion. Proc Natl Acad Sci USA. (2006) 103: 7901 & ndash; 5. 10.1073 / pnas.0600161103 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Holland AN, Fahrer ME, Liste EO, Flyvbjerg A, Kopchick JJ. Die Deletion, aber nicht der Antagonismus des Maus-Wachstumshormonrezeptors führt zu einer starken Verringerung des Körpergewichts, des Insulins und des Insulin-ähnlichen Wachstumsfaktors I sowie zu einer Verlängerung der Lebensdauer. Endocrinology (2003) 144: 3799 & ndash; 810. 10.1210 / de.2003-0374 [PubMed] [CrossRef] [Google Scholar]
- Holzenberger M., Dupont J., Ducos B., Leneuve P., Géloën A., Even PC et al. Der IGF-1-Rezeptor reguliert die Lebensdauer und die Beständigkeit gegen oxidativen Stress bei Mäusen. Nature (2003) 421: 182–7. 10.1038 / nature01298 [PubMed] [CrossRef] [Google Scholar]
- Bokov AF, Garg N., Ikeno Y., Thakur S., Musi N., DeFronzo RA et al. Verändert eine verringerte IGF-1R-Signalübertragung in Igf1r +/– -Mäusen das Altern? Plos ONE (2011) 6: e26891. 10.1371 / journal.pone.0026891 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Xu J, Gontier G, Chaker Z, Lacube P, Dupont J, Holzenberger M. Der Langlebigkeitseffekt der IGF-1R +/– -Mutation hängt von der genetischen Hintergrund-spezifischen Rezeptoraktivierung ab. Aging Cell (2014) 13: 19–28. 10.1111 / acel.12145 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Mulvey L, Sinclair A, Selman C. Lebensdauermodulation bei Mäusen und die verwirrenden Auswirkungen des genetischen Hintergrunds. J Genet Genomics (2014) 41: 497 & ndash; 503. 10.1016 / j.jgg.2014.06.002 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Kappeler L., De Magalhaes Filho C., Dupont J., Leneuve P., Cervera P., Périn L. et al. Die IGF-1-Rezeptoren des Gehirns steuern das Wachstum und die Lebensdauer von Säugetieren über einen neuroendokrinen Mechanismus. PLOS Biol. (2008) 6: e254. 10.1371 / journal.pbio.0060254tt [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Svensson J., Sjögren K., Fäldt J., Andersson N., Isaksson O., Jansson JO, et al. Von der Leber stammender IGF-1 reguliert die mittlere Lebensdauer bei Mäusen. PLoS ONE (2011) 6: e22640 10.1371 / journal.pone.0022640 [PMC-freier Artikel] [PubMed] [CrossRef] [Google Scholar]
- Conover CA, Bale LK. Loss of pregnancy-associated plasma protein A extends lifespan in mice. Aging Cell (2007) 6:727–9. 10.1111/j.1474-9726.2007.00328.x [PubMed] [CrossRef] [Google Scholar]
- Conover CA. Role of PAPP-A in aging and age-related disease. Exp Gerontol. (2013) 48:612–3. 10.1016/j.exger.2012.06.017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al.. Evidence for lifespan extension and delayed age-related biomarkers in insulin receptor substrate 1 null mice. FASEB J. (2008) 22:807–18. 10.1096/fj.07-9261com [PubMed] [CrossRef] [Google Scholar]
- Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science (2000) 317:369–72. 10.1126/science.1142179 [PubMed] [CrossRef] [Google Scholar]
- Kuro M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugu T, et al. Mutation of the mouse Klotho gene leads to a syndrome resembling ageing. Nature (1997) 390:45–51. 10.1038/36285 [PubMed] [CrossRef] [Google Scholar]
- Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, et al.. Suppression of aging in mice by the hormone Klotho. Science (2005) 309:1829–33. 10.1126/science.1112766 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Migliaccio E, Giorgio M, Mele S, Pelicci G, Reboldi P, Pandolfi PP, et al. The p66 Shc adaptor protein controls oxidative stress response and life span in mammals. Nature (1999) 402:309–13. 10.1038/46311 [PubMed] [CrossRef] [Google Scholar]
- Ramsey JJ, Tran D, Giorgio M, Griffey SM, Koehne A, Laing ST, et al.. The influence of Shc proteins on life span in mice. J Gerontol A Biol Sci Med Sci. (2014) 69:1177–85. 10.1093/gerona/glt198 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ashpole NM, Logan S, Yabluchanskiy A, Mitschelen MC, Yan H, Farley JA, et al.. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience (2017) 39:129–45. 10.1007/s11357-017-9971-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al.. Late-life targeting of the IGF-1 receptor improves healthspan and lifespan in female mice. Nat Commun. (2018) 9:2394. 10.1038/s41467-018-04805-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Passarino G, Mari D, Monti D. Centenarians as a 21st century healthy aging model: a legacy of humanity and the need for a world-wide consortium (WWC100+). Mech Ageing Dev. (2017) 165(Pt. B):55–8. 10.1016/j.mad.2017.06.002 [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Barbieri M, Kamenetskaya M, Paolisso G. GH/IGF-I/insulin system in centenarians. Mech Ageing Dev. (2017) 165:107–114. 10.1016/j.mad.2016.12.001 [PubMed] [CrossRef] [Google Scholar]
- Ferrannini E, Vichi S, Beck-Nielsen H, Laasko M, Paolisso G, Smith U. For European Group for the Study of Insulin Resistance (EGIR). Insulin action and age. Diabetes (1996) 45:947–53. 10.2337/diab.45.7.947 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Barbieri M, Rizzo MR, Carella C, Rotondi M, Bonafè M, et al. Low insulin resistance and preserved beta-cell function contribute to human longevity but are not associated with TH-INS genes. Exp Gerontol. (2001) 37:149–56. 10.1016/S0531-5565(01)00148-6 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, D'Amore A, Balbi V, Varricchio M, et al.. Glucose tolerance and insulin action in healty centenarians. Am J Physiol. (1996) 270:E890–4. 10.1152/ajpendo.1996.270.5.E890 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, Tagliamonte MR, Rizzo MR, Capurso A, et al.. Preserved antilipolytic insulin action is associated with a less atherogenic plasma lipid profile in healthy centenarians. J Am Geriatr Soc. (1997) 45:1504–9. 10.1111/j.1532-5415.1997.tb03203.x [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Brugts M, Ogliari G, Castaldi D, Fatti L, Varewijck A, et al.. Low circulating IGF-I bioactivity is associated with human longevity: findings in centenarians' offspring. Aging (2012) 4:580–89. 10.18632/aging.100484 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Wolinska-Witort E, Bik W, Baranowska-Bik A, Martynska L, Broczek K, et al.. Evaluation of neuroendocrine status in longevity. Neurobiol Aging (2007) 28:774–83. 10.1016/j.neurobiolaging.2006.03.014 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Manzella D, Barbieri M, Rizzo MR, Gambardella A, Varricchio M. Baseline heart rate variability in healthy centenarians: differences vs. aged subject. Clin. Sci. (1999) 97:579–84. 10.1042/cs0970579 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Tagliamonte MR, Rizzo MR, Carella C, Gambardella A, Barbieri M, et al. Low plasma Insulin like growth factor-1 concentrations predict worsening of insulin mediated glucose uptake in the elderly. J. Am. Geriatr. Soc. (1999) 47:1312–8. 10.1111/j.1532-5415.1999.tb07431.x [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Ammendola S, Del Buono A, Gambardella A, Riondino M, Tagliamonte MR, et al.. Serum levels of insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 in healthy centenarians: relationship with plasma leptin and lipid concentrations, insulin action, and cognitive function. J Clin Endocrinol Metab. (1997) 82:2204–9. 10.1210/jcem.82.7.4087 [PubMed] [CrossRef] [Google Scholar]
- Bonafè M, Barbieri M, Marchegiani F, Olivieri F, Ragno E, Giampieri C, et al.. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity: cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab. (2003) 88:3299–304. 10.1210/jc.2002-021810 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Hirose N, Yamamura K, Shimizu K, Takayama M, Ebihara Y, et al.. Serum insulin-like growth factor-1 in centenarians: implications of IGF-1 as a rapid turnover protein. J Gerontol A Biol Sci Med Sci. (2001) 56:M79–82. 10.1093/gerona/56.2.M79 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Takayama M, Gondo Y, Inagaki H, Yamamura K, Nakazawa S, et al.. Adipose endocrine function, insulin-like growth factor-1 axis, and exceptional survival beyond 100 years of age. J Gerontol A Biol Sci Med Sci. (2008) 63:1209–18. 10.1093/gerona/63.11.1209 [PubMed] [CrossRef] [Google Scholar]
- Herr M, Jeune B, Fors S, Andersen-Ranberg K, Ankri J, Arai Y, et al.. Frailty and associated factors among centenarians in the 5-COOP countries. Gerontology (2018) 64:521–31. 10.1159/000489955 [PubMed] [CrossRef] [Google Scholar]
- Bucci L, Ostan R, Cevenini E, Pini E, Scurti M, Vitale G, et al.. Centenarians' offspring as a model of healthy aging: a reappraisal of the data on Italian subjects and a comprehensive overview. Aging (Albany. NY). (2016) 8:1–11. 10.18632/aging.100912 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gueresi P, Miglio R, Monti D, Mari D, Sansoni P, Caruso C, et al.. Does the longevity of one or both parents influence the health status of their offspring? Exp Gerontol. (2013) 48:395–400. 10.1016/j.exger.2013.02.004 [PubMed] [CrossRef] [Google Scholar]
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (2015) 7:1159–70. 10.18632/aging.100861 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Caselli G, Pozzi L, Vaupel JW, Deiana L, Pes G, Carru C, et al.. Family clustering in Sardinian longevity: a genealogical approach. Exp Gerontol. (2006) 41:727–36. 10.1016/j.exger.2006.05.009 [PubMed] [CrossRef] [Google Scholar]
- Suh Y, Atzmon G, Cho MO, Hwang D, Liu B, Leahy DJ, et al.. Functionally significant insulin-like growth factor I receptor mutations in centenarians. Proc Natl Acad Sci USA. (2008) 105:3438–42. 10.1073/pnas.0705467105 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, van den Akker EB, Trompet S, van Heemst D, Mooijaart SP, Slagboom PE, Beekman M. Employing biomarkers of healthy ageing for leveraging genetic studies into human longevity. Exp Gerontol. (2016) 82:166–74. 10.1016/j.exger.2016.06.013 [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Rozing MP, Houwing-Duistermaat JJ, Slagboom PE, Beekman M, de Craen AJ, et al.. Association analysis of insulin-like growth factor-1 axis parameters with survival and functional status in nonagenarians of the Leiden Longevity Study. Aging (2015) 7:956–63. 10.18632/aging.100841 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rozing MP, Westendorp RG, Frölich M, de Craen AJ, Beekman M, Heijmans BT, et al.. Human insulin/IGF-1 and familial longevity at middle age. Aging (2009) 1:714–22. 10.18632/aging.100071 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Jansen SW, Akintola AA, Ballieux BE, Cobbaert CM, Slagboom PE, et al.. Growth hormone secretion is diminished and tightly controlled in humans enriched for familial longevity. Aging Cell (2016) 15:1126–31. 10.1111/acel.12519 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Sun FX, Andersen SL, Lee JH, Wojczynski MK, Sanders JL, et al.. Families enriched for exceptional longevity also have increased health-span: findings from the long life family study. Front Public Health (2013) 1:38. 10.3389/fpubh.2013.00038 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Thyagarajan B, Sun F, Honig LS, Schupf N, Cosentino S, et al.. Age and sex distributions of age-related biomarker values in healthy older adults from the long life family study. J Am Geriatr Soc. (2016) 64:e189–94. 10.1111/jgs.14522 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Teumer A, Qi Q, Nethander M, Aschard H, Bandinelli S, Beekman M, et al.. Genomewide meta-analysis identifies loci associated with IGF-I and IGFBP-3 levels with impact on age-related traits. Aging Cell (2016) 15:811–24. 10.1111/acel.12490 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, Uh HW, Monajemi R, van Heemst D, Thijssen PE, Böhringer S, et al.. Gene set analysis of GWAS data for human longevity highlights the relevance of the insulin/IGF-1 signaling and telomere maintenance pathways. Age (2013) 35:235–49. 10.1007/s11357-011-9340-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van Heemst D, Beekman M, Mooijaart SP, Heijmans BT, Brandt BW, Zwaan BJ, et al.. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell (2005) 4:79–85. 10.1111/j.1474-9728.2005.00148.x [PubMed] [CrossRef] [Google Scholar]
- Ben-Avraham D, Govindaraju DR, Budagov T, Fradin D, Durda P, Liu B, et al.. The GH receptor exon 3 deletion is a marker of male-specific exceptional longevity associated with increased GH sensitivity and taller stature. Sci Adv. (2017) 3:e1602025. 10.1126/sciadv.1602025 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- McKiernan SH, Colman RJ, Lopez M, Beasley TM, Aiken JM, Anderson RM, et al.. Caloric restriction delays aging-induced cellular phenotypes in rhesus monkey skeletal muscle. Exp Gerontol. (2011) 46:23–9. 10.1016/j.exger.2010.09.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Calorie restriction delays disease onset and mortality in rhesus monkeys. Science (2009) 325:201–4. 10.1126/science.1173635 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Willcox DC, Willcox BJ, Todoriki H, Curb JD, Suzuki M. Caloric restriction and human longevity: what can we learn from the Okinawans? Biogerontology (2006) 7:173–7. 10.1007/s10522-006-9008-z [PubMed] [CrossRef] [Google Scholar]
- Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, et al.. Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. Nature (2012) 489:318–21. 10.1038/nature11432 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dunn SE, Kari FW, French J, Leininger JR, Travlos G, Wilson R, et al.. Dietary restriction reduces insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice. Cancer Res. (1997) 57:4667–72. [PubMed] [Google Scholar]
- Berrigan D, Perkins SN, Haines DC, Hursting SD. Adult-onset calorie restriction and fasting delay spontaneous tumorigenesis in p53-deficient mice. Carcinogenesis (2002) 23:817–22. 10.1093/carcin/23.5.817 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Veldhuis JD, Rood J, Smith SR, Williamson D, Ravussin E, et al.. The effect of caloric restriction interventions on growth hormone secretion in nonobese men and women. Aging Cell (2010) 9:32–9. 10.1111/j.1474-9726.2009.00530.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Das SK, Smith SR, Meydani SN, Pittas AG, et al.. Effects of 2-year calorie restriction on circulating levels of IGF-1, IGF-binding proteins and cortisol in nonobese men and women: a randomized clinical trial. Aging Cell (2016) 15:22–7. 10.1111/acel.12400 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lettieri-Barbato D, Giovannetti E, Aquilano K. Effects of dietary restriction on adipose mass and biomarkers of healthy aging in human. Aging (2016) 8:3341–55. 10.18632/aging.101122 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al.. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell (2013) 12:645–51. 10.1111/acel.12088 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Kojima T, Takayama M, Hirose N. The metabolic syndrome, IGF-1, and insulin action. Mol Cell Endocrinol. (2009) 299:124–8. 10.1016/j.mce.2008.07.002 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Ravussin E. Endocrine alterations in response to calorie restriction in humans. Mol Cell Endocrinol. (2009) 299:129–36. 10.1016/j.mce.2008.10.014 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Garagnani P, Vitale G, Capri M, Salvioli S. Inflammaging and 'Garb-aging'. Trends Endocrinol Metab. (2017) 28:199–212. 10.1016/j.tem.2016.09.005 [PubMed] [CrossRef] [Google Scholar]
- Qian M, Liu B. Pharmaceutical Intervention of Aging. Adv Exp Med Biol. (2018) 1086:235–54. 10.1007/978-981-13-1117-8_15 [PubMed] [CrossRef] [Google Scholar]
- Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, et al.. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature (2011) 479:232–6. 10.1038/nature10600 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Derous D, Mitchell SE, Wang L, Green CL, Wang Y, Chen L, et al.. The effects of graded levels of calorie restriction: XI. Evaluation of the main hypotheses underpinning the life extension effects of CR using the hepatic transcriptome. Aging (2017) 9:1770–824. 10.18632/aging.101269 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Madeo F, Tavernarakis N, Kroemer G. Can autophagy promote longevity? Nat Cell Biol. (2010) 12:842–6. 10.1038/ncb0910-842 [PubMed] [CrossRef] [Google Scholar]
- Cevenini E, Monti D, Franceschi C. Inflamm-ageing. Curr Opin Clin Nutr Metab Care. (2013) 16:14–20. 10.1097/MCO.0b013e32835ada13 [PubMed] [CrossRef] [Google Scholar]
- Meydani SN, Das SK, Pieper CF, Lewis MR, Klein S, Dixit VD, et al.. Long-term moderate calorie restriction inhibits inflammation without impairing cell-mediated immunity: a randomized controlled trial in non-obese humans. Aging (2016) 8:1416–31. 10.18632/aging.100994 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ott B, Skurk T, Hastreiter L, Lagkouvardos I, Fischer S, Büttner J, et al.. Effect of caloric restriction on gut permeability, inflammation markers, and fecal microbiota in obese women. Sci Rep. (2017) 7:11955. 10.1038/s41598-017-12109-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Unamuno X, Gómez-Ambrosi J, Rodríguez A, Becerril S, Frühbeck G, Catalán V. Adipokine dysregulation and adipose tissue inflammation in human obesity. Eur J Clin Invest. (2018) 48:e12997. 10.1111/eci.12997 [PubMed] [CrossRef] [Google Scholar]
- Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab. (2014) 28:25–31. 10.1016/j.beem.2013.06.003 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Balaskó M, Soós S, Székely M, Pétervári E. Leptin and aging: Review and questions with particular emphasis on its role in the central regulation of energy balance. J Chem Neuroanat. (2014) 61–62:248–55. 10.1016/j.jchemneu.2014.08.006 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Nakazawa S, Kojima T, Takayama M, Abihara Y, Shimizu K, et al. High adiponectin concentration and its role for longevity in female centenarians. Geriatr Gerontol Int. (2006) 6:32–9. 10.1111/j.1447-0594.2006.00304.x [CrossRef] [Google Scholar]
- Bik W, Baranowska-Bik A, Wolinska-Witort E, Kalisz M, Broczek K, Mossakowska M, et al.. Assessment of adiponectin and its isoforms in Polish centenarians. Exp Gerontol. (2013) 48:401–7. 10.1016/j.exger.2013.01.015 [PubMed] [CrossRef] [Google Scholar]
- Meazza C, Vitale G, Pagani S, Castaldi D, Ogliari G, Mari D, et al.. Common adipokine features of neonates and centenarians. J Pediatr Endocrinol Metab. (2011) 24:953–7. 10.1515/JPEM.2011.373 [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Bik W, Baranowska-Bik A, Wolinska-Witort E, Szybinska A, Martynska L, et al.. Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol. (2006) 57 (Suppl. 6):55–61. [PubMed] [Google Scholar]
- Miura Y, Hashii N, Tsumoto H, Takakura D, Ohta Y, Abe Y, et al.. Change in N-glycosylation of plasma proteins in Japanese semisupercentenarians. PLoS ONE (2015) 10:e0142645. 10.1371/journal.pone.0142645 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Atzmon G, Pollin TI, Crandall J, Tanner K, Schechter CB, Scherer PE, et al.. Adiponectin levels and genotype: a potential regulator of life span in humans. J Gerontol A Biol Sci Med Sci. (2008) 63:447–53. 10.1093/gerona/63.5.447 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mariotti S, Barbesino G, Caturegli P, Bartalena L, Sansoni P, Fagnoni F, et al.. Complex alteration of thyroid function in healthy centenarians. J Clin. Endocrinol Metab. (1993) 77:1130–4. 10.1210/jcem.77.5.8077303 [PubMed] [CrossRef] [Google Scholar]
- Maugeri D, Russo MS, Di Stefano F, Receputo G, Rosso D, Rapisarda R, et al.. Thyroid function in healthy centenarians. Arch Gerontol Geriatr. (1997) 25:211–7. 10.1016/S0167-4943(97)00012-5 [PubMed] [CrossRef] [Google Scholar]
- Ostan R, Monti D, Mari D, Arosio B, Gentilini D, Ferri E, et al.. Heterogeneity of thyroid function and impact of peripheral thyroxine deiodination in centenarians and semi-supercentenarians: association with functional status and mortality. J Gerontol A Biol Sci Med Sci. (2018). 10.1093/gerona/gly194. [Epub ahead of print]. [PubMed] [CrossRef] [Google Scholar]
- He Y, Chen X, Yan D, Xiao F, Liu Y, Lin R, et al.. Thyroid function decreases with age and may contribute to longevity in chinese centenarians' families. JAGS (2015) 63:1474–6. 10.1111/jgs.13553 [PubMed] [CrossRef] [Google Scholar]
- Corsonello A, Montesanto A, Berardelli M, De Rango F, Dato S, Mari V, et al.. A cross-section analysis of FT3 age-related changes in a group of old and oldest-old subjects, including centenarians' relatives, shows that a down-regulated thyroid function has a familial component and is related to longevity. Age Ageing (2010) 39:723–7. 10.1093/ageing/afq116 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pereira da Silva A, Matos A, Valente A, Gil Â, Alonso I, Ribeiro R, et al.. Body composition assessment and nutritional status evaluation in men and women portuguese centenarians. J Nutr Health Aging (2016) 20:256–66. 10.1007/s12603-015-0566-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Ostan R, Santoro A. Nutrition and inflammation: are centenarians similar to individuals on calorie-restricted diets? Annu Rev Nutr. (2018) 38:329–56. 10.1146/annurev-nutr-082117-051637 [PubMed] [CrossRef] [Google Scholar]
- Gentilini D, Mari D, Castaldi D, Remondini D, Ogliari G, Ostan R, et al.. Role of epigenetics in human aging and longevity: genome-wide DNA methylation profile in centenarians and centenarians' offspring. Age (2013) 35:1961–73. 10.1007/s11357-012-9463-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sgarbi G, Matarrese P, Pinti M, Lanzarini C, Ascione B, Gibellini L, et al.. Mitochondria hyperfusion and elevated autophagic activity are key mechanisms for cellular bioenergetic preservation in centenarians. Aging (2014) 6:296–310. 10.18632/aging.100654 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Emanuele E, Minoretti P, Sanchis-Gomar F, Pareja-Galeano H, Yilmaz Y, Garatachea N, et al.. Can enhanced autophagy be associated with human longevity? Serum levels of the autophagy biomarker beclin-1 are increased in healthy centenarians. Rejuvenation Res. (2014) 17:518–24. 10.1089/rej.2014.1607 [PubMed] [CrossRef] [Google Scholar]
- Raz Y, Guerrero-Ros I, Maier A, Slagboom PE, Atzmon G, Barzilai N, et al.. Activation-induced autophagy is preserved in CD4+ T-cells in familial longevity. J Gerontol A Biol Sci Med Sci. (2017) 72:1201–6. 10.1093/gerona/glx020 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Weiss EP, Racette SB, Steger-May K, et al. Calorie restriction or exercise: effects on coronary heart disease risk factors. A randomized, controlled trial. Am J Physiol Endocrinol Metab. (2007) 293:E197–202. 10.1152/ajpendo.00102.2007 [PubMed] [CrossRef] [Google Scholar]
- Ravussin E, Redman LM, Rochon J, Das SK, Fontana L, et al.. A 2-year randomized controlled trial of human caloric restriction: feasibility and effects on predictors of health span and longevity. J Gerontol A Biol Sci Med Sci. (2015) 70:1097–104. 10.1093/gerona/glv057 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bruunsgaard H, Andersen-Ranberg K, Jeune B, Pedersen AN, Skinhoj P, Pedersen BK. A high plasma concentration of TNF-α is associated with dementia in centenarians. J Gerontol A Biol Sci Med Sci. (1999) 54:M357–64. 10.1093/gerona/54.7.M357 [PubMed] [CrossRef] [Google Scholar]
- Gangemi S, Basile G, Merendino RA, Minciullo PL, Novick D, et al.. Increased circulating interleukin-18 levels in centenarians with no signs of vascular disease: another paradox of longevity? Exp Gerontol. (2003) 38:669–72. 10.1016/S0531-5565(03)00061-5 [PubMed] [CrossRef] [Google Scholar]
- Gerli R, Monti D, Bistoni O, Mazzone AM, Peri G, et al.. Chemokines, sTNF-Rs and sCD30 serum levels in healthy aged people and centenarians. Mech. Ageing Dev. (2000) 121:37–46. 10.1016/S0047-6374(00)00195-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Capri M, Monti D, Giunta S, Olivieri F, Sevini F, et al.. Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans. Mech Ageing Dev. (2007) 128:92–105. 10.1016/j.mad.2006.11.016 [PubMed] [CrossRef] [Google Scholar]
- Salvioli S, Monti D, Lanzarini C, Conte M, Pirazzini C, Bacalini MG, et al.. Immune system, cell senescence, aging and longevity–inflamm-aging reappraised. Curr Pharm Des. (2013) 19:1675–9. 10.2174/1381612811319090015