Bevor ich mit der Präsentation des Materials beginne, möchte ich einige Worte über mich selbst sagen: ein Mitglied der Gemeinschaften zur Bekämpfung der HIV-Verweigerung („HIV / AIDS-Dissens“): 2016-2018 „HIV / AIDS-Dissidenten und ihre Kinder“, ab 2018 - "HIV / AIDS-Verweigerung und alternative Medizin."
Meine - und nicht nur meine - Meinung ist, dass die meisten Fälle der Ablehnung der HIV-Behandlung durch ein banales Missverständnis verursacht werden, dass es sich um eine kontrollierte chronische Infektion handelt, sowie durch die Stigmatisierung von Menschen, die mit HIV leben - die Verwendung des üblichen Klischees, dass HIV - eine Krankheit der unteren Schichten der Gesellschaft oder umgekehrt, der "kulturellen Elite". Dies ist seit langem nicht mehr so - in Russland lebt ungefähr 1% der Bevölkerung mit HIV, und die Situation plant nicht, sich zu verbessern.
Vor ungefähr einem Jahr ermutigten mich mehrere Artikel zu dieser Ressource, fünf Notizen zur Geschichte des Kampfes gegen Viren zu schreiben. Der Zweck dieser Artikel war es, die Arbeitsprinzipien verschiedener Arten von HIV-Medikamenten zu beschreiben (Berater waren ein Mikrobiologe und ein Spezialist für Infektionskrankheiten). Ich wünsche Ihnen viel Spaß beim Arrangieren dieser Notizen.
Über Viren
Ein paar Worte zu Viren im Allgemeinen: Sie nehmen eine Zwischenposition zwischen der lebenden und der nicht lebenden Welt ein; Sie sind nicht in der Lage, sich unabhängig zu vermehren. Dazu werden die Zellen des Wirtsorganismus benötigt.
Das Virus ist ganz einfach organisiert: Es trägt einen genetischen Code, der Code ist in einem Kapsid eingeschlossen, das Kapsid ist manchmal von einer Hülle umgeben. Der Code kann auf verschiedene Arten dargestellt werden. Der Codeträger ist DNA oder RNA, d.h. Nukleinsäure (NK). Die Codeketten können eine oder zwei sein: doppelsträngige und einzelsträngige NK. Die Kette kann ringförmig oder linear geschlossen werden. Nach diesen Zeichen teilte David Baltimore die Viren 1971 in sieben Klassen ein. Diese Klassifizierung wird heute noch verwendet und wird wichtig sein, um zu erklären, wie einige Medikamente wirken.
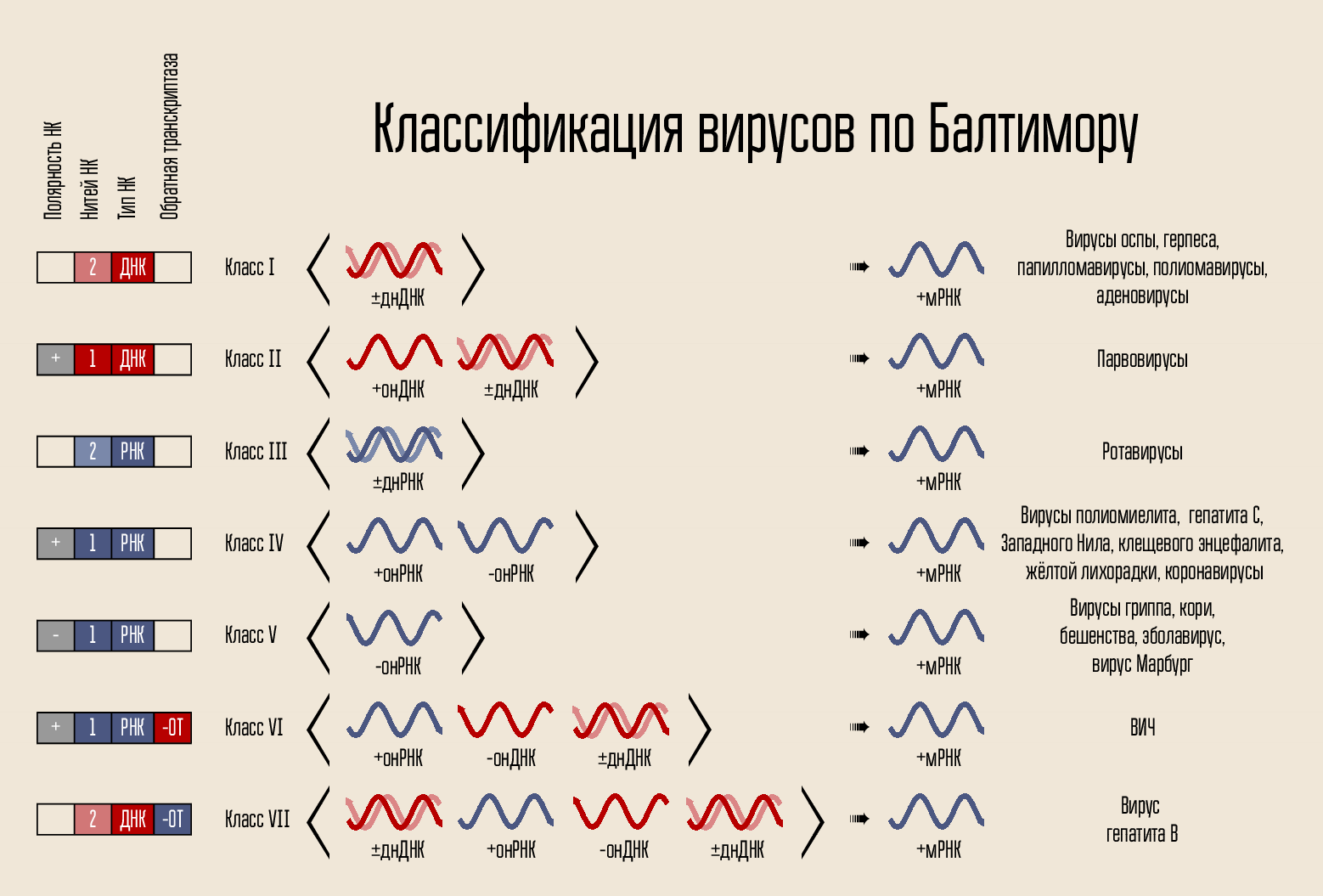
Der Code selbst zum Aufbau eines neuen Virus kann die Zelle selbst nicht durchdringen, er benötigt einen Penetrationsmechanismus. Daher gibt es eine Proteinhülle - ein Kapsid, das die NK des Virus schützt und dabei hilft, in die Zelle einzudringen. In einigen Fällen können Viren zusätzliche Lipidmembranen aufweisen.
Das Eindringen des Virus in die Zelle

Um in eine Zelle zu gelangen, muss sich das Virus mit seiner Membran verbinden. Dazu befinden sich Proteine auf der Oberfläche des Virus, die an die Rezeptorproteine der Wirtszelle binden - an Stellen auf der Oberfläche der Zellwand, an die sich das Virus anlagern kann. Und sie müssen genau auf das Virus abgestimmt sein, sonst kann es nicht einmal an der Zelle haften.
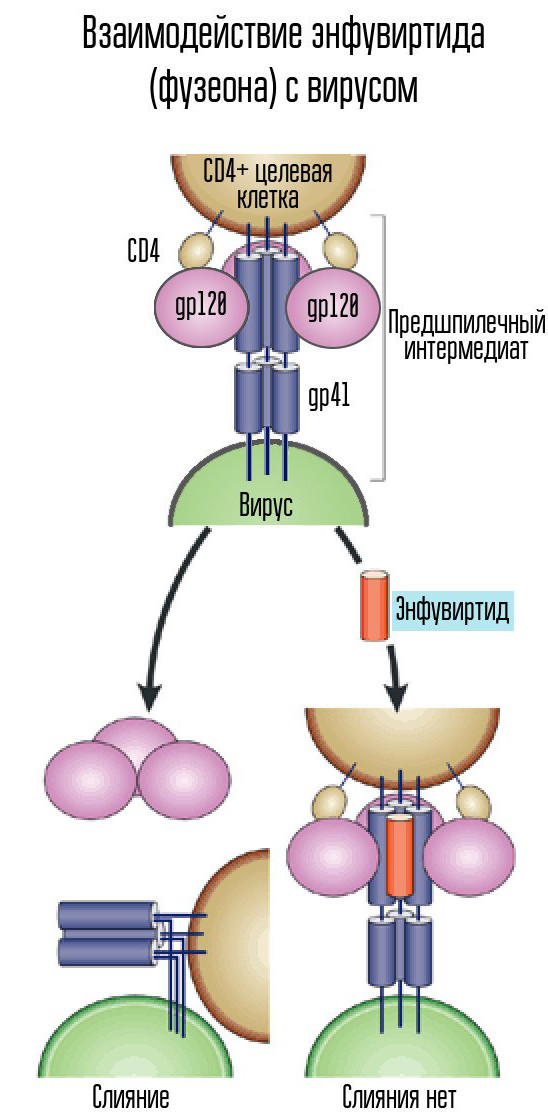
Zu diesem Zweck verwendet HIV den CD4-Rezeptor (Zellen mit einem solchen Rezeptor sind die Immunzellen des Körpers, einschließlich T-Lymphozyten, Monozyten, Makrophagen usw.). CD4 allein reicht nicht aus - Sie benötigen einen anderen Coreceptor, entweder CCR5 oder CXCR4. HIV verwendet gp120-Hüllprotein, um sich anzuschließen. Danach ändert sich die Form eines anderen Virushüllproteins, gp41. Es biegt sich zur Seite, bildet eine Haarnadel und lässt das Kapsid des Virus mit der Zelle verschmelzen.
Enfuvirtid (Fuzeon), ein Inhibitor des gp41-Proteins, ist eines der Mittel zur Bekämpfung des Virus. Enfuvirtid verbindet sich mit diesem Protein, um die Bildung von Haarnadeln zu verhindern. Somit kann das Kapsid des Virus nicht mit der Zelle verschmelzen und es tritt keine Infektion auf. Dieses Medikament ist der einzige entwickelte und zugelassene Fusionshemmer.
Retroviren, zu denen HIV gehört, sind aufgrund ihrer Variabilität ein äußerst unangenehmes Ziel für Medikamente. Menschliche Zellen sind viel weniger flüchtig. Es ist bekannt, dass etwa 1% der Bevölkerung Nordeuropas gegen HIV immun ist: Sie sind Träger der CCR5-∂32-Mutation, wodurch die CCR5-Rezeptorform für die Kombination mit HIV ungeeignet wird.
Leider ist es eine äußerst schwierige Aufgabe (obwohl es Versuche gegeben hat), die Form dieses Rezeptors für immer zu ändern, auch für neue Zellen, die weiterhin im menschlichen Körper auftreten. Die Entwicklung eines Rezeptorinhibitors ist jedoch ein Medikament, das sich an den Zellrezeptor anlagert und dadurch verhindert, dass sich HIV anschließt zu ihm - durchaus möglich.
Mehrere CCR5- und CXCR4-Rezeptorinhibitoren waren in der Entwicklung, aber der einzige bisher zugelassene ist Maraviroc, ein CCR5-Inhibitor.
Reverse Transkription
Was passiert nach der Fusion des Virus mit der Zelle bei HIV?
HIV ist Baltimores Klasse-VI-Virus und speichert sein Genom in RNA. Da sich im Kern der Zelle DNA befindet, muss HIV eine Nukleinsäure in eine andere verwandeln. Eine solche Transkription (NK → NK) wird von den entsprechenden Enzymen durchgeführt, die als Polymerasen bezeichnet werden. Für RNA-abhängige (d. H. Lesen von Informationen aus RNA) DNA-Polymerase (d. H. An deren Ausgang DNA erscheint) gibt es einen speziellen Namen - reverse Transkriptase. Reverse Transkriptase nimmt das gewünschte Desoxynukleosid (der Einfachheit halber beinhaltet es tatsächlich Desoxynukleosidtriphosphate) und baut DNA auf, die zur entsprechenden viralen RNA komplementär ist.
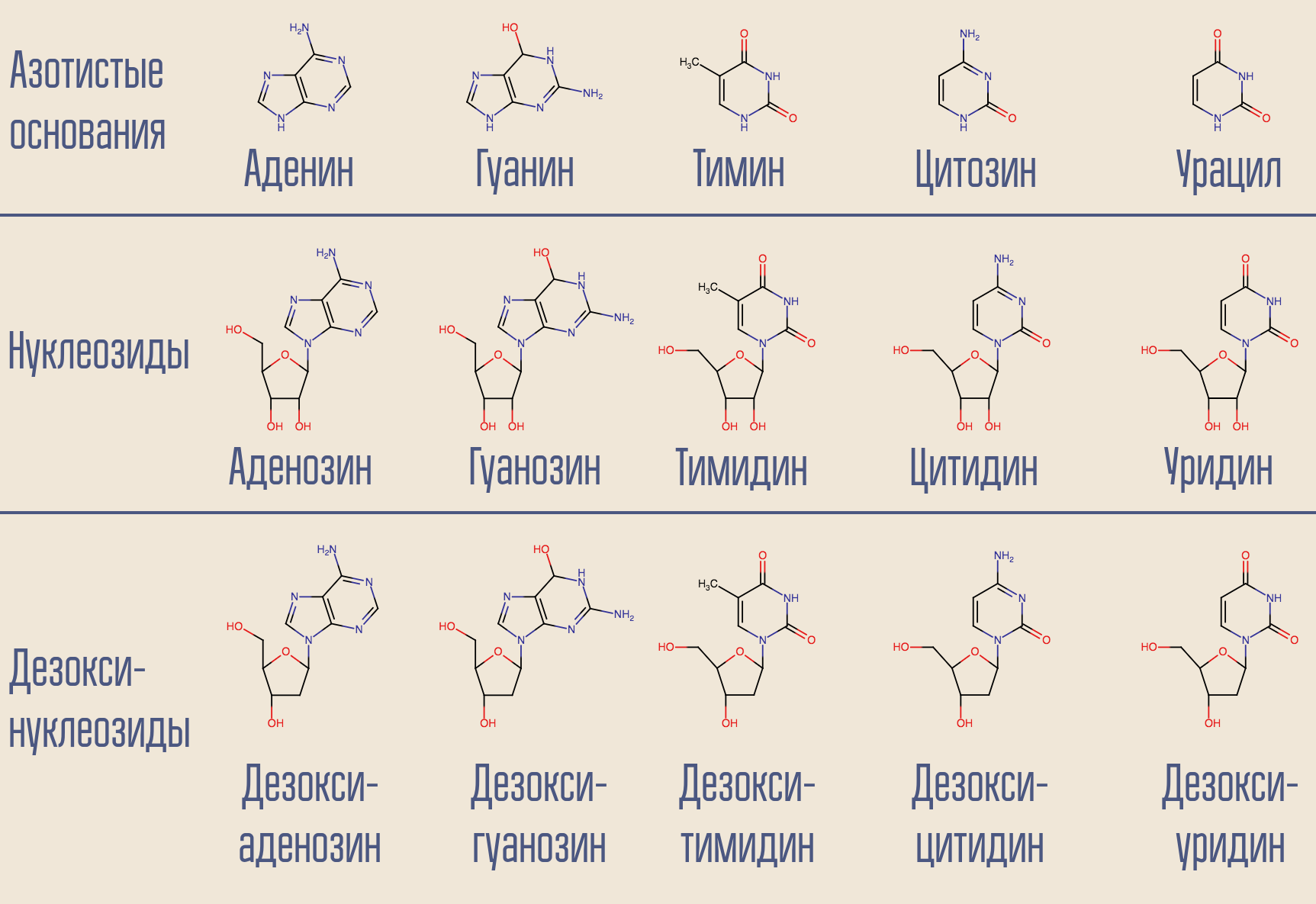
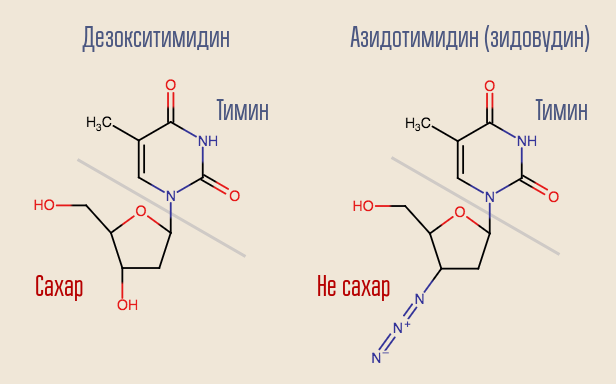
Kann dieser Vorgang unterbrochen werden? Ja, dafür müssen Sie nur eine reverse Transkriptase abtasten, die einem Desoxynukleosid ähnelt, aber keine ist. So wirkte das allererste HIV-Medikament, Zidovudin (Azidothymidin, AZT). Es ist ähnlich wie Desoxythymidin, ist es aber nicht.
Azidothymidin wurde im Rahmen der Suche nach Substanzen entwickelt, die Tumore bekämpfen können. Es wurde angenommen, dass er in die Konstruktion gewöhnlicher menschlicher DNA eingebettet sein und diese unterbrechen würde. Somit würde das Medikament die sich am schnellsten teilenden Zellen - Tumorzellen - am stärksten beeinflussen. Es gab bestimmte Gründe zu der Annahme, dass ein zuvor synthetisiertes anderes Medikament dieser Gruppe, 6-Mercaptopurin, bei der Behandlung von Leukämie wirksam war.
Leider erwies sich das Medikament im Tierversuch als unwirksam und wurde für einige Zeit vergessen, bis der Virologe Marty St. Clair, der in den Labors der Burroughs Wellcome Foundation arbeitete, 1984 Studien einleitete, um alle verfügbaren Substanzen für die Behandlung zu überprüfen Sie haben eine neue Krankheit - eine HIV-Infektion.
Die reverse Transkriptase "erkannte" Zidovudin als Desoxythymidin und versuchte, es in die DNA einzubauen. Die DNA-Synthese an dieser Stelle wurde unterbrochen, da das Arzneimittel nur Desoxythymidin ähnlich war. Zidovudin unterdrückte die Reproduktion des Virus vollständig, und Versuche am Menschen wurden fast sofort begonnen.
HIV-infizierte Freiwillige wurden in zwei Gruppen eingeteilt, von denen eine ein Placebo und die andere AZT erhielt. Der Unterschied zwischen den beiden Gruppen war so auffällig, dass weitere Tests als unmenschlich angesehen wurden - das Medikament zeigte eine erstaunliche Wirksamkeit.
Der Erfolg von Zidovudin hat Studien zu anderen Nucleosid-Reverse-Transkriptase-Inhibitoren (NRTIs) ausgelöst, und viele andere Medikamente sind in kurzer Zeit erschienen. Das interessanteste der ersten Medikamente ist Lamivudin, ein Analogon eines anderen Desoxynukleosids, Desoxycytidin. Der Nachteil von Lamivudin ist, dass sich bei Monotherapie mit diesem Medikament innerhalb von etwa einem Monat sehr schnell Resistenzen entwickeln. Dies ist auf die Einzelpunktmutation von HIV, M184V, zurückzuführen. Trotzdem war es wünschenswert, Lamivudin im System zu belassen. Tatsache ist, dass ein Virus mit dieser Mutation überempfindlich gegen Zidovudin ist und die Mutation selbst die Virusreplikationsrate verringert.
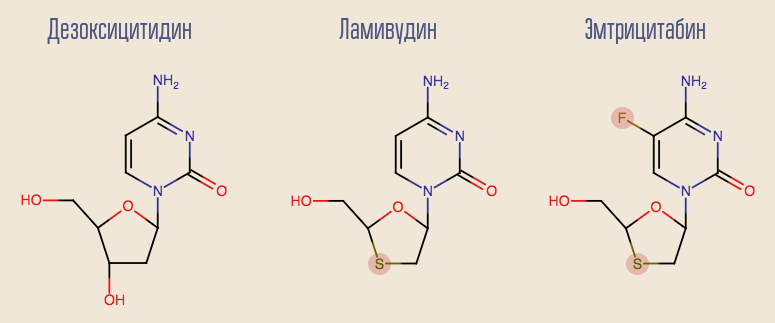
Gegenwärtig tritt Lamivudin allmählich in die Vergangenheit zurück und weicht seinem moderneren Analogon Emtricitabin. Sowohl Lamivudin als auch das Desoxyadenosin-Analogon Adefovir zeigen gute Ergebnisse bei der Behandlung von Hepatitis B. Leider wurde gezeigt, dass Adefovir bei der Behandlung von HIV unwirksam ist. Nach einer geringfügigen Modifikation seines Moleküls erschien jedoch eine aktualisierte Version davon - Tenofovir. Tenofovir und Emtricitabin sind Teil vieler moderner Therapielinien.
Die Kombination von zwei NRTIs könnte das Leben von Menschen mit HIV erheblich verlängern. Es war jedoch klar, dass zur vollständigen Unterdrückung des Virus mindestens ein Medikament mit einer anderen Wirkungsweise enthalten sein musste, da das Virus früher oder später eine Resistenz gegen eine beliebige Kombination von NRTIs entwickelte. Eine der ersten Substanzen einer anderen Art von Wirkung war eine andere Art von Inhibitor der reversen Transkriptase - Nicht-Nucleosid (NNRTI). Obwohl die reverse Transkriptase (RT) mit etwas ähnlichem wie einem Nukleosid (Nukleosidtriphosphat) arbeiten möchte, können Sie versuchen, eine Substanz herzustellen, die an RT bindet und ihre Form ändert, so dass sie ihre Funktionen nicht mehr erfüllen kann.
In den Jahren 1996 und 1998 wurden zwei solche Substanzen, Nevirapin bzw. Efavirenz, zugelassen. Jeder von ihnen unterdrückt wirksam die Arbeit von OT und schafft in Kombination mit zwei NRTIs ein vollständiges Schema einer hochaktiven antiretroviralen Therapie (HAART) - ausreichend für eine Person, die mit HIV lebt, um ein erfülltes Leben zu führen, dessen Dauer sich nicht wesentlich vom Leben einer Person ohne HIV unterscheidet .
Im Jahr 2006 wurde das erste Kombinationspräparat zur einmaligen Anwendung pro Tag zugelassen: Atripla. Atripla besteht aus zwei NRTIs, Emtricitabin und Tenofovir (in Form von Tenofovirdisoproxil - einem Prodrug, einer chemisch modifizierten Darreichungsform, die sich direkt im Körper in ein Medikament verwandelt) und einem NNRTI, Efavirenza. Atripla war ein qualitativ neuer Schritt zur Verbesserung der Lebensqualität von Patienten. Bis heute sind die Generika von Atripla eines der am häufigsten verwendeten Medikamente der Welt (in Entwicklungsländern).
Heute verlassen NNRTIs jedoch allmählich den Markt - alte Medikamente verursachen verschiedene Nebenwirkungen. So können beispielsweise die ersten zwei Monate nach Beginn der Einnahme von Efavirenz bei einigen Patienten (nicht bei allen!) Schwindel und ähnliche Auswirkungen haben. Das ist natürlich viel besser als der bevorstehende Tod; Dieser Zustand hält nicht so lange an und sie haben bereits gelernt, damit umzugehen. Der aktuelle Trend ist jedoch der Übergang zu solchen Medikamenten, der Patient bemerkt keine Nebenwirkungen von ihnen.
Integration
Wenn die reverse Transkriptase ihre Aufgabe erfüllt hat, ist es dann möglich, den Einbau von viraler DNA in die Zell-DNA zu stoppen? Ein spezielles Enzym namens Integrase ist an diesem Prozess beteiligt.
Der Prozess der Integration von viraler DNA verläuft in mehreren Schritten. Anfänglich bindet Integrase an virale DNA und entfernt das GT-Dinukleotid vom 3'-Ende jedes Strangs. Dann wird der gesamte Komplex zum Kern transportiert, wo die Integrase das Stadium des Kettenübergangs katalysiert. Diese Stufe ist eine Umesterungsreaktion (Austausch von Radikalen): Die DNA-Nukleotide einer Zelle werden nicht miteinander verbunden, sondern mit den Nukleotiden der viralen DNA. Integrase greift Internukleotidbindungen an, die sich in einem Abstand von fünf Nukleotiden befinden. Nach der Integration verbleiben also: die Verarbeitung der 5'-Enden der viralen DNA-Ketten, die Vervollständigung von 5 fehlenden Nukleotiden und die Ligation (die Verbindung zweier NK-Stränge mit einer Enzymligase), die unter Beteiligung zellulärer Proteine durchgeführt werden [1].
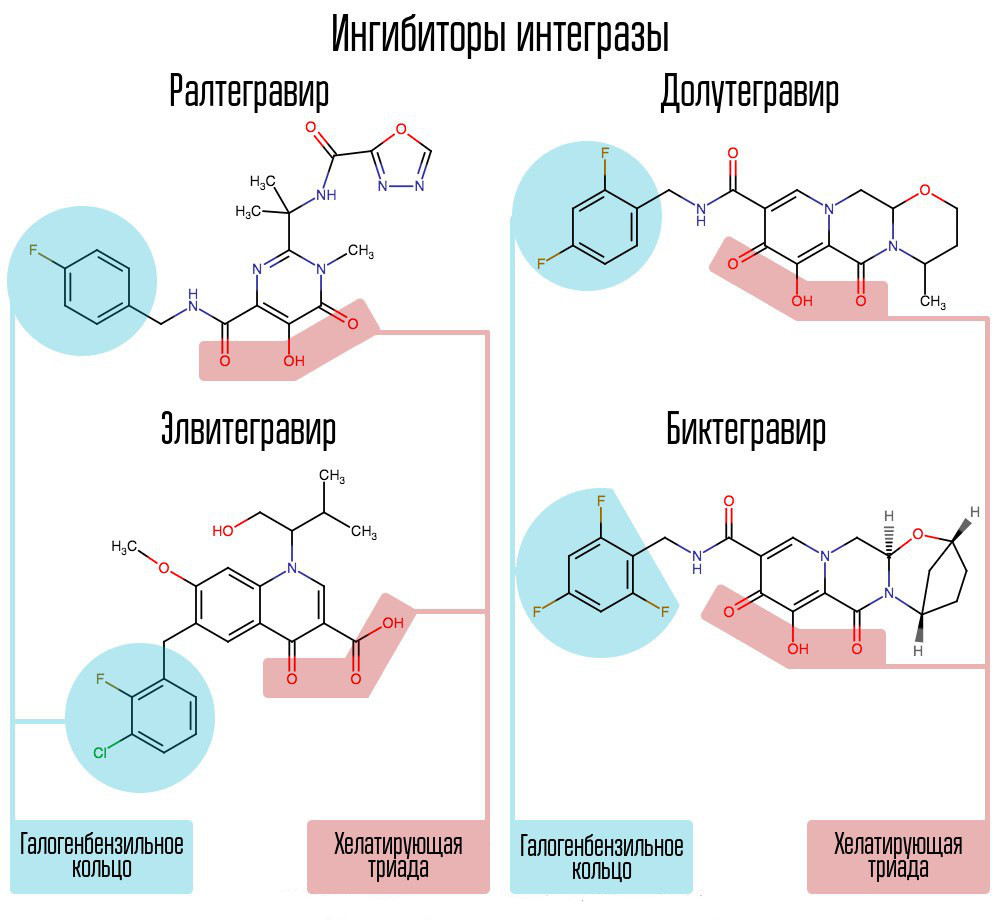
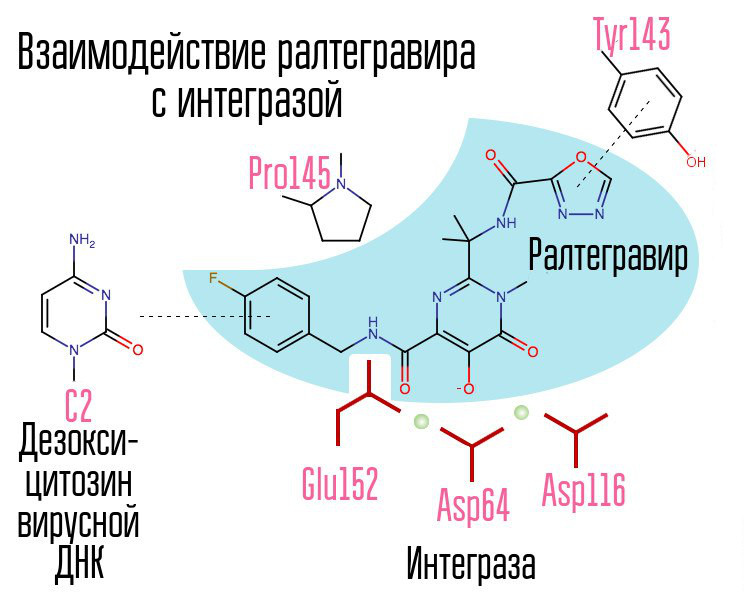
Das Screening von etwa 250.000 Substanzen in Bibliotheken chemischer Verbindungen ergab Substanzen, die die HIV-Integrase hemmen würden. Alle erwiesen sich als 2,4-Dioxobutansäureverbindungen. Sie koordinierten Metallionen im aktiven Zentrum der Integrase - in dem Teil, der für den Kettenübergang verantwortlich war. Weitere Versuche, HIV-1-Integrase-Inhibitoren zu entwickeln, führten zur Entstehung eines Derivats von N-Pyrimidinon, einer Substanz MK-0518 namens Raltegravir. [2]
Raltegravir und nachfolgenden Integrase-Inhibitoren gemeinsam sind die Chelat-Triade (koordinierende Metallionen) und der Halogen-Benzyl-Ring, der mit dem vorletzten Desoxycytosin am 3'-Ende der an das Enzym gebundenen viralen DNA interagiert.
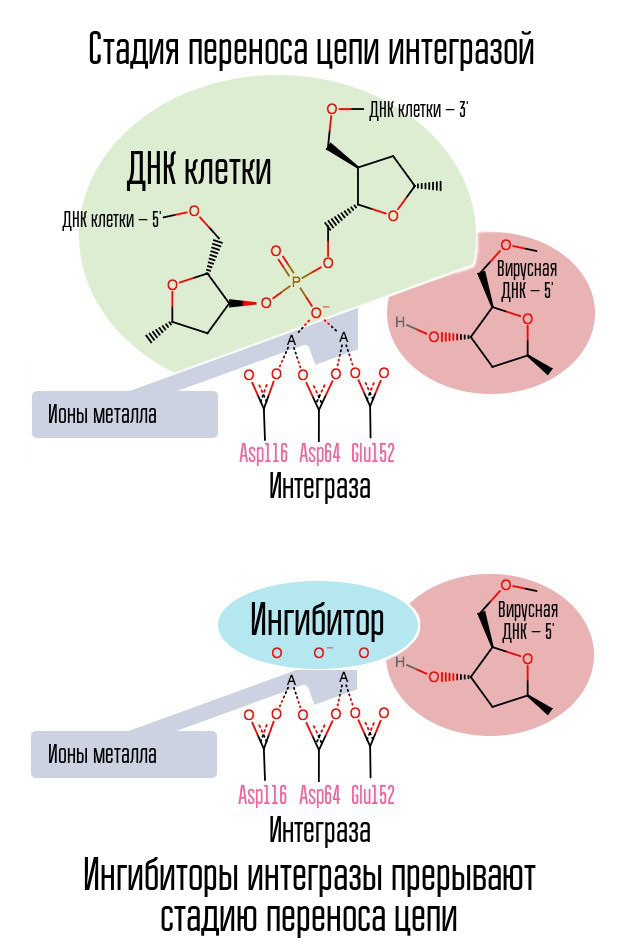
Der Prozess der Integration des Virus in die Zelle ist der letzte Schritt, in dem die Postexpositionsprophylaxe wirksam ist. Danach erscheinen im menschlichen Körper Zellen, die HIV-DNA in ihrem Kern tragen. Das effektivste Fenster für die Postexpositionsprophylaxe beträgt etwa 6 bis 10 Stunden.
Der Halogenbenzylring im Integrase-Inhibitor-Molekül interagiert mit viraler DNA, und die Gruppe der Sauerstoffatome interagiert mit zwei Metallatomen. Die Virusintegrase verwendet diese Metallatome, um virale DNA in die Zelle einzuführen. Dadurch wird der Integrationsprozess blockiert.
Moderne AIs wie Dolutegravir konnten Raltegravirs „Kinderkrankheiten“, die mit der raschen Bildung von Resistenzen verbunden sind, besiegen.
Proteolyse
Nachdem das virale Genom das Transkriptionsstadium durchlaufen hat, werden die erzeugten viralen RNAs gesendet, um die Zelle zu verlassen. Bei der Herstellung des Virions ist ein anderes virales Enzym namens Protease beteiligt. Protease schneidet lange Polyproteine in einzelne funktionelle Proteine, was zur Bildung von viralen Enzymen und Strukturproteinen des Virus führt.
Protease ist nicht nur gegen HIV-Proteine aktiv, sondern auch gegen Wirtszellproteine, was die zytotoxische Wirkung von HIV (Zelltod) erklären kann.
Wenn die Protease blockiert ist, kann das Virion die Reifungsphase nicht durchlaufen und bleibt vollständig funktionsunfähig. Die HIV-1-Protease ist eine typische retrovirale Asparaginprotease mit der charakteristischen Aminosäuresequenz Asp25 Thr26 Gly27 (Asparaginsäure - Threonin - Glycin) im aktiven Zentrum. Der erste Proteasehemmer, Saquinavir, wurde am 6. Dezember 1995 von der FDA zugelassen. So wurde nach der Entwicklung von Saquinavir erstmals eine hochaktive antiretrovirale Therapie verfügbar.
Ein weiterer typischer Vertreter dieser Arzneimittelgruppe ist Lopinavir (in Verbindung mit Ritonavir - Kaletra - einem der häufigsten HIV-Arzneimittel in Russland). Ritonavir ist ebenfalls ein Proteasehemmer, wird jedoch als Booster verwendet - dank seiner Wirkung steigt die Konzentration des Hauptarzneimittels.
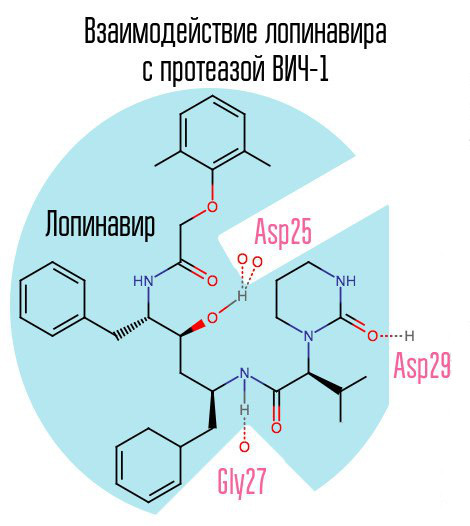
Da Saquinavir und nachfolgende Proteaseinhibitoren (PIs) spezifisch auf das aktive Zentrum des Enzyms abzielen und eine Resistenz gegen einen PI entwickelt, besteht eine hohe Wahrscheinlichkeit, dass Resistenzen gegen andere PIs auftreten. Die Lösung für dieses Problem kann die Schaffung solcher Inhibitoren sein, die auf andere Proteasezonen gerichtet sind.
Das Medikament Darunavir (Prezista), das 2006 erschien, erleichterte das Problem der gegen IP resistenten HIV-1-Stämme etwas, da es an Position 30 eine zuvor nicht verwendete Verbindung mit Asparaginsäure bildete.
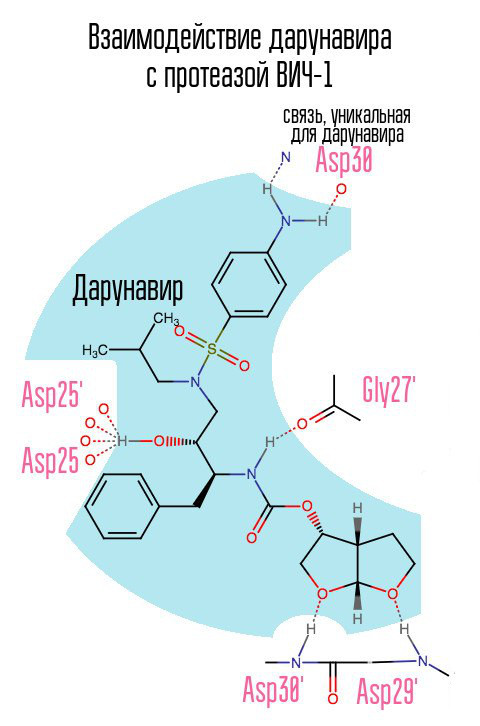
Ohne Protease kann das Virus den Reifungsprozess nicht durchlaufen. Inhibitoren binden an das aktive Zentrum der Protease und verhindern deren Wirkung.
Proteaseinhibitoren sind bei hoher Viruslast hochwirksam: Da derzeit viele neue Virionen im Körper geboren werden, lassen PIs sie nicht reifen, wodurch die Viruslast in kurzer Zeit wirksam reduziert wird. Derzeit werden PIs jedoch nicht in der Erstlinientherapie eingesetzt, wodurch Integrase-Inhibitoren (II) Platz machen.
Der Grund dafür waren die Nebenwirkungen: Tatsache ist, dass beispielsweise dasselbe Kaletra zu einer unspezifischen Hemmung der Proteolyse von Proteinen aus der Nahrung führte, da diese Proteine in den Dünndarm gelangen und Durchfall verursachen. Das Befolgen einer bestimmten Diät oder die Verwendung neuer PIs wie Prezista kann diesen Effekt auf nahezu Null reduzieren. Ein anderer Effekt, der mit einem erhöhten Zuckergehalt verbunden ist, verhindert jedoch häufig die Verwendung von Proteaseinhibitoren auf unbestimmte Zeit.
Moderne Behandlungsschemata
Bisher werden die modernsten als Schemata angesehen, die aus einem Integrase-Inhibitor und einem oder zwei NRTIs bestehen (Dolutegravir + Abacavir + Lamivudin; Dolutegravir + Lamivudin ist ein beliebtes Zweikomponenten-Schema, das jedoch nicht für alle geeignet ist). Diese Systeme ermöglichen es einer Person, ein erfülltes Leben zu führen, das sich in seiner Dauer nicht vom Leben einer Person ohne HIV unterscheidet.
Trotz aller Erfolge ist eine vollständige Heilung von HIV immer noch nicht möglich (eine Knochenmarkstammzelltransplantation von einem Spender mit CCR5-∂32-Mutation ermöglicht das Erreichen eines solchen Ergebnisses, aber anscheinend nur, wenn eine Transplantat-gegen-Wirt-Reaktion auftritt. in einer großen Anzahl von Fällen, die zum Tod des Empfängers führen).
Fazit
Die entwickelten HIV-Methoden haben im Kampf gegen andere Infektionskrankheiten geholfen: Wie oben erwähnt, sind Lamivudin und Tenofovir gegen das Hepatitis-B-Virus wirksam (Baltimore-Klasse VII - Hepatitis-B-Polymerase kann RNA auf DNA übertragen, so dass einige NRTIs bei der Bekämpfung wirksam sind). . Die gewonnenen Erkenntnisse haben dazu beigetragen, direkt wirkende Medikamente gegen Hepatitis C zu entwickeln, die diese Krankheit heute vollständig heilen können (Hepatitis C hat keine latente Phase, daher können bei der Unterdrückung der Viruslast keine neuen Virionen entstehen - die Krankheit ist vollständig geheilt).
[1] Korolev S. P., Agapkina Yu. Yu., Gottikh M. B. Probleme und Perspektiven der klinischen Verwendung von HIV-1-Integrationsinhibitoren
[2] Shahgildyan V.I. HIV-Integrase-Hemmer - die Grundlage einer wirksamen und sicheren antiretroviralen Therapie