
Woran erinnern wir uns mit dem Satz "Science Fiction"? Natürlich Roboter, fliegende Autos, das Studium bisher unerforschter Ecken des Universums, Außerirdische und eine ganze Reihe von Handlungen. Unter ihnen hat das Thema der Ansiedlung auf einem anderen Planeten immer einen besonderen Platz eingenommen, entweder aus dem Vertrauen in die Unvermeidlichkeit des eigenen Todes oder aus dem Wunsch, die Situation radikal zu verändern. Der erste Anwärter auf den Titel Earth 2.0 war schon immer der Mars, kalt und leblos. Im Moment ist es noch nicht möglich, Ihre Koffer zu packen und zwei Wochen im Urlaub zum Mars zu fliegen, aber das ist absolut realistisch und machbar, die Frage ist nur, wie schnell. Das auffälligste Minus des Mars (mit Ausnahme des Fehlens eines normalen Internets) ist das Fehlen einer akzeptablen Lebensatmosphäre. Um zum Ziel zu fliegen, aus dem Flugzeug auszusteigen und tief zu atmen, spüren Sie die Frische der lokalen Luft - hier geht es nicht um den Mars. Das wird aber nicht immer so sein.
Heute werden wir mit Ihnen eine Studie treffen, die eine neue Methode zur Erzeugung von Sauerstoff durch eine ungewöhnliche chemische Reaktion beschreibt. Wie haben Wissenschaftler molekularen Sauerstoff aus CO
2 hergestellt , wie effektiv ist diese Methode und wo kann sie anders als interplanetare Reisen eingesetzt werden? Wir werden im Bericht von Wissenschaftlern nach Antworten auf diese Fragen suchen. Lass uns gehen.
Studienbasis
Ein Mensch braucht nur drei Dinge fürs Leben: Nahrung, Wasser und Luft, in denen genügend Sauerstoff vorhanden ist. Dies sind unsere Hauptbedürfnisse (ja, das Internet ist nicht auf dieser Liste). Aber Sauerstoff liegt einfach nicht auf der Straße, besonders außerhalb unseres geliebten Planeten. Wenn wir also irgendwohin wollen, müssen wir es mitnehmen und verschiedene Geräte verwenden, um die Luft zu reinigen und wiederzuverwenden. All diese Freude nimmt viele Plätze ein und früher oder später wird der Sauerstoff erschöpft sein. Und das Auffüllen von Reserven im Weltraum oder auf dem Mars wird, gelinde gesagt, problematisch sein.
Vor relativ kurzer Zeit entdeckten Wissenschaftler jedoch eine ziemlich große Menge Sauerstoff im Kometen 67P / CG6, was sie dazu veranlasste, eine sehr offensichtliche Frage zu stellen - woher kam sie? Sauerstoff in Körpern wie Kometen ist das Ergebnis einer abiotischen Reaktion, die unter extremen Bedingungen auftritt, bei denen H
2 O, CO
2 , CO usw. O
2 (Sauerstoff) wird freigesetzt. Wissenschaftler behaupten, dass solche Reaktionen das Vorhandensein von Sauerstoff in Kometen, der oberen Marsatmosphäre und in der frühen Erdatmosphäre erklären können. Eine Person kann eine solche chemische Reaktion verwenden, um aus CO
2 O
2 zu erzeugen, wodurch der Mars lebensfähig wird.
Wenn sehr übertrieben und kurz, dann ist die oben erwähnte Reaktion die Zersetzung von CO
2 in Komponenten: C + O
2 . Mit anderen Worten, Dissoziation.
Die Dissoziation von CO
2 kann in Abhängigkeit von der für die Reaktion verfügbaren Energie in verschiedenen Szenarien stattfinden. Die teilweise Dissoziation von CO
2 → CO + O (5,43 oder 7,56 eV) erfordert die geringste Energie. Es gibt auch eine vollständige Dissoziation von CO
2 → C + O + O, was 16,46 eV erfordert. Und die merkwürdigste, exotischste Dissoziation ist, wenn sich CO
2 in C und O
2 zersetzt. Berechnungen zeigen, dass eine ähnliche Reaktion auf der Oberfläche der potentiellen Energie des Grundzustands abläuft und zunächst eine cyclische CO
2 -Zwischenverbindung [c-CO
2 (
1 A
1 )] bildet, die sich dann auf dem Weg zur Dissoziation in ein kolineares COO-Zwischenprodukt (
1 Σ
+ ) umwandelt in C + O
2 .
Eine solche Reaktion ist möglich, wenn das Molekül so "gebogen" wird, dass die beiden O-Atome so nahe wie möglich beieinander liegen. Dies erfordert 6 eV innere Energie. Und Sie müssen zugeben, egal wie stark Männer Metallstangen biegen, es wird viel schwieriger sein, ein Molekül zu biegen.
Übergänge in elektronisch angeregte und anionische Zustände von CO
2 können helfen, das Molekül zu biegen. Wissenschaftler erinnern sich, dass jüngste Experimente ihrer Kollegen gezeigt haben, dass die Verwendung von VUV-Photoanregung (Vakuum-Ultraviolett) und Elektronenaddition die Dissoziation von CO
2 zu C (
3 P) + O
2 (X
3 Σ
g -) ermöglicht. Bisher hat jedoch niemand diesen exotischen Prozess auf einer ausreichend detaillierten Ebene untersucht. Und das alles, weil als Ergebnis solcher Experimente keine ionisierten O
2 -Produkte gefunden wurden. Aber wie wir wissen, bedeutet es nicht, etwas nicht zu finden, dass es überhaupt nicht ist.
Daher haben Wissenschaftler in der Studie, die wir heute betrachten, Ionenstrahlstreuungsmethoden zusammen mit mathematischen Modellen angewendet, um einen neuen Weg zur Aktivierung der direkten Reduktion von CO
2 zu O
2 beim Nachweis ionisierter O
2 -Produkte aufzuzeigen. Dieser Prozess enthält einen bisher unbekannten intramolekularen Reaktionsweg, der bei aktiven Kollisionen von Ionen und der Oberfläche von CO
2 auftritt. Am überraschendsten ist die fehlende Abhängigkeit dieser Reaktion von der Art und Temperatur der Oberfläche.
Forschungsergebnisse
Zunächst demonstrieren Wissenschaftler die Bildung von O
2 bei hyperthermischen CO
2 + / Au-Kollisionen, indem sie die kinetische Energieverteilung von drei gestreuten Molekülionenprodukten (CO
2 + , O
2 + und O
2 - ) für verschiedene einfallende CO
2 + -Energien (E
0 )
auftragen. . Bei E
0 <80 eV wurde ein sehr schwaches Signal von gestreutem CO
2+ festgestellt (
1a , Grafik links).
 Bild Nr. 1
Bild Nr. 1Die Spitzenenergie des ausgehenden CO
2+ ist proportional zu E
0 , dh es gibt einen ballistischen oder gepulsten Rückprall von der Oberfläche, der physikalisches Sputtern ausschließt. Wissenschaftler glauben, dass die Beobachtung eines „dynamischen“ CO
2+ -Signals von entscheidender Bedeutung ist, da dies ein Beweis dafür ist, dass einige CO
2 eine Oberflächenkollision überleben. Zusätzlich kann man die Reihenfolge der Kollisionen von Atomen bestimmen. Zusätzlich zu CO 2+ wurden auch Signale von gestreuten O
2 -Ionen beobachtet (
1b ,
1c / Graph in der Mitte und rechts). In diesem Fall stellen die Energien des freigesetzten O
2+ und O
2+ - einen großen Teil der Energie der einfallenden Partikel dar (57%) und steigen in einem größeren Bereich parallel zu E
0 gleichmäßig an als das gestreute CO
2+ . Das maximale Signal von O
2 -Ionen wurde bei E
0 ~ 100 eV beobachtet.
Forscher bezeichnen die Entdeckung von O
2 -Ionenprodukten als überraschend, da weder die Zerstäubung von Oberflächen-O
2 noch die Abstraktion des O-Atoms die Bildung dieser Ionen erklären können. Und das alles, weil diese beiden Mechanismen O
2 bei viel niedrigeren Ausgangsenergien produzieren würden als beobachtet. Es ist logisch anzunehmen, dass hier genau die Dissoziation von CO
2 beteiligt ist.
Sowohl die teilweise als auch die vollständige Dissoziation von CO
2 stimmt gut mit anderen nachgewiesenen ionischen Produkten (CO
+ , CO
- , O
+ , O
- und C
+ ) überein. Und die Energie des ausgehenden CO
+ , CO
- und O
- ändert sich parallel zur Energie der einfallenden Partikel, was mit der dynamischen Bildung bei einer Oberflächenkollision übereinstimmt.
Die Peaks O
+ und C
+ zeigen jedoch eine extrem geringe Abhängigkeit von E
0 , was auf einen anderen Ursprung hinweist, d. H. Sprühen. Bestätigung der vollständigen Dissoziation sind gestreute C
+ -Produkte, die sich bei E
0 > 80 eV manifestieren.
Als nächstes verwendeten die Wissenschaftler Kinematik, um den Streumechanismus zu beschreiben.
Die binäre Kollisionstheorie (BPS) ermöglicht es uns, den kinematischen Faktor zu berechnen, der als Anteil der Energie der einfallenden Partikel definiert ist, die von dem von der Oberfläche austretenden gestreuten Produkt gehalten wird. Im einfachsten Modell wird CO 2+ als ganzes Molekül gestreut, d.h. als feste Kugel mit einer Atommasse von 44 Da. In diesem Fall sagt das BPS einen kinematischen Koeffizienten von 0,6349 voraus, der mit den Daten eher schwach korreliert ist (
2a ).
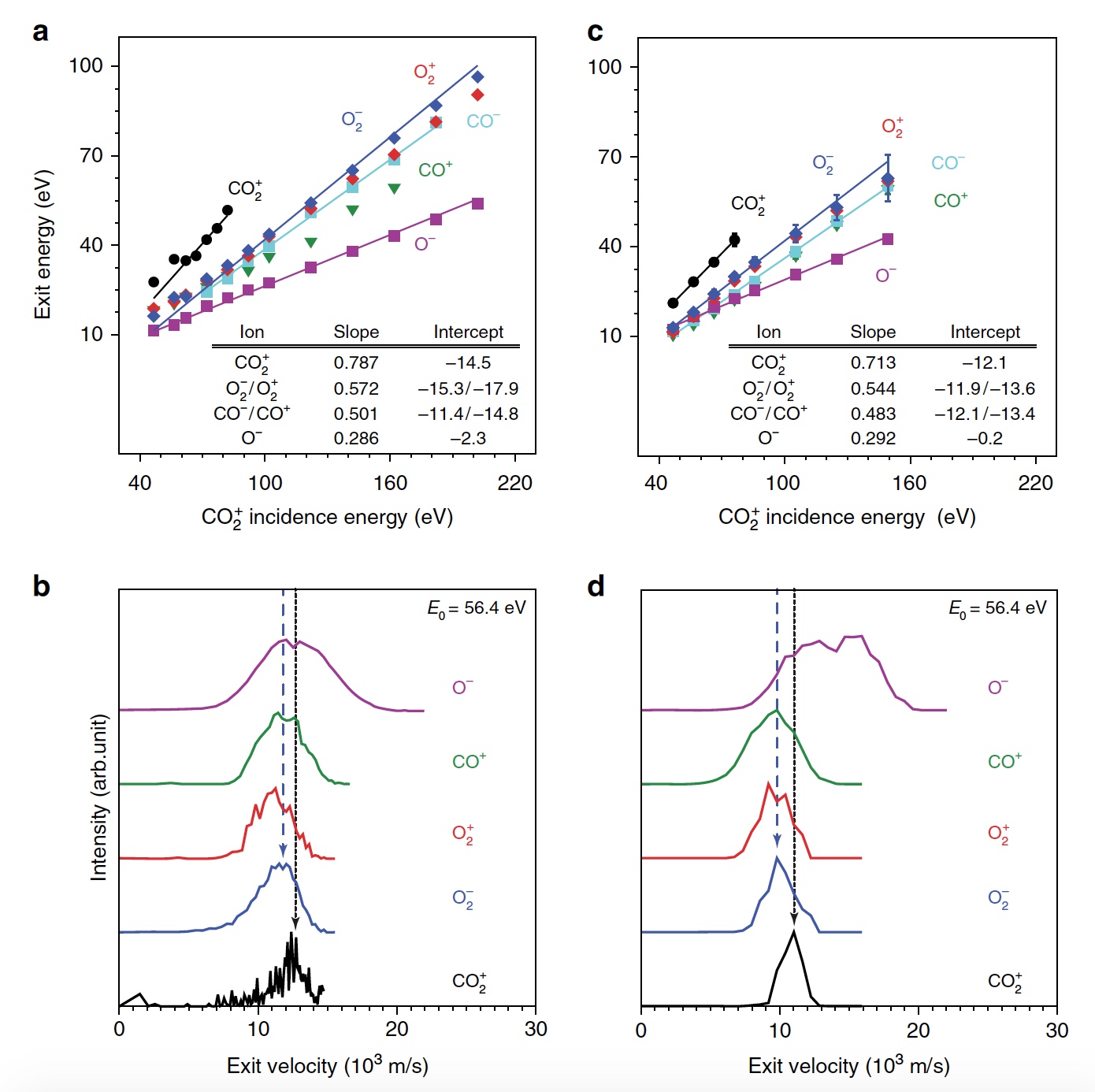 Bild Nr. 2
Bild Nr. 2Danach verwendeten die Wissenschaftler ein Modell, bei dem das O-Atom zuerst mit dem Oberflächen-Au-Atom kollidiert und dann die zweite Kollision des CO-Fragments ohne schnelle Dissoziation des CO
2 -Moleküls erfolgt. Die Anwendung von BPS auf dieses Modell aufeinanderfolgender Kollisionen ergibt einen kinematischen Koeffizienten von 0,7870, was in hervorragender Übereinstimmung mit den Energiedaten des ausgehenden CO 2+ (schwarze Linie bei
2a ) ist. Grafik
2a zeigt auch die Energien anderer ausgehender gestreuter ionischer Produkte.
Die potentielle Hauptquelle solcher Produkte kann als teilweise oder vollständige Dissoziation von CO
2 und Oberflächenspritzen von adsorbierten CO
2 -Fragmenten bezeichnet werden. Trotz der Tatsache, dass bei hohen Werten von E
0 (> 140 eV) tatsächlich ein gewisses Sputtern beobachtet wird, liefert eine kinematische Analyse der Daten zur Energie der austretenden Partikel überzeugende Beweise für das Vorhandensein einer genau gepulsten Dissoziation des CO
2 -Moleküls.
Als nächstes führten die Wissenschaftler eine Analyse der Geschwindigkeit der beobachteten Streupartikel durch.
2b zeigt einen Vergleich der Peaks der Ionenverteilung bei E
0 = 56,4 eV. Wie wir sehen können, überlappen sich die Austrittsraten von gestreutem CO
+ , O
2 + , O
2 - und dem langsameren Teil der O
- Verteilung, was auf einen gemeinsamen Ursprung hinweist. Die Verteilung von O
ist jedoch merklich breiter und erstreckt sich auf höhere Ausgangsgeschwindigkeiten, was auf einen alternativen Ursprung hinweisen kann. O
2 -Ionenprodukte treten aufgrund von Inelastizität aufgrund des Aufbrechens chemischer Bindungen und nicht resonanter Oberflächenionisation mit einer Geschwindigkeit aus, die niedriger als CO 2+ ist.
Die obige kinematische Analyse hat laut Wissenschaftlern schlüssige Beweise dafür geliefert, dass einige CO
2 -Moleküle nach einer zweistufigen sequentiellen Kollision von O- und CO-Fragmenten intakt gestreut sind. Es bleiben jedoch noch Fragen zu verschiedenen Aspekten des O
2 -Bildungsmechanismus offen.
Nach den Experimenten bleiben noch einige Fragen offen. Erstens bleibt unklar, ob O
2 durch den elektronischen adiabatischen oder nicht-adiabatischen Mechanismus erzeugt wird. Zweitens sind die Kollisionspfade, die der Geschwindigkeitsverteilung am Ausgang ionischer Fragmente zugrunde liegen, unbekannt. Drittens ist nicht bekannt, wie viel neutrales O
2 gebildet wird .
In diesem Fall kann die Modellierung die Situation klären, nämlich die klassische molekulardynamische Methode (MD-Methode).
Um die Streubahn von CO
2 auf Au (111) zu simulieren, wurde die im Experiment beobachtete Streugeometrie angewendet. Es wird angenommen, dass bei der Neutralisation der ankommenden CO
2+ -Ionen vor einer harten Kollision CO
2 an der Oberfläche der potentiellen Energie eines Singulett-Elektrons freigesetzt wird.
Eine schnelle Neutralisation erfolgt durch resonantes Tunneln von Elektronen von der Metalloberfläche zum molekularen Kation, da der molekulare Gehalt an CO
2 (-13,8 eV) innerhalb der besetzten Au-Zone liegt (von -5,3 bis -15,3 eV). In der Simulation wurden auch Elektronentransfers von / zur Oberfläche berücksichtigt, um die Ionisierung neutraler Kollisionsprodukte zu berücksichtigen.
Bild
2c zeigt die berechneten Energiewerte der austretenden Partikel.
Es wurde gefunden, dass eine kleine Anzahl von CO
2 die Integrität bei E
0 > 80 eV beibehält, was mit dem Fehlen eines Signals bei diesen Energien während praktischer Experimente übereinstimmt. Die durch Modellierung erhaltenen Daten stimmen hervorragend mit den experimentellen Daten überein, was durch Vergleich der Graphen
2a (Experiment) und
2c (Simulation) leicht
erkennbar ist .
Zusätzlich zu dieser Übereinstimmung zwischen Experimenten und Modellierung manifestiert sich dies auch in einem Vergleich der Rate der Ausgangsionen bei E
0 = 56,4 eV (
2d ). Sowohl das Modell als auch das Experiment zeigen eine Erweiterung der Verteilung der CO
+ - und O
- Geschwindigkeiten. Es wurde auch bestätigt, dass die Verteilungen von O
2+ und O
2 - dem Kation ähnlich sind, das langsamer austritt als das Anion. Zusätzlich wurde in beiden Fällen festgestellt, dass CO 2+ mit einer höheren Geschwindigkeit als ionisierte O
2 -Produkte austritt.
Daher kann die Verwendung dieser Modellierungstechnik ziemlich genaue Daten bezüglich des Reaktionsmechanismus der direkten Umwandlung von CO
2 in O
2 liefern.
Während der Hauptphase der Simulation wurden 20.000 CO
2 -on-Au-Kollisionsbahnen bei verschiedenen Energien der austretenden Partikel nachgebildet. Als Ergebnis wurden mehrere Varianten von Dissoziationsprodukten erhalten, einschließlich O
2 (
3a ).
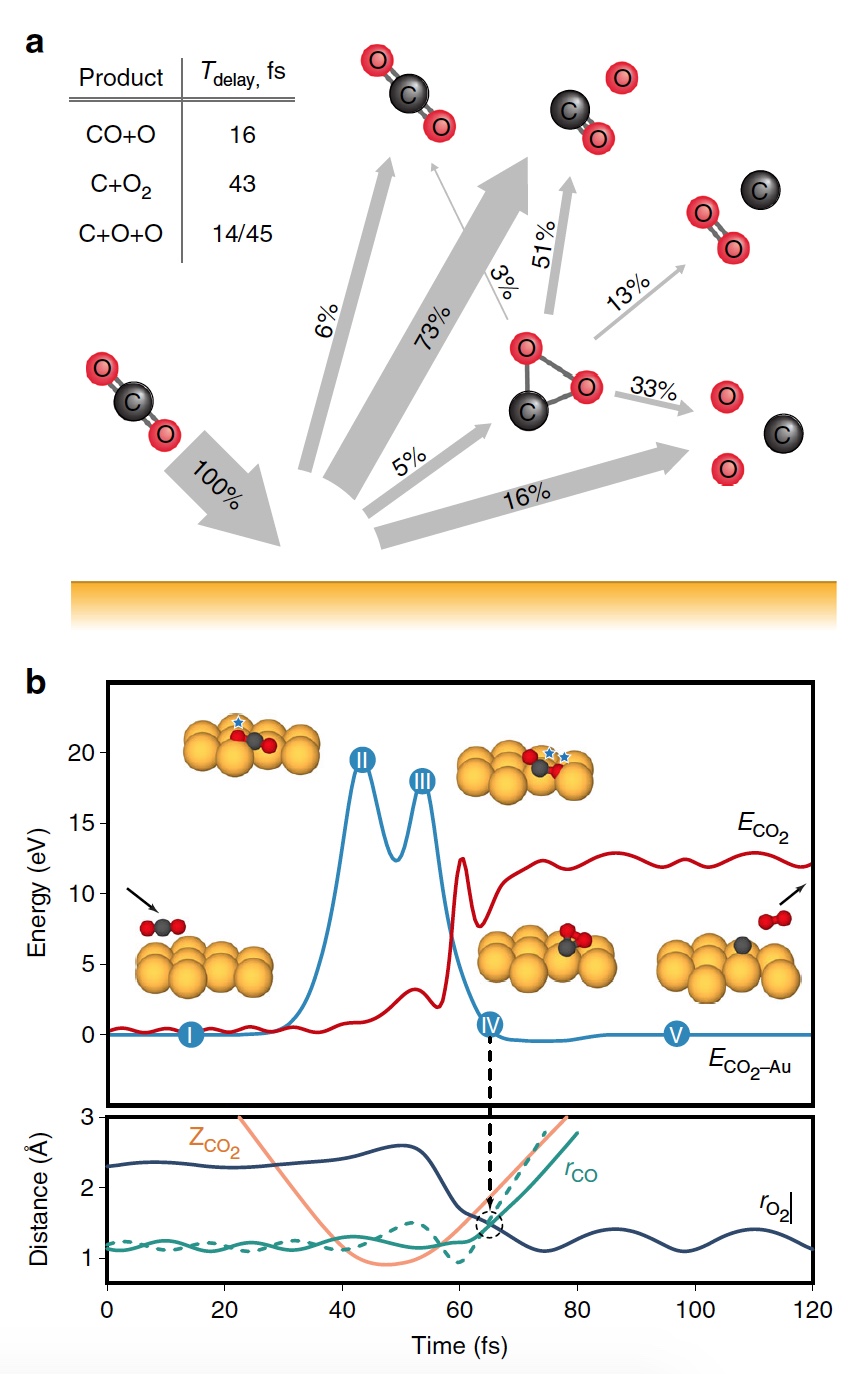 Bild Nr. 33b
Bild Nr. 33b zeigt eine repräsentative Trajektorie, die zur O
2 -Bildung führt. Infolge der gepulsten Energieübertragung während einer Kollision tritt eine signifikante intramolekulare Umlagerung innerhalb des springenden CO
2 auf . Der OO-Abstand nimmt ab und der CO-Abstand nimmt zu und erreicht einen Peak, wenn CO
2 eine dreieckige Konfiguration mit nahezu gleichen Bindungslängen annimmt. Solch ein stark gebogenes CO
2 -Zwischenprodukt hat eine signifikante Menge an innerer Energie und dissoziiert schnell, was zur Bildung eines freien C-Atoms und eines schwingungsheißen O
2 -Moleküls führt.
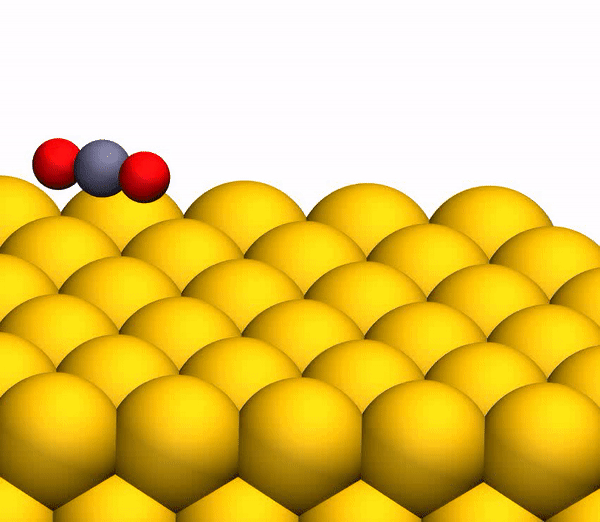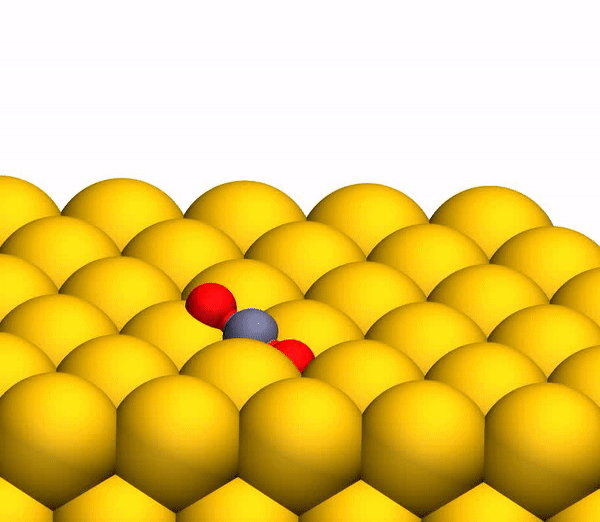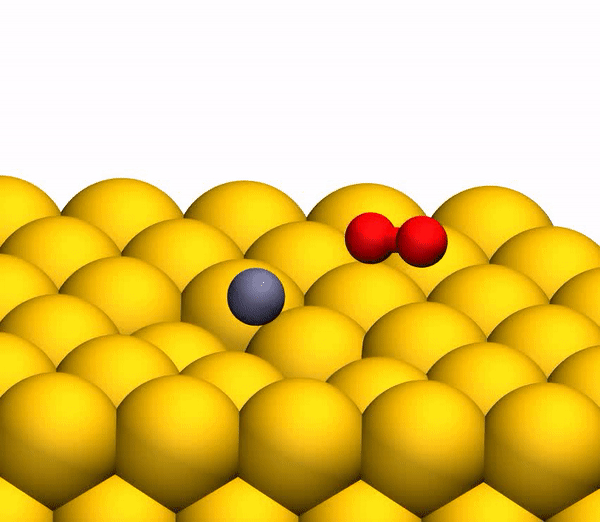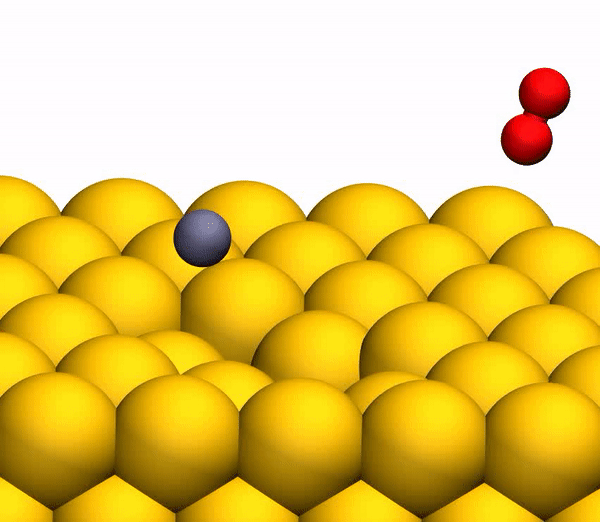 Der Prozess der Trennung von CO 2 in ein freies C-Atom und ein schwingungsheißes O 2 -Molekül.
Der Prozess der Trennung von CO 2 in ein freies C-Atom und ein schwingungsheißes O 2 -Molekül.Es ist anzumerken, dass der oben beschriebene Trennmechanismus vollständig mit den Schlussfolgerungen des zuvor verwendeten kinematischen Modells übereinstimmt.
Berechnungen zeigten, dass ungefähr 5% aller Trajektorien zu einem stark gebogenen Zwischenzustand von CO
2 führen , der eine der Stufen der O
2 -Extraktion ist. Dieser Zustand wird hauptsächlich durch partielle Dissoziation (51%) fragmentiert, wonach wieder eine vollständige Dissoziation folgt, jedoch mit einem höheren Ergebnis (33%).
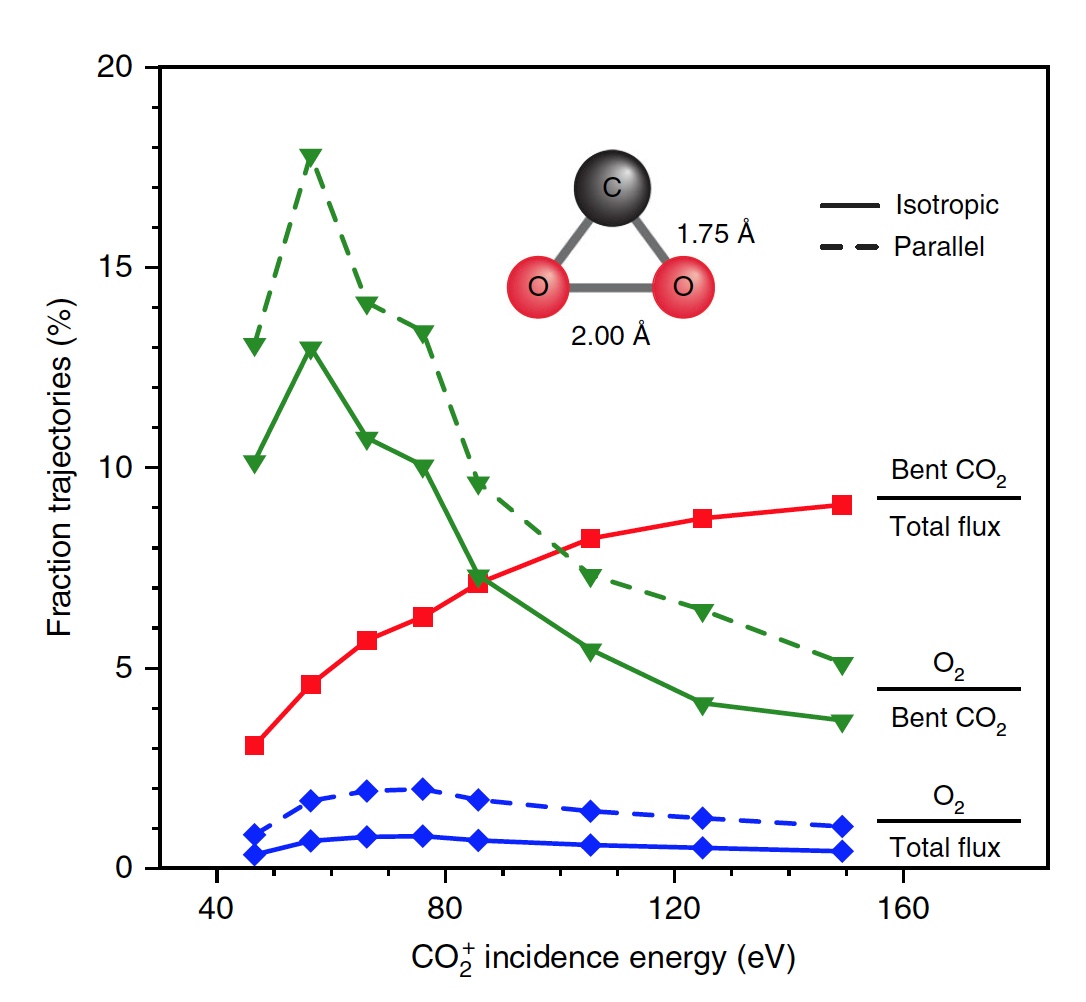 Bild Nr. 4
Bild Nr. 4Wissenschaftler stellen fest, dass von allen gekrümmten CO
2 -Molekülen nur 13 Prozent Sauerstoff produzieren. Das heißt, das Gesamtergebnis der Dissoziation von CO
2 → C + O
2 beträgt 0,6% bei E
0 = 56,4 eV. Wenn Sie die Energie der einfallenden Partikel erhöhen, können Sie O
2 bei E
0 ~ 70 ± 15 eV auf bis zu 0,8 ± 0,2% erhalten (blaue Linie in Bild Nr. 4).
Zusätzlich nimmt der Anteil der O
2 -bildenden Trajektorien signifikant zu, wenn ein stark gebogener Zwischenzustand von CO
2 (grüne Linie) erreicht wird, der bei E
0 ~ 55 ± 10 eV ein Maximum von 13% erreicht. Die geringere Gesamtausbeute an neutralem O
2 ist darauf zurückzuführen, dass nur ein kleiner Teil der linearen CO
2 -Moleküle einen stark gebogenen Zustand erreicht (rote Linie). Wenn Sie die Ausrichtung der ankommenden CO
2 -Moleküle (Achse parallel zur Oberfläche) spezifisch ändern, erhalten Sie als Ergebnis 2% mehr O
2 (gestrichelte grüne Linie).
Um die Nuancen der Studie genauer kennenzulernen, empfehle ich Ihnen, den
Bericht von Wissenschaftlern zu lesen .
Nachwort
Diese Arbeit hat gezeigt, dass es durch nicht standardmäßige chemische Reaktionen möglich ist, Sauerstoff aus Kohlendioxid zu gewinnen. Niemand wird argumentieren, dass eine solche Technik weitere Verfeinerungen und Verbesserungen erfordert. Die Tatsache, dass diese Arbeit wirklich neue Möglichkeiten für interplanetare Reisen, die Kolonisierung des Mars, eröffnet und nicht nur nicht geleugnet werden kann. Es gibt auch ein Problem mit Sauerstoff und Kohlendioxid auf unserem Heimatplaneten. Vielmehr hat bei letzterem das Volumen seit der Industrialisierung erheblich zugenommen. Und wenn man bedenkt, dass CO
2 einer der Hauptverursacher der globalen Erwärmung ist, klingt es nach einer sehr verlockenden Idee, seine Menge zu reduzieren und Sauerstoff daraus zu gewinnen. Da wir immer noch nicht auf Fabriken, Fabriken, Autos mit Verbrennungsmotor und andere Dinge verzichten können, werden die neuen Methoden zur Reinigung unserer Atmosphäre nicht nur benötigt, sondern sind äußerst notwendig. Für Reisen zu fernen Planeten ist es sicherlich cool, aber bevor die massive Bewegung zum Mars noch sehr, sehr weit ist, lohnt es sich, mehr über die Erde nachzudenken, auf der wir leben, als über den Mars, von dem wir träumen.
Vielen Dank für Ihre Aufmerksamkeit, bleiben Sie neugierig und haben Sie eine gute Arbeitswoche, Jungs! :) :)
Vielen Dank für Ihren Aufenthalt bei uns. Gefällt dir unser Artikel? Möchten Sie weitere interessante Materialien sehen? Unterstützen Sie uns, indem Sie eine Bestellung
aufgeben oder Ihren Freunden empfehlen, einen
Rabatt von 30% für Habr-Benutzer auf ein einzigartiges Analogon von Einstiegsservern, das wir für Sie erfunden haben: Die ganze Wahrheit über VPS (KVM) E5-2650 v4 (6 Kerne) 10 GB DDR4 240 GB SSD 1 Gbit / s von $ 20 oder wie teilt man den Server? (Optionen sind mit RAID1 und RAID10, bis zu 24 Kernen und bis zu 40 GB DDR4 verfügbar).
Dell R730xd 2 mal günstiger? Nur wir haben
2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2,6 GHz 14C 64 GB DDR4 4 x 960 GB SSD 1 Gbit / s 100 TV von 199 US-Dollar in den Niederlanden! Dell R420 - 2x E5-2430 2,2 GHz 6C 128 GB DDR3 2x960 GB SSD 1 Gbit / s 100 TB - ab 99 US-Dollar! Lesen Sie mehr über
den Aufbau eines Infrastrukturgebäudes. Klasse mit Dell R730xd E5-2650 v4 Servern für 9.000 Euro für einen Cent?