
Berechnen Sie vor dem Lesen, wie viele Geräte mit Batterien sich in einem Umkreis von mehreren Metern neben Ihnen befinden. Sicherlich werden Sie ein Smartphone, ein Tablet, eine Smartwatch, einen Fitness-Tracker, einen Laptop oder eine drahtlose Maus sehen? Alle diese Geräte sind mit Lithium-Ionen-Batterien ausgestattet - ihre Erfindung kann als eines der wichtigsten Ereignisse auf dem Gebiet der Energie angesehen werden.
Leichte, geräumige und kompakte Lithium-Ionen-Batterien trugen zum Boom der tragbaren Elektronik bei, dessen Existenz bisher unmöglich war. Nur Geräte in den letzten 30 Jahren haben einen fantastischen Technologiesprung gemacht, und moderne Lithium-Ionen-Batterien unterscheiden sich kaum von den ersten Serienmodellen der frühen neunziger Jahre. Wer und wie hat wiederaufladbare Lithium-Ionen-Batterien erfunden, welche Zusammensetzungen werden in ihnen verwendet und gibt es eine globale Verschwörung gegen „ewige“ Batterien? Wir erzählen.
Die Legende der ersten Batterie
Zwischen dem ersten Versuch, Elektrizität chemisch zu erzeugen, und der Herstellung von Lithium-Ionen-Batterien sind vielleicht zwei Jahrtausende vergangen. Es gibt eine unbestätigte Vermutung, dass das erste vom Menschen geschaffene galvanische Element in der Geschichte der Menschheit die „Bagdad-Batterie“ war, die 1936 vom Archäologen Wilhelm Koenig in der Nähe von Bagdad gefunden wurde. Der Fund, datiert II-IV Jahrhundert v. ist ein Tongefäß, in dem sich ein Kupferzylinder und ein Eisenstab befinden, dessen Raum mit "Elektrolyt" - Säure oder Alkali gefüllt werden könnte. Die moderne Rekonstruktion des Funds hat gezeigt, dass es möglich ist, eine Spannung von bis zu 0,4 Volt zu erreichen, wenn das Gefäß mit Zitronensaft gefüllt ist.
 Die Bagdad-Batterie ist einer tragbaren Batterie ziemlich ähnlich. Oder ein Papyrusfall? Quelle: Ironie / Wikimedia
Die Bagdad-Batterie ist einer tragbaren Batterie ziemlich ähnlich. Oder ein Papyrusfall? Quelle: Ironie / Wikimedia
Warum könnte die „Bagdad-Batterie“ verwendet werden, wenn noch ein paar tausend Jahre bis zur Entdeckung der Elektrizität verbleiben? Vielleicht wurde es für die genaue Abscheidung von Gold auf Figuren durch die Galvanisierungsmethode verwendet - Strom und Spannung von der „Batterie“ reichen dafür völlig aus. Dies ist jedoch nur eine Theorie, da die alten Völker keine Beweise für die Verwendung von Elektrizität und derselben „Batterie“ erhalten haben: Die Vergoldung wurde zu dieser Zeit durch Verschmelzung angewendet, und das ungewöhnliche Gefäß selbst könnte genauso gut ein geschützter Behälter für Schriftrollen sein.
Die Little Bang Theorie
Das russische Sprichwort „Es würde kein Glück geben, aber das Unglück hat geholfen“ veranschaulicht den Arbeitsverlauf an Lithium-Ionen-Batterien bestmöglich. Ohne einen unerwarteten und unangenehmen Vorfall könnte sich die Erstellung neuer Batterien um mehrere Jahre verzögern.
In den 1970er Jahren verwendete der Brite Stanley Whittingham, der bei der Exxon Energy Company arbeitete, eine Titansulfidanode und eine Lithiumkathode, um eine wiederaufladbare Lithiumbatterie herzustellen. Die erste wiederaufladbare Lithiumbatterie zeigte tolerierbare Strom- und Spannungsindikatoren, explodierte nur in regelmäßigen Abständen und vergiftete die Menschen um sie herum mit Gas: Titandisulfid setzte beim Kontakt mit Luft Schwefelwasserstoff frei, der zumindest unangenehm zu atmen ist, aber höchstens gefährlich. Darüber hinaus war Titan immer sehr teuer, und in den 1970er Jahren lag der Preis für Titandisulfid bei etwa 1.000 USD pro Kilogramm (das entspricht heutzutage 5.000 USD). Ganz zu schweigen von der Tatsache, dass metallisches Lithium in der Luft brennt. Also wandte Exxon Whittinghams Projekt von der Sünde ab.
1978 forschte Koichi Mizushima, der seine Promotion in Physik verteidigte, an der Universität Tokio, als er von Oxford eingeladen wurde, sich John Goodenoughs Gruppe anzuschließen, um nach neuen Materialien für Batterieanoden zu suchen. Dies war ein sehr vielversprechendes Projekt, da das Potenzial von Lithium-Stromquellen bereits bekannt war, sie es jedoch nicht wirklich schafften, das launische Metall zu zähmen. Jüngste Whittingham-Experimente zeigten, dass der Beginn der Massenproduktion der begehrten Lithium-Ionen-Batterien noch weit entfernt war.
Die experimentellen Batterien verwendeten eine Lithiumkathode und eine Sulfidanode. Die Überlegenheit von Sulfiden gegenüber anderen Materialien in den Anoden gab Mizushima und seinen Kollegen eine Richtung zur Suche. Wissenschaftler bestellten vor Ort in ihrem Labor einen Sulfidofen, um schneller mit verschiedenen Verbindungen zu experimentieren. Die Arbeit mit dem Ofen endete nicht sehr gut: Eines Tages explodierte er und verursachte ein Feuer. Der Vorfall zwang ein Forscherteam, ihre Pläne zu überdenken: Vielleicht waren Sulfide trotz ihrer Wirksamkeit nicht die beste Wahl. Wissenschaftler haben ihre Aufmerksamkeit auf Oxide gerichtet, deren Synthese viel sicherer war.
Nach vielen Tests mit verschiedenen Metallen, einschließlich Eisen und Mangan, stellte Mizushima fest, dass Lithiumkobaltoxid die besten Ergebnisse zeigt. Verwenden Sie es einfach nicht so, wie es Gudenafs Team zuvor angenommen hatte - um nicht nach Material zu suchen, das Lithiumionen absorbiert, sondern nach Material, das am leichtesten Lithiumionen liefert. Kobalt war auch besser als andere, da es alle Sicherheitsanforderungen erfüllt und die Zellenspannung auf 4 Volt erhöht, was im Vergleich zu früheren Batterieoptionen doppelt so viel ist.
Die Verwendung von Kobalt war der wichtigste, aber nicht der letzte Schritt bei der Herstellung von Lithium-Ionen-Batterien. Nachdem sich die Wissenschaftler mit einem Problem befasst hatten, standen sie vor einem anderen: Die Stromdichte war zu niedrig, als dass Lithium-Ionen-Zellen wirtschaftlich eingesetzt werden könnten. Und das Team, das einen Durchbruch erzielt hat, hat den zweiten geschafft: Wenn die Dicke der Elektroden auf 100 Mikrometer reduziert wurde, konnte die Stromstärke mit doppelter Spannung und Kapazität auf das Niveau anderer Batterietypen erhöht werden.
Erste kommerzielle Schritte
Die Geschichte der Erfindung der Lithium-Ionen-Batterien endet hier nicht. Trotz der Entdeckung von Mizushima hatte das Gudenaf-Team noch keine Probe für die Massenproduktion bereit. Aufgrund der Verwendung von Lithiummetall in der Kathode während des Batterieladens kehrten Lithiumionen nicht in einer gleichmäßigen Schicht zur Anode zurück, sondern durch Dendriten - geprägte Ketten, die beim Wachsen einen Kurzschluss und ein Feuerwerk verursachten.
1980 entdeckte der marokkanische Wissenschaftler Rachid Yazami, dass Graphit die Rolle einer Kathode übernimmt und absolut feuerfest ist. Die zu diesem Zeitpunkt vorhandenen organischen Elektrolyte zersetzten sich bei Kontakt mit Graphit schnell, so dass Yazami sie durch festen Elektrolyten ersetzte. Yazamis Graphitkathode wurde von der Entdeckung der Polymerleitfähigkeit durch Professor Hideki Shirakawa inspiriert, für die er den Nobelpreis für Chemie erhielt. Und die Yazami-Graphitkathode wird immer noch in den meisten Lithium-Ionen-Batterien verwendet.
In Produktion gehen? Und wieder nein! Weitere 11 Jahre vergingen, die Forscher verbesserten die Batteriesicherheit, erhöhten die Spannung und experimentierten mit verschiedenen Kathodenmaterialien, bevor die erste Lithium-Ionen-Batterie in den Handel kam.
Die kommerzielle Probe wurde von Sony und dem japanischen Chemiekonzern Asahi Kasei entwickelt. Es wurde die Batterie für den Film-Amateur-Camcorder Sony CCD-TR1. Es hielt 1000 Ladezyklen stand und die Restkapazität nach einem solchen Verschleiß war viermal höher als die einer ähnlichen Art von Nickel-Cadmium-Batterie.
Kobalt-Stolperstein
Vor der Entdeckung von Lithium-Kobaltoxid von Koichi Mizushima war Kobalt kein begehrtes Metall. Seine Hauptvorkommen wurden auf dem Territorium Afrikas in dem Staat entdeckt, der heute als Demokratische Republik Kongo bekannt ist. Der Kongo ist der größte Kobaltlieferant - 54% dieses Metalls werden hier abgebaut. Aufgrund der politischen Umwälzungen im Land in den 1970er Jahren stieg der Kobaltpreis um 2000%, kehrte aber später zu seinen vorherigen Werten zurück.
Hohe Nachfrage schafft hohe Preise. Weder in den 1990er noch in den 2000er Jahren war Kobalt eines der Hauptmetalle auf dem Planeten. Aber was begann mit der Popularisierung von Smartphones in den 2010er Jahren? Im Jahr 2000 betrug die Nachfrage nach Metall etwa 2.700 Tonnen pro Jahr. Bis 2010, als iPhone- und Android-Smartphones triumphierend um den Planeten marschierten, stieg die Nachfrage auf 25.000 Tonnen und wuchs von Jahr zu Jahr weiter. Jetzt übersteigt die Anzahl der Bestellungen das verkaufte Kobaltvolumen um das Fünffache. Als Referenz: Mehr als die Hälfte des weltweit abgebauten Kobaltes fließt in die Herstellung von Batterien.
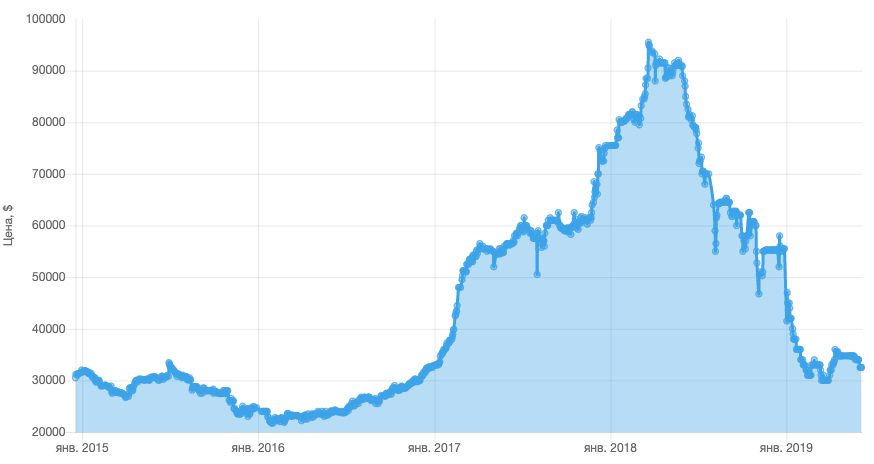 Kobaltpreis-Chart für die letzten 4 Jahre. Kommentare sind überflüssig. Quelle: Elec.ru
Kobaltpreis-Chart für die letzten 4 Jahre. Kommentare sind überflüssig. Quelle: Elec.ru
Wenn der Preis pro Tonne Kobalt im Jahr 2017 durchschnittlich 24.000 USD betrug, ist er seit 2017 stark gestiegen und erreichte 2018 einen Höchststand von rund 95.500 USD. Obwohl Smartphones nur 5-10 Gramm Kobalt verbrauchen, haben steigende Metallpreise die Kosten der Geräte beeinflusst.
Und dies ist einer der Gründe, warum Hersteller von Elektroautos besorgt sind über den Rückgang des Kobaltanteils in Autobatterien. Zum Beispiel reduzierte Tesla die Masse an knappem Metall von 11 auf 4,5 kg pro Maschine und plant, in Zukunft überhaupt wirksame Verbindungen ohne Kobalt zu finden. Bis 2019 stieg der Kobaltpreis ungewöhnlich an und fiel auf die Werte von 2015, aber die Batterieentwickler haben ihre Bemühungen verstärkt, den Kobaltanteil abzulehnen oder zu verringern.
In herkömmlichen Lithium-Ionen-Batterien macht Kobalt etwa 60% der Gesamtmasse aus. Die in Kraftfahrzeugen verwendete Lithium-Nickel-Mangan-Zusammensetzung umfasst je nach den gewünschten Eigenschaften der Batterie 10% bis 30% Kobalt. Die Lithium-Nickel-Aluminium-Zusammensetzung beträgt nur 9%. Diese Gemische sind jedoch kein vollständiger Ersatz für Lithiumkobaltoxid.
Li-Ionen-Probleme
Bis heute sind verschiedene Arten von Lithium-Ionen-Batterien die besten Batterien für die meisten Verbraucher. Sie sind geräumig, leistungsstark, kompakt und kostengünstig und weisen dennoch schwerwiegende Nachteile auf, die den Anwendungsbereich einschränken.
Brandgefahr. Für den normalen Betrieb benötigt ein Lithium-Ionen-Akku einen Leistungsregler, um ein Überladen und Überhitzen zu verhindern. Andernfalls wird der Akku zu einer sehr brennbaren Sache, die in der Hitze oder beim Laden über einen Adapter von schlechter Qualität anschwillt und explodiert. Die Explosionsgefahr ist möglicherweise der Hauptnachteil von Lithium-Ionen-Batterien. Um die Kapazität innerhalb der Batterien zu erhöhen, wird die Anordnung verdichtet, wodurch bereits geringfügige Schäden an der Hülle sofort zu einem Brand führen. Jeder erinnert sich an die sensationelle Geschichte mit dem Samsung Galaxy Note 7, bei der aufgrund der Dichtheit im Inneren des Gehäuses die Batteriehülle mit der Zeit gerieben wurde, Sauerstoff in das Gehäuse eindrang und das Smartphone plötzlich blitzte. Seitdem haben einige Fluggesellschaften beantragt, Lithium-Ionen-Batterien nur im Handgepäck mitzuführen. Auf Frachtflügen ist auf der Verpackung ein großer Warnaufkleber mit Batterien angebracht.
Druckentlastung ist eine Explosion. Aufladen ist eine Explosion. Das Energiepotential von Lithium muss mit Vorsichtsmaßnahmen bezahlt werden.Altern Lithium-Ionen-Batterien neigen zum Altern, auch wenn sie nicht verwendet werden. Daher wird das vor 10 Jahren als Sammler ausgepackte Smartphone, beispielsweise das allererste iPhone, aufgrund der Alterung des Akkus viel weniger geladen. Übrigens sind die Empfehlungen gerechtfertigt, die Batterien bis zur Hälfte der Kapazität aufgeladen zu halten - wenn sie bei langer Lagerung vollständig aufgeladen werden, verliert die Batterie ihre maximale Kapazität viel schneller.
Selbstentladung. Es ist eine schlechte Idee, Energie in Lithium-Ionen-Batterien anzusammeln und über viele Jahre zu speichern. Grundsätzlich verlieren alle Batterien ihre Ladung, Lithium-Ionen tun dies jedoch besonders schnell. Wenn NiMH-Zellen 0,08–0,33% pro Monat verlieren, verlieren Li-Ion-Zellen 2-3% pro Monat. In einem Jahr verliert der Lithium-Ionen-Akku ein Drittel der Ladung und setzt sich nach drei Jahren auf Null. Nehmen wir fairerweise an, dass Nickel-Cadmium-Batterien immer noch schlechter sind - 10% pro Monat. Aber das ist eine ganz andere Geschichte.
Temperaturempfindlichkeit. Kühlung und Überhitzung wirken sich stark auf die Parameter einer solchen Batterie aus: +20 ° C gelten als ideale Umgebungstemperatur für Lithium-Ionen-Batterien. Wenn sie auf +5 ° C reduziert wird, gibt die Batterie dem Gerät 10% weniger Energie. Das Abkühlen unter Null beansprucht mehrere zehn Prozent der Kapazität und wirkt sich auch auf den Zustand der Batterie aus: Wenn Sie versuchen, sie beispielsweise über eine Energiebank aufzuladen, tritt ein "Memory-Effekt" auf, und die Batterie verliert aufgrund der Bildung von Lithiummetall auf der Anode unwiderruflich an Kapazität. Bei durchschnittlichen russischen Wintertemperaturen ist die Lithium-Ionen-Zelle nicht funktionsfähig. Lassen Sie das Telefon im Januar eine halbe Stunde lang auf der Straße, um dies zu überprüfen.
Um die beschriebenen Probleme zu lösen, experimentieren Wissenschaftler mit Materialien von Anoden und Kathoden. Beim Ersetzen der Elektrodenzusammensetzung wird ein großes Problem durch kleinere Probleme ersetzt - der Brandschutz führt zu einer Verkürzung des Lebenszyklus und ein hoher Entladestrom verringert den spezifischen Energieverbrauch. Daher wird die Zusammensetzung für die Elektroden in Abhängigkeit von der Anwendung der Batterie ausgewählt.
Wer hat die Revolution gestohlen?
Jedes Jahr gibt es in Newsfeeds Berichte über einen weiteren Durchbruch bei der Entwicklung extrem geräumiger und langlebiger Batterien - es scheint, als würden Smartphones ein Jahr lang ohne Aufladen funktionieren und in zehn Sekunden aufgeladen. Und wo ist die Batteriewende, die Wissenschaftler allen versprechen?
In solchen Berichten verzerren Journalisten häufig die Fakten und lassen wichtige Details aus. Beispielsweise kann ein Akku mit sofortiger Aufladung eine sehr geringe Kapazität haben, die nur zur Stromversorgung eines Nachtweckers geeignet ist. Oder die Spannung erreicht nicht ein Volt, obwohl Smartphones 3,6 V benötigen. Und um eine Eintrittskarte für das Leben zu erhalten, muss der Akku kostengünstig und mit hohem Brandschutz ausgestattet sein. Leider war die überwiegende Mehrheit der Entwicklungen in mindestens einem Parameter minderwertig, weshalb die "revolutionären" Batterien nie über das Labor hinausgingen.
 In den späten 00ern experimentierte Toshiba mit wiederaufladbaren Methanol-Brennstoffzellen (auf dem Foto mit Methanol tanken), aber Lithium-Ionen-Batterien waren noch praktischer. Quelle: Toshiba
In den späten 00ern experimentierte Toshiba mit wiederaufladbaren Methanol-Brennstoffzellen (auf dem Foto mit Methanol tanken), aber Lithium-Ionen-Batterien waren noch praktischer. Quelle: Toshiba
Und natürlich lassen wir die Verschwörungstheorie außer Acht: "Endlose Batterien sind für Hersteller nicht rentabel." Heutzutage sind Batterien in Verbrauchergeräten unersetzlich (oder besser gesagt, sie können gewechselt werden, sind aber schwierig). Vor 10 bis 15 Jahren war das Ersetzen eines beschädigten Akkus in einem Mobiltelefon einfach, aber dann haben die Stromquellen in ein oder zwei Jahren aktiven Gebrauchs wirklich viel Kapazität verloren. Moderne Lithium-Ionen-Batterien halten länger als der durchschnittliche Lebenszyklus des Geräts. Bei Smartphones können Sie daran denken, den Akku frühestens nach 500 Ladezyklen auszutauschen, wenn er 10-15% seiner Kapazität verliert. Vielmehr verliert das Telefon selbst an Relevanz, bevor der Akku endgültig ausfällt. Das heißt, Batteriehersteller verdienen nicht mit dem Austausch, sondern mit dem Verkauf von Batterien für neue Geräte. Der „ewige“ Akku eines zehn Jahre alten Telefons schadet also nicht dem Geschäft.
Goodenoughs Team ist wieder im Geschäft
Aber was ist mit den Wissenschaftlern der John Goodenough-Gruppe passiert, die das Lithium-Kobalt-Oxid entdeckt und damit effiziente Lithium-Ionen-Batterien zum Leben erweckt haben?
2017 gab der 94-jährige Goodenough bekannt, dass er zusammen mit Wissenschaftlern der University of Texas einen neuen Typ von Festkörperbatterien entwickelt hat, der 5- bis 10-mal mehr Energie speichern kann als frühere Lithium-Ionen-Batterien. Hierzu wurden die Elektroden aus reinem Lithium und Natrium hergestellt. Versprochen und niedriger Preis. Es gibt jedoch noch keine genauen Angaben und Prognosen zum Beginn der Massenproduktion. Angesichts des langen Weges zwischen der Eröffnung der Gudenaf-Gruppe und dem Beginn der Massenproduktion von Lithium-Ionen-Batterien sind in 8 bis 10 Jahren echte Proben zu erwarten.
Koichi Mizushima forscht weiter bei der Toshiba Research Consulting Corporation. „Rückblickend bin ich überrascht, dass niemand vor uns vermutet hat, so einfaches Material wie Lithiumkobaltoxid für die Anode zu verwenden. Zu diesem Zeitpunkt waren viele andere Oxide ausprobiert worden. Wenn wir also nicht gewesen wären, hätte wahrscheinlich jemand anderes diese Entdeckung innerhalb weniger Monate gemacht “, sagte er.
 Koichi Mizushima erhielt eine Auszeichnung der Royal Chemical Society of Great Britain für die Teilnahme an der Herstellung von Lithium-Ionen-Batterien. Quelle: Toshiba
Koichi Mizushima erhielt eine Auszeichnung der Royal Chemical Society of Great Britain für die Teilnahme an der Herstellung von Lithium-Ionen-Batterien. Quelle: Toshiba
Die Geschichte toleriert keine Konjunktivstimmungen, zumal Herr Mizushima selbst zugibt, dass ein Durchbruch bei der Herstellung von Lithium-Ionen-Batterien unvermeidlich war.
Trotzdem ist es interessant, sich vorzustellen, wie die Welt der mobilen Elektronik ohne kompakte und geräumige Batterien aussehen würde: Laptops mit einer Dicke von wenigen Zentimetern, riesige Smartphones, die zweimal am Tag aufgeladen werden müssen, und keine Smartwatches, Fitnessarmbänder, Actionkameras, Quadcopter und sogar Elektrofahrzeuge. Jeden Tag bringen Wissenschaftler auf der ganzen Welt eine neue Energiewende näher, die uns leistungsstärkere und kompaktere Batterien und mit ihnen eine unglaubliche Elektronik bietet, von der wir nur träumen können.