
Die Erfolge der modernen klinischen Onkologie sind unbestreitbar. Immer komplexere Operationen, neue Medikamente, wirksame Methoden zur Schmerzlinderung und Beseitigung schmerzhafter Symptome. Wir haben in unserem Blog genug darüber
gesprochen , wie es heute möglich ist, Patienten das Leben auch in den letzten Stadien der Krankheit zu verlängern und zu erleichtern.
Dennoch erfahren täglich Tausende von Krebspatienten auf der ganzen Welt, dass ein Tumor, der gestern einer bestimmten Behandlung nachgegeben hat, heute wieder wächst oder metastasiert. Ärzte stehen regelmäßig still: Alle verschriebenen Medikamente und Behandlungsmethoden wurden ausprobiert, und für diesen Patienten sind keine wirksamen Medikamente mehr vorhanden.
Es kann jedoch auch ein Ausweg aus dieser Sackgasse gefunden werden. Mit der Entwicklung der Genetik und Molekularbiologie haben Onkologen einen neuen Weg gefunden, den Tumor zu untersuchen, um Schwachstellen darin zu finden.
Verwenden Sie dazu molekulargenetische Tests, um die Eigenschaften der DNA von Krebszellen zu bestimmen. Die Methode ist technisch kompliziert, teuer und erfordert spezifisches Wissen eines Arztes.
Die Studie dauert 3 Wochen und kostet zwischen 250 und 670 tr Als Ergebnis erhält der Arzt einen Bericht mit 30 Seiten komplexer Informationen, die er weiterhin verwenden sollte. Für Patienten, die bereits aufgehört haben zu hoffen, bedeutet dies zusätzliche Lebenszeit.
Bei
Medicine 24/7 greifen
wir regelmäßig auf molekulargenetische Forschung zurück, um eine Person zu behandeln, wenn "jeder es versucht hat - nichts anderes zu tun". Und die Patienten, denen nichts mehr zu helfen schien, leben weiter. Einige sind zwei Monate statt zwei Wochen, andere Jahre statt ein paar Monate.
Heute wollen wir darüber sprechen, wie molekulargenetische Tests durchgeführt werden, in welchen Fällen sie dem Patienten helfen können und welches Wissen der Arzt vermittelt.
Wir sind alle Mutanten, das ist die Norm. Einige Mutationen führen jedoch zu Krebs"Anständige" Zellen leben, ohne andere zu stören. Sie verbrauchen eine streng zugewiesene Menge an Ressourcen, erfüllen ihre biologischen Funktionen angemessen und sterben zu gegebener Zeit, um den nächsten Generationen Platz zu machen (dieser Prozess wird Apoptose genannt). Alle 7-10 Jahre wird der menschliche Körper vollständig aktualisiert.
Zu diesem Zweck teilen sich alle somatischen Zellen (die den Körper bilden) mit Ausnahme der roten Blutkörperchen kontinuierlich.
Vor der Teilung wird die Zelle mit einer „Kopie“ erblicher genetischer Informationen gefüllt, die sich in ihrem Kern befindet. DNA-Stränge, die innerhalb des Kerns zu Chromosomen "gefaltet" sind, werden repliziert, d.h. verdoppeln. Danach teilt sich die Zelle und verteilt leise einen identischen Chromosomensatz auf jede der Tochterzellen. Aus einer Zelle sind zwei absolut gleich, und zusammen mit ihrem genetischen Gepäck erhält jeder von ihnen „Wissen“ darüber, wie er leben muss, welche Funktion er erfüllen muss und wie oft er im Leben geteilt werden muss.
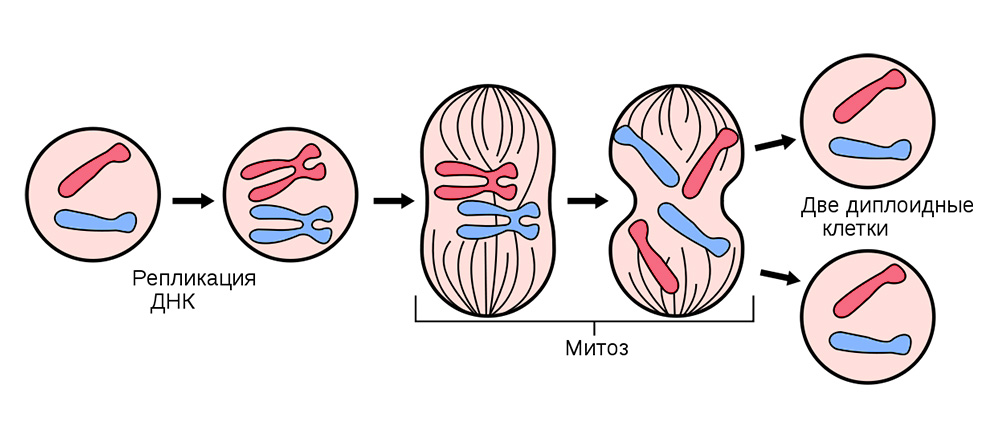 Die somatische Zellteilung erfolgt in allen Organen und Geweben.
Die somatische Zellteilung erfolgt in allen Organen und Geweben.Manchmal während des Teilungsprozesses Fehler - Mutationen. Entweder bricht der DNA-Strang, er wird mit einem Fehler kopiert oder die Chromosomenabschnitte werden gemischt. Hunderte von Faktoren können dies beeinflussen: von Stress und Tabakrauch bis hin zur Strahlenexposition.
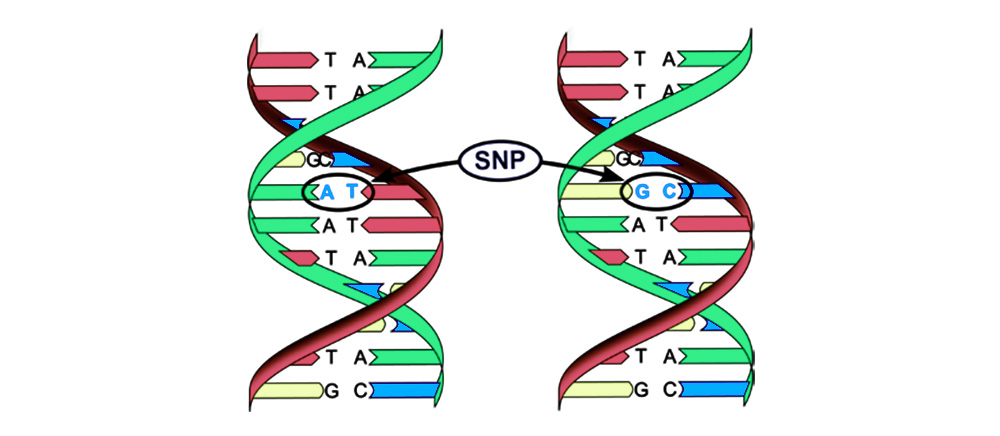
Mutationen können in 4 Typen unterteilt werden.1. Ersatz eines Basenpaars (Single-Nucleotide Polymorphism, SNP): Ein Nucleotid - der "Buchstabe" des genetischen Codes - wechselt zu einem anderen. Die Struktur des von dieser Nukleotidsequenz codierten Proteins ist ebenfalls gestört.
 2. Chromosomenaberrationen.Deletion
2. Chromosomenaberrationen.Deletion - Verlust einer Chromosomenstelle. Sie treten aufgrund der Beendigung des terminalen Teils oder des DNA-Bruchs an zwei Stellen gleichzeitig auf. Das war's - dieses Gen wird nicht mehr auf dem Chromosom exprimiert.
Abgerissene "DNA-Stücke" können in das benachbarte Chromosom eingefügt werden - eine
Insertion (oder Inversion, wenn die Insertion in umgekehrter Reihenfolge erfolgt) führt dazu. Manchmal findet zwischen den Chromosomen ein "gegenseitiger Austausch" von DNA-Schnitten statt -
Translokation . Das Ergebnis ist eins: "zusätzliche" Gene werden
exprimiert .
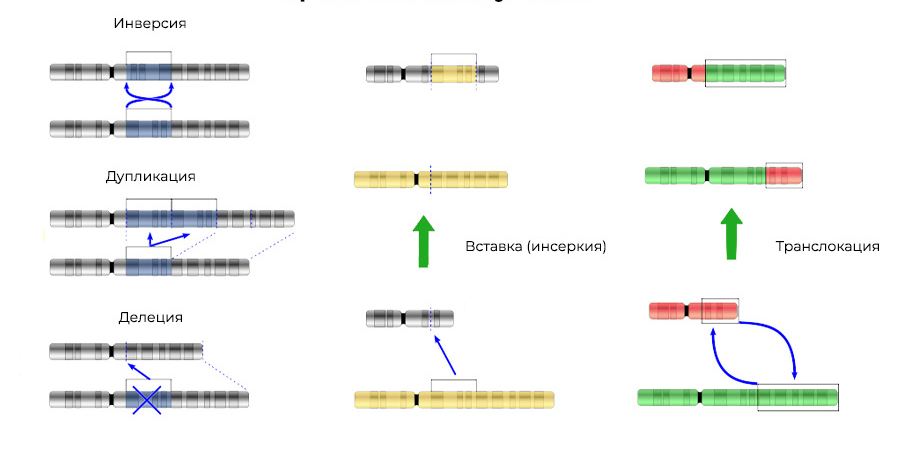 Mutationen verändern nicht nur die Struktur einer DNA-Stelle, sondern auch die Reihenfolge dieser Stellen3. Genfusion
Mutationen verändern nicht nur die Struktur einer DNA-Stelle, sondern auch die Reihenfolge dieser Stellen3. Genfusion - Ein Gen wird aus Teilen anderer Gene "zusammengesetzt" und als Ganzes exprimiert (ausgelöst). Das Protein bei der Expression eines solchen chimären Gens erweist sich ebenfalls als ungewöhnlich, hybride mit schädlichen Eigenschaften.
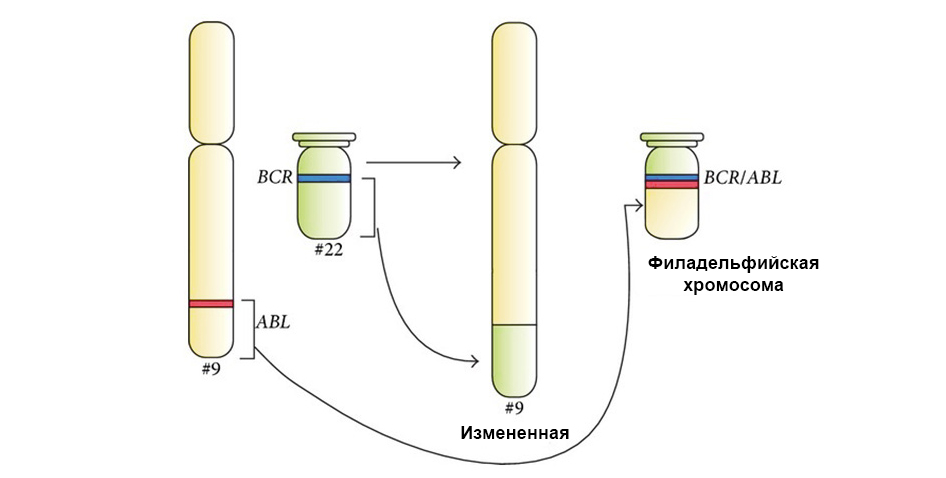 Zwei Gene "klebten" während der Translokation zusammen und bildeten ein chimäres Gen (verursacht Leukämie)
Zwei Gene "klebten" während der Translokation zusammen und bildeten ein chimäres Gen (verursacht Leukämie)Wir haben Glück, dass die DNA voll von nicht zu bedeutenden Abschnitten ist, die nichts codieren. In diesen Bereichen treten viele Mutationen auf - die sich als unbedeutend herausstellen und keinen Einfluss auf die weitere Arbeit der Zellen haben. Und eine solche Zelle, die sich geringfügig vom „Standard“ unterscheidet, lebt und teilt normal weiter.
Über 70 Jahre lang treten im menschlichen Körper 100 Billionen Zellteilungen auf. Dies sind 1,4 Billionen Divisionen pro Jahr - es gibt genug Fälle, um im Laufe der Zeit eine „kritische Masse“ an DNA-Fehlern zu akkumulieren, oder damit ein weiterer Fehler in den DNA-Bereich gelangt, der etwas Wichtiges codiert. Dies führt zu einer nicht harmlosen Mutation, aufgrund derer die Zelle bösartig (bösartig) wird.
Eine maligne Zelle unterscheidet sich von einer normalen Zellzyklusstörung.Der Zellzyklus (Zellleben von Teilung zu Teilung / Tod) wird streng durch die
Arbeit spezieller Proteine reguliert
: Kinasen, Cycline, Wachstumsfaktoren und Transkriptionsfaktoren - es gibt Dutzende von ihnen in jeder lebenden Zelle und jede hat ihre eigene spezielle, aber wichtige Funktion.
Sie übertragen Signale zwischen den Zellen eines mehrzelligen Organismus, aktivieren sich gegenseitig, starten den Teilungsprozess und kontrollieren dessen Richtigkeit, behalten die korrekte Aktivierung von Genen bei, führen ihre Funktionen durch die Zelle aus, "überprüfen" die Genomintegrität, "befehlen" der Zelle, die Apoptose zu starten, wenn es Zeit ist zu sterben, und t .p.
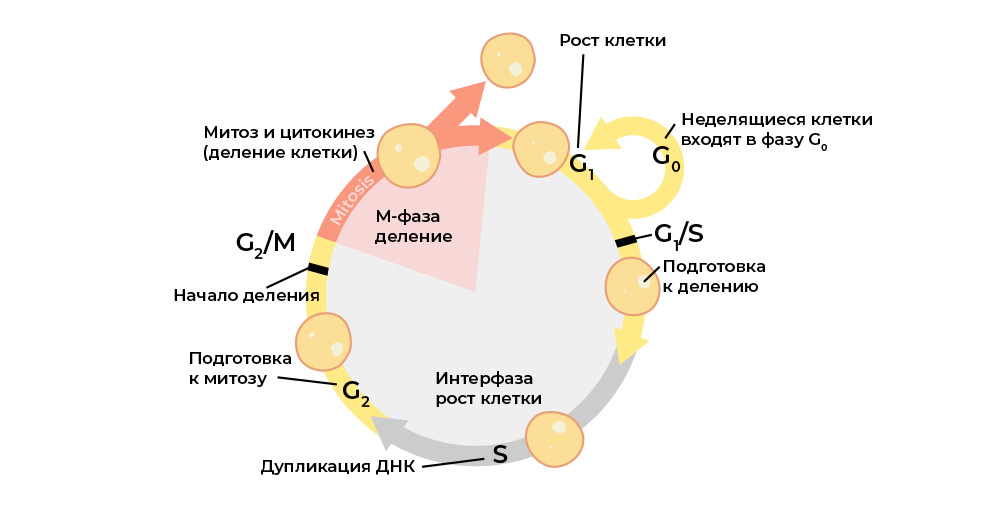 Jede Stufe des Zellzyklus wird durch regulatorische Proteine gesteuert.
Jede Stufe des Zellzyklus wird durch regulatorische Proteine gesteuert.Und jedes dieser Proteine ist in einem
bestimmten Teil der DNA - dem Gen - kodiert. Wenn ein solches Gen eine schädliche Mutation erfährt, "reproduziert" es das entsprechende regulatorische Protein falsch. Und der „falsche“ Proteinregulator stört den Zellzyklus und damit das Verhalten der gesamten Zelle.
Zum Beispiel "bricht" das Gen für den Proteinregulator der Proliferation (Zellmassenwachstum) zusammen - und die "Mutanten" beginnen sich mehr zu teilen als sie sollten, gesunde Zellen "zerquetschen".
Solche signifikanten Gene, deren Veränderungen zur Karzinogenese (dem Auftreten von Krebs) führen können, sind zwei große Gruppen.Protoonkogene sind „normale“ Gene, die aufgrund der Verbesserung oder Änderung ihrer Funktionen zu
Onkogenen werden können. Gene, deren Expression zu einer Malignität der Zelle und zur Entwicklung von Neoplasmen führen kann, werden als
Onkogene bezeichnet . Wenn im Protoonkogen eine schädliche Mutation auftritt, wird es zu einem
Onkogen und kann einen Tumor verursachen.
Von denen, die am besten
studiert sind und weithin gehört werden:
- EGFR, ALK, BRAF - nichtkleinzelliger Lungenkrebs;
- BRAF - Melanom;
- HER2 - Brustkrebs (Brustkrebs);
- KRAS - Darmkrebs.
Darüber hinaus finden sich Mutationen dieser Gene in verschiedenen Arten von Tumoren. Beispielsweise findet sich eine erhöhte Expression von HER2 nicht nur bei Brustkrebs, sondern auch bei Lungen- und Magenkrebs.
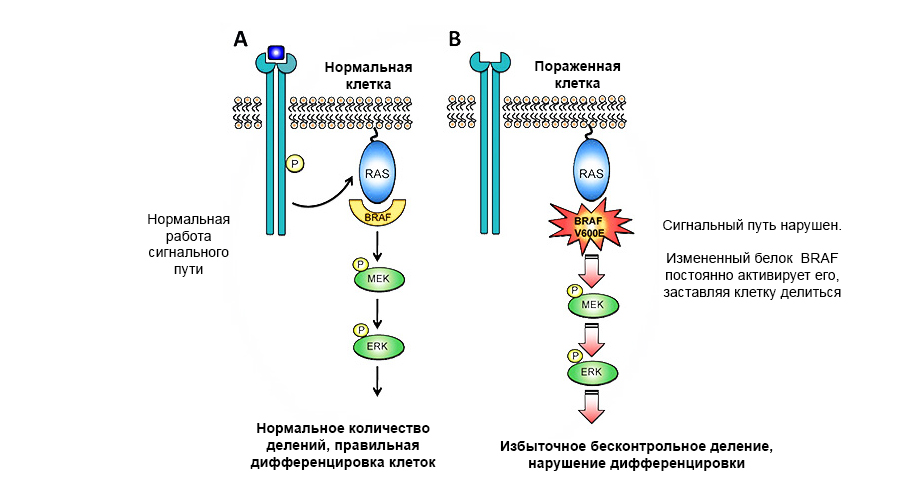 Eine Mutation im Protoonkogen des BRAF-Proteins führt zu einem unkontrollierten Tumorwachstum.
Eine Mutation im Protoonkogen des BRAF-Proteins führt zu einem unkontrollierten Tumorwachstum.Tumorsuppressorgene (Anti-Onkogene) - können im Gegenteil
das Wachstum von Tumorzellen
unterdrücken oder an der Reparatur (Reparatur) beschädigter DNA teilnehmen. Die Inaktivierung von Suppressorgenen infolge von Mutationen erhöht jedoch die Wahrscheinlichkeit eines bösartigen Tumors dramatisch.
Zum Beispiel:
- Mutationen BRCA1, BRCA2 - Krebs der Brustdrüsen, Eierstöcke;
- Mutationen p53 - bis zu 50% verschiedener Arten von Krebstumoren, einschließlich Sarkome;
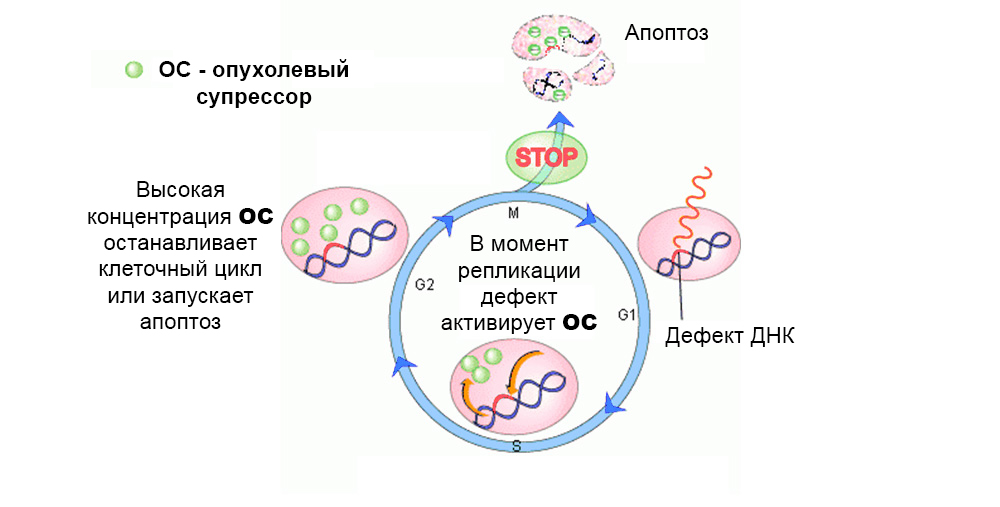 Normalerweise wirken Schutzmechanismen gegen die Entwicklung mutierter Zellen. Ein Defekt im Tumorsuppressorgen „schaltet“ sie aus
Normalerweise wirken Schutzmechanismen gegen die Entwicklung mutierter Zellen. Ein Defekt im Tumorsuppressorgen „schaltet“ sie ausInsgesamt wurde die Wirkung von mehreren zehn Protoonkogenen und Tumorsuppressoren auf die Karzinogenese untersucht.
Warum gibt es so viele Schwierigkeiten und wie verlängern sie das Leben der Patienten?Jede Mutation, die in einem Protoonkogen- oder Suppressorgen gefunden wird, ist eine Ursache für „Superkräfte“ von Krebszellen, wie die Vernachlässigung der Apoptose und die Fähigkeit, sich vor der Immunität zu verstecken. Gleichzeitig ist dies die potenzielle Schwachstelle.
Wenn man weiß, was der Grund für die Besonderheiten des Mechanismus der Tumoroperation ist, kann man eine Substanz finden, die diesen Mechanismus „verkeilt“ und die pathologischen Reaktionen in der Zelle unterbricht. Das heißt, spezifische Mutationen im Tumor - geben das Ziel an, auf das die Ärzte mit dem Arzneimittel „geschlagen“ haben. Dieses Prinzip hat die Entwicklung einer
gezielten Therapie ermöglicht .
Gezielte Therapie - der Name eines ganzen Zweigs einer wirksamen medikamentösen Therapie gegen Krebs - wurde aus dem englischen Wort target geboren. Gezielte Medikamente wirken "gezielt" auf Krebszellen - weil nur sie Mutationen in den entsprechenden Genen aufweisen. Gesunde Zellen haben solche Mutationen nicht - und die Medikamente wirken nicht auf sie.
Die folgende Abbildung zeigt den Wirkungsmechanismus des Zielarzneimittels Imatinib auf Tumorzellen mit der Philadelphia-Chromosomenmutation: das BCR-ABL-Fusionsgen. Diese Mutation führt dazu, dass der Mechanismus der Apoptose in der Zelle nicht mehr funktioniert - Fehler im Genom häufen sich, die Zelle degeneriert zu einer krebsartigen.
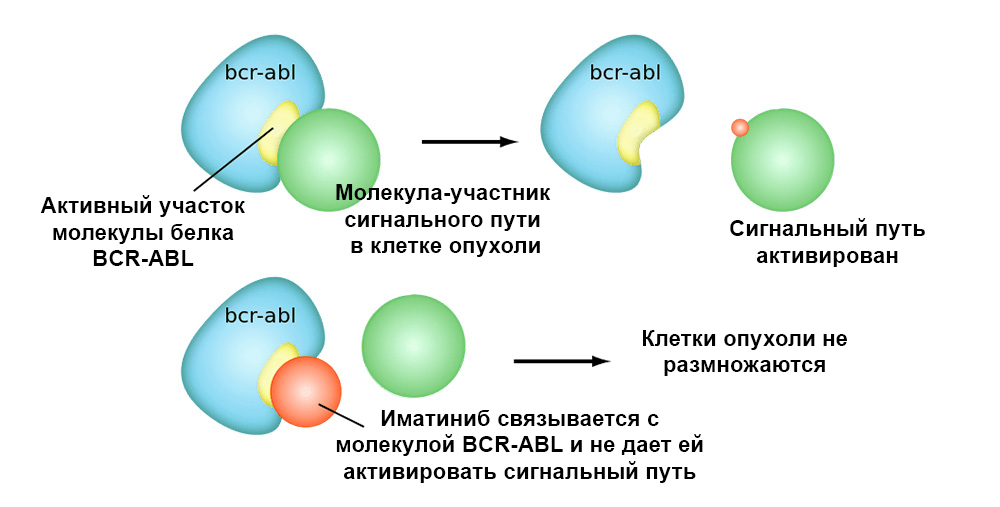 Imatinib bindet an das aktive Zentrum des BCR-ABL-Proteinmoleküls und blockiert dessen Fähigkeit, mit anderen Molekülen in den Signalwegen zu interagieren.Gezielte Medikamente haben also zwei wichtige Vorteile gegenüber der klassischen Chemotherapie.Höhere Effizienz.
Imatinib bindet an das aktive Zentrum des BCR-ABL-Proteinmoleküls und blockiert dessen Fähigkeit, mit anderen Molekülen in den Signalwegen zu interagieren.Gezielte Medikamente haben also zwei wichtige Vorteile gegenüber der klassischen Chemotherapie.Höhere Effizienz. Die gezielte Wirkung auf Tumorzellen ermöglicht eine bessere „Reaktion“ des Tumors auf die Behandlung. Beispielsweise
erhöhte die Zugabe des zielgerichteten Arzneimittels Trastuzumab zusammen mit einer Chemotherapie gegen Brustkrebs mit HER2-Überexpression im Vergleich zur klassischen Behandlung
die Häufigkeit von „Reaktionen“
signifikant - 81% gegenüber 73% und die Häufigkeit der vollständigen morphologischen Remission (Verschwinden des Tumors) - 43% gegenüber 23%
Weniger Nebenwirkungen. Klassische Chemotherapie mit zytotoxischer Wirkung. Im Wesentlichen toxische Substanzen, um das Wachstum von Krebszellen abzutöten oder zumindest zu verlangsamen. Vor allem wirken sie auf Zellen, die sich schnell teilen. Deshalb fallen zum Beispiel Haare aus: Es ist auch eine Art sich aktiv teilender Zellen, und sie „fallen unter die Verteilung“. Aufgrund dieser nicht sehr gezielten Wirkung verursachen Chemotherapeutika schwerwiegende Nebenwirkungen: Auch der Magen-Darm-Trakt und andere Organe leiden darunter.
In der
medizinischen Praxis verschreiben wir im Rahmen einer umfassenden Behandlung am häufigsten gezielte Medikamente: Wir kombinieren Chemotherapie, Zieltherapie und Immuntherapie.
Die Schwierigkeit besteht darin, dass jeder Tumor in seiner Reihe von "Ziel" -Mutationen einzigartig istSo wie jede Person einen eindeutigen DNA-Code hat, sind Tumore einzigartig. Schließlich werden sie aus körpereigenen Zellen „geboren“. Es gibt keine Tumoren mit den gleichen genetischen molekularen Eigenschaften. Daher ist es grundsätzlich unmöglich, eine universelle „Pille“ für Krebs zu schaffen. Krebs ist eine zu individuelle Krankheit.
Die Behandlung für ihn sollte jedoch angemessen sein - individuell für einen bestimmten Patienten ausgewählt -, basierend auf der Tatsache, dass wir Mutationen in seinen Tumorzellen bestimmen.
In der jüngeren Vergangenheit konnten bösartige Tumoren nur histologisch klassifiziert werden, dh je nachdem, aus welchem Organ sie stammten und wie die Krebszellen unter dem Mikroskop aussahen.
Dies reicht nicht aus, um eine gezielte Therapie effektiv einzusetzen. Der Arzt sollte wissen, welche Mutationen in den Tumorzellen eines bestimmten Patienten vorhanden sind, ob es Biomarker-Ziele für dieses oder jenes Medikament gibt. Personalisierte Medizin wie sie ist.
Dafür verwenden wir molekulargenetische Studien. Um die "Ziele" zu finden, auf die Sie mit gezielten und immunotrerapevticheski-Medikamenten treffen müssen, müssen Sie bestimmen, aus welchen Genen die DNA des Tumors gesammelt wird und welche Gene darin "gebrochen" sind. Ergebend:
- wir lernen die Empfindlichkeit des Tumors gegenüber Drogen;
- Finden Sie heraus, ob der Tumor gegen bestimmte Medikamente resistent ist.
- Entdecken Sie die genetischen Eigenschaften, die eine Überempfindlichkeit gegen Medikamente hervorrufen.
- Wir werden eine neue Behandlung wählen, wenn der Tumor nicht mehr auf die Standardtherapie anspricht.
einen Tumor / eine Metastasierung sehr früh erkennen - durch Fragmente seiner DNA im Blut; - Wir können einen günstigen oder aggressiven Krankheitsverlauf vorhersagen.
Die Probe ist meistens das Tumorgewebe, entweder während der Operation zur Entfernung der primären Läsion oder eine Biopsie - ein mikroskopisches Stück des Tumors wird mit einer speziellen dünnen langen Nadel entnommen.
Sie können nach der DNA von Tumorzellen im Blut suchen - dann benötigen Sie eine sogenannte Flüssigkeitsbiopsie, zwei Reagenzgläser mit jeweils 8,5 ml Blut.
Während einer Biopsie stoßen wir häufig auf die Tatsache, dass viele Patienten Angst haben, den Tumor insgesamt zu berühren - sie haben Angst, dass dies ihn zum Wachsen bringt. Bisher sind keine Studien verfügbar, die einen solchen Zusammenhang belegen würden. Natürlich muss eine Biopsie korrekt durchgeführt werden. Wenn wir eine Biopsie durchführen, markieren Ärzte am häufigsten die Eintrittsstelle der Nadel: Entweder machen sie ein kleines Tattoo (es gibt ein solches Instrument ) oder sie setzen eine Klammer (chirurgisch). Wenn später eine Operation erforderlich ist, wird der gesamte Verlauf der Nadel - von der Haut bis zum Tumor - entfernt, sodass die Wahrscheinlichkeit, dass sich Krebszellen über den Tumor hinaus ausbreiten, noch geringer ist.Als nächstes werden die Proben an das Labor für molekulargenetische Studien geschickt.Dort wird Tumor-DNA aus der Probe isoliert und sequenziert. Das heißt - sie "lesen" die Folge von "Buchstaben" -Nukleotiden. Und dann vergleichen sie es mit einem Diagnose-Panel, das aus der Datenbank der Bibliotheken ausgewählt wurde - bereits entschlüsselte Genome von Tausenden anderer Menschen. Das Panel wird für jeden Patienten ausgewählt - unter Berücksichtigung der Anamnese und der klinischen Daten. All dies wird natürlich von automatischen Sequenzern und einem Computer erledigt.
Und wenn das „Lesen“ des Genoms vor 20 Jahren Monate dauerte, erforderte es eine langsame und komplexe Entschlüsselung. Heute wird in dem Labor, mit dem wir arbeiten, eine Analyse in wenigen Arbeitstagen durchgeführt.
Darüber hinaus werden mehrere Methoden gleichzeitig angewendet:
Sequenzierung einer neuen Generation (NGS), Sanger-Sequenzierung und Methode der Fluoreszenzhybridisierung (FISH) . Zusammen ermöglichen sie es Ihnen, die gesamte DNA-Sequenz eines Tumors zu lesen, Treibermutationen herauszufinden - dh diejenigen, die den malignen Prozess ausgelöst haben und nun durch gezielte Therapie gezielt werden können - und sogar den gesamten Karyotyp (Chromosomensatz) zu visualisieren.
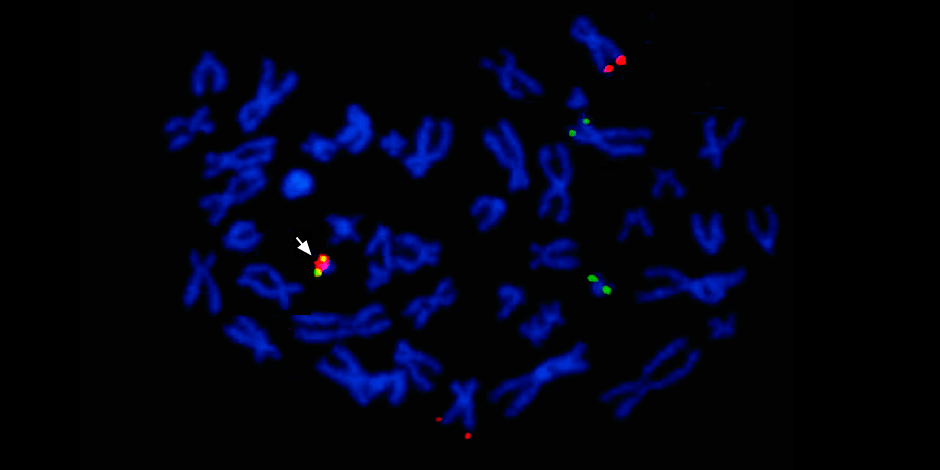 Unter dem Pfeil links - die Fusion des roten und des grünen Signals - Hinweise auf die Fusion des genetischen Materials der Chromosomen 9 und 22 mit der Bildung des chimären Philadelphia-Chromosoms.
Unter dem Pfeil links - die Fusion des roten und des grünen Signals - Hinweise auf die Fusion des genetischen Materials der Chromosomen 9 und 22 mit der Bildung des chimären Philadelphia-Chromosoms.Darüber hinaus muss eine vollständige molekulargenetische Studie notwendigerweise die
Mikrosatelliteninstabilität (MSI, Mikrosatelliteninstabilität) bestimmen - eine Verletzung des DNA-Reparaturmechanismus, die zur raschen Akkumulation von Mutationen in Zellen führt. Mit diesem Faktor können Sie eine Prognose über den weiteren Krankheitsverlauf erstellen.
Nachdem das molekulargenetische Profil des Tumors ermittelt wurde, beginnt seine AnalyseSpezielle Programme verarbeiten die Ergebnisse und geben automatisch Empfehlungen ab. Diese Empfehlungen werden jedoch zwangsläufig manuell von einem Expertenteam überwacht. Die Analyse umfasst Genetik, Bioinformatik, Onkologen, Immunologen und Chemotherapeuten. In diesem Stadium treten notwendigerweise Verfeinerungen und Ergänzungen auf.
Je nach Anforderung kann eine solche Studie
5 bis 15 Arbeitstage dauern : Ein Patient muss lediglich die Art des Tumors bestimmen und die empfohlene Therapie klären - überprüfen Sie einfach das Vorhandensein eines Basissatzes von 20 DNA-Mutationen gemäß den Empfehlungen der Weltkrebsverbände. Und eine andere, mit einer seltenen Diagnose oder Resistenz gegen Standardbehandlung - Sie müssen einen "molekularen Pass" des Tumors erstellen und dafür 400 Gene sequenzieren.
Infolgedessen werden im ersten Teil des Berichts alle gefundenen Mutationen im Tumor des Patienten und gezielte Medikamente, die in diesem Fall am wirksamsten sind,
registriert .
Eine gezielte Therapie ist für diese Art von Tumor mit erkannten Mutationen zugelassen, und eine gezielte Therapie ist für die Behandlung anderer Krebsarten mit denselben Mutationen zugelassen. In der Praxis gab es Fälle, in denen Off-Label-Medikamente zweiter Ordnung verschrieben wurden und gut wirkten.
Darüber hinaus leistet das Laborpersonal hervorragende Arbeit bei der Überwachung der wissenschaftlichen Forschung, was bei diesem Patienten von Bedeutung sein kann.
Der zweite Teil des Berichts enthält eine Übersicht über die zu diesem Zeitpunkt vorliegenden Studien mit detaillierten Daten zur Häufigkeit des Auftretens dieser Mutation, zur Wirkung verschiedener Arzneimittel und zur Möglichkeit, die eine oder andere Art der gezielten Therapie für identifizierte Mutationen anzuwenden. Dies hilft, zumindest eine grobe Prognose für den Patienten zu erstellen.
Der dritte Teil des Berichts enthält relevante klinische Studien, an denen der Patient teilnehmen kann, um eine experimentelle Behandlung zu erhalten. Dies ist die neueste Notfallmethode, aber alle Details darüber zu kennen, ist nützlich, um den Patienten zu beruhigen.
Aus diesem Bericht erhält der Arzt das vollständigste molekulargenetische Profil des bösartigen Tumors. Er hat Informationen darüber, was genau wir behandeln, welchen spezifischen Zusammenbruch in einer Zelle. Es gibt ein „frischestes“ Verständnis darüber, welche Arzneimittel derzeit für die Verwendung in klinischen Studien zugelassen oder verfügbar sind.
 Der Bericht ist ziemlich gewichtig - 30 Seiten atemberaubende Lektüre
Der Bericht ist ziemlich gewichtig - 30 Seiten atemberaubende LektüreWer braucht das?
Diejenigen, die eine Tumorresistenz oder Unverträglichkeit gegenüber allen Arzneimitteln aus dem Standardbehandlungsprotokoll entwickelt haben.
Die Situation, als "jeder es versuchte - es hat nicht geholfen.", , (NCCN), « 24/7», – « » .
, 1- – , . . – – – 2- – , . – 3- , .. «» .
, , : , «» , . – . , , . – , , .
– «», . , off-label, . , ?
- , , . – .
. , . , , 80% , 20% – . , - , 80% , 20% .
- , , . , , . , : , , , . , , 10 – 10 .
30% – . , – : 600 . , , HER2/Neu.
. - – , – . , . 600 . ., 5 – , , , . .
- . . «» . , , , , ..
, . (, , ) – , .
, , «». – .
, , .
, 48 , ( ). , . , , . .
- . , 600 . , , 250, – , .
, . EGRF – .
4 . 5 , . , , 4 , .
,
« 24/7» , – .
.