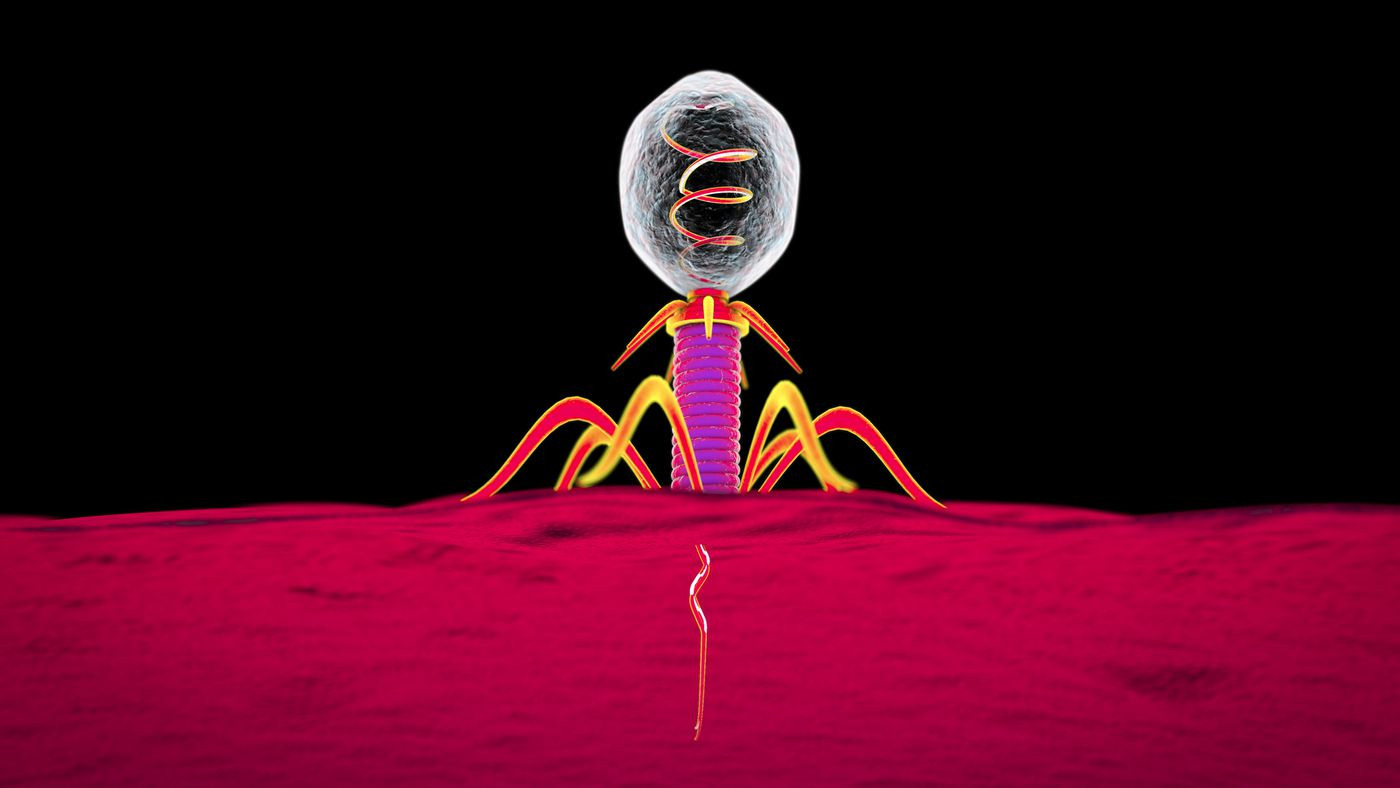
(
c ) Phagentherapie
91 Jahre sind seit der Entdeckung von Penicillin vergangen, dem ersten Medikament, das die Wirksamkeit der Behandlung von bakteriellen Krankheiten revolutioniert.
Seit fast einem Jahrhundert der Existenz von Antibiotika sind viele Krankheiten fast vergessen. Seit 1947 wird angenommen, dass Yersinia pestis, das Pestbakterium, das den Tod von 150 Millionen Menschen verursacht hat, besiegt wurde. Das Hauptmittel der ersten Behandlungsstufe waren Antibiotika.
Aufgrund der erhöhten Wahrscheinlichkeit der Rückkehr der Vergessenen und des Auftretens neuer Infektionskrankheiten hat die Weltgesundheitsorganisation in den letzten zehn Jahren Alarm geschlagen. Die Ursachen der Katastrophe waren Nachlässigkeit, Dummheit und Entwicklung. Bald kann sogar ein normaler Schnitt am Finger zum Tod führen. Aber es kommen neue Kampfmethoden.
Erste Probleme
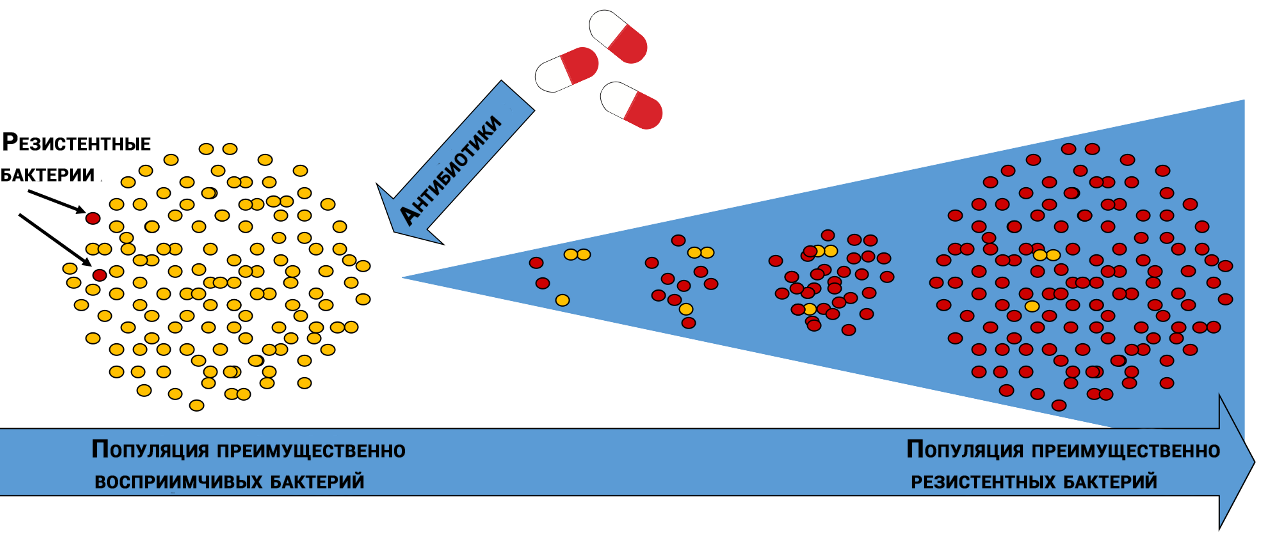 Natürliche Selektion antibiotikaresistenter Bakterien
Natürliche Selektion antibiotikaresistenter BakterienIn verschiedenen Bakterienpopulationen weisen von Antibiotika betroffene Moleküle unterschiedliche „Empfindlichkeiten“ auf. Darüber hinaus können sich Bakterien derselben Art wie Schneeflocken voneinander unterscheiden - durch Vielfalt findet das Leben immer seinen Weg.
Zufällig sind einige Bakterien weniger anfällig für die Wirkung des Antibiotikums, und einige der Bakterien, die nach dem Völkermord überlebt haben, geben Nachkommen, die wachsen und sterben, aber Zeit haben, ihre Nachkommen zu verlassen, was in einer Reihe von Generationen eine „ideale“ Population schafft.
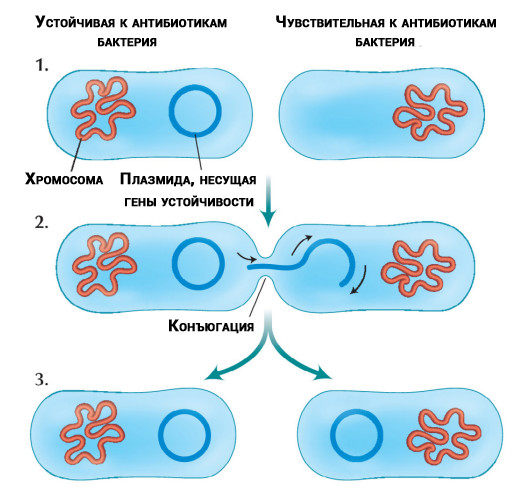 Transfer von Antibiotika-resistenten DNA-Molekülen (Plasmiden), die aus Chromosomen isoliert wurden, zwischen Bakterien
Transfer von Antibiotika-resistenten DNA-Molekülen (Plasmiden), die aus Chromosomen isoliert wurden, zwischen BakterienDas Problem kommt nicht alleine. Forscher
haben herausgefunden, dass einige Bakterien Resistenzgene auf andere Bakterien derselben oder einer anderen Art übertragen können. Die Übertragung erfolgt unabhängig davon, ob Antibiotika in der Behandlung vorhanden sind oder nicht.
Seit der Entdeckung von Penicillin hat der übermäßige Einsatz von Antibiotika die Entwicklung von Bakterienresistenzen - Immunität gegen antimikrobielle Mittel - erheblich beeinflusst, was zur Entstehung unheilbarer Superinfektionen führte.
Überquere den Rubikon
Um die Ausbreitung von Antibiotikaresistenzen zu verringern, wird
derzeit das
AWaRe- Tool (Access, Watch and Reserve) verwendet, das von WHO-Experten in Form einer
Liste der wichtigsten wirksamen Arzneimittel entwickelt wurde.
In dieser Liste sind Antibiotika in drei Gruppen unterteilt: Zugang (Verfügbarkeit, Medikamente erster Wahl), Beobachtung (Wachsamkeit) und Reserve (Reserve). Es wird festgelegt, welche Antibiotika nur für bestimmte Bakterien verwendet werden sollen, die die häufigsten Krankheiten verursachen, die das Resistenzrisiko erheblich erhöhen und die in extremen Fällen bei Infektionen mit multipler Resistenz angewendet werden sollten.
In der Praxis arbeitet der Algorithmus wie folgt. Die Entladung aus dem Körper des Patienten (Eiter, Wunde, Abkratzen des Bronchus usw.) wird in einer sterilen Durchstechflasche gesammelt und an ein bakteriologisches Labor geschickt, wo festgestellt wird, welches Bakterium im Material enthalten ist, welche Antibiotika dafür empfindlich sind und welche resistent sind .
Wenn das Bakterium nicht empfindlich gegen Antibiotika der ersten Wahl ist, wenden sich Ärzte weniger verwendeten Medikamenten zu. Einige von ihnen sollten immer auf Lager sein und nicht dort verwendet werden, wo andere Arzneimittel damit umgehen können. Dementsprechend sind Mikroorganismen mit ihnen weniger vertraut und immer noch empfindlich.
Ironischerweise gibt es unter den Antibiotika der Reserve Medikamente, die von den Bakterien selbst stammen. Beispielsweise stammt das 1949 hergestellte Colistin aus dem Bakterium Paenibacillus polymyxa. Dieses Antibiotikum wurde, wie andere aus der Gruppe der letzten Reserve,, wie man glaubte, selten verwendet. Im Jahr 2015 wurden jedoch Colistin-resistente Bakterien gefunden.
Mehr als 100 Länder haben nationale Pläne zur Bekämpfung der Antibiotikaresistenz entwickelt, aber 75% von ihnen verfügen weder über die Mittel noch über die Motivation, den Plan für den ordnungsgemäßen Einsatz von Antibiotika zu finanzieren.
Insbesondere verwendete China trotz internationaler Empfehlungen 12.000 Tonnen Colistin (Reservepräparat) pro Jahr zur Mast von Schweinen und zur Vorbeugung von Krankheiten bei anderen Tieren.
In Ermangelung eines klaren Verständnisses, warum eine vollständige Kontrolle der Ausbreitung der Resistenz gegen antimikrobielle Mittel erforderlich ist, hilft die Mathematik Forschern auf der ganzen Welt, mit denen Sie verschiedene Situationen simulieren und das Risiko der Entwicklung von Resistenzen, einschließlich tödlicher, berechnen können. Wissenschaft mit herzloser Genauigkeit zeigt, was die Welt bedroht.
Pharmazeutisches Fiasko
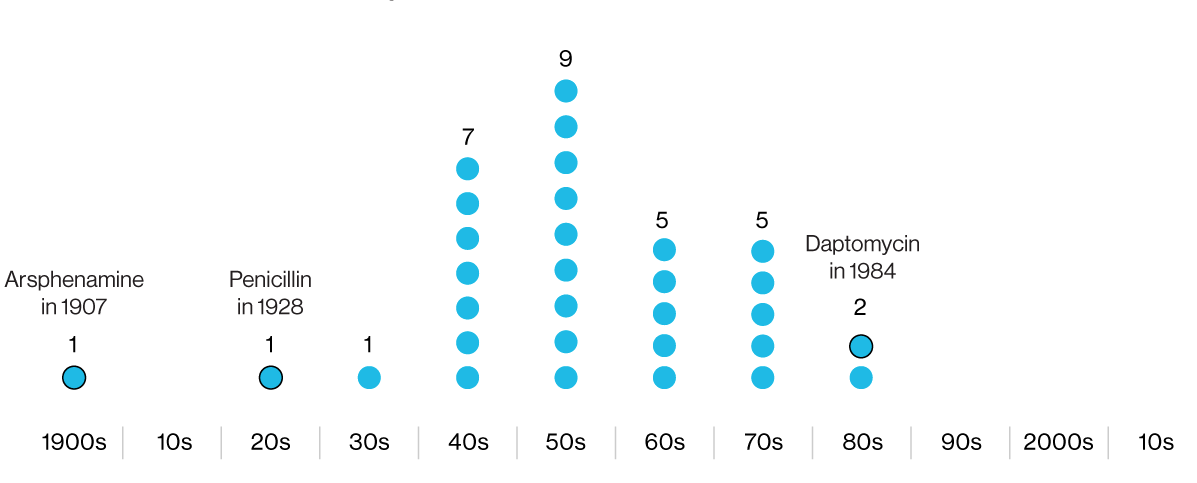 Die Infografiken zeigen die Jahre der Entwicklung von Antibiotika, die anschließend in die klinische Praxis umgesetzt wurden. Das erste ist Arsphenamin, eine gefährliche arsenhaltige antimikrobielle Chemikalie. Letzteres, Daptomycin, hat gegen einige MRSA-Stämme an Wirksamkeit verloren .
Die Infografiken zeigen die Jahre der Entwicklung von Antibiotika, die anschließend in die klinische Praxis umgesetzt wurden. Das erste ist Arsphenamin, eine gefährliche arsenhaltige antimikrobielle Chemikalie. Letzteres, Daptomycin, hat gegen einige MRSA-Stämme an Wirksamkeit verloren .Nach der Penicillin-Revolution auf den Schlachtfeldern des Zweiten Weltkriegs trat die Pharmaindustrie in die goldene Ära der Antibiotika ein. Unternehmen stellten Forscher, Missionare und Reisende aus der ganzen Welt ein, um Bodenproben auf der Suche nach neuen antibakteriellen Verbindungen zu sammeln. Aber das „goldene Zeitalter“ wurde schnell zunichte gemacht, und in den 1980er Jahren kam der „Winter der Antibiotika“, der bis heute andauert.
Die Entwicklung grundlegend neuer Antibiotika ist heute ein seltenes Ereignis. Von den fünfzig Medikamenten in verschiedenen Stadien klinischer Studien sind
weniger als ein Dutzend wirklich innovativ.
Investoren lassen sich von Logik und nicht von Emotionen leiten: Die Kosten für solche Medikamente sind schwer zu erhöhen, da die Öffentlichkeit empört sein kann und Sie sich nicht auf regelmäßige Lieferungen verlassen sollten - aus dem Grund, dass das Medikament in die Reserve aufgenommen werden kann.
Darüber hinaus laufen Pharmaunternehmen nach jahrelanger Suche nach einer neuen Substanz und klinischen Studien zur Wirksamkeit und Sicherheit nur wenige Monate nach dem Markteintritt Gefahr, Resistenzen zu bekommen.
Von allen in den letzten Jahren in doppelblinden, placebokontrollierten randomisierten Studien getesteten Antibiotika wurden nur acht Antibiotika oder Kombinationen davon zugelassen: Delafloxacin, Meropenem + Waborbactam, Ozenoxacin, Plasomycin, Eravacyclin, Imipenem + Cilastatin + Relebactam, Lefamulin.
Lefamulin, das unter der Marke Xenlent vertrieben wird, war das erste Medikament seit 20 Jahren, das mit einem neuen Wirkmechanismus gegen ambulant erworbene bakterielle Lungenentzündung zugelassen wurde. Es ist bezeichnend, dass der Hersteller von dem bedingungslosen medizinischen Triumph nichts bekommen kann.
Das ist schon
passiert . Das Unternehmen Achaogen, das 250 Millionen Dollar ausgegeben hatte, versuchte 15 Jahre lang, ein neues Antibiotikum auf den Markt zu bringen - Plasomycin, woraufhin es plötzlich bankrott ging.
Angesichts der Relevanz des Problems suchen andere Forscher nach neuen pragmatischen Ansätzen bei der Entwicklung von Methoden zur Hemmung des Bakterienwachstums.
Fahrer des Optimismus
 Das Startup hat eine Plattform zur Neuprogrammierung von Bakterien auf einem genetischen Bioprinter entwickelt, der DNA-Fragmente mit einer Länge von bis zu 10.000 Basenpaaren druckt.
Das Startup hat eine Plattform zur Neuprogrammierung von Bakterien auf einem genetischen Bioprinter entwickelt, der DNA-Fragmente mit einer Länge von bis zu 10.000 Basenpaaren druckt.Das in Boston ansässige Biotechnologieunternehmen Ginkgo Bioworks, das von der US-Militärabteilung DARPA und dem Risikokapital Y Combinator unterstützt wird, stellt anstelle wirksamerer Antibiotika Probiotika auf dem Bioprinter her - nützliche Bakterien zur Bekämpfung „konkurrierender“ resistenter Mikroorganismen.
Experten von Locus Biosciences
entwickeln ein ebenso beeindruckendes Produkt unter Verwendung der CRISPR Cas3-Geneditierungsmethode. Die CRISPR-Technologie ist dafür bekannt, das Cas9-Enzym zu verwenden, das als „genetische Schere“ zum Schneiden, Bearbeiten und Ersetzen von DNA-Fragmenten fungiert.
Cas3 übersteigt die Breite von Cas9 - es kann lange DNA-Abschnitte beeinflussen. CRISPR Cas3
wirkt gezielt auf Bakterien und Viren und schneidet nicht nur bestimmte DNA-Sequenzen, sondern löscht sie effektiv - bis zu 100.000 Nukleotidpaare gleichzeitig.
Locus Biosciences plant, diese Technologie zur Bekämpfung gefährlicher Bakterien einzusetzen. Für die Methode spielt die große Größe des Cas3-Enzyms eine Rolle - es wirkt auf Bakterienzellen, ist aber zu groß, um in die menschliche Zelle einzudringen und unsere DNA zu schädigen.
Ich möchte den Artikel, der mit Tod und Enttäuschung gefüllt ist, in einem wichtigen Punkt beenden. Wir sind nicht allein im Kampf gegen Bakterien. Bakteriophagenviren blieben über Milliarden von Jahren eines der wirksamsten Instrumente zur Bekämpfung mikrobieller Populationen, wurden jedoch vor dem Hintergrund des Erfolgs von Antibiotika kaum untersucht.
 Die Phagen sind damit beschäftigt, das zu tun, was sie lieben - sie greifen das Bakterium an .
Die Phagen sind damit beschäftigt, das zu tun, was sie lieben - sie greifen das Bakterium an .Nach dem Zweiten Weltkrieg entwickelte sich eine paradoxe Situation. In den USA und Westeuropa standen Bakteriophagen nur für Biologen im Mittelpunkt der Aufmerksamkeit, und in den Ländern des Ostblocks wurden echte Medikamente aus Bakteriophagen hergestellt. Infolgedessen ist Russland weltweit führend bei der Anzahl
registrierter Bakteriophagenpräparate.
In den Vereinigten Staaten hat eine Renaissance der Bakteriophagen erst in den letzten Jahren stattgefunden. Im Mai 2019 wurden die Ergebnisse der Verwendung einer Mischung aus drei Arten von Bakteriophagen bei einem Patienten mit einer schwer zu behandelnden Infektion veröffentlicht, die von einem der Vertreter der nicht tuberkulösen Mykobakterien Mycobacterium abscessus verursacht wurde. Die Ergebnisse sind
ermutigend - der Patient erholt sich.
Die Forschung an einer Reihe anderer natürlicher und genetisch veränderter Bakteriophagenstämme
hat bereits begonnen, aber Medikamente, die dem Massenkonsumenten zur Verfügung stehen und gegen bestimmte Bakterien wirksam sind, werden erst in wenigen Jahren erscheinen.
Trotz aller Erfolge stehen wir am Anfang eines langen und anstrengenden Kampfes gegen Bakterien - der Hauptkampf steht vor der Tür. Bisher wurden die meisten Phagen
nicht beschrieben oder stehen für eine genetische Manipulation nicht zur Verfügung.
Andere Werkzeuge zur Lösung des antibakteriellen Problems sind ebenfalls alles andere als perfekt. In der Zwischenzeit sind wir, ohne das Tempo der chemischen und pharmazeutischen Forschung zu erhöhen, mit schwierigen Jahrzehnten globaler Bedrohungen konfrontiert.
Im September 2019 legte das Global Preparedness Monitoring Committee (
GPMB) den
World at Risk- Bericht vor, in dem die tatsächliche Wahrscheinlichkeit eines Krankheitserregers erkannt wurde, der bei einer neuen Pandemie
50 bis 80 Millionen Menschen töten könnte.