
Das Problem
Mitochondrien erzeugen in jeder menschlichen Zelle Energie. Mutationen in der mitochondrialen DNA, die im Laufe des Lebens vererbt oder erworben wurden, führen zu metabolischen, neurodegenerativen und kardiovaskulären Manifestationen des Alterns.
Die SENS Research Foundation hat sieben praktische Strategien entwickelt, um die wichtigsten Alterungsfaktoren
zu „reparieren“ . Während einige dieser Strategien von der wissenschaftlichen Gemeinschaft umfassend untersucht werden,
ist die mitochondriale Schadensbegrenzungsstrategie von
MitoSENS eine der neuesten. Unsere Theorie ist, dass unter Verwendung der "allotopischen Expression", dh durch Platzieren funktioneller Kopien kritischer mitochondrialer DNA (mtDNA) -Gene im Zellkern, Defekte, die aus Mutationen in der mtDNA resultieren, beseitigt werden können.
Als vorgeschlagen, war diese einzigartige und ehrgeizige Strategie für viele Laboratorien und Förderorganisationen vielleicht zu "mutig". MitoSENS war somit ein „internes“ SENS-Projekt, das ohne die Unterstützung der Community nicht möglich gewesen wäre. Bisher hat dieser von der Gemeinde finanzierte Ansatz eine große Geschichte, die zu revolutionären Entdeckungen führt.
2013 startete SENS in Zusammenarbeit mit
LongeCity seine erste Crowdfunding-Kampagne speziell für
MitoSENS . Diese kleine Initiative erregte großes Interesse und ebnete den Weg für eine größere Spendenaktion im Jahr 2015 auf
Lifespan.io . Es folgten bahnbrechende Entdeckungen, und zum ersten Mal in menschlichen Zellen
zeigten Wissenschaftler
die grundlegende Arbeit des MitoSENS-Ansatzes .

Um die klinische Anwendung zu approximieren, schuf SRF bald ein "
hochvariables Mausmodell ". Diese Maus hat eine einzigartige Modifikation in ihrem Kerngenom, die die gezielte Insertion neuer Gene an einem bestimmten Ort ermöglicht. Mit dieser Maus sind wir bereit, den nächsten Schritt zu tun und die mitochondriale Gentherapie im Tiermodell fortzusetzen.
Lösung
C57 / BL6MT-FVB-Linienmäuse (nennen wir sie „
kranke Mäuse “) haben einen genetischen Defekt (Mutation im mitochondrialen ATP8-Gen) und weisen mehrere altersbedingte Symptome auf, darunter verminderte Fruchtbarkeit, Arthritis, Typ-II-Diabetes mellitus und neurologische Störungen. Da mitochondriale DNA nur von der Mutter vererbt wird, führt die Kreuzung der weiblichen
kranken Maus mit männlichen Mäusen aus anderen Linien zu derselben mitochondrialen Dysfunktion.
Wir werden das variabelste Mausmodell verwenden, um eine neue transgene Maus zu entwerfen („allotop ATP8 transgene Maus -
MitoMouse “). Diese Maus hat das für die Mitochondrienfunktion wichtige ATP8-Gen, das im Zellkern „versteckt“ ist und daher unabhängig vom Geschlecht auf die Nachkommen übertragen werden kann.
Unsere Hypothese ist, dass sowohl Männer als auch Frauen in den Nachkommen der
Sick Mouse und
MitoMice wiederhergestellte Mitochondrienfunktionen zeigen. Dies würde die Durchführbarkeit der MitoSENS-Strategie bedeuten und zeigen, dass funktionelle Backups mitochondrialer DNA-Gene im Zellkern ihre mutierten Analoga bei lebenden Tieren ersetzen können.
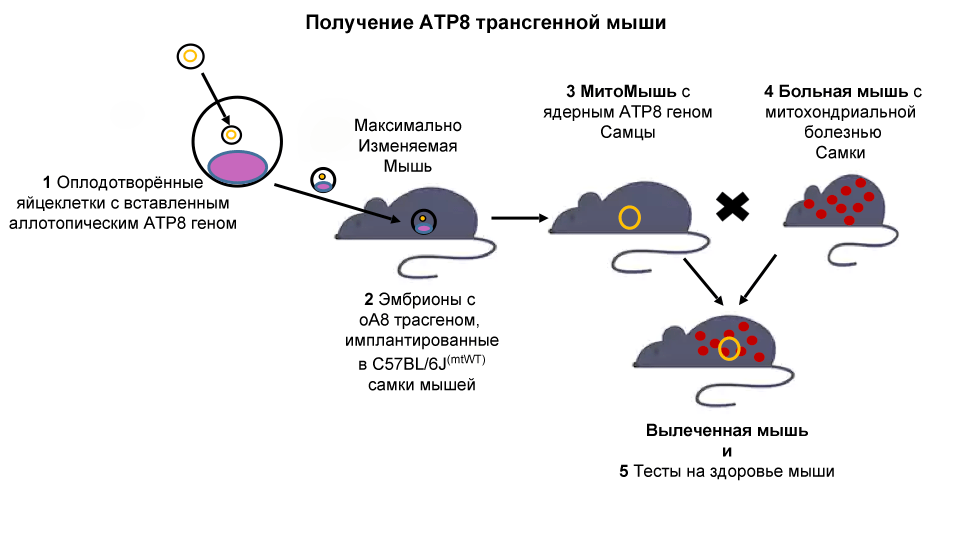
Schließlich werden Mäuse auf phänotypische Verbesserungen wie Verhaltens-, physiologische und biochemische Veränderungen untersucht. Der Erfolg des Projekts wird den Grundstein für eine erfolgreiche Gentherapie beim Menschen legen.