Während sich die Werkzeuge für das Studium der Biologie verbessern, enthüllen die Forscher die Details von Mikroproteinen, die anscheinend für einige zelluläre Prozesse, einschließlich solcher im Zusammenhang mit Krebs, von entscheidender Bedeutung sind. Proteine bestehen aus Ketten verknüpfter Aminosäuren, und das durchschnittliche menschliche Protein enthält etwa 300 Aminosäurereste. Inzwischen enthalten Mikroproteine weniger als 100 Aminosäurereste. Wissenschaftler haben kürzlich gezeigt, dass eines der Mikroproteine, PIGBOS, bestehend aus 54 Aminosäuren, zur Linderung von Zellstress beiträgt.
Arbeiten von Alan Saghatelian et al. wurde in Nature Communications veröffentlicht.
Die Studie begann, als Wissenschaftler PIGBOS in Mitochondrien entdeckten.
Der erste Versuch, PIGBOS-Protein durch grün fluoreszierendes Protein (GFP) nachzuweisen, schlug fehl. Das Mikroprotein war im Vergleich zur Größe von GFP zu klein. Das Wissenschaftlerteam löste dieses Problem, indem es einen weniger verbreiteten Ansatz namens Shared GFP versuchte, bei dem nur ein kleiner Teil des GFP, Beta genannt, mit PIGBOS kombiniert wurde.
Die Forscher konnten PIGBOS sehen und untersuchen, wie es mit anderen Proteinen interagiert. Als sie den Ort von PIGBOS kartierten, stellten sie fest, dass es sich auf der äußeren Mitochondrienmembran befand und bereit war, Kontakt mit Proteinen auf anderen Organellen aufzunehmen. Sie waren überrascht zu sehen, dass PIGBOS mit einem Protein namens CLCC1 interagiert, das Teil einer Organelle ist, die als endoplasmatisches Retikulum (ER) bezeichnet wird.
"PIGBOS dient als Verbindungsstelle zwischen Mitochondrien und Notaufnahme", sagt Qian Chu, ein weiterer Mitautor der Arbeit. "Früher haben wir dies bei Mikroteinen nicht gesehen - und bei gewöhnlichen Proteinen selten."
Die Forscher fanden heraus, dass PIGBOS tatsächlich an CLCC1 bindet, um den Stress in ER zu regulieren. Ohne PIGBOS ER ist es wahrscheinlich, dass Stress auftritt, der zu einer Kette von Ereignissen führt, wenn die Zelle versucht, die schlecht deformierten Proteine zu entfernen (Reaktion auf falsche Proteinfaltung, UPR). Wenn eine Zelle diese Proteine nicht loswerden kann, initiiert sie eine Selbstzerstörungssequenz und stirbt ab.
Wissenschaftler hatten nicht erwartet, die Rolle des mitochondrialen Proteins bei der UPR-Reaktion zu erkennen. Dieses neue Verständnis von PIGBOS öffnet die Tür für zukünftige Behandlungen, die auf Stresszellen abzielen können.
"In Zukunft könnten wir überlegen, wie PIGBOS an Krankheiten wie Krebs beteiligt ist", sagt Q. Chu. "Bei Krebspatienten ist die Notaufnahme stressiger als bei einem normalen Menschen, daher kann die Behandlung der Notaufnahme ein gutes Ziel sein."
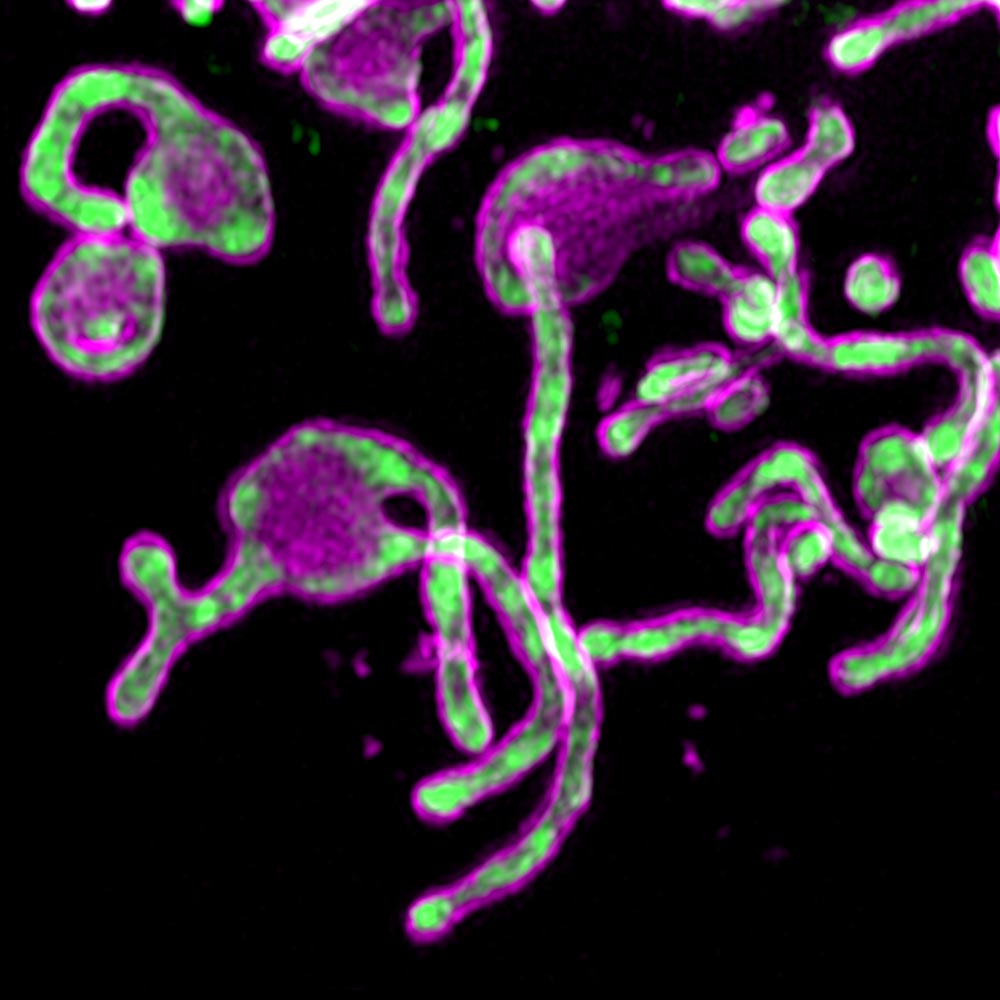 Abb. 1. PIGBOS Microprotein Imagingwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-disease
Abb. 1. PIGBOS Microprotein Imagingwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-diseaseDie Forscher sind daran interessiert, die Rolle anderer mitochondrialer Proteine bei ER-Stress sowie die Funktionsweise von PIGBOS in Tiermodellen zu untersuchen. Das Team arbeitet auch an der Charakterisierung einer umfangreichen Bibliothek von Mikroteinen, die für die Zellbiologie von entscheidender Bedeutung sein können.
Was sind Mikroproteine?
Der Begriff "Mikroproteine" bezieht sich auf kleine Proteine, die von kleinen offenen Leserahmen (smORF) codiert werden. Fortschritte in der Genomik und Proteomik zeigen, dass Säugetiergenome vermutlich Hunderte bis Tausende von Mikroteinen enthalten, die von smORFs codiert werden. Als großer und noch wenig untersuchter Teil des Genoms bieten Mikroteine eine großartige Gelegenheit, ein neues Verständnis der modernen Biologie zu erlangen.
Es ist kein Zufall, dass die amerikanische Zeitschrift The Scientist Mikroproteine "die dunkle Materie des menschlichen Proteoms" nannte. Obwohl der erste von ihnen, Id, vor etwa 30 Jahren entdeckt wurde. Ein gemeinsames Merkmal der Familie der Id-Proteine bei Säugetieren ist ihre Regulation des Zellschicksals. Id-Proteine wirken in verschiedenen Geweben und Zellen, einschließlich Myoblasten, dem Nervensystem und dem Immunsystem. Neben der Tatsache, dass sie als Modulatoren des Transkriptionsmechanismus wirken und das Schicksal von Entwicklungszellen beeinflussen, beeinflussen Id-Proteine auch die Kontrolle des Zellzyklus und werden in verschiedenen menschlichen Tumoren überexprimiert. Die molekulare Funktion von Id-Proteinen in Entwicklungsprozessen ist gut bekannt, über die Funktion von Id-Proteinen bei Erwachsenen ist jedoch bisher wenig bekannt.
Bisher sind nur wenige smORFs und Mikroteine gut charakterisiert. Einige muskelspezifische smORFs haben es uns beispielsweise ermöglicht, neue Wege zu beschreiben, die die Muskelfunktion und -entwicklung steuern. Das menschliche MOTS-C-Mikroprotein reguliert die metabolische Homöostase. Das NoBody-Mikroprotein (nicht annotiertes P-Körper-dissoziierendes Polypeptid) interagiert mit mRNA-spaltenden Proteinen, die die molekularen Komponenten des ersten enzymatischen Schritts im mRNA-Abbauweg sind. Und ein Mikrotein namens CYREN reguliert die Wahl des DNA-Reparaturweges während des Zellzyklus.
Der derzeit bekannte Wirkmechanismus von Mikroproteinen besteht darin, die Bildung von Proteinkomplexen zu unterdrücken. Und so sieht es aus. Viele Proteine erfüllen ihre Funktionen, indem sie als Teil von Multiproteinkomplexen wirken. Die Bildung dieser Komplexe wird streng reguliert und durch Protein-Protein-Interaktionsdomänen vermittelt. Eine Störung des Komplexes oder der Fähigkeit von Proteinen zur Bildung von Homodimeren, Heterodimeren oder Multimeren kann schwerwiegende Folgen für die Zellfunktion haben. In dieser Hinsicht kann die Bildung von Dimeren und Multimeren durch Mikroteine gestört werden. Mikroproteine verhalten sich wie posttranslationale Regulatoren, bilden mit ihren Zielen homotypische Dimere und wirken durch dominant-negative Unterdrückung der Funktion des Proteinkomplexes.
Einfach ausgedrückt, stören Mikroproteine die komplexe Arbeit größerer Proteine, hemmen einige zelluläre Prozesse und stimulieren andere. Studien zeigen, dass die Wirkung von Mikroteinen evolutionär konservativ ist und sowohl dem Tier- als auch dem Pflanzenreich gemeinsam ist. Die Ergebnisse von Primärstudien zeigen, dass Mikroproteine an Immunprozessen beteiligt sind, die Zerstörung defekter RNA-Moleküle kontrollieren, Bakterien vor Hitze und Kälte schützen, die Blütezeit von Pflanzen bestimmen und als Quelle für Toxine vieler Arten von Tiergiften dienen. Laut Wissenschaftlern scheinen Mikroproteine an allen biologischen Prozessen beteiligt zu sein. Kurz bevor sie nicht aufgepasst haben.
Es ist wahrscheinlich, dass viele andere wichtige zelluläre Prozesse ebenfalls durch unbeschriebene Mikroteine vermittelt werden. Sowohl der Nachweis als auch die Charakterisierung von smORFs und Mikroteinen sind eine wichtige Forschungsaufgabe.
Trotz der verbleibenden Rätsel testen Wissenschaftler bereits die mögliche Verwendung dieser Moleküle. Ein Unternehmen verkauft Insektizide aus Mikroproteinen, die im Gift eines australischen Atracids enthalten sind. In klinischen Studien wird ein Kontrastmittel getestet, das auf einem anderen winzigen Protein im Skorpiongift basiert. Die Aufgabe dieser Substanz ist es, die Grenzen der Tumoren zu isolieren, damit Chirurgen sie genauer extrahieren können. Viele Pharmaunternehmen suchen jetzt nach Mikroproteinen mit medizinischem Potenzial.
Wie klein sie sein können, ist noch unklar. Drosophila benötigt ein Mikroprotein mit 11 Aminosäuren, um normale Pfoten wachsen zu lassen, und einige Mikroben können Proteine mit einer Länge von weniger als zehn Aminosäuren produzieren. Aber selbst die größten Mikroteine erreichen keine mittelgroßen Proteine wie Alpha-Amylase, ein Enzym mit 496 Aminosäuren, das in unserem Speichel vorkommt und Stärke abbaut.
Nur der kürzlich erfolgte Nachweis einer kleinen Menge von Mikroteinen ist mit dem vor etwa 20 Jahren festgelegten Generkennungskriterium verbunden. Wenn Wissenschaftler das Genom des Körpers analysieren, scannen sie häufig offene Leserahmen (ORFs). Um nicht in einer großen Datenmenge zu ertrinken, haben Forscher in der Vergangenheit generell ORS mit einem Protein von weniger als 100 Aminosäuren in Eukaryoten oder 50 Aminosäuren in Bakterien ausgeschlossen. Beispielsweise beschränkte dieser Zustand in Hefe die Liste der OPCs auf ungefähr sechstausend.
Die Schwächung dieses Kriteriums zeigt, dass die Zellen signifikant mehr OPC enthalten. Anfang dieses Jahres identifizierten Wissenschaftler Fragmente des Genoms von Mikroben, die vier Teile des menschlichen Körpers, einschließlich Darm und Haut, bewohnen. Bei der Suche nach kleinen OPCs, die Proteine mit einer Länge von fünf bis 50 Aminosäuren codieren können, fanden die Forscher etwa viertausend Familien potenzieller Mikroteine. Fast die Hälfte von ihnen ähnelt nicht bekannten Proteinen, aber die Sequenz eines kleinen ORS legt nahe, dass sich das entsprechende Protein in den Ribosomen befindet - und dies zeigt, dass es eine grundlegende Rolle spielen kann. Als Wissenschaftler kleine OPCs übersahen, wurden nicht nur Gene mit einigen seltenen Funktionen übersehen, sondern auch Gene mit Schlüsselfunktionen.
Andere Zellen enthalten ebenfalls eine große Anzahl kurzer OPCs: Hefe kann beispielsweise mehr als 260.000 Moleküle mit einem Spektrum von zwei bis 99 Aminosäuren produzieren. Aber Zellen verwenden mit ziemlicher Sicherheit nicht alle diese ORS, und einige der von ihnen produzierten Aminosäureketten sind möglicherweise nicht funktionsfähig.
Weissman et al. fanden Mikroproteine auf andere Weise: mit der von ihnen erfundenen Methode, die darauf abzielte, die Art der Proteine, die von Zellen produziert werden, besser zu identifizieren. Um ein Protein zu bilden, kopiert die Zelle das Gen zuerst in einen RNA-Messenger. Dann lesen die Ribosomen die mRNA und binden die Aminosäuren in einer bestimmten Reihenfolge. Durch die Sequenzierung von an die Ribosomen gebundener mRNA bestimmen Weissman und sein Team genau, welche von ihnen tatsächlich zu Proteinen werden und wo das Ribosom beginnt, auf RNA zu „lesen“. In einer Zellstudie von 2011 wendete ein Wissenschaftler mit seinem Team diese Ribosomenprofilierungsmethode, auch Ribo-seq genannt, auf embryonale Stammzellen von Mäusen an und stellte fest, dass die Zellen Tausende unvorhergesehener Proteine produzieren, darunter viele, bei denen die Anzahl der Aminosäuren unter dem Schwellenwert von 100 liegt Einheiten. "Es war klar, dass das Standarduniversum das riesige Universum an Proteinen ignorierte, von denen viele kurz waren", sagt Weissman.
Saghatelian und Kollegen haben einen dritten Ansatz gewählt, um die Häufigkeit von Mikroteinen in unseren eigenen Zellen festzustellen. Die Wissenschaftler verwendeten eine massenspektrometrische Analyse, bei der Proteine in nach Masse sortierte Fragmente aufgeteilt werden, um das Identifikationsspektrum jedes Proteins zu identifizieren. Saghatelyan und Kollegen wendeten diese Methode auf Gemische von Proteinen aus menschlichen Zellen an und subtrahierten dann die Anzeichen bekannter Arten von Proteinen von ihnen. Diese Methode enthüllte Spektren von 86 bisher unbekannten winzigen Proteinen, von denen die kleinsten 18 Aminosäuren lang waren, wie Wissenschaftler in einem Artikel in der Zeitschrift Nature Chemical Biology aus dem Jahr 2013 feststellten.
Kleine Größe begrenzt das Proteinpotential. Größere Proteine verbinden sich zu komplexen Formen, die auf die Implementierung bestimmter Funktionen abzielen, beispielsweise die Katalyse chemischer Reaktionen. Proteine mit 50 bis 60 Aminosäuren bilden wahrscheinlich keine Verbindungen. Und deshalb sind sie nicht zur Bildung von Enzymen oder Strukturproteinen geeignet.
Ihre geringe Größe eröffnet jedoch auch gewisse Möglichkeiten. Sie sind klein genug, um in die Ecken großer Proteine zu passen, die als Kanäle und Rezeptoren fungieren. Kleine Proteine teilen oft kurze Aminosäurestrecken mit ihren größeren Partnern und können daher die Aktivität dieser Proteine binden und verändern. Gebundene Mikroproteine können auch große Moleküle an neue Orte lenken - beispielsweise indem sie das Eindringen in Zellmembranen erleichtern.
Aufgrund ihrer Anziehungskraft auf größere Proteine können kleinere Proteine Zellen eine reversible Möglichkeit bieten, größere Proteine zu aktivieren oder zu deaktivieren. In einer 2016 in der Zeitschrift PLOS Genetics veröffentlichten Studie haben Stephan Wenkel und Kollegen Arabidopsis-Pflanzen gentechnisch verändert, um eine zusätzliche Menge von zwei kleinen Proteinen zu produzieren. Pflanzen blühen normalerweise zu einer Zeit, in der der Tag lang genug ist, aber nach der Geburt einer übermäßigen Menge von zwei Arten von Mikroteinen verzögerte sich die Blüte. Kleine Proteine provozierten diese Verzögerung, indem sie das blühende große Protein namens CONSTANS blockierten. Sie binden CONSTANS an andere hemmende Proteine, die es ausschalten.
Im Jahr 2016 stellten Saghatelyan und seine Kollegen fest, dass menschliche Zellen ein Protein mit 68 Aminosäuren produzieren, das sie NoBody nannten. Dieses Protein kann bei der Zerstörung defekter oder unnötiger RNA-Moleküle helfen. Der Name "Nikto" spiegelt die Rolle dieses Proteins bei der Verhinderung der Bildung von prozessiven Körpern wider, mysteriösen Clustern im Zytoplasma, in denen RNA-Zerstörung auftreten kann. Wenn nicht genügend Protein vorhanden ist, werden prozessivere Körper gebildet, was die Zerstörung der RNA beschleunigt und die innere Struktur der Zelle verändert. "Dies beweist, dass kleine Proteine eine große Wirkung in der Zelle haben können", sagen Wissenschaftler.
Muskeln hängen von vielen verschiedenen Mikroproteinen ab. Während der Entwicklung des Embryos verschmelzen einzelne Muskelzellen zu Fasern, die eine Kontraktion auslösen. Das 84-Aminosäuren-Protein von Myomixer verbindet sich mit einem größeren Protein, um Zellen zu verbinden, wie Olson et al. 2017 in seiner Arbeit in der Zeitschrift Science gezeigt haben. Ohne sie können Mausembryonen keine Muskeln bilden und sind fast transparent.
Während der Entwicklung tritt Myoregulin in Kraft, wodurch die Muskelaktivität reguliert wird. Wenn ein Muskel einen Reiz erhält, setzt das Zelllager Kalzium frei, was die Gewebekontraktion und die Energieproduktion stimuliert. Als nächstes beginnt eine Ionenpumpe, ein Protein namens SERCA, Kalzium wieder zu speichern, wodurch sich das Muskelgewebe entspannen kann. Mioregulin bindet an SERCA und hemmt es. Dieser Effekt begrenzt die Häufigkeit der Muskelkontraktion und bietet wahrscheinlich eine Energiereserve für einen Notfall, beispielsweise auf der Flucht vor einem Raubtier. Ein anderes kleines Protein, DWORF, hat den gegenteiligen Effekt, SERCA zu aktivieren und eine systematische Muskelkontraktion zu stimulieren.
Selbst gründlich untersuchte Organismen wie E. coli-Bakterien (Escherichia coli) verbergen unerwartete kleine Proteine, die eine wichtige Rolle spielen. Storz et al. berichteten 2012, dass ein bisher unbekanntes 49-Aminosäuren-Protein namens AcrZ dieser Mikrobe hilft, zu überleben, wenn sie bestimmten Arten von Antibiotika ausgesetzt wird, indem sie eine arzneimittelfreie Pumpe stimuliert.
Das Gift, das von einer Vielzahl von Organismen produziert wird - darunter Spinnen, Skolopendren und giftige Weichtiere - ist auch reich an winzigen Proteinen. Viele Bestandteile des Giftes immobilisieren oder töten und blockieren die Kanäle für Natrium oder andere Ionen, die für die Übertragung von Nervenimpulsen erforderlich sind. Kleine Proteine "treffen diese Ionenkanäle mit erstaunlicher Genauigkeit und Kraft, sagen Wissenschaftler. Sie sind die Hauptbestandteile von Giften, und mit ihnen sind die meisten pharmakologischen und biologischen Folgen verbunden.
Das riesige fischfressende australische Insekt zum Beispiel ist nicht nur auf scharfe Kiefer und spitzenartige Mundteile angewiesen, um seine Beute zu besiegen. Es stellt seinen Opfern eine Dosis vor, die mehr als 130 Proteine enthält, von denen 15 weniger als 100 Aminosäuren sind.
Im Gegensatz zu großen Proteinen wie Antikörpern können Mikroproteine, die aus Tabletten oder Injektionen aufgenommen werden, in Zellen eindringen und deren Funktionen verändern. Captopril, das erste einer Klasse von Hochdruckmedikamenten, die als Angiotensin-Converting-Enzym-Inhibitor bekannt sind, wurde aus dem kleinen Protein entwickelt, das im Gift der gewöhnlichen Hitze, einer Art giftiger Grubenotter, gefunden wurde. Dieses Arzneimittel, das 1981 in den USA zum Verkauf zugelassen wurde, wurde zufällig entdeckt, noch bevor Wissenschaftler kleine Proteine als separate Gruppe erkannten. Bisher sind nur wenige Mikroteine auf den Markt gekommen oder befinden sich in klinischen Studien.
Krebsforscher versuchen, das im gelben Skorpiongift enthaltene Mikroprotein zu verwenden, das in Afrika und im Nahen Osten verbreitet ist. Dieses Molekül wird auf mysteriöse Weise von Tumoren angezogen. Durch die Zugabe zu einer fluoreszierenden Färbesubstanz erwarten die Wissenschaftler, die Grenzen von Hirntumoren hervorzuheben, damit Chirurgen von Krebs betroffene Bereiche sicher herausschneiden können. Sie beleuchten den Tumor. So können Sie seine Grenzen sehen und das Vorhandensein von Metastasen erkennen.
In klinischen Studien untersuchen Forscher derzeit, ob ein Doppelmolekül Chirurgen dabei helfen wird, Hirntumoren bei Kindern zu entfernen.Es ist noch nicht bekannt, wie kleine Proteine in der Medizin eine wichtige Rolle spielen, aber sie haben bereits eine Reihe von Behauptungen von Biologen auf den Kopf gestellt. Norbert Hübner vom Max-Delbrück-Zentrum für Molekulare Medizin in Berlin und Kollegen entdeckten Dutzende neuer Mikroteine in menschlichen Herzzellen. Die Gruppe enthüllte ihre unerwartete Quelle: kurze Sequenzen in langen nicht-kodierenden RNAs, dh in einer Spezies, von der zuvor angenommen wurde, dass sie keine Proteine produziert. Durch die Identifizierung von 169 langen nicht-kodierenden RNAs, die wahrscheinlich von Ribosomen gelesen wurden, verwendeten Huybner und sein Team eine der Arten der Massenspektrometrie, um zu bestätigen, dass mehr als die Hälfte von ihnen Mikroproteine in Herzzellen produzieren. Ihr Performance Paper wurde dieses Jahr in Cell veröffentlicht.Die DNA-Sequenzen anderer winziger Proteine können auch an unkonventionellen Orten gefunden werden. Zum Beispiel sind einige in den offenen Leserahmen, OPC, größere Proteine. Wissenschaftler glaubten zuvor, dass diese Sequenzen helfen, die Produktion größerer Proteine zu kontrollieren, aber selten selbst Proteine produzieren. Einige codierende Sequenzen neu nachgewiesener Mikroteine liegen sogar in Sequenzen, die für andere, längere Proteine codieren.Diese genomischen Überraschungen können Aufschluss darüber geben, wie neue Gene entstehen, sagt die Biologin für Evolutionssysteme Anne-Ruxandra Carvunis von der University of Pittsburgh, Pennsylvania. Wissenschaftler glaubten zuvor, dass die meisten Gene auftreten, wenn sich vorhandene Gene vermehren oder fusionieren oder wenn Arten DNA austauschen. Laut Karvunis weisen Mikroproteine jedoch darauf hin, dass sich Protogene bilden können, wenn Mutationen im nichtkodierenden Teil des Genoms neue Start- und Stoppsignale setzen. Wenn das resultierende OPC ein nützliches Protein produziert, bleiben die neuen Sequenzen im Genom und durchlaufen den Prozess der natürlichen Selektion, wobei sie sich weiter zu größeren Genen entwickeln, die komplexere Proteine codieren.In einer Studie von 2012 fanden Carvounis und Kollegen heraus, dass Hefe mehr als tausend kurze ORS in Proteine umwandelt. Und dies legt nahe, dass diese Sequenzen Protogene sind. In einer neuen Studie testeten Carvounis und ihr Team, ob junge ORS für Zellen von Vorteil sein könnten. Sie haben die Hefe genetisch verändert, um das Ergebnis von 285 neu entwickelten ORS zu steigern, von denen die meisten auf kleinere Moleküle als Standardproteine oder etwas mehr abzielen. Bei fast 10% der Proteine erhöhte eine Erhöhung ihrer Spiegel das Zellwachstum in mindestens einem Medium."Mikroproteine sind ein schnell wachsendes Gebiet", sagt A. Saghatelian. "Aber ich denke, dass unsere Studie das derzeitige Verständnis des Einflusses von Mikroproteinen auf die Biochemie und Zellbiologie wirklich beeinflusst hat."Links :Regulation der Proteinfunktion durch 'microProteins' Dasneue Universum der Miniproteine verbessert die Zellbiologie und -genetik.Regulation der ER-Stressantwort durch ein mitochondriales Mikroprotein