
Jedes System, egal wie komplex und vielschichtig es sein mag, hat seine eigene Grundlage - die Basis, ohne die es nicht so funktionieren würde, wie es funktioniert. In der Biosphäre unseres Planeten gibt es auch grundlegende Bausteine, auf denen alles ruht. Sie sind Autotrophen - Organismen, die anorganische Verbindungen in organische umwandeln können. Heute treffen wir uns mit Ihnen in einer Studie, in der Wissenschaftler aus Israel im Labor eine neue Art von Bakterien geschaffen haben, die sich von Kohlendioxid ernähren. Welche Methoden wurden im Entwicklungsprozess angewendet, wie hat sich das Bakterium verhalten und was kann diese Arbeit für die Menschheit bedeuten? Dies erfahren wir aus dem Bericht der Forschergruppe. Lass uns gehen.
Studienbasis
Autotrophen können als eine der ältesten Kreaturen auf dem Planeten bezeichnet werden. Es wird angenommen, dass die ersten Autotrophen vor zwei Milliarden Jahren auftraten, als ein heterotropes (nicht in der Lage, organische Stoffe aus anorganischen) Bakterium durch Evolution die Fähigkeit zur Photosynthese erlangte. Der Begriff selbst wurde bereits 1892 vom deutschen Wissenschaftler Albert Bernhard Frank vorgeschlagen.
 Albert Bernhard Frank
Albert Bernhard FrankEinige Organismen befinden sich am Scheideweg zwischen autotropher und heterotropher Synthese, da sie Kohlenstoff aus organischen Verbindungen, aber Energie aus anorganischen Verbindungen erhalten. Nach dieser Logik können Autotrophe in mehrere Haupttypen unterteilt werden: Phototrophe, Chemotrophe, Radiotrophe, Lithotrophe und Mixotrophe. Es gibt auch Übergangsgruppen, deren Vertreter der einen oder anderen Kante des Synthesespektrums nur äußerst schwer zuzuordnen sind, deren Klassifizierung jedoch noch nicht abgeschlossen ist.
Die Phototrophen nutzen , wie der Name
schon sagt , Photonen als Energiequelle bzw. Sonnenenergie. Es ist von diesen Organismen, dass eine solche Art der Ernährung wie Photosynthese auftritt.
Chemotrophe sind Chemie näher als Physik. Solche Organismen verwenden verschiedene Redoxreaktionen als Energiequellen, d.h. Chemosynthese.
Die am schlechtesten untersuchten und zugleich kuriosesten Arten sind
Radiotrophen - das Ergebnis eines Phänomens, das als "
Radiostimulation von Pilzen" bezeichnet wird. Dies ist der Prozess der Stimulierung des mikroskopischen Pilzstoffwechsels durch ionisierende Strahlung. Zum ersten Mal wurden diese Organismen bereits 1991 als Teil eines Schwarzschimmels gefunden, von dem Proben aus dem Kernkraftwerk Tschernobyl entnommen wurden. Wenig später (2006) testeten Wissenschaftler aus New York die Hypothese der Radiostimulation von Pilzen und stellten fest, dass drei Pilze der Spezies Cladosporium sphaerospermum, Wangiella dermatitidis und Cryptococcus neoformans, die das Pigment Melanin enthalten, ihre Biomasse erhöhten und Acetat anreicherten (Essigsäure, CH
3 OH). ) in einer Umgebung, in der der Strahlungspegel die Norm um das 500-fache überstieg.
Lithotrophen wandeln anorganische Verbindungen in die Energie und den Kohlenstoff um, die sie durch aerobe oder anaerobe Atmung benötigen. Nur Vertreter von Archaeen (einzellig ohne Zellkern und Membranorganellen) und Bakterien können sich einer Chemolithotrophie rühmen.
Mixotrophen sind universelle Soldaten, da sie gleichzeitig mehrere verschiedene Arten von Lebensmitteln verwenden können (oder alternativ, abhängig von den Umständen), d. H. B. sowohl Phototrophe als auch Chemotrophe sein.
Die Autoren der Studie, über die wir heute nachdenken, glauben, dass ein detaillierteres Verständnis der Prozesse der lebenswichtigen Aktivität von Autotrophen die Anwendung des erworbenen Wissens in großem Maßstab ermöglichen wird. Und ihrer Meinung nach besteht der beste Weg zur Untersuchung der Autotropie darin, einen synthetischen autotrophen Organismus zu schaffen. Theoretisch können Sie ein Bakterium schaffen, das sich von Kohlendioxid ernährt. Aber um diesen Prozess einfach zu nennen, dreht sich die Sprache nicht. Die Forscher selbst identifizieren drei Hauptphasen, die abgeschlossen sein müssen, damit ihre Arbeit verwirklicht werden kann.
Erstens muss der Körper für einen vollständigen Übergang zur autotrophen Ernährung den Mechanismus der CO
2 -Fixierung auf dem Weg nutzen, auf dem der ankommende Kohlenstoff ausschließlich aus CO
2 besteht , und die Ausgangsmoleküle sind organische Moleküle, die in den zentralen Kohlenstoffmetabolismus eintreten und alle 12 wichtigen Biomassevorläufer liefern.
Zweitens muss der Körper enzymatische Mechanismen einsetzen, um regenerative Energie zu gewinnen, indem er nicht-chemische Energie (Licht, Elektrizität usw.) sammelt oder Redoxprozesse durchführt, die keine Kohlenstoffquellen sind.
Drittens muss der Körper die Art und Weise regulieren und koordinieren, wie Energie gesammelt und CO2 gebunden wird, damit sie zusammen ein nachhaltiges Wachstum aufrechterhalten, wenn CO2 die einzige Kohlenstoffquelle ist.
Zuvor wurden Studien durchgeführt, in denen versucht wurde, einen Organismus zu schaffen, der sich von CO
2 ernährt. In diesen Arbeiten gab es jedoch einen großen Mangel - das Vorhandensein von organischen Verbindungen mit mehreren Kohlenstoffen im Körper, die als "Reserven" für die Ernährung dienten. Mit anderen Worten, es war noch nicht möglich, einen heterotrophen Organismus zu schaffen, der Kohlenstoff ausschließlich aus CO
2 gewinnt.
Als methodische Grundlage für ihre Forschung verwendeten
die Wissenschaftler
den Calvin-Zyklus (Calvin-Benson-Bassam-Zyklus) - eine Reihe biochemischer Reaktionen bei der Photosynthese in Pflanzen, Cyanobakterien usw. Dieser Zyklus ist der häufigste Kohlendioxid-Fixierungsmechanismus.
Und das wichtigste Experiment war das Bakterium
Escherichia coli , das uns unter dem Namen "E. coli" besser bekannt ist.
Forschungsergebnisse
Zunächst war es notwendig, eine metabolische Reorganisation und Laborevolution des Körpers durchzuführen, um den Übergang zur Autotrophie zu realisieren. Es wurden mehrere Kandidatenverbindungen in Betracht gezogen, die als Elektronendonoren für die Fixierung von CO
2 dienen könnten, wodurch die Bakterien zur vollständigen Autotropie übergehen könnten.
Als Elektronenquelle wurde das
Format * gewählt, da diese organische Verbindung mit einem Kohlenstoff als Quelle für den reduzierenden Teil des Prozesses dienen kann, das Wachstum von
E. coli jedoch nicht auf natürliche Weise unterstützt und nicht in die Biomasse aufgenommen wird.
Formiate * - Salze und Ester der Ameisensäure.
Das Wiederherstellungspotential von Formiat (E
0 = 420 mV) ist niedrig genug, um NAD
+ , den wichtigsten elektronischen Träger in der Zelle, zu reduzieren (E
0 = 280 mV in
E. coli ). Ein weiterer Vorteil ist, dass es elektrochemisch aus erneuerbaren Quellen gewonnen werden kann, während die Biomasse kohlenstoffnegativ ist.
Um Elektronen aus dem Formiat zu sammeln und sie in das zelluläre Hauptenergierückgewinnungsreservoir NADH (Nicotinamidadenindinukleotid), die NAD
+ -gebundene FDH (Formiatdehydrogenase) aus dem methylotrophen Bakterium
Pseudomonas sp .
Eine stöchiometrische Analyse (Massenverhältnis der chemischen Verbindung) des metabolischen Netzwerks in
E. coli ergab, dass die Zugabe von FDH, Rubisco (Ribulosebisphosphatcarboxylase) und Prk (Phosphoribulokinase) zum metabolischen Netzwerk von
E. coli für das autotrophe Wachstum ausreicht (Bild unten).
 Bild 1: Schema eines labormodifizierten chemotrophen Bakteriums E. coli.
Bild 1: Schema eines labormodifizierten chemotrophen Bakteriums E. coli.Leider führte die Koexpression von drei rekombinanten Enzymen im primären
E. coli- Stamm (BW25113) unter autotrophen Bedingungen nicht zu Wachstum. Da die stöchiometrische Analyse die Kinetik des Enzyms, den Expressions- und Regulationsgrad nicht berücksichtigt, wurde beschlossen, die adaptive Laborevolution als Instrument zur Stoffwechseloptimierung zu verwenden, um ein autotrophes Wachstum zu erzielen.
Diese Methode beruht auf der Tatsache, dass die heterologe Expression eines fremden enzymatischen Mechanismus den Raum möglicher Stoffwechselreaktionen für die Zelle erweitert und die Möglichkeit eines autotrophen Wachstums bietet. Das Problem ist, dass es keine Garantie dafür gibt, dass der erforderliche Stream eine kürzlich erweiterte Reihe von Reaktionen durchläuft.
Da der Zentralstoffwechsel von
E. coli an das heterotrophe Wachstum angepasst
ist , wird wahrscheinlich eine Flussverteilung verwendet, die das heterotrophe Wachstum unterstützt. Genau aus diesem Grund wurde die Laborevolution eingesetzt, mit der der Fluss entlang des gewünschten Stoffwechselwegs umgeleitet werden kann.
Einer der wichtigsten Prozesse der Laborevolution ist die Umlagerung des Zentralstoffwechsels, um eine Abhängigkeit vom Rubisco-Carboxylierungsstrom herzustellen, und die Anpassung des Wachstumsmediums, um den Fluss durch die ursprünglichen heterotrophen Pfade zu unterdrücken (
2A ). Mit anderen Worten, es war notwendig, das Bakterium zu stoppen, indem die heterotrophen Mechanismen des Metabolismus genutzt und auf Autotrophie umgestellt wurden.
 Bild Nr. 2: Schema der entwickelten Evolutionsstrategie zur Umwandlung des heterotrophen Bakteriums E. coli in ein chemotrophes.
Bild Nr. 2: Schema der entwickelten Evolutionsstrategie zur Umwandlung des heterotrophen Bakteriums E. coli in ein chemotrophes.Zunächst wurden während der künstlichen Evolution drei Gene ausgeschlossen, die für zwei Enzyme im zentralen Kohlenstoffaustausch kodieren: Phosphofructokinase (Pfk) bei der Glykolyse und Glucose-6-phosphatdehydrogenase (Zwf) im oxidativen Pentosephosphatweg. Das erste hat zwei Isoenzyme, die von zwei Genen (pfkA und pfkB) kodiert werden. Wenn Zellen auf
Xylose * gezüchtet werden
, stellt diese Umlagerung sicher, dass das Zellwachstum von der Rubisco-Carboxylierung abhängt, die für den Übergang zur Chemotrophie erforderlich ist.
Xylose * ist ein Pentosemonosaccharid (C 5 H 10 O 5 ).
Als nächstes wurde eine heterologe Expression von Rubisco, Prk, Carboanhydrase (CA) durchgeführt, die CO
2 und Bicarbonat und FDH umwandelt. Im Anschluss daran wachsen Zellen in Xylose-limitierten
Chemostaten * , die Zellen bei ständigem Kohlenstoffmangel unterstützen.
Chemostat * ist eine Methode zur Kultivierung von Mikroorganismen, bei der das optimale Gleichgewicht und die optimale Konzentration der Substrate im Nährmedium, in dem sie wachsen, erhalten bleiben .
Solch ein Kulturmedium ermöglicht es den Zellen, sich zu vermehren (Gewebewachstum durch Zellteilung), verlangsamt jedoch heterotrophe
katabolische * Wege.
Katabolismus * - metabolische Zersetzung komplexer Substanzen in einfachere oder Oxidation einer Substanz (Energiestoffwechsel).
Der Chemostat, in dem die Zellen gezüchtet wurden, enthielt ebenfalls einen Überschuss an Formiat und wurde ständig mit CO
2 -angereicherter Luft (CO
2 -Gehalt
von 10%) gespült.
Somit verlangsamt dieses Wachstumsmedium die Heterotropie, wodurch die Zellen zur Autotropie neigen. Zellen sind buchstäblich gezwungen, ihre Abhängigkeit vom externen Kohlenstoffanteil von Bio-Zucker zu verringern.
Die Anbaumethode war fertig, es musste überprüft werden. Einmal pro Woche wurden Proben aus den Chemostaten entnommen und unter autotrophen Bedingungen auf Wachstum getestet. Dies sind insbesondere chemoorganotrophe Bedingungen für Escherichia coli, die aus einem Medium vom Typ M9 unter Zusatz von 30 mM (millimolar) Natriumformiat in einer Atmosphäre mit hohem CO
2 -Gehalt (10%), jedoch ohne sonstige Kohlenstoffquelle bestehen.
Nach ungefähr 200 Tagen Vermehrung in Chemostaten, was ungefähr 150 Generationen entspricht, wurde Wachstum in Medien ohne Xylose (d. H. Unter autotrophen Bedingungen) nachgewiesen. Dieser Phänotyp war in allen Proben dieses Tages vorhanden. Am 350. Tag wurde Xylose vollständig aus dem Kulturmedium (
2B ) ausgeschlossen. Anhaltendes Wachstum und Trübung implizierten, dass im Chemostat ausschließlich Xylose-unabhängige Zellen vorhanden waren. Es wurde festgestellt, dass die Proben ein Medium mit einer hohen CO
2 -Konzentration für ihr Wachstum benötigten, was auf einen Kohlenstoff-Fixierungsmechanismus schließen lässt.
Als nächstes wählten die Wissenschaftler einen der robustesten
Klone im Wachstum
* für eine eingehendere Analyse. Die
Verdopplungszeit wurde auf 18 ± 4 Stunden (
2C ) eingestellt.
Klon * - in diesem Fall meinen wir eine Gruppe von genetisch identischen Zellen.
Verdopplungszeit * - die Zeit, die benötigt wird, um eine Größe zu verdoppeln.
Es musste sichergestellt werden, dass die gewachsenen Zellen wirklich autotrop sind und während ihres Wachstums keine „verborgenen“ Kohlenstoffquellen oder heterotrophen Formiataktivierungen vorhanden waren. Hierzu wurden Versuche zur Markierung von Isotopen durchgeführt.
Zunächst wurden die entwickelten Klone in einem Medium mit
13 C-markiertem Formiat und
13 CO
2 gezüchtet (10 Generationen, bis ein stabiler Isotopenzustand erhalten wurde). Als nächstes wurde eine Analyse von
13 C-Markierungen auf verschiedene Metaboliten mittels Flüssigkeitschromatographie und Tandem-Massenspektrometrie durchgeführt.
13 C * - Kohlenstoff-13, ein stabiles Kohlenstoffisotop.
Metaboliten * - Stoffwechselprodukte jeglicher Verbindungen.
Die Methode der Flüssigchromatographie und Tandem-Massenspektrometrie * ist eine chemische Forschungsmethode, bei der flüssigchromatographische Trennmischungen mehrerer Komponenten und die Massenspektrometrie kombiniert werden, um die strukturelle Identität der einzelnen Komponenten sicherzustellen.
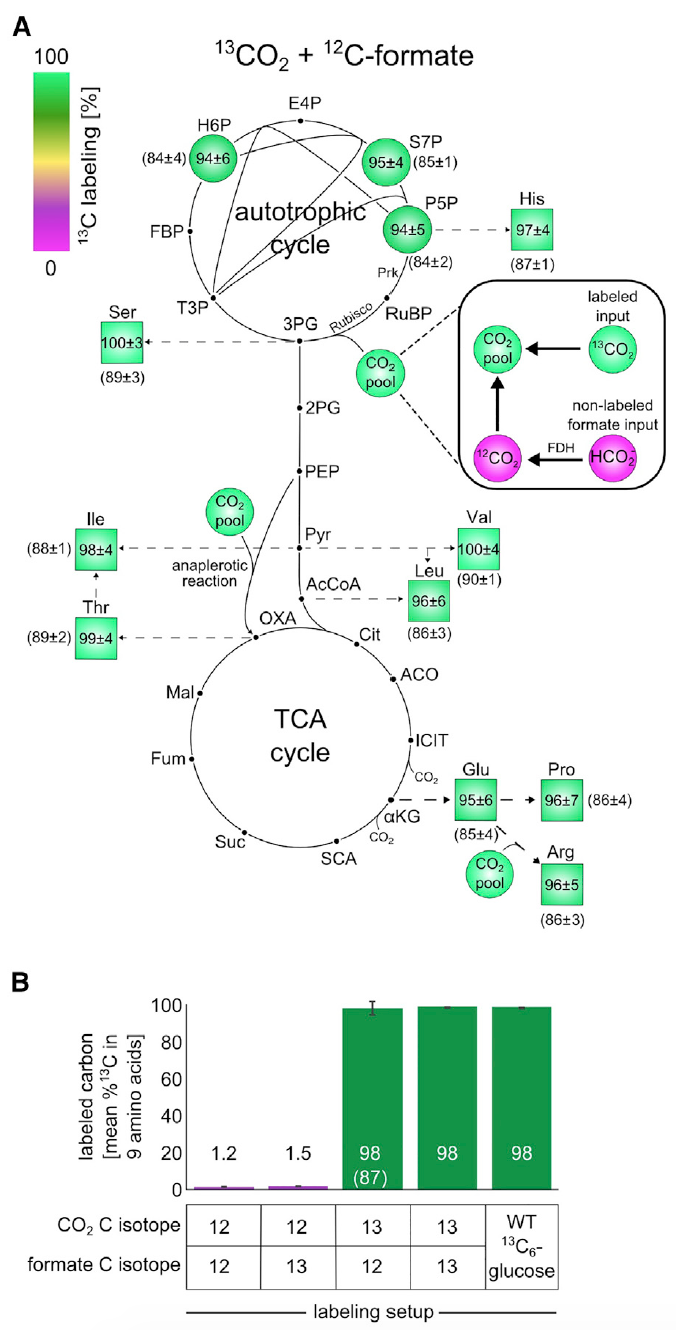 Bild 3: Isotopenmarkierungsexperimente mit 13 C zeigen, dass alle Biomassekomponenten aus CO 2 als einziger Kohlenstoffquelle gebildet werden.
Bild 3: Isotopenmarkierungsexperimente mit 13 C zeigen, dass alle Biomassekomponenten aus CO 2 als einziger Kohlenstoffquelle gebildet werden.Die Analyse ergab, dass ca. 98% der Kohlenstoffatome in den Bausteinen der Biomasse des Zentralstoffwechsels erfolgreich markiert wurden. Diese Daten entsprechen markiertem Formiat und CO
2, das etwa 99%
13 C und 1% unmarkiertes Bicarbonat, gelöst in einem Nährmedium, enthält.
Diese Beobachtung ist ein unwiderlegbarer Beweis dafür, dass der Kohlenstoff in der Biomasse von Zellen genau aus CO
2 und Formiat stammt.
Weiterhin wurde geprüft, ob Formiat in Biomasse konzentriert ist. Zu diesem Zweck wurden die Zellen in M9-Medium (die CO
2 -Konzentration in der Atmosphäre betrug 10%, wie in früheren Experimenten) unter Verwendung von mit Kohlenstoff-13 markiertem Formiat gezüchtet.
Das
13 C-Markierungsschema für Biomassebausteine nach Wachstum in einer bestimmten Umgebung zeigte eine
13 C-Markierung innerhalb von 1-2% (
3B ), was der erwartete Wert ist, basierend auf dem natürlichen
13 C-Gehalt und einer geringen Menge an markiertem Formiat. Mit anderen Worten, die Ergebnisse zeigten, dass Zellen kein Formiat assimilieren.
Die Gesamtheit der Ergebnisse der obigen Experimente legt sicher nahe, dass die Kohlenstoffquelle für die angebauten Pflanzen ausschließlich CO2 und Formiat ist. Dies wiederum deutet auf eine hundertprozentige Autotropie von
E. coli- Zellen hin, die sich im Labor weiterentwickelt haben.
Die Wissenschaftler führten ein weiteres Experiment durch, um diese Aussage zu verifizieren, bei dem
13 CO
2 und nicht markiertes Formiat verwendet wurden. Aufgrund der hohen Kosten für
13 CO
2 wurden die Gefäße, in denen das Experiment durchgeführt wurde, geschlossen. Diese kleine Nuance ist äußerst wichtig, da aufgrund der geschlossenen Umgebung (in den vorherigen Experimenten wurden die Behälter belüftet) unmarkiertes CO
2 angesammelt wurde, das aufgrund der Oxidation von Formiat angesammelt wurde. Und das verfälscht die Beobachtungsergebnisse. Der "Kontaminations" -Prozess konnte jedoch durch Analyse von markiertem Glutamat überwacht und sogar im Auge korrigiert werden.
Diese Erfahrung zeigte, dass ca. 85-90% der Kohlenstoffatome in den Bausteinen der Biomasse des Zentralstoffwechsels erfolgreich markiert wurden. Wie in den Bildern
3A und
3B zu sehen ist,
beträgt die Markierung der Atome in der Biomasse nahezu 100%, wenn die
13 C-markierte Komponente angepasst wird, was auf die autotrophe Natur der Entwicklung von
E. coli- Bakterien hinweist.
Die Tatsache, dass Bakterien zu Autotrophen geworden sind, steht außer Zweifel. Es bleibt abzuwarten, welche genetischen Veränderungen, dh Mutationen, im Verlauf der Laborevolution aufgetreten sind.
Um dies zu klären, isolierten die Wissenschaftler sechs Klone, die in der Lage waren, auf Formiat autotrop zu wachsen, und sequenzierten ihr Genom und ihre
Plasmide * .
Plasmide * sind DNA-Moleküle, die physikalisch von den Chromosomen getrennt sind und sich autonom replizieren können (der Prozess, bei dem zwei Tochter-DNA-Moleküle basierend auf dem Eltern-DNA-Molekül erzeugt werden).
Zwei Klone (Klon 1 und 2) wurden isoliert, als sich noch Xylose im Kulturmedium befand (250. Tag der Evolution), drei Klone (Klon 3, 4 und 5), nachdem Xylose vom Kulturmedium des Chemostaten ausgeschlossen worden war ( 400. Tag der Evolution). Der letzte Klon (Klon 6) wird nach der Vermehrung eines der zuvor isolierten Klone (Klon 1) für mehrere Reihenverdünnungszyklen isoliert.
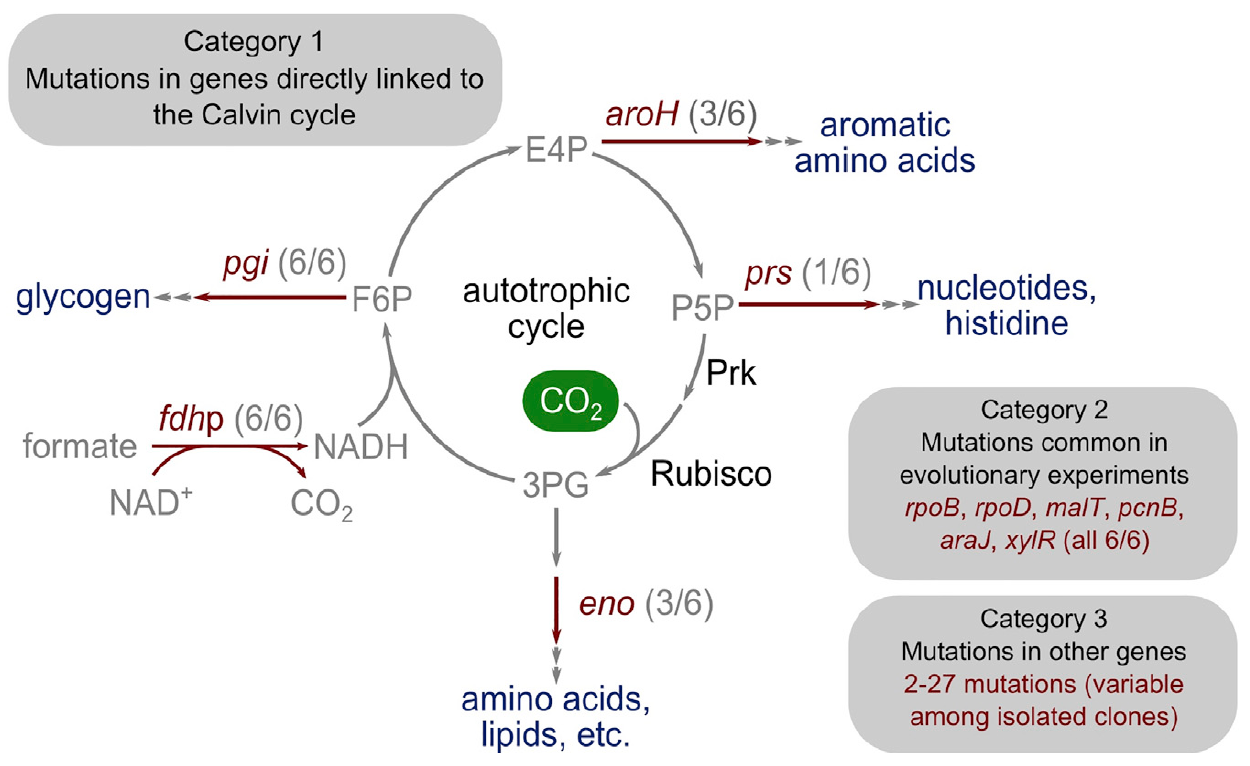 Bild 4: Die genetische Basis des Übergangs zur Autotrophie.
Bild 4: Die genetische Basis des Übergangs zur Autotrophie.Überraschenderweise war die Anzahl der Mutationen recht gering. Die Forscher teilten sie in drei Hauptkategorien ein.
Die erste Kategorie besteht aus Genen, die Enzyme codieren, die in direktem metabolischen Zusammenhang mit der Funktion des Calvin-Zyklus stehen. Dieses Gen, das für Ribosephosphat-Diphosphokinase kodiert, lenkt Ribosephosphat in die Biomasse.
Die zweite Kategorie mutierter Gene umfasst jene, die in früheren Experimenten zur adaptiven Laborevolution mutiert waren: pcnB (R161P), rpoB (D866E), rpoD (F563S), malT (E359K) und araJ (W156). Wissenschaftler assoziieren diese Mutationen mit dem Prozess der Laborevolution, das heißt, sie sind nicht notwendigerweise mit dem Prozess des Übergangs von Bakterien zur Autotrophie assoziiert. In ähnlicher Weise wurde eine Mutation im xylR-Gen gefunden, das ein regulatorisches Protein für Operons codiert, die für den Katabolismus von D-Xylose-Zucker (E337K) verantwortlich sind. Es ist mit einem längeren Mangel an Xylose in einem Chemostat während der Kultivierung verbunden, steht jedoch in keiner Verbindung mit einer Autotrophie.
Die dritte Kategorie von Mutationen umfasst solche, die keine charakteristische Rolle spielen und möglicherweise das Ergebnis eines Phänomens wie „genetisches Trampen“ sind. In verschiedenen Isolaten gibt es 2 bis 27 zusätzliche mutierte Gene, von denen einige Mutationen des autotrophen Phänotyps sein können, aber nicht unbedingt notwendig sind.
Zukünftig wollen die Wissenschaftler zusätzliche Studien zu genetischen Mutationen durchführen, um festzustellen, welche von ihnen grundlegend sind und für den Übergang von Bakterien zur Autotrophie erforderlich sind.
Um die Nuancen der Studie genauer kennenzulernen, empfehle ich, dass Sie sich den
Bericht der Wissenschaftler und
weitere Materialien dazu ansehen.
Nachwort
In dieser Studie konnten Wissenschaftler hervorragende Ergebnisse erzielen. Zunächst ist die Laborentwicklung zu erwähnen - ein von Wissenschaftlern gesteuerter Prozess, der es ihnen ermöglicht, den Körper nach einem neuen "Design" zu transformieren.
E. coli wurde buchstäblich durch evolutionäre Manipulation gezwungen, ein Autotropher zu werden, der CO
2 absorbierte, um sich mit Kohlenstoff zu versorgen. Ein solches mutiertes Bakterium kann für eine Gesellschaft, die unter der globalen Erwärmung leidet, äußerst nützlich sein. Einer der Gründe dafür ist genau Kohlendioxid. , ,
2 , . «» , . -, . -, , ,
2 . , , .
Das Bakterium, das die Welt vor der globalen Erwärmung bewahrt, klingt unglaublich, sogar ein bisschen Science-Fiction. Aber selbst wenn ein solches Bakterium erzeugt wird, entbindet es eine Person nicht von der Verantwortung für die Umweltsituation auf dem Planeten. Denn es geht nicht nur darum, wo sie putzen, sondern wo sie nicht verunreinigen.Vielen Dank für Ihre Aufmerksamkeit, bleiben Sie neugierig, kümmern Sie sich um den Planeten und haben Sie eine gute Arbeitswoche, Jungs. :)
Ein bisschen Werbung :)
Vielen Dank für Ihren Aufenthalt bei uns. Mögen Sie unsere Artikel? Möchten Sie weitere interessante Materialien sehen? Unterstützen Sie uns, indem Sie eine Bestellung
aufgeben oder Ihren Freunden
Cloud-basiertes VPS für Entwickler ab 4,99 US-Dollar empfehlen, ein
einzigartiges Analogon zu Einstiegsservern, das wir für Sie erfunden haben: Die ganze Wahrheit über VPS (KVM) E5-2697 v3 (6 Kerne) 10 GB DDR4 480 GB SSD 1 Gbit / s ab 19 Dollar oder wie teilt man den Server? (Optionen sind mit RAID1 und RAID10, bis zu 24 Kernen und bis zu 40 GB DDR4 verfügbar).
Dell R730xd 2-mal billiger im Equinix Tier IV-Rechenzentrum in Amsterdam? Nur wir haben
2 x Intel TetraDeca-Core Xeon 2 x E5-2697v3 2,6 GHz 14C 64 GB DDR4 4 x 960 GB SSD 1 Gbit / s 100 TV ab 199 US-Dollar in den Niederlanden! Dell R420 - 2x E5-2430 2,2 GHz 6C 128 GB DDR3 2x960 GB SSD 1 Gbit / s 100 TB - ab 99 US-Dollar! Lesen Sie mehr über
das Erstellen von Infrastruktur-Bldg. Klasse mit Dell R730xd E5-2650 v4 Servern für 9.000 Euro für einen Cent?