Einleitung
 »Der Dunst vor dem Morgengrauen zog sich widerwillig entlang der Schluchten zurück, und Roggenhalme schimmerten unter dem Wind. Die Vögel hatten es bereits geschafft, sich am Morgen zu freuen und unauffällig über ihr Ohr zu klappern. Die letzten Tropfen Schlaf fielen in eine Tasse aromatischen Kaffees. Es ist angenehm, der Sonnenscheibe zu begegnen, die frostigen Gelenke zu strecken und in die Ferne zu schauen. Wer ist das? Der Gedanke erstarrte, als sein Blick auf einem Weg glitt, der aus dem Wald führte. Ein breites Lächeln erhellte sein Gesicht. Von den ersten Sätzen an erkannte er sie. Nur sie konnte sich so anmutig und anmutig bewegen. Die Hand erstarrte auf halbem Weg zum Tisch. Er lächelte weiter, drehte sich plötzlich scharf um und ging in die Küche. Eine weitere Tasse und ein Tablett mit Beeren standen auf dem Tisch. Der Duft von Lavendelsirup überflutete die Veranda. Es wäre ein guter Tag, dachte er, ein angenehmes Frühstück - auf jeden Fall.
Eine Handvoll Himbeeren verschwand schnell von der Beerenschale nach der Beere. Eine sanfte Frauenstimme erzählte die neuesten Nachrichten. In der vergangenen Woche wurde auf dem Friedhof der Stadt kein einziges Kreuz angebracht. Wir haben überlebt! Aus den bereits altersverkürzten Lungen brach ein Ausatmen der Freude hervor. Ja! “Antwortete sie ihm. Dieses verdammte Vierteljahrhundert. Ein Vierteljahrhundert, in dem sich kein einziger glatter Fleck auf Ihrem Gesicht befindet.
Seine ohnehin kurzsichtigen Augen sahen sie an und in ihnen sah sie die endlosen Linien der Graphen des Massenspektrometers, die bodenlose Müdigkeit, die bei dem Versuch, ihn in eine Schachtel zu stecken, nicht nachließ. Er kam zurecht, hielt aus. Die Menschen hatten keine schreckliche tierische Angst mehr vor dem Untergang, wahrscheinlich den schrecklichsten Tod, den man sich hätte vorstellen können ... "
Dies ist der Beginn einer fantastischen Geschichte, die ich in meiner Freizeit lese. Es beschreibt eine neue Art von biologischer Waffe. Schrecklich in seiner zerstörerischen Kraft. Die Menschen waren fassungslos, als sie ihr Schicksal erkannten. Die Angst vor diesem unsichtbaren und unvermeidlichen Unglück war schlimmer als der Tod.
"Pruritus"Großbritannien, erste Hälfte des 18. Jahrhunderts. Nebel zerstreut sich über den grünen saftigen Feldern. Eine große Schafherde bewegt sich langsam in Richtung Fluss. Plötzlich bemerken wir etwas Ungewöhnliches. Mindestens ein Fünftel der Schafe rollt wütend über das Gras und reibt ihre Häute an Steinen, die über die Erdoberfläche ragen, wodurch unordentliche Fetzen zurückbleiben. Gekämmt, verlor das Haar der Seite mit schrecklichen Geschwüren und Erosion bedeckt. Ein Teil der Schafe ist nicht mehr in der Lage zu jucken, sie bewegen sich nur langsam, mit zitterndem Gang und knirschenden Zähnen über das Feld zum Ort der letzten Ruhe. Was für ein Unglück ist das, dachten die Hirten und nannten die Krankheit nach ihrer Hauptmanifestation - SCRAPIE ("Pruritus"). Diese Infektion ist seit Jahrhunderten nicht mehr zurückgegangen und erscheint hier und da und hinterlässt zerstörte Familien.
GehirnwürmerEchte Wissenschaftler sind keine gewöhnlichen Menschen, die ihre Biografien kennenlernen. Man ist oft erstaunt, wie verrückt sich das Fass des Schicksals drehte.
Einer der Themen unserer Geschichte beginnt mit der Biografie von Daniel Carlton Gaidusek (1923-2008). Stellen Sie sich einen jungen Mann vor, er ist 23 Jahre alt, hat gerade einen Master-Abschluss in Harvard erhalten, er wird mit großer Begeisterung an der California Technological University arbeiten und nicht mit irgendjemandem, sondern mit Linus Pauling selbst (zweimal Nobelpreisträger). Drei Jahre später nimmt er die Einladung an und übernimmt in seiner Alma Mater die Stelle eines Wissenschaftlers an der Fakultät für Pädiatrie und Infektionskrankheiten. Trotz einer so erfolgreichen Karriere läuft etwas nicht gut und gibt ihm keinen Frieden. Nachdem er drei Jahre nicht gearbeitet hat, wirft er alles und reist zuerst am Pasteur-Institut nach Teheran. Drei Jahre später findet er sich im seltsamen Zickzack durch den Hindukusch am Walter and Eliza Hall Medical Institute in Melbourne wieder. Herunterschalten, sonst nicht.
In Australien fand die schicksalhafte Bekanntschaft von Daniel Gaidusek mit dem medizinischen Offizier Vincent Zigas (1920-1983) statt, der eng mit den Stämmen Papua-Neuguineas zusammenarbeitete und sie medizinisch versorgte. Zigas erzählt Daniel von einer unbekannten Krankheit, deren seltsame Symptome sich in einer einzigen Nation manifestieren - Foret. Gaidusek beeilt sich ungeduldig, die Sprache der Aborigines zu lernen, und ein paar Monate später bringt Zigas Gaidusek der Volksgruppe Foret mit und vertritt ihn. Fast ein Jahr lang leben sie unter einem wilden Stamm und verfolgen alle Gewohnheiten und Bräuche. Beobachten Sie die Patienten und führen Sie eine Autopsie der Toten durch. [1]
So beschreiben sie den Ablauf einer für sie interessanten Krankheit in ihrem Artikel:
„... Apathie und überwältigende Müdigkeit überholen einen Menschen. Nach einem Monat oder etwas mehr beginnen charakteristische Zuckungen und Zittern. Das Zittern der Gliedmaßen, des Rumpfes und des Kopfes wird deutlicher und konstanter. Eine Person verliert die Fähigkeit, sich zu bewegen. Zwischen einem und zwei Jahren tritt der Tod ein. Mitglieder des Phorenstammes nennen diese Krankheit „Kuru“, was Zittern und Verwöhnen bedeutet. Und sie glauben, dass der Grund im bösen Blick des Schamanen liegt. "
Nach einer Autopsie stellte sich heraus, dass Zigas und Gaidusek, die an der Krankheit starben, das Gehirn in eine schwammige Substanz verwandelt hatten. [2]
Langfristiger Aufenthalt innerhalb des Stammes ermöglichte es Haidusek und Zigas, die Ursache der Krankheit zu entdecken. Es stellte sich heraus, dass der Stamm der Foret Kannibalismus praktizierte.
Nach dem Tod eines der ältesten Mitglieder der Gattung wurde sein Körper geschnitzt, die Schädelschachtel geöffnet und das Gehirn gegessen, da angenommen wurde, dass das Essen des Gehirns ein Ritual der letzten Ehre für den Verstorbenen ist und derjenige, der das Gehirn isst, seine Weisheit, seinen Mut und andere edle Eigenschaften erwerben wird. was er besaß. Normalerweise wurde der größte Teil des Gehirns von Frauen gefressen, weshalb die Anzahl der Fälle höher war. [3] Mit der Ausrottung eines solchen schädlichen Brauchs wurde die Kuru-Krankheit fast vollständig besiegt.
Für die Beschreibung der Kuru-Krankheit im Jahr 1976 erhielt Gaidusek den Nobelpreis. Und hier sind die Motive des Nobelkomitees, auf die Vincent Zigas aufmerksam wurde, nicht klar. In seinem Nobel-Vortrag sprach Gaidusek über die virale Natur der Kuru-Krankheit. Wir erfahren später, ob er Recht hatte oder nicht.

Ein von der "Henne" betroffener Patient.
"Ich hatte Zeit"In der Zwischenzeit schnell nach Deutschland. Anfang des 20. Jahrhunderts wurde in Breslau eine psychiatrische Klinik eingerichtet, eine Abteilung unter der Leitung von Alois Alzheimer. Ein junger Schiffsarzt kommt zur Arbeit und beschließt, Neurologe zu werden. Während er die Grundlagen des Berufs beharrlich versteht, gelingt es ihm, Patienten mit bisher unbekannter Krankheit zu finden. Die Forschung wird durch den Ersten Weltkrieg unterbrochen, der Dr. Hans-Gerhard Kreutzfeld zur Marine zurückbrachte. Erst 1920, nach 6 Jahren, veröffentlicht er eine Krankheitsbeschreibung.
In der Beschreibung stellen wir fest, dass Patienten ihr Gedächtnis mit hoher Geschwindigkeit verloren, sich ihrer selbst nicht mehr bewusst waren und 8-12 Monate nach den ersten Manifestationen des Krankheitsbildes starben. In Gehirnpräparaten, die von solchen Patienten erhalten wurden, wurden charakteristische "schwammige Strukturen" gefunden.
Es ist anzumerken, dass er unglaublich glücklich war, wenn er sechs Monate zu spät war, und der Wind der Zeit seinen Namen jahrhundertelang verdrängt hätte, da einige Monate später das Werk von Alfons Jacob dieselbe Krankheit beschrieb, die den Namen seiner Entdecker fand - die Creutzfeldt-Jakob-Krankheit (CJK).
Was könnte zwischen Scrapie, Kuru und CJK gemeinsam sein? Diese Frage begannen Wissenschaftler in den 50er Jahren des 20. Jahrhunderts zu stellen, da diese Krankheiten einer langen Inkubationszeit von 5 bis 10 Jahren und dem unveränderlichen traurigen Schicksal der betroffenen Person, sei es ein Tier oder eine Person, sehr ähnlich waren. Darüber hinaus überholte der Schaden vor allem das Gehirn. Diese Gruppe von Neurodegenerationskrankheiten mit langer Inkubationszeit wurde genannt.
Hauptteil
Die Experimente
Mit der Entwicklung experimenteller Methoden der Biochemie wurde es möglich, diese Pathologien endlich anzugehen. Es war unglaublich schwierig, die Infektionsquelle zu finden, vorausgesetzt, die Manifestationen der Krankheit können erst nach Jahren festgestellt werden. Trotz der Schwierigkeiten konnten die Versuche, die Ursachen der Krankheit herauszufinden, nicht aufhören. Die Laboratorien suchten nach Wegen, um die experimentelle Arbeit zu vereinfachen und die Inkubationszeit auf ein akzeptables Maß zu verkürzen.
So konnten Patison und Guiley die Krankheit mit zellfreien Filtraten von Schaf zu Schaf übertragen. Zu Beginn der Laborexperimente blieb nur ein Schritt - die Übertragung der Krankheit vom Schaf auf das Labortier. Und Chandler tut es 1960, worüber er 1961 einen kleinen, aber sehr berühmten Artikel schreibt [4]. Es gelang ihm, eine Labormaus mit einer Substanz aus dem Gehirn eines kranken Tieres zu infizieren. Darüber hinaus musste in jüngsten Studien die Manifestation der Krankheit nur 7 Monate warten. Es ist praktisch geworden, die Krankheit im Labor zu untersuchen.
Die Suche nach einem Infektionserreger hat zugenommen. Es war lange nicht möglich, es zu installieren. Zuerst suchten sie nach einem unbekannten Virus, ähnlich wie Herpes oder Enzephalitis, fanden aber nichts. Es war für alle Forscher überraschend, dass die Fähigkeit zur Infektion dieser Substanz, die aus dem Gehirn kranker Tiere isoliert wurde, nach starker längerer Erhitzung und nach Behandlung mit Acetaminethylamin bestehen blieb. Es wurden Versuche durchgeführt, bei denen das Filtrat mit harter UV- und ionisierender Strahlung behandelt wurde. Trotzdem behielt das Filtrat die Fähigkeit, sich anzustecken. [5] Der Verdacht schlich sich ein, dass Viren in diesem Fall nichts damit zu tun hatten, weil Nukleinsäuren (ein unverzichtbarer Bestandteil eines Virus) einfach unter einem solchen Einfluss kollabierten.
Griffith äußerte 1967 in einer kurzen Notiz auf anderthalb Textseiten einen ketzerischen Gedanken: Der Erreger enthält keine Nukleinsäuren. [6] Dies ist ein Protein, das sich in der Zelle selbst reproduzieren kann. Mit dieser Notiz begann eine neue Ära.
Infektiöses Protein
Scrapie-Forschungsexperimente blieben weiterhin komplex und langwierig. Nur 15 Jahre später identifizierte und beschrieb Stanley Pruziner von der University of California in San Francisco einen Wirkstoff, der in seiner reinen Form die Entstehung einer Scrapie-Krankheit verursachen kann. Es stellte sich heraus, dass diese erstaunliche Substanz hitzebeständig ist und die Infektiosität nach Behandlung mit verschiedenen Schadstoffen wie Proteinase K, Harnstoff, Guanidinchlorid, Detergenzien, SDS und Nukleasen - DNA-schädigende Enzyme - beibehält. Es wurde jedoch auch festgestellt, dass dieses infektiöse Mittel empfindlich gegen Ionisierung ist Strahlung in Gegenwart von Sauerstoff, die für hydrophobe Proteine mit einer hohen Affinität für Lipide charakteristisch ist. [8]
Pruziner prägte den Namen für ein Mittel, das Scrapie auslöst - „PRION“ (Prion-Protein-Infektionspartikel). Prionprotein (Prione Protein PrP) wurde wenig später isoliert. Die damaligen Sequenzierungsmethoden waren bereits recht gut entwickelt und ermöglichten eine schnelle Etablierung der primären PrP-Sequenz. Alle suchten nach der Quelle von PrP. Ein Artikel in Nature aus dem Jahr 1985, der das Ende der Suche markierte, verblüffte viele Forscher: In einem gesunden Gehirn wurde die für die PrP-Synthese notwendige Matrix-RNA (ein Molekül - ein Template, mit dem Proteine synthetisiert werden) gefunden. [7]
Dies bedeutete nur eines: Das Protein, das für die Entwicklung der Krankheit verantwortlich ist, ist immer im Gehirn vorhanden, unabhängig von der Entwicklung der Krankheit. Es wurde später entdeckt, dass das Gen, das PrP codiert, in allen Säugetieren sowie in Vögeln und Fischen vorhanden ist.
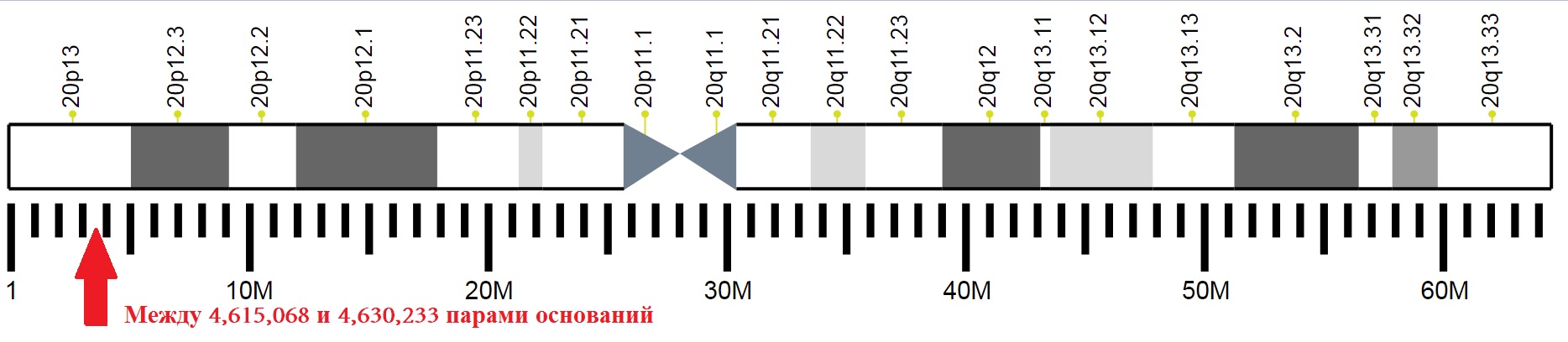
Die Position einzelner Abschnitte des 20. Chromosoms einer Person mit einer Markierung der Position des für PrPC kodierenden Gens.
Proteinstruktur
Was ist dieses erstaunliche Protein? Seine Funktion und nach 37 Jahren ab dem Zeitpunkt der Entdeckung wurde nicht geklärt (hier ist es dank des westlichen Modells der Grant-Artikel-Wissenschaft zu sagen). Es ist bekannt, dass dieses Protein an die Zellmembran gebunden ist. Und vielleicht verantwortlich für interzelluläre Interaktionen im Gehirn.
Um zu verstehen, wie normales Protein ansteckend wird, müssen Sie die Struktur von Proteinen untersuchen. Die Primärstruktur eines Proteins ist die Sequenz von Aminosäureresten. Diese Sequenz ist in normalem PrPC und in der infektiösen Form von PrPSc dieselbe.
Unterschiede zeigten sich auf der Ebene der sekundären und tertiären Raumstruktur. In PrPC besteht die Sekundärstruktur zu 42% aus α-Helices und zu 3% aus β-Strukturen, während PrPSc zu 30% aus α-Helices und zu 43% aus β-Strukturen besteht. Diese Tatsache legt nahe, dass die pathologische Form des Proteins bei unsachgemäßer Faltung der Aminosäuresequenz in β-gefaltete Schichten gebildet wird.
Im obigen Bild ist die Aminosäuresequenz von PrP mit hervorgehobenen Regionen verschiedener Proteinstrukturen der Helices H1, H2, P3 - α dargestellt. Die Transformation von Spiralen in β-gefaltete Schichten ist unten gezeigt. Bild: Von Olivia May, Ph.D
Prion-Hypothese
Auf der Grundlage der 1991 gesammelten Daten bildet Pruziner die Prion-Hypothese, die Folgendes postuliert:
- der Infektionserreger ist PrPSc-Protein,
- der Infektionserreger PrPSc kann sich in Abwesenheit einer Nukleinsäure selbst replizieren,
- Die Umwandlung des Proteins von der normalen Form (PrPC) in die infektiöse Form (PrPSc) erfolgt über einen Konformationsübergang.
- Der Konformationsübergang von PrPC zu PrPSc kann spontan erfolgen und zu sporadischen Formen von Prionkrankheiten führen. Es kann durch die Aufnahme der pathologischen Form von PrPSc von außen verursacht werden (erworbene Formen von Prionkrankheiten),
- Der Übergang kann aufgrund von Mutationen im Prnp-Gen erfolgen, die zur Bildung von PrPSc aus PrPC (erbliche Formen von Prionkrankheiten) beitragen. [9,10].
Somit können Prionkrankheiten durch einen genetischen Defekt, eine äußere Infektion oder eine Kombination davon verursacht werden.
Trotz der leidenschaftlichen Angriffe von Kritikern dieser Theorie sind sich jetzt fast alle einig, dass Pruziner Recht hatte, und es gibt eine beträchtliche Menge experimenteller Beweise dafür. Wenn wir uns beispielsweise vorstellen, dass die Reproduktion von PrPSc nach der Einnahme durch die Übertragung der pathologischen Konformation auf PrPC erfolgt, sollten Organismen, denen PrPC fehlt, resistent gegen eine Prioninfektion sein. Ein solches Experiment wurde unter Verwendung von transgenen Mäusen durchgeführt, die homozygot für eine Deletion des Prnp-Gens (Prnp0 / 0) waren. Die Einführung des geriebenen Hirngewebes von Mäusen, die an Scrapie erkrankt waren, bei transgenen Mäusen Prnp0 / 0 führte aufgrund des Mangels an normalem PrP nicht zur Entwicklung der Krankheit. Darüber hinaus stellte sich heraus, dass in Abwesenheit von PrPC nicht nur eine Prionenreproduktion, sondern auch eine Schädigung des Nervengewebes nicht auftritt.
Der endgültige Beweis für das Konzept der Prionen war lange Zeit durch die Unmöglichkeit eingeschränkt, eine signifikante Menge von PrPres zu erhalten, einer in vitro gebildeten Form von PrPSc, die gegen partielle Proteolyse resistent ist und bei der Verabreichung an Versuchstiere Krankheiten verursachen kann. Kürzlich wurde gezeigt, dass ein in Escherichia coli synthetisiertes rekombinantes Maus-PrP-Fragment in vitro Fibrillen bildet, die bei Einführung in transgene Mäuse, die das gleiche PrP-Fragment exprimieren, zur Entwicklung einer Prion-Krankheit führen. [13]
Kürzlich wurde ein System zur zyklischen Amplifikation der Prionform von PrP-Protein entwickelt, mit dessen Hilfe es möglich ist, eine signifikante Menge von PrPres (künstliche pathologische Version von Prion) in vitro zu bilden. Dies ermöglichte es, die Infektiosität des künstlich synthetisierten Prions zu erhalten und nachzuweisen.
Ein aufmerksamer Leser wird feststellen, dass es unwahrscheinlich ist, dass die im Gehirn eines Schafes gebildeten Prionen für den Menschen pathogen sind. Und sie werden fast recht haben. Es ist bekannt, dass die Übertragung von Prioneninfektionen zwischen Säugetierarten durch interspezifische Barrieren begrenzt ist. Zum Beispiel wird die Creutzfeldt-Jakob-Krankheit von Mensch zu Mensch und vom Menschen auf Schimpansen übertragen; Scrapie wird bei Schafen und Ziegen übertragen, jedoch nicht bei Schimpansen. Gleichzeitig sind interspezifische Barrieren nicht absolut. Interspezifische Barrieren können nicht so sehr in der Unmöglichkeit der Übertragung der Infektion auf Tiere einer entfernten Art zum Ausdruck gebracht werden, sondern in der Verlängerung der Inkubationszeit sowie in der Tatsache, dass nicht alle, sondern ein Teil der experimentell infizierten Tiere krank werden. Es wird angenommen, dass interspezifische Barrieren durch Unterschiede in der Primärstruktur von PrP und Modifikationen bei Säugetieren verschiedener Spezies verursacht werden. Dies wurde durch die folgenden Beobachtungen bestätigt. Transgene Mäuse, die das PrP des Hamsters exprimierten, waren im Gegensatz zu Wildtyp-Mäusen gegenüber einer Infektion durch das Prion des Hamsters hochempfindlich. Die Übertragung der Creutzfeldt-Jakob-Krankheit von Mensch zu Maus wird durch die interspezifische Barriere begrenzt, aber transgene Mäuse, die menschliches PrP exprimieren, sind anfällig für Infektionen.
Es gibt auch immer noch Schwierigkeiten, Tiere mit reinem Prionprotein zu infizieren. Diese Schwierigkeiten können leicht erklärt werden.
Der erste Grund ist, dass Proteine in den Zellen eines gewöhnlichen Organismus posttranslationale Modifikationen erfahren, die unter experimentellen Bedingungen schwierig zu reproduzieren sind.
Der zweite Grund ist, dass das Prion ein Membranprotein ist, und es sollte angenommen werden, dass seine Struktur unter den Bedingungen einer membranartigen Umgebung am stabilsten ist, wie jüngste Studien gezeigt haben.
In ihnen wurde gezeigt, dass Prionen in Gegenwart von Cholesterin und Phosphatidylethanolamin viel leichter die pathogene Form bilden und eine viel größere Infektiosität aufweisen.
Prionen - biologische Waffen
Hier könnte man über gruselige Prionen reden. Der Leser wird jedoch zu Recht fragen: "Und was ist mit biologischen Waffen?" Schließlich muss das pathogene Prionenmolekül in das Gehirn gelangen, damit eine Infektion auftreten kann. Wir werden keine Kraniotomie für uns selbst durchführen. “
Tatsächlich stellte sich die Situation mit möglichen Infektionswegen als viel schlimmer heraus, als man sich vorstellen konnte.
1974 wurde der erste Fall einer iatrogenen (aufgrund äußerer Exposition) Erkrankung der Creutzfeldt-Jakob-Krankheit beschrieben, die üblicherweise als genetische Pathologie angesehen wird.Es gibt Beschreibungen von 3 Fällen der Übertragung von CJD als Folge einer Bluttransfusion von einem Spender, bei dem CJD während eines Ausbruchs der Krankheit in Großbritannien diagnostiziert wurde [28]. Woher kam dieser Ausbruch ... Wie immer aus Gier. CJD hat sich beim Menschen nach dem Verzehr von mit Prionen infiziertem Rindfleisch entwickelt.1986 brach in Großbritannien eine Prionenkrankheitsepidemie bei Kühen aus, die auch als „Rinderwahnsinn“ bezeichnet wurde und zum Tod von mehr als 160.000 Rindern führte [29]. Der Grund war die Verwendung von Tiermehl-Nahrungsergänzungsmitteln, die aufgrund schlecht kontrollierter Vorschriften für die Verarbeitung von tierischen Nebenprodukten von PrPSc aus Scrapie-infizierten Schafen und anderen Rindern an Kuhfutter verfüttert wurden. Gewöhnlich umfasst die Technologie zur Herstellung eines solchen Mehls nach gründlichem Mahlen des Ausgangsmaterials die Behandlung mit aktiven Fettlösungsmitteln sowie die Wärmebehandlung bei einer Temperatur von 130 ° C. In den späten 70er Jahren reduzierten Unternehmer, die beschlossen hatten, den Nährwert von Fleisch- und Knochenmehl zu erhöhen, den Wärmebehandlungsmodus auf 110 ° C und reduzierten auch die Menge an fettentfernenden Substanzen.Diese Veränderungen trugen zur Entstehung und Entwicklung der Epidemie bei den Rindern bei.Es wurde nachgewiesen, dass die Epidemie bei Kühen zur Entstehung eines neuen CJD-Typs führte, der als "CJD-Variante" bezeichnet wird [15]. Die ersten Fälle von BCF wurden 1995 gemeldet, als die Krankheit bei 2 britischen Jugendlichen diagnostiziert wurde [16,17]. Aufgrund der langen Inkubationszeit wurde der Zusammenhang zwischen der Krankheit und infiziertem Fleisch in Großbritannien erst hergestellt, als sich die Inzidenz bei Kühen zu einer Epidemie entwickelte. Die Epidemie wurde nach einer massiven Schlachtung des Viehs und Änderungen in der Produktionstechnologie, die die Kontamination des Fleisches mit Bestandteilen des Nervengewebes drastisch verringerten, unter Kontrolle gebracht. Im Vereinigten Königreich ist die jährliche Anzahl neuer Fälle von CJD, die ihren Höhepunkt im Jahr 2000 hatte, stetig rückläufig, und 2013 wurde nur ein Fall bestätigt [18].Bei allen Patienten entwickelte sich CJD nach dem Verzehr von Fleisch von erkrankten Rindern. Aber trotz der weit verbreiteten Epidemie, von der Hunderttausende Rinder betroffen waren, entwickelten relativ wenige Menschen, die Fleisch von kranken Tieren aßen, eine CJD [33]. (Beachten Sie die interspezifische Barriere).Die Inkubationszeit (die Zeit zwischen dem Verzehr von infiziertem Rindfleisch und der Manifestation von Symptomen) war lang: Die meisten Patienten waren Ende der 80er Jahre infiziert, und die höchste Inzidenz trat Anfang der 2000er Jahre auf, d. H. Die Inkubationszeit betrug 11-12 Jahre. In den letzten diagnostizierten Fällen lag die Inkubationszeit zwischen 12 und mehr als 20 Jahren [18.19].Die klinischen Manifestationen der CJD-Variante unterscheiden sich von anderen Formen der CJD. Die Krankheit holt junge Menschen im Alter von bis zu 30 Jahren ein, ihr Ausbruch ist durch Persönlichkeitsveränderungen gekennzeichnet: Der Patient verliert seine alten Interessen, beginnt, enge Menschen zu meiden, entwickelt Angstzustände, Schlaflosigkeit, Depressionen. Bewegungsstörungen treten etwa sechs Monate nach Ausbruch der Krankheit auf. Demenz tritt später auf als in der klassischen Form, der Patient ist sich seines sich verschlechternden Zustands bewusst. Ziemlich schnell verliert er die Fähigkeit zur Selbstbedienung. Nicht nur der Beginn im jüngeren Alter, sondern auch das durchschnittliche Überleben von mehr als 14 Monaten sind typisch für cJDV [18,19]. Es ist wahrscheinlich, dass Unterschiede im Überleben zwischen klassischer CJD und ihrer Variante teilweise mit dem jungen Alter der Patienten zusammenhängen.Die Natur selbst hat uns also die Möglichkeit gezeigt, Prionen mit einer verzögerten Expositionszeit als Waffen einzusetzen.Zu meinem größten Bedauern wurde 2011 während der experimentellen Arbeit zur Untersuchung der Creutzfeldt-Jakob-Krankheit bei Mäusen die Möglichkeit einer Infektion in der Luft mit Aerosolen, die Prionpartikel enthielten, gezeigt.Sind Prionen eine ideale biologische Waffe?
Was sind die Hauptvorteile:- Die Krankheit manifestiert sich verzögert, der Angreifer hat Zeit, möglichst viele Menschen zu infizieren. In diesem Fall sind alle Menschen in völliger Unwissenheit.
- Sie können die Infektion so leise stoppen, wie Sie sie starten. Das Auffinden von Spuren und der Infektionsquelle nach 5-7 Jahren wird unglaublich schwierig sein. Außerdem müssen Sie wissen, wonach Sie suchen müssen.
- . ,
- .
- , . . , .
- .
- . , [9]
Prionen sind die perfekte Technologie gegen Terror. Es gibt eine gut beschriebene Technologie zur Synthese pathogener Formen von Prionproteinen [13].Selbst wenn es für einen gewöhnlichen Terroristen schwierig wäre, ein biochemisches Labor zu organisieren, stört es niemanden, unzählige Tierherden zu verwenden, um eine große Menge an Hirnsubstanz mit CJD zu infizieren.Niemand und nichts wird die Terroristen davon abhalten, mit der Massensynthese von Prionproteinen zu beginnen und sie Milchpulver, Säuglingsnahrung, Hackfleisch, Schlachtnebenerzeugnissen, Sojabohnenmehl oder anderen Stoffen zuzusetzen, deren Produktionsanlage in ihrer Reichweite sein wird.Wenn wir uns vorstellen, dass ein talentierter Biochemiker gewaltsam oder aus finanziellen, ideologischen oder anderen Gründen in die Hände von Terroristen fällt, wird ihn niemand davon abhalten, ein Lipid-Protein-Aerosol mit Prionpartikeln zu synthetisieren. Sprühen Sie dann nicht nachweisbares Aerosol in Lüftungssysteme. Diese Methode ist schrecklicher als über die Nahrung, da der Nasen-Rachen-Knoten in enger Verbindung mit dem Gehirn steht und die Wahrscheinlichkeit einer Infektion um ein Vielfaches zunimmt.Stellen Sie sich die Auswirkungen einer Infektion vor. Nach 3-7 oder vielleicht allen 15 Jahren in einem unbegrenzten Gebiet beginnt die Massenentwicklung der Prionkrankheit des Gehirns. Panik, Entsetzen, Angst, Zerstörung. Ganze Städte von Menschen sind Zombies, deren Gehirn sich buchstäblich in einen Schwamm verwandelt. Es gibt keine Heilung, keine Hoffnung, nur den Schrecken eines unvermeidlichen bevorstehenden Todes.Fazit
Der Einsatz solcher Waffen ist nur eine Frage der Zeit. Daher müssen Sie jetzt eine Reihe von Schritten ausführen:- Führen Sie Forschungen zur Entwicklung zuverlässiger Nachweissysteme für pathologische Prionen in Lebensmitteln, Wasser und Luft durch und machen Sie diesen Test für den weltweiten Einsatz obligatorisch. Einführung von Prionprotein-Nachweissystemen.
- Suche nach Möglichkeiten zur Diagnose des Auftretens pathologischer Prionen beim Menschen. Es gibt gute Nachrichten, dass eine hochempfindliche Methode zum Nachweis pathologischer Prionen entwickelt wurde. [12]
- Suchen Sie nach einer Möglichkeit, eine Person zu heilen. Das scheint unglaublich schwierig, trotz vielversprechender Fortschritte bei Anti-Prion-Antikörpern, die die Blut-Hirn-Schranke überwinden können.
- Verfolgen Sie Massenfälle von Prionkrankheiten bei Tieren auf der Ebene von Spezialdiensten.
Neujahrswunsch
Ich möchte niemals ein einziges PrPSC-Molekül treffen!Ich suche nach einer Möglichkeit, einen hochsensiblen Diagnosetest durchzuführen - ein System, mit dem festgestellt werden kann, ob es uns bereits gelungen ist, uns zu infizieren ...Verweise auf Quellen1.
www.nobelprize.org/prizes/medicine/1976/gajdusek/biographical2. Gajdusek, DC; Zigas, V. (1957-11-14). «Degenerative Disease of the Central Nervous System in New Guinea». New England Journal of Medicine. 257 (20): 974–978.
3. Hussain Khan, CG Bio-medical Paradigm // Bio-social issues in health. General editor, RK Pathak. New Delhi: Northern Book Centre, 2008. — p. 15
4. Chandler RL (1961) Lancet, 1,1378–1379
5. Alper T., Cramp WA, Haig DA, and Clarke MC (1967) Nature, 214, 764–766.
6. Griffith JS (1967) Nature, 215,1043–1044.
7. Chesebro B., Race R., Wehrly K., Nishio J., Bloom M., Lechner D., Bergstrom S., Robbins K., Mayer L., Keith JM, et al. (1985) Nature,315, 331–333.
8. Prusiner SB (1982) Science, 216,136–144
9. Prusiner SB (1991) Science, 252,1515–1522
10. Prusiner SB (1993) Proc. Natl. Acad. Sci. USA Vol. 90, pp. 10962-10966, December 1993 Biochemistry
11. Saima Zafar et al., Handbook of Clinical Neurology, Vol. 165, 2019 (3rd series)
12. Serena Singh, Mari L. DeMarco JALM, January 2020
13. Nature Communications (2018) Chae Kim, Xiangzhu Xiao, Shugui Chen, Tracy Haldiman, Vitautas Smirnovas, Diane Kofskey, Miriam Warren, Krystyna Surewicz, Nicholas R. Maurer, Qingzhong Kong, Witold Surewicz & Jiri G. Safar Artificial strain of human prions created in vitro volume 9, Article number: 2166
14. Llewelyn CA, Hewitt PE, Knight RS, Amar K, Cousens S, Mackenzie J, Will RG. Possible transmission of variant Creutzfeldta Jakob disease by blood transfusion. Lancet. 2004;363:417-421.
15. Collinge J. Human prion diseases and bovine spongiform encephalopathy (BSE). Hum Mol Genet. 1997;6(10):1699-1705
16. Bateman D, Hilton D, Love S, Zeidler M, Beck J, Collinge J. Sporadic Creutzfeldt Jakob disease in a 18-year-old in the UK. Lancet. 1995; 346(8983):1155-1156.
17. Britton TC, al-Sarraj S, Shaw C, Campbell T, Collinge J. Sporadic Creutzfeldt—Jakob disease in a 16-year-old in the UK. Lancet. 1995; 346(8983): 1155.
18. Soomro S, Mohan Ch. Biomarkers for sporadic Creutzfeldt Jakob disease. Annals of Clinical and Translational Neurology. 2016;3(6):465-472.
19. Imran M, Mahmood S. An overview of human prion diseases. Virol J. 2011;8:559.