Pregúntele a Ethan No. 36: un asombroso electrón giratorio
El lector pregunta:Cuando leí tu respuesta sobre los láseres, recordé mi vieja pregunta sobre el principio de Pauli. Según tengo entendido, para dos electrones en una molécula de hidrógeno, los giros deben ser opuestos. ¿Significa esto que durante la formación de una molécula, los electrones cambian su giro, o solo los electrones con espines opuestos forman una molécula?
Hay mucho que decir sobre esto, así que comencemos con el principio de la prohibición de Pauli.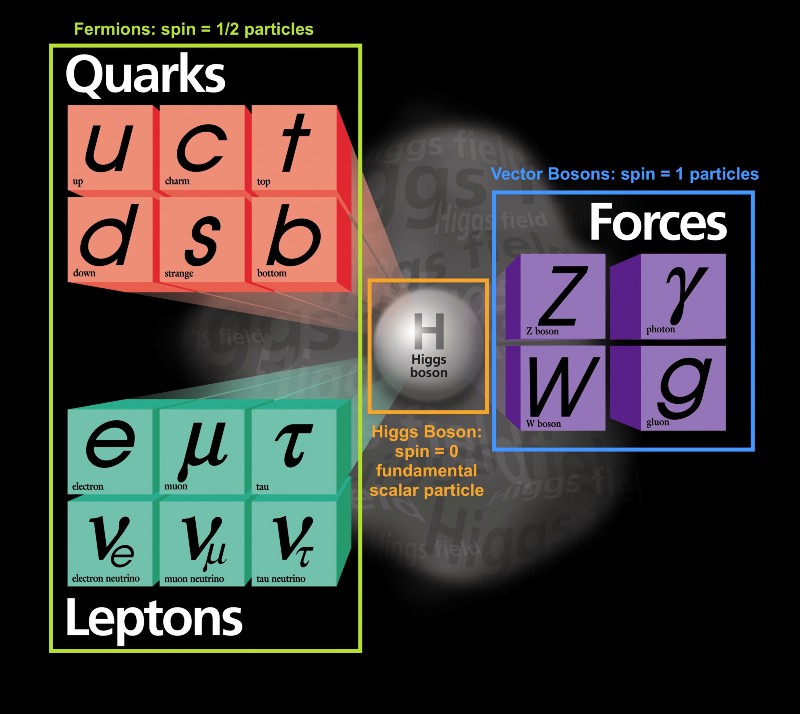 A pesar de la gran variedad de diferentes tipos de partículas elementales que existen en el Universo, todas se pueden dividir en dos tipos:
A pesar de la gran variedad de diferentes tipos de partículas elementales que existen en el Universo, todas se pueden dividir en dos tipos:- los fermiones son partículas con un giro de medio entero: ± 1/2, ± 3/2, ± 5/2, ..
- los bosones son partículas con un giro completo: 0, ± 1, ± 2, ..
Curiosamente, las partículas compuestas también se comportan como fermiones o como bosones. Los protones y los neutrones se comportan como fermiones con espines ± 1/2, como electrones. Cada partícula tiene un conjunto de estados cuánticos que puede ocupar, con niveles de energía discretos, momentos angulares, direcciones de giro, etc.La principal diferencia entre fermiones y bosones es que si tienes dos partículas idénticas, entonces puedes enviar tantos bosones en el mismo estado cuántico allí, pero los fermiones idénticos no pueden ocupar el mismo estado.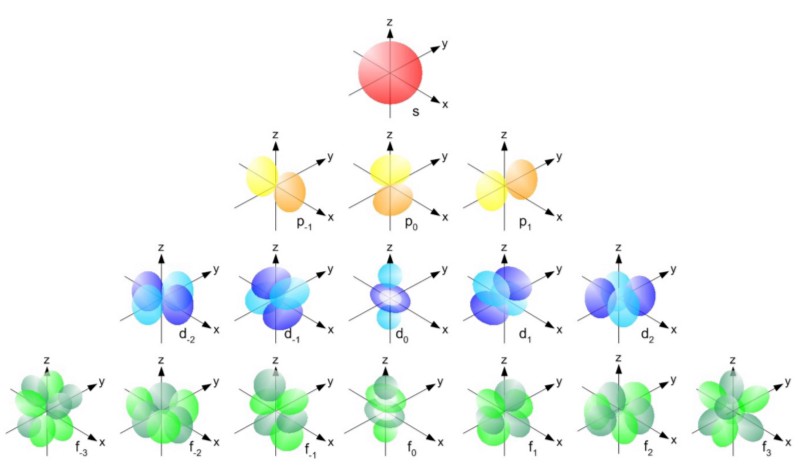 Si el electrón no era un fermión, sino un bosón, entonces cualquier átomo podría estar metido en cualquier átomo a cualquier nivel de energía inferior (rojo arriba). Pero un electrón es un fermión, por lo que obedece el principio de prohibición. Dos electrones pueden tomar el nivel mínimo de energía, ya que pueden tener giros +1/2 y -1/2, pero para agregar un tercer electrón, tienes que saltar a otro estado cuántico.Los estados cuánticos en los átomos están dispuestos de modo que pueda ir a un nivel de energía más alto (n en la imagen a continuación) y luego a estados con un momento angular más alto (l).
Si el electrón no era un fermión, sino un bosón, entonces cualquier átomo podría estar metido en cualquier átomo a cualquier nivel de energía inferior (rojo arriba). Pero un electrón es un fermión, por lo que obedece el principio de prohibición. Dos electrones pueden tomar el nivel mínimo de energía, ya que pueden tener giros +1/2 y -1/2, pero para agregar un tercer electrón, tienes que saltar a otro estado cuántico.Los estados cuánticos en los átomos están dispuestos de modo que pueda ir a un nivel de energía más alto (n en la imagen a continuación) y luego a estados con un momento angular más alto (l).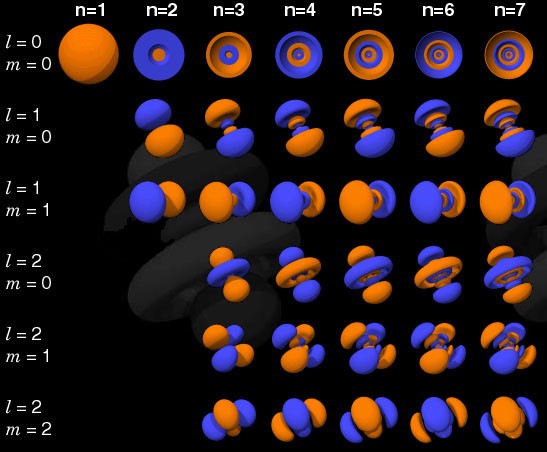 Por lo tanto, los estados l = 0 son orbitales s, l = 1 son orbitales p, l = 2 son orbitales d, y así sucesivamente. Por lo tanto, la tabla periódica tiene tal estructura: con dos elementos en la fila superior (n = 1, l = 0, m = 0 y spin = ± 1/2), 8 elementos en la segunda fila (n = 2, l = 0, m = 0, y spin = ± 1/2, yn = 2, l = 1, m = 1,0, o -1 y spin = ± 1/2), 18 elementos en la tercera fila, etc.
Por lo tanto, los estados l = 0 son orbitales s, l = 1 son orbitales p, l = 2 son orbitales d, y así sucesivamente. Por lo tanto, la tabla periódica tiene tal estructura: con dos elementos en la fila superior (n = 1, l = 0, m = 0 y spin = ± 1/2), 8 elementos en la segunda fila (n = 2, l = 0, m = 0, y spin = ± 1/2, yn = 2, l = 1, m = 1,0, o -1 y spin = ± 1/2), 18 elementos en la tercera fila, etc.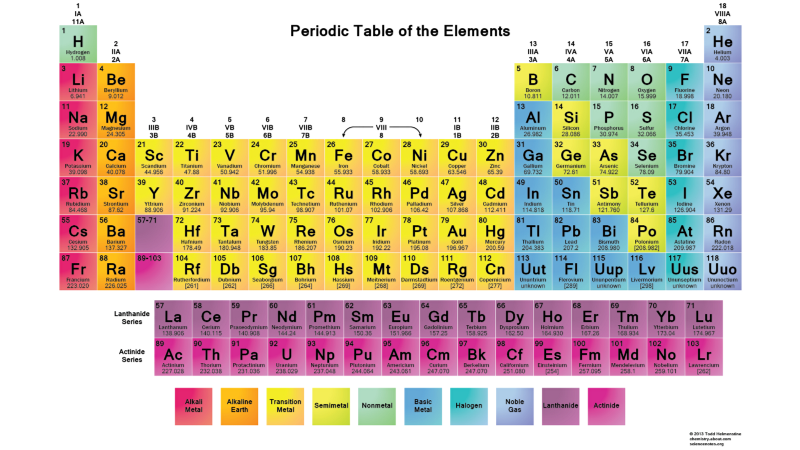 Por lo tanto, agregando 6, 10, 14, etc. adicionales Las ocurrencias con cada nueva fila de la tabla se deben al principio de Pauli.Y aunque no podemos distinguir un electrón de otro, ya que son idénticos, cada sistema atómico es único. En otras palabras, si tiene cuatro átomos de hidrógeno diferentes en el estado fundamental, no necesitarán ocupar diferentes niveles de energía.
Por lo tanto, agregando 6, 10, 14, etc. adicionales Las ocurrencias con cada nueva fila de la tabla se deben al principio de Pauli.Y aunque no podemos distinguir un electrón de otro, ya que son idénticos, cada sistema atómico es único. En otras palabras, si tiene cuatro átomos de hidrógeno diferentes en el estado fundamental, no necesitarán ocupar diferentes niveles de energía. En general, dado que los núcleos atómicos (protones) son diferentes entre sí (no están en el mismo núcleo o están en estados cuánticos superpuestos en ningún sentido), y los electrones están unidos a su protón (es decir, no están en estados cuánticos superpuestos entre sí), Lo más probable es que un sistema de átomos de hidrógeno libres esté organizado de tal manera que todos estén en un estado básico, algo como esto:
En general, dado que los núcleos atómicos (protones) son diferentes entre sí (no están en el mismo núcleo o están en estados cuánticos superpuestos en ningún sentido), y los electrones están unidos a su protón (es decir, no están en estados cuánticos superpuestos entre sí), Lo más probable es que un sistema de átomos de hidrógeno libres esté organizado de tal manera que todos estén en un estado básico, algo como esto: al menos, es aconsejable configurar su sistema de esta manera desde el principio. Pero si un par de tales átomos interactúan entre sí, se unirán y formarán una molécula de hidrógeno. Al igual que un átomo de hidrógeno en su estado fundamental es ligeramente más ligero (13,6 eV) que un protón libre y un electrón libre debido a la energía de unión, una molécula de hidrógeno es ligeramente más ligera (4,52 eV) que dos átomos de hidrógeno libres .Pero la pregunta se hizo correctamente. Dado que si dos átomos diferentes intentan reconectarse, las funciones de onda de los electrones intentarán superponerse entre sí.
al menos, es aconsejable configurar su sistema de esta manera desde el principio. Pero si un par de tales átomos interactúan entre sí, se unirán y formarán una molécula de hidrógeno. Al igual que un átomo de hidrógeno en su estado fundamental es ligeramente más ligero (13,6 eV) que un protón libre y un electrón libre debido a la energía de unión, una molécula de hidrógeno es ligeramente más ligera (4,52 eV) que dos átomos de hidrógeno libres .Pero la pregunta se hizo correctamente. Dado que si dos átomos diferentes intentan reconectarse, las funciones de onda de los electrones intentarán superponerse entre sí.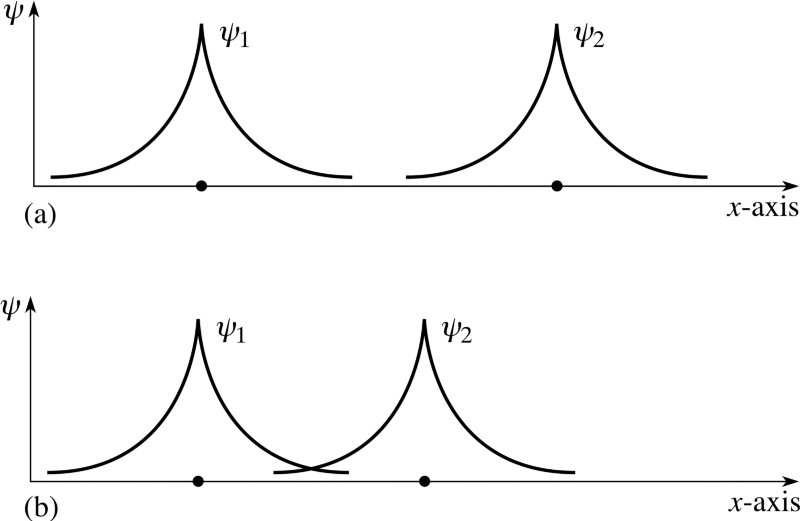 Pero los electrones no solo tienen giro, sino también funciones de onda espacial. Esto significa que ocupan espacio de una manera especial. Si juntamos dos átomos de hidrógeno, sus funciones de onda espacial pueden ser simétricas, como en el diagrama de arriba, o antisimétricas, como en el diagrama de abajo.
Pero los electrones no solo tienen giro, sino también funciones de onda espacial. Esto significa que ocupan espacio de una manera especial. Si juntamos dos átomos de hidrógeno, sus funciones de onda espacial pueden ser simétricas, como en el diagrama de arriba, o antisimétricas, como en el diagrama de abajo.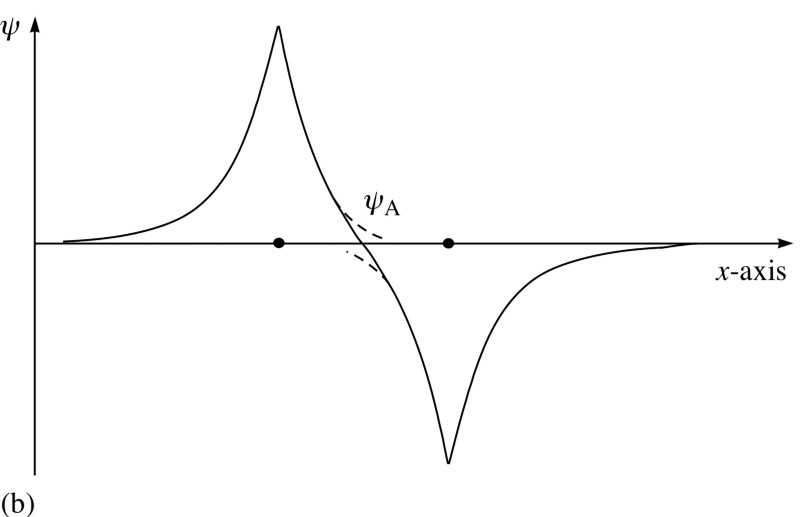 Y aquí entra en vigor el principio de Pauli.Si los átomos de hidrógeno se acercan a funciones de onda simétricas, entonces los giros de los electrones deben ser antidireccionales; si uno tiene un giro de +1/2, el segundo tiene un giro de -1/2, y viceversa.Y si dos átomos se acercan con funciones de onda antisimétricas, entonces los espines de los electrones deben estar alineados: si el primero es +1/2, el segundo también debería tener +1/2, y viceversa.Por lo tanto, los átomos de hidrógeno se pueden conectar de dos maneras: con funciones de onda simétrica y giros antidireccionales, o viceversa.
Y aquí entra en vigor el principio de Pauli.Si los átomos de hidrógeno se acercan a funciones de onda simétricas, entonces los giros de los electrones deben ser antidireccionales; si uno tiene un giro de +1/2, el segundo tiene un giro de -1/2, y viceversa.Y si dos átomos se acercan con funciones de onda antisimétricas, entonces los espines de los electrones deben estar alineados: si el primero es +1/2, el segundo también debería tener +1/2, y viceversa.Por lo tanto, los átomos de hidrógeno se pueden conectar de dos maneras: con funciones de onda simétrica y giros antidireccionales, o viceversa.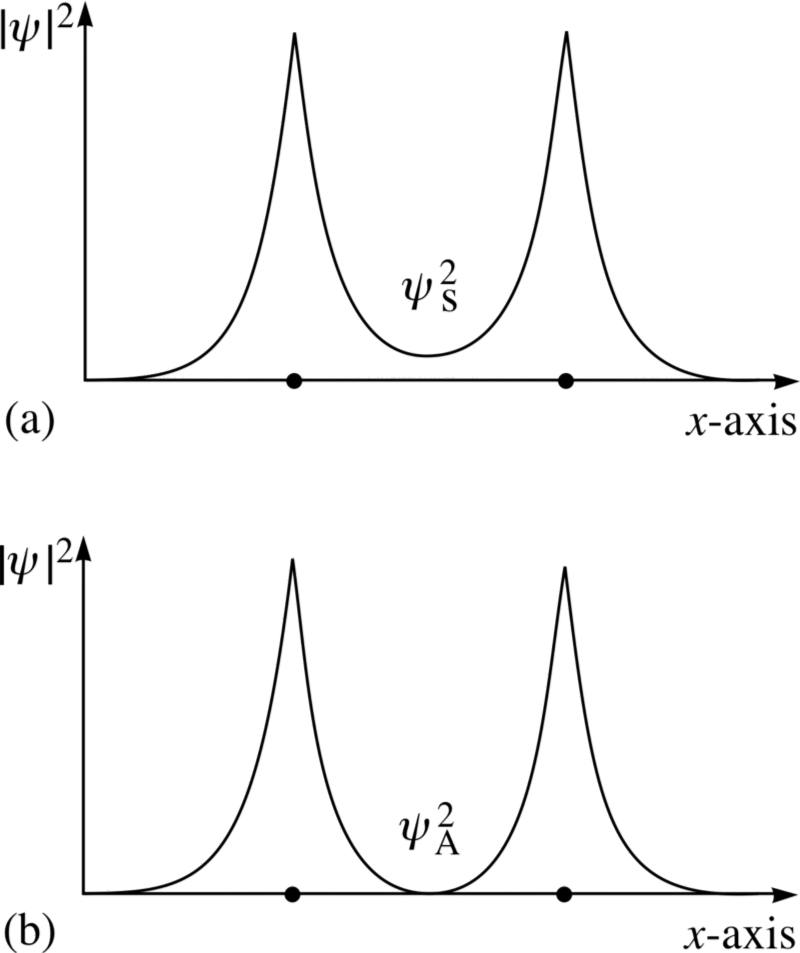 Eche un vistazo a estas dos combinaciones: en la parte superior, las funciones de onda se superponen, denotando la conexión, y en la parte inferior, no se superponen, lo que indica que este estado no está conectado.Podemos calcular cuál será la energía de enlace para estos dos estados.
Eche un vistazo a estas dos combinaciones: en la parte superior, las funciones de onda se superponen, denotando la conexión, y en la parte inferior, no se superponen, lo que indica que este estado no está conectado.Podemos calcular cuál será la energía de enlace para estos dos estados.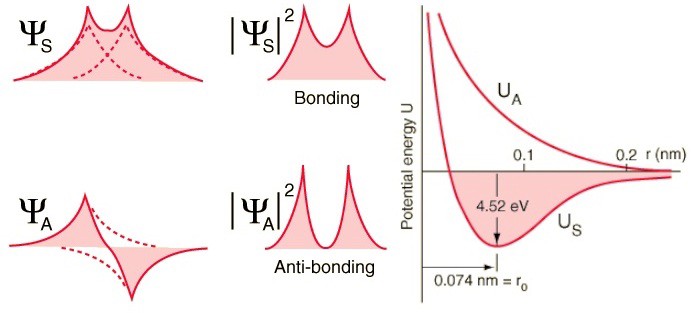 En un estado antisimétrico, donde los espines de los electrones están alineados, los átomos no se formarán. Solo en un estado simétrico, donde las funciones de onda espacial son simétricas y los espines están dirigidos en sentido opuesto, se puede formar una molécula de hidrógeno.Por lo tanto, para formar una molécula, necesita dos átomos de hidrógeno con funciones de onda espacial simétrica y giros multidireccionales (+1/2 y -1/2). Y además, puedes ver cómo la mecánica cuántica te prohíbe empujar un tercer átomo de hidrógeno en él; por lo tanto, puedes hacer un átomo de H, una molécula de H2, pero nunca H3.
En un estado antisimétrico, donde los espines de los electrones están alineados, los átomos no se formarán. Solo en un estado simétrico, donde las funciones de onda espacial son simétricas y los espines están dirigidos en sentido opuesto, se puede formar una molécula de hidrógeno.Por lo tanto, para formar una molécula, necesita dos átomos de hidrógeno con funciones de onda espacial simétrica y giros multidireccionales (+1/2 y -1/2). Y además, puedes ver cómo la mecánica cuántica te prohíbe empujar un tercer átomo de hidrógeno en él; por lo tanto, puedes hacer un átomo de H, una molécula de H2, pero nunca H3.
Source: https://habr.com/ru/post/es386011/
All Articles