¿Qué causa las diferencias entre baterías y supercondensadores?
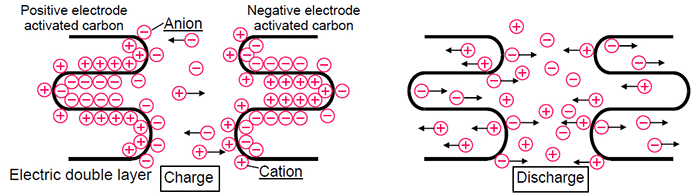
Hoy en día, las fuentes de energía electroquímica se usan en todas partes y tienen características distintivas: capacidad o la cantidad de energía almacenada, así como energía, o la capacidad de transferir o acumular rápidamente esta energía (descarga / carga a altas corrientes). Además, la seguridad y la longevidad son muy importantes para las baterías. En esta publicación, le diré cómo las baterías y los supercondensadores difieren a nivel químico, y cómo esto afecta sus características técnicas.Comenzaré con las baterías. Hoy en día, las baterías de iones de litio y de hidruro de níquel-metal (NiMH) se usan con mayor frecuencia, pero las baterías de iones de litio están reemplazando gradualmente a NiMH por varias razones. En primer lugar, las baterías de iones de litio consumen más energía. Esto se debe al hecho de que, en comparación con los electrolitos alcalinos NiMH, que limitan el voltaje de la celda a 1.2 V, los electrolitos de las baterías basadas en carbonato de iones de litio proporcionan un voltaje de 3V. Y esto significa que se necesitan menos celdas para lograr un cierto voltaje, así como tamaños más compactos, lo cual es simplemente necesario para los dispositivos electrónicos portátiles modernos. Y, lo más importante, en comparación con NiMH, que utiliza aleaciones con metales de tierras raras, las baterías de iones de litio contienen materiales más baratos.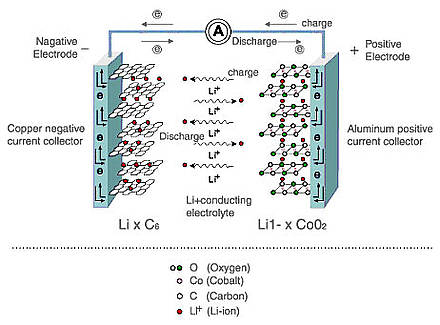
Linden's Handbook of Batteries, cuarta edición,
IEEE TRANSACTIONS ON POWER ELECTRONICS, vol. 24, N ° 2, 2009
J. Electrochem Soc., Vol. 145, N ° 10, 1998
BE Conway, Supercapacitores electroquímicos: fundamentos científicos y aplicaciones tecnológicas, 1999
Source: https://habr.com/ru/post/es397915/
All Articles