¿Es posible hacer una fuente de energía comestible o el principio de funcionamiento de una pila de combustible abiótica? Parte 1: Teoría
En Internet hay muchas instrucciones sobre cómo hacer baterías "comestibles" a partir de limones, etc. Pero la comestibilidad de tales dispositivos está en duda, ya que los electrodos, como regla, son placas de metal (generalmente zinc y cobre), y solo el electrolito, cuyo papel es el limón, es comestible. Recientemente, me pregunté, ¿es posible crear una batería totalmente comestible?Explicaré de inmediato que la batería no debe ser de biocompatibles, sino de componentes comestibles. Por supuesto, sería fácil hacer un supercondensador comestible a partir de carbón activado, pero, como saben, el consumo de energía de los supercondensadores es muy bajo en comparación con las baterías.La principal dificultad de tal idea es encontrar electrodos / colectores de corriente adecuados. Primero, es necesario que el material comestible posea buena conductividad, y segundo, podría participar en reacciones electroquímicas. Y lo primero que viene a la mente cuando piensas en conductores comestibles son los colorantes alimentarios E174 y E175, también son alimentos de oro y plata. Pero, ¿en qué reacciones electroquímicas se pueden usar estos materiales si están cerca uno del otro en una serie electroquímica de voltajes? Pero aquí debemos recordar que el oro y la plata tienen actividad electrocatalítica. ¿Dónde se utilizan los catalizadores en las fuentes de alimentación electroquímicas? En pilas de combustible!¿Cómo funciona una pila de combustible? Al igual que otras fuentes de energía electroquímica, las celdas de combustible tienen dos electrodos sumergidos en un electrolito. Pero a diferencia de las baterías y los supercondensadores, estos electrodos no son materiales activos, sino catalizadores en los que se produce la oxidación del "combustible", que se suministra desde el exterior, y la reducción del oxidante. Por ejemplo, en el ejemplo clásico de una celda de combustible de hidrógeno, el combustible es hidrógeno y el agente oxidante es oxígeno. Por cierto, en comparación con otras fuentes de energía electroquímica, por ejemplo, baterías y supercondensadores, las celdas de combustible son las más intensivas en energía, ya que funcionan mientras se suministran reactivos a los electrodos. Pero su desventaja es la baja potencia, limitada por la velocidad de las reacciones electroquímicas y la velocidad de suministro de combustible y oxidante a los electrodos.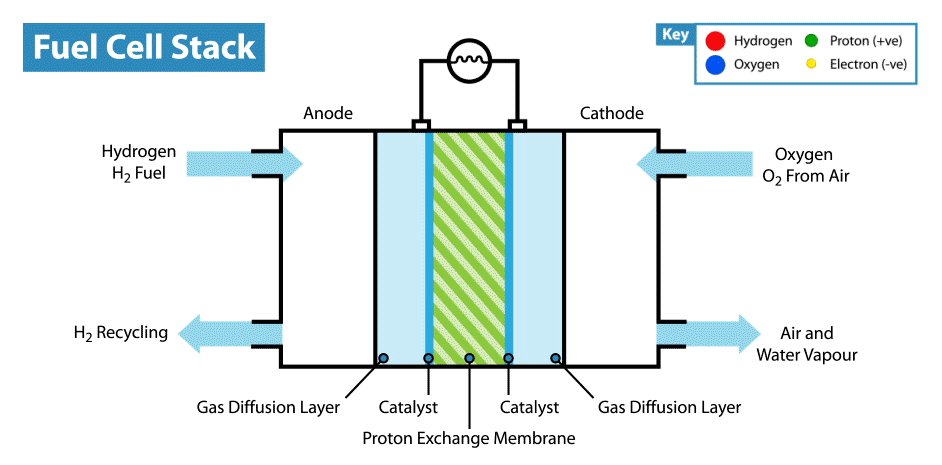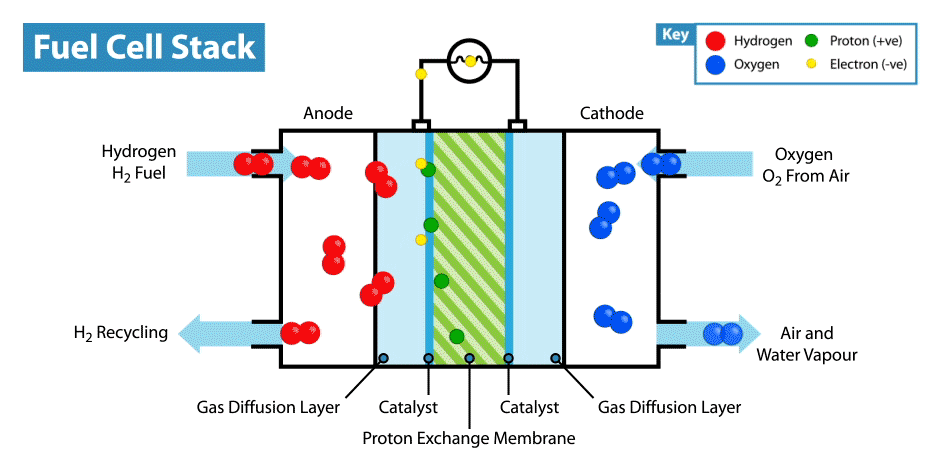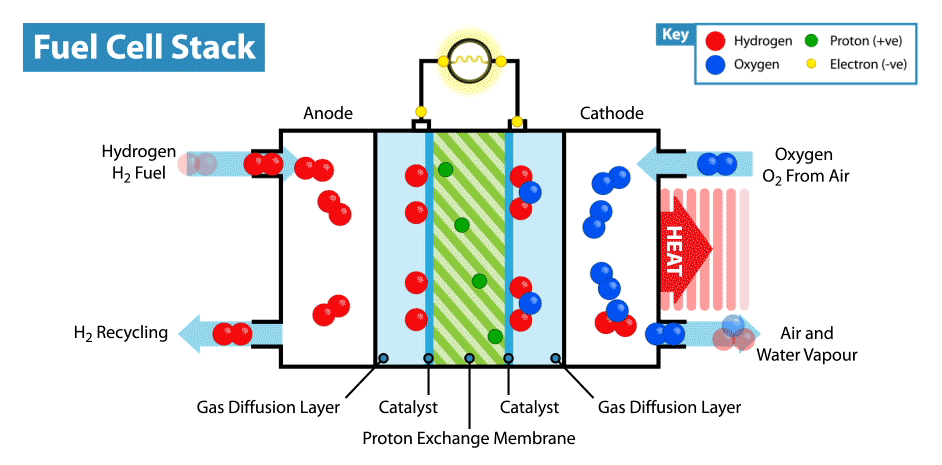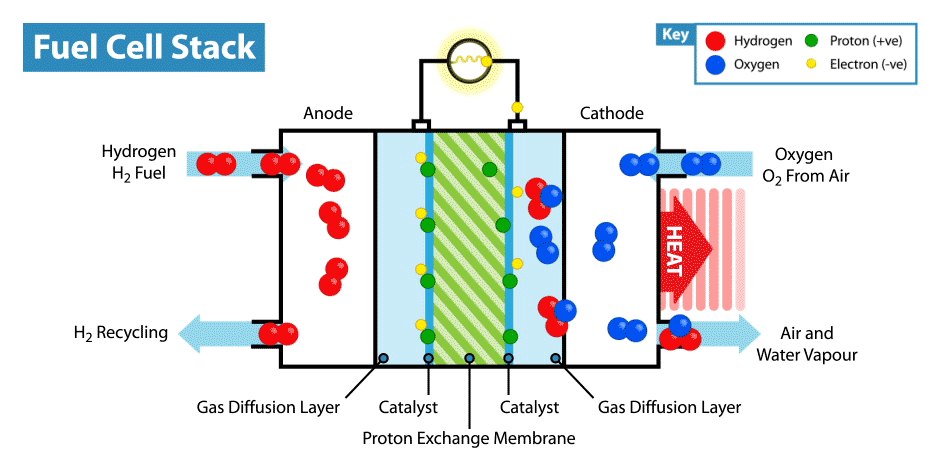

Source: https://habr.com/ru/post/es398091/
All Articles