 Cristales líquidos en la fase nemática
Cristales líquidos en la fase nemáticaProbablemente estudiaste que una sustancia puede estar en tres
fases termodinámicas : sólida, líquida y gaseosa. (El término "fase" se usa junto con el término "estado", y ninguno de ellos tiene una definición clara y universalmente aceptada). Para los jóvenes estudiantes, esta es una simplificación útil, pero en realidad hay muchas más fases. En los últimos cien años, hemos descubierto la existencia de cientos de fases sólidas diferentes, algunas de las cuales se utilizan para crear chips de silicio en su computadora. Además, hay docenas de fases de cristales líquidos, algunas de ellas crean imágenes en su pantalla. Y ni siquiera hemos tocado cosas realmente exóticas: fases cuánticas, líquidos superfluidos, plasma de quarks-gluones, condensados de Bose-Einstein, etc. "Fases topológicas".
Pero primero, volvamos al principio y discutamos qué es la "fase". Como muchos conceptos fundamentales, se explica mejor con un ejemplo. Considere un vaso de agua en el que flotan unos cubitos de hielo. Solo hay una sustancia en un vaso: agua. Muchas moléculas de H2O.
Y aunque las moléculas de hielo son idénticas a las moléculas en el agua circundante, obviamente hay una gran diferencia entre ellas. Lo más obvio es que uno de ellos es sólido, conserva su forma, mientras que el otro fluye libremente y toma la forma de un vaso. También hay una diferencia de densidad, conductividad eléctrica y muchas otras propiedades. Por lo tanto, decimos que el agua líquida y el hielo son fases diferentes de la misma sustancia. (El agua es la única sustancia que una persona encuentra en tres fases diferentes constantemente. Esta es una de las razones por las cuales el agua es una sustancia especial).
¿Cómo es que el hielo y el agua exhiben un comportamiento completamente diferente? Puede sentirse tentado a decir que todo depende de la temperatura: el agua está tibia, el hielo está frío y, por eso, las moléculas de agua se comportan de manera diferente. Pero a 0 ° C y la presión atmosférica normal, el hielo y el agua líquida son estables, es decir, pueden existir indefinidamente y no cambiar.
Pero si la diferencia clave no es la temperatura, ¿entonces qué?
Escala grande y pequeña
Los científicos han estado discutiendo durante mucho tiempo la relación entre las propiedades macroscópicas de varios materiales y la disposición microscópica de las partículas de las que están hechas. Uno de los primeros intentos fue realizado en 1611 por Johannes Kepler en el trabajo con el hermoso título: "Copo de nieve hexagonal: regalo del Año Nuevo". Kepler argumentó que la simetría seis veces mayor de los copos de nieve puede explicarse suponiendo que el hielo se crea a partir de pequeñas esferas empaquetadas en conjuntos hexagonales.
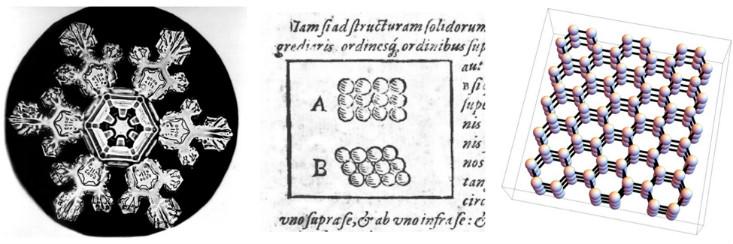
Ahora sabemos que la suposición de Kepler sobre la disposición especial de los átomos era ligeramente incorrecta: su esquema no refleja la forma tridimensional y la interacción compleja de las moléculas de agua. (A su favor, digamos que la química aún no se inventó, y la existencia de átomos finalmente se demostró casi 300 años después). Sin embargo, estaba en el camino correcto. La simetría de los copos de nieve de seis veces proviene del hecho de que las moléculas de agua se alinean en una estructura tridimensional con una simetría de seis veces (y también hay
cristales de nieve triangulares , y nadie sabe exactamente por qué).
En el lenguaje de la física moderna, Kepler sugirió que la nieve es un sólido cristalino, una fase de la materia que obtiene sus propiedades debido al hecho de que sus átomos o moléculas se alinean en filas periódicas, o redes cristalinas. Los físicos usan la palabra "cristal" para describir la estructura microscópica, sin importar si el material parece un diamante, un grano de arena o un copo de nieve. Por lo tanto, para el físico, muchos metales y cerámicas son cristales, porque sus átomos o moléculas están dispuestos en una red periódica, en una cierta versión tridimensional de los dibujos de Kepler de 1611.
Esto explica el hielo en un vaso de agua. ¿Qué pasa con el agua líquida? En cualquier sustancia, a temperaturas superiores al cero absoluto (-273 ° C), las moléculas se mueven constantemente y rebotan en la palabra bolas de billar después de una fuerte descomposición. La temperatura de una sustancia es una medida de la velocidad de movimiento de las moléculas.
En un líquido, este movimiento térmico aleatorio es lo suficientemente fuerte como para superar las fuerzas que mantienen las moléculas en la red. Y sin esta red, las moléculas pueden moverse mucho más libremente. Esto explica por qué el líquido sucumbe cuando lo empuja con el dedo, y el hielo no. Curiosamente, hay sustancias, en particular vidrios para ventanas, con una microestructura completamente aleatoria, pero a nivel macroscópico se comportan, sin embargo, como sólidos. Comprender su comportamiento es la más importante de las preguntas abiertas de la física de los materiales.
Fases fantasticas
En materiales tridimensionales, como el hielo real, y no como en los bocetos de Kepler, todo se vuelve más complicado, porque en tres dimensiones hay muchas formas de organizar las moléculas en estructuras periódicas. Por ejemplo, hay aproximadamente 17 fases de hielo (aproximadamente porque este número depende de cómo clasificarlas), la más nueva de las cuales fue creada y estudiada por científicos italianos el año pasado. Se producen diferentes fases a diferentes temperaturas y presiones, y aunque todas son sólidas, cada una de ellas tiene su propia densidad, resistencia, reacción a los campos eléctricos y magnéticos, conductividad térmica, etc. Debido a la existencia de estas diferencias en el comportamiento macroscópico, las llamamos diferentes fases. En condiciones "normales" (temperatura y presión sobre la superficie de la Tierra), el hielo generalmente tiene la forma de "hielo I
h ". Esta forma cristalina hexagonal estable es precisamente responsable de la simetría de seis veces de los copos de nieve.
Según las etiquetas de las diversas fases del hielo, el hielo IX existe realmente. Afortunadamente, a temperatura y presión en la superficie de la Tierra, es mucho más frágil que el otro "hielo nueve", la fase estable, por la cual> los océanos se endurecieron catastróficamente en la novela "Cuna para el gato" de Kurt Vonnegut.
Y eso no es todo, incluso con una sustancia tan familiar. Pueden existir otras fases de hielo aún no descubiertas a presiones ultra altas en los centros de gigantes gaseosos como Urano y Neptuno. En condiciones tan extremas, a una presión de 10 millones de atm. y más, el agua debe formar fases sólidas cristalinas muy extrañas. Entre ellos hay una fase conductora de metal, que debería verse brillante si descubres cómo pulirla.
Opciones intermedias
La conexión entre la microestructura y las macropropiedades es la idea principal de la ciencia y la ingeniería, se utiliza en el desarrollo de muchos materiales. Por ejemplo, los cristales líquidos son un componente clave de las computadoras portátiles, televisores y pantallas de teléfonos inteligentes. Las moléculas de cristal líquido tienen una estructura inusualmente larga que se asemeja a un palo. Debido a esto, pueden estar en varias fases diferentes, con propiedades que no se encuentran en los materiales convencionales.
Por ejemplo, a altas temperaturas, las moléculas están en desorden. Cada "barra" está en un lugar aleatorio, como las moléculas en agua líquida, y está orientada en una dirección arbitraria. Esta es una fase isotrópica. A temperaturas más bajas, las moléculas pueden entrar en la fase nemática, en la que se ubican al azar, como en el agua líquida, pero dirigidas en la misma dirección. Como no se forma una red, la fase nemática fluye como un líquido, pero dado que las barras se dirigen en una dirección, tiene un orden microscópico. Por lo tanto, se llaman "cristales líquidos".
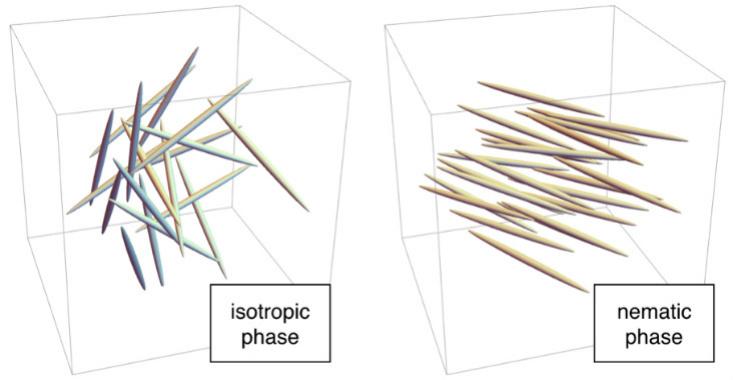
Afortunadamente para los humanos modernos, la fase nemática tiene propiedades inusuales asociadas con la dirección. Cuando se golpea en un campo eléctrico, las moléculas se alinean a lo largo de él. En las pantallas LCD, las moléculas en la fase nemática se comportan como un filtro polarizador: un dispositivo que transmite luz cuando las moléculas están orientadas de una manera especial (por ejemplo, de arriba hacia abajo) y la retrasa cuando están orientadas perpendicularmente. Dado que se necesita un filtro polarizador para dicho trabajo, el filtro se coloca entre la fuente de luz y la pantalla en los teléfonos y pantallas. En la pantalla LCD, pequeños electrodos al lado de cada píxel crean un campo eléctrico que controla la posición de las moléculas en su interior y, por lo tanto, la emisión de luz. Este esquema de trabajo se utiliza en pantallas IPS ("conmutación en el plano"). Hay otras opciones, por ejemplo, pantallas TN que usan una fase nemática retorcida aún más exótica.
Modelando una miniatura
Está claro que la microestructura ayuda a explicar las propiedades de los materiales que encontramos y creamos. ¿Pero podemos ver el orden microscópico en la vida real? Para sustancias ordinarias, como hielo, sal o metal, esto es difícil porque los átomos y las moléculas son muy pequeños. Una molécula de agua mide menos de una billonésima parte de un metro: no se puede ver en un microscopio óptico convencional, y es muy difícil de ver incluso utilizando técnicas microscópicas modernas.
Afortunadamente, no solo los átomos y las moléculas pueden organizarse independientemente en fases. En el laboratorio de Chaikin en el Centro de Investigación de Materiales Blandos de la Universidad de Nueva York, utilizamos pequeñas esferas duras para estudiar las fases de la materia. Se llaman coloides, y pueden estar hechos de varios materiales, como vidrio, plástico o metal. Los coloides en el laboratorio son 3.000 veces más grandes que las moléculas de agua: son comparables en tamaño a las bacterias o núcleos de células animales. Para los especialistas en materiales, los coloides son algo así como "partículas ideales": lo suficientemente grandes como para ser visibles bajo un microscopio, y lo suficientemente pequeños como para formar fases que son en gran medida similares a los materiales ordinarios.
 Esta foto muestra coloides plásticos recubiertos con una composición química, debido a que se repelen, estando en la superficie del agua.
Esta foto muestra coloides plásticos recubiertos con una composición química, debido a que se repelen, estando en la superficie del agua.En nuestro laboratorio, fabricamos coloides con un recubrimiento especial que les permite adherirse a la superficie del agua. Cuando se adhieren a las gotas, podemos tomar hermosas microfotografías, como esta. Puede ver la estructura microscópica de las diversas fases en ellos, y cómo su orientación conduce a la aparición de propiedades macroscópicas como la dureza. Por ejemplo, ahora estamos estudiando cómo cambia el comportamiento de nuestras partículas dependiendo del uso de gotas esféricas o superficies planas de agua. ¿La presencia de partículas en una esfera ayuda o dificulta la formación de cristales y la aparición de sistemas como un sólido? Esto puede ayudarnos a comprender las propiedades de estructuras importantes que tienen una forma esférica o más compleja. Si, por ejemplo, supiéramos más sobre los recubrimientos proteicos que protegen los genes del VIH, podríamos aprender cómo descomponerlos y vencer al virus.
Cuando los cristales van mal
Una de las etapas más importantes del estudio del orden microscópico es el estudio de las condiciones bajo las cuales se altera el orden. Por ejemplo, si observa la imagen de coloides en la red cristalina, notará que su orden es heterogéneo. Puedes ver imperfecciones e irregularidades, defectos.
 La imagen se tomó con un microscopio confocal: se agrega una pintura fluorescente a la muestra, que luego se ilumina con un láser
La imagen se tomó con un microscopio confocal: se agrega una pintura fluorescente a la muestra, que luego se ilumina con un láserDefectos similares ocurren en cristales de átomos o moléculas, y juegan un papel importante. Por ejemplo, determinan la fragilidad de un material: qué tipo de carga puede soportar antes de que se rompa. Además, dado que los defectos pueden afectar la conductividad eléctrica de un material, los fabricantes de semiconductores gastan miles de millones de dólares en la producción de cristales únicos de silicio, bloques gigantes de silicio que casi no tienen defectos. Por otro lado, a veces estos defectos microscópicos son muy útiles. Investigaciones recientes se han centrado en el manejo y control de defectos en el grafeno para optimizarlo como un filtro para la desalinización.
Utilizamos cristales coloidales para observar cómo aparecen, se mueven e interactúan los defectos entre sí. Al igual que los estudios de fase, el estudio de los cristales coloidales puede ayudarnos a comprender los defectos en otros materiales. Como en muchas áreas de la vida, a veces las imperfecciones son la parte más interesante.