
Cuando se excede una cierta temperatura, la celda queda inutilizable y muere. Una de las explicaciones más simples para tal intolerancia al calor es que las proteínas necesarias para la vida son aquellas que extraen energía de los alimentos o la luz solar, se defienden de intrusiones, destruyen desechos, etc. - A menudo tienen una forma sorprendentemente precisa. Comenzando como largas hebras, se tuercen en forma de espirales, "horquillas" y otras formas dictadas por la secuencia de sus componentes. Y estas formas juegan un papel muy importante en sus actividades. Pero cuando la temperatura comienza a aumentar, los enlaces que sostienen las estructuras proteicas se rompen: primero los más débiles y luego los más fuertes. Es lógico que la pérdida de propagación de la estructura de la proteína sea letal, pero hasta hace poco, los detalles de cómo exactamente esto mata las células sobrecalentadas no estaban claros.
Ahora, los biofísicos de la Escuela Técnica Superior Suiza de Zurich han estudiado el comportamiento de cada proteína en las células de cuatro organismos diferentes con el aumento de la temperatura. Este estudio y la rica colección de datos
publicados en la revista Science mostraron que a una temperatura suficiente para la muerte de una célula - células humanas o Escherichia coli E. coli - solo se destruyen unas pocas proteínas clave. Además, la abundancia de proteínas en las células se asoció inesperadamente con su estabilidad. Los estudios han permitido a los científicos familiarizarse rápidamente con las reglas fundamentales mediante las cuales se construye el trabajo de las proteínas y su ordenación, y las consecuencias de las cuales, como quedó claro, se extienden mucho más allá de la simple muerte por calor.
Paola Piccotti , la biofísica que dirigió el trabajo, explicó que los experimentos fueron impulsados por viejas preguntas sin resolver: ¿por qué algunas células sobreviven a altas temperaturas, mientras que otras mueren? La bacteria Thermus thermophilus vive felizmente en aguas termales y en calentadores domésticos [a una temperatura óptima de 65 ° C - aprox. trans.], mientras que las células de E. coli languidecen a temperaturas superiores a 40 ° C. Evidencia convincente sugiere que el punto aquí es la diferente estabilidad de las proteínas de estos organismos. Pero hacer un seguimiento de la proteína en una célula viva, que sería un método ideal de estudio, es muy inconveniente. El aislamiento de la proteína en un tubo de ensayo no da todas las respuestas, porque dentro del cuerpo las proteínas se unen y afectan la química de las demás, o se apoyan mutuamente en la forma necesaria. Para comprender exactamente qué y por qué se está desmoronando, es necesario observar las proteínas en un momento en que todavía se están afectando entre sí.
Como el calor destruye las proteínas
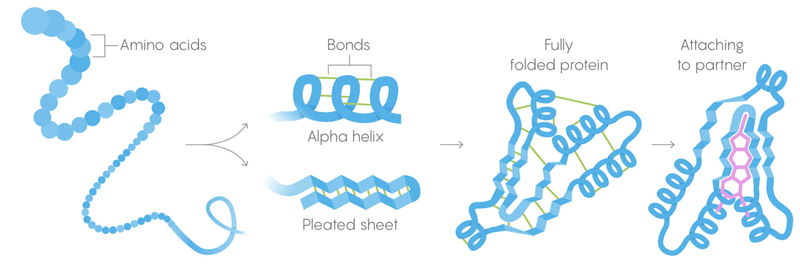 1) La estructura primaria de las proteínas son largas cadenas de aminoácidos, combinadas en secuencias dadas por genes.
1) La estructura primaria de las proteínas son largas cadenas de aminoácidos, combinadas en secuencias dadas por genes.
2) La estructura secundaria es un aminoácido que también se pliega en configuraciones mantenidas por enlaces intermoleculares débiles.
3) Estructura terciaria: enlaces débiles que estabilizan la ubicación de secciones rectas y retorcidas de la estructura tridimensional de la proteína. Su ubicación permite que la proteína se una a las moléculas deseadas.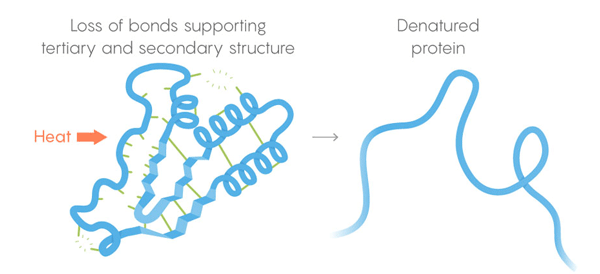 Muerte termal. Los enlaces débiles pierden su capacidad de retener estructuras terciarias y secundarias, y la desnaturalización de las proteínas, es decir, se desarrolla. Pero no todas las proteínas se desarrollan a la misma temperatura: el entorno de la proteína en la célula puede proporcionarle una estabilización adicional.
Muerte termal. Los enlaces débiles pierden su capacidad de retener estructuras terciarias y secundarias, y la desnaturalización de las proteínas, es decir, se desarrolla. Pero no todas las proteínas se desarrollan a la misma temperatura: el entorno de la proteína en la célula puede proporcionarle una estabilización adicional.Para resolver la tarea, el equipo desarrolló un procedimiento de monitoreo automatizado. Cortan las células y calientan su contenido en etapas, liberando en cada etapa las enzimas que separan las proteínas. Estas enzimas son especialmente buenas para cortar proteínas desplegadas, por lo que los investigadores basados en los restos de las proteínas cortadas podrían juzgar qué proteínas se desmoronaron a una temperatura dada. Por lo tanto, pudieron construir curvas de desnaturalización para cada una de las miles de proteínas estudiadas. Los arcos de las curvas van desde la estructura intacta de la proteína a una temperatura confortable para alcanzar un estado completamente desarrollado a alta temperatura. Para buscar diferencias entre las curvas de diferentes especies de seres vivos, se realizaron experimentos en las células de humanos, E. coli, T. thermophilus y levadura. "El estudio fue hermoso", dijo
Alan Drummond , biólogo de la Universidad de Chicago, refiriéndose tanto a la escala como a la precisión del proceso.
Durante las observaciones, se vio claramente que las proteínas de todos los seres vivos no se desenrollan todas a la vez con el aumento de la temperatura. "Vimos que solo un pequeño subconjunto de proteínas colapsó en las primeras etapas", dijo Piccotti, "y estas fueron proteínas clave". En un diagrama con entrelazado de enlaces proteína-proteína, las proteínas más frágiles de este pequeño subconjunto a menudo tenían una gran cantidad de enlaces, lo que significa que afectan muchos procesos que ocurren en las células. "Sin estas proteínas, las células no pueden funcionar", dijo Piccotti. "Cuando desaparecen, toda la red se destruye". Y con ello, obviamente, la vida de la célula se detiene.
Esta paradoja, las proteínas más importantes que resultan ser las más frágiles, puede ser un reflejo de cómo la evolución las creó para realizar las tareas correspondientes. Si una proteína tiene muchos roles, su inestabilidad y su tendencia a expandirse y colapsarse puede ser una ventaja, ya que puede permitirle tomar diferentes formas, adecuadas para diferentes tareas. "Muchas de estas proteínas clave tienen una gran flexibilidad, lo que las hace menos estables", pero al mismo tiempo les otorga la capacidad de unirse a diversas moléculas objetivo en la célula, explicó Piccotti. “Lo más probable es que así es como hacen frente a sus funciones. Esto es un compromiso ”.
Habiendo estudiado cuidadosamente E. coli, para la cual los datos recopilados fueron de la más alta calidad, los investigadores encontraron una relación entre la abundancia de proteínas, el número de copias en la célula, y su estabilidad. Cuantas más copias haga una proteína de una célula, más temperatura se necesita para destruirla. Resulta que una gran cantidad de copias no se correlaciona con la criticidad de la proteína para la supervivencia. Algunas proteínas clave son muy raras. Esta conexión entre abundancia y confiabilidad confirma la idea presentada por Drummond hace diez años: el sistema celular que produce proteínas tiende a cometer errores de vez en cuando. El error generalmente desestabiliza la proteína. Si se encuentra que esta proteína es abundante, y dicha proteína aparece en la célula cien o mil veces al día, las copias dobladas incorrectamente producidas en grandes cantidades pueden obstruir la célula. Por lo tanto, sería beneficioso que el cuerpo evolucione para que las proteínas más abundantes sean también las más estables, como lo confirman los datos obtenidos por el equipo de Piccotti.
Para comprender qué cualidades de una proteína la hacen estable, los investigadores compararon los datos de E. coli y T. Thermophilus. Las proteínas de E. coli comenzaron a desmoronarse a 40 ° C y se degradaron casi por completo a 70 ° C. Pero a esta temperatura, las proteínas de T. thermophilus apenas comenzaban a sentir molestias, algunas de ellas mantenían su forma incluso a 90 ° C. El equipo descubrió que T. thermophilus generalmente tenía proteínas más cortas, y algunos tipos de formas y componentes de proteínas eran más comunes en los más estables.
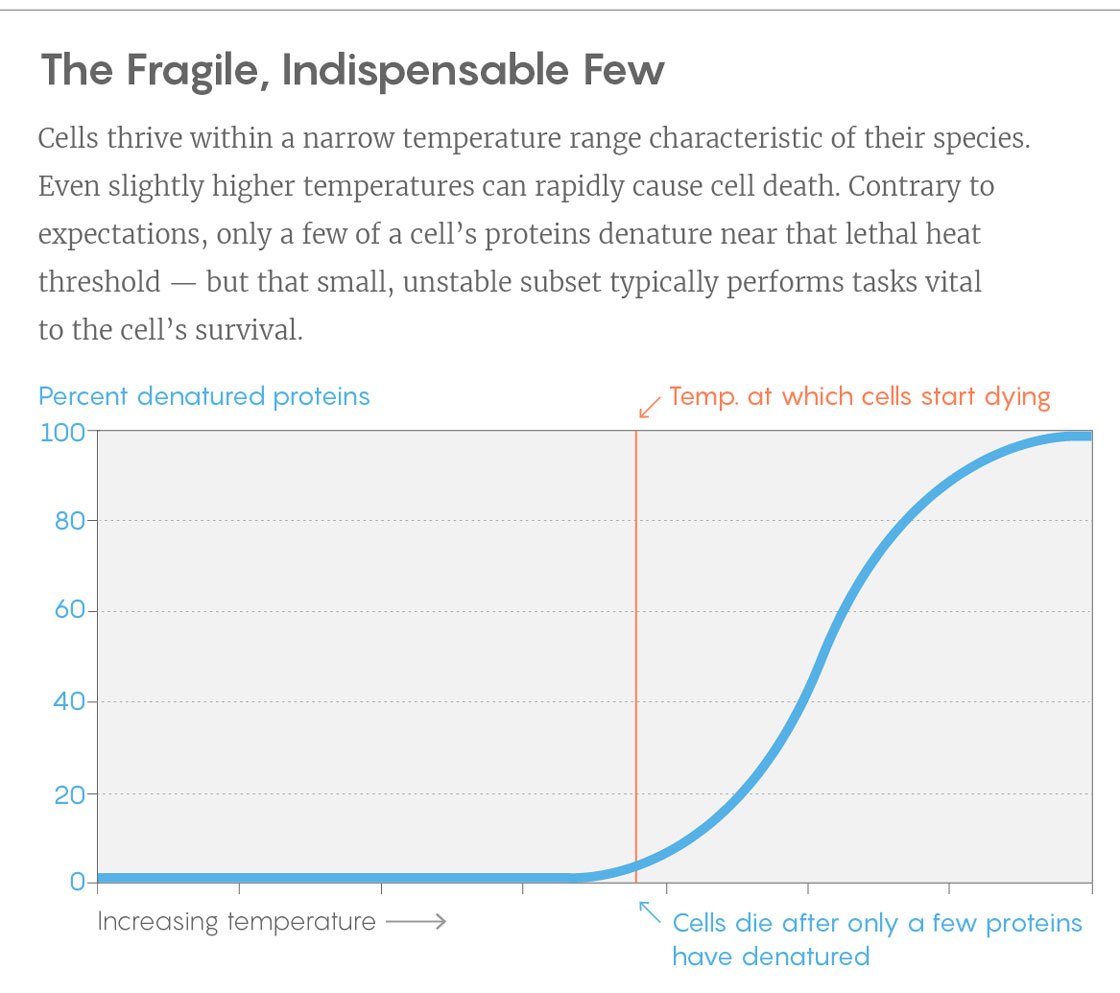 Un ejemplo de una curva de un experimento. Vertical - porcentaje de proteínas desplegadas, horizontal - temperatura. La barra vertical es la temperatura a la cual las células comienzan a morir. Para hacer esto, cambie algunas proteínas clave.
Un ejemplo de una curva de un experimento. Vertical - porcentaje de proteínas desplegadas, horizontal - temperatura. La barra vertical es la temperatura a la cual las células comienzan a morir. Para hacer esto, cambie algunas proteínas clave.Los descubrimientos pueden ayudar a los investigadores a desarrollar proteínas cuya estabilidad se adapte a sus necesidades. En muchos procesos industriales donde se usan bacterias, el aumento de la temperatura aumenta el retorno, pero muy pronto las bacterias comienzan a morir por el calor. Sería interesante saber si podemos estabilizar las bacterias al hacer que las proteínas clave sean más resistentes a la temperatura, dijo Piccotti.
La abundancia de información sobre la facilidad con que se despliegan ciertas proteínas complació enormemente a algunos biólogos. La probabilidad de su agregación depende directamente de la estabilidad de la proteína: la aparición de grumos de proteínas no desarrolladas que se adhieren entre sí. Los agregados de proteínas pueden convertirse en una pesadilla para las células e interferir con la implementación de las tareas principales. Por ejemplo, se les acusa de causar algunos problemas neurológicos graves, como la enfermedad de Alzheimer, en la cual placas de proteínas desplegadas obstruyen el cerebro.
 Paola Piccotti
Paola PiccottiPero esto no significa que la agregación ocurra solo en organismos que padecen ciertas enfermedades. Por el contrario, los investigadores se dieron cuenta de que es posible que suceda todo el tiempo y que las células sanas tengan métodos para enfrentarlo. "Creo que este fenómeno se está volviendo cada vez más común", dijo Michele Vendruscolo, bioquímica de la Universidad de Cambridge. “La mayoría de las proteínas no se pliegan correctamente y no se agregan dentro de las células. Lo más importante que estableció el equipo de Piccotti es el período de tiempo en que cualquier proteína seleccionada se encuentra en estado expandido. Esta vez determina el grado de posible agregación de proteínas ". Algunas proteínas casi nunca dan la vuelta y no se agregan, otras se comportan en ciertas condiciones, mientras que otras lo hacen todo el tiempo. Según el bioquímico, una descripción detallada de las proteínas en el nuevo trabajo facilitará en gran medida el estudio y la comprensión de estas diferencias entre proteínas. Algunas de las curvas de desnaturalización indican que sus proteínas se agregan después de desplegarse. "Se las arreglaron para rastrear ambas etapas, tanto la implementación como la agregación posterior", dijo Vendruscolo. "Esa es la belleza de este estudio".
Y aunque muchos científicos están interesados en los agregados debido al daño que causan, algunos miran este fenómeno desde un punto de vista diferente. Drummond dice que está quedando claro que algunos agregados no son solo pedazos de basura que cuelgan en una jaula. Contienen proteínas activas que continúan desempeñando sus funciones.
Imagínese desde la distancia que ve humo saliendo de un edificio, dice Drummond. Alrededor del edificio ves algunas figuras, e imaginas que estos son cuerpos extraídos de las ruinas. Pero si te acercas, puedes encontrar que son personas vivas que escaparon de un edificio en llamas, esperando que el incidente termine. Este es el caso del estudio de los agregados, dice Drummond: los investigadores encuentran que las proteínas en los agregados no son víctimas, sino sobrevivientes. "Ahora un nuevo campo de la ciencia está creciendo a un ritmo explosivo", dice.
La acumulación de proteínas puede no ser un signo de daño, sino una forma de que la proteína mantenga sus funciones en una situación difícil. Puede, por ejemplo, protegerlos del medio ambiente. Y cuando las condiciones mejoran, las proteínas pueden dejar los agregados y plegarse nuevamente. "Su forma cambia con la temperatura de tal manera que a primera vista parece ser un plegado incorrecto", dice Drummond. "Pero eso tiene otro sentido". En un
artículo publicado en la revista Cell de 2015, él y sus colegas identificaron 177 proteínas de levadura que conservaron sus funciones después de que ingresaron a los agregados. En un
artículo publicado en marzo, este equipo describió que si una de las proteínas se cambiaba para que no pudiera agregarse, esto conduciría a serios problemas en el funcionamiento de la célula.
En general, el trabajo afirma que las proteínas son estructuras sorprendentemente dinámicas. Al principio, pueden parecer máquinas rígidas que trabajan en tareas fijas para las cuales una forma particular es adecuada. Pero, de hecho, las proteínas pueden tomar varias formas diferentes durante su funcionamiento normal. Y en el momento adecuado, su forma puede cambiar tanto que puede parecer que se están deteriorando, aunque de hecho se están fortaleciendo por el contrario. A nivel molecular, la vida puede ser conexiones y desconexiones permanentes de enlaces.