Clasificación de los trastornos depresivos; el papel de las monoaminas (dopamina, noradrenalina y serotonina); mecanismos de acción de antidepresivos; depresión, estrés y neuroplasticidad.
Depresión (del lat.
Deprimo - suprimir) - una enfermedad mental caracterizada por una
"tríada depresiva" , que incluye los siguientes trastornos:
1.
En la esfera emocional. Estado de ánimo deprimido y anhedonia: la incapacidad de disfrutar cosas naturales: comida, alcohol, socialización, sexo, etc.
2. En la esfera cognitiva. Una autoimagen negativa, una experiencia negativa del mundo, una visión negativa del futuro: esta es la llamada
"tríada cognitiva" . La tríada dentro de la tríada + una persona es incapaz de una evaluación adecuada de la situación, no puede aplicar la experiencia positiva previa de resolver el problema.
3.
En la esfera motora. Como regla general, la inhibición motora, pero también puede haber una reacción inversa: agitación agitada: un paciente en un ambiente tranquilo puede saltar constantemente, balancear los brazos, cambiar constantemente su postura o, por ejemplo, levantarse e irse en medio de una conversación.
 Psiquiatría: una guía nacional. M .: GEOTAR-Media, 2009.1000 s.
Psiquiatría: una guía nacional. M .: GEOTAR-Media, 2009.1000 s.Hay síntomas adicionales: pérdida o aumento del apetito (pérdida o aumento de peso), trastornos del sueño (somnolencia o insomnio), sensación de cansancio, aumento de la fatiga, etc.
Según la OMS (Boletín No. 369), más de 300 millones de personas sufren de depresión, y este indicador tiene una tendencia a aumentar. La depresión es diferente de los cambios de humor ordinarios y las reacciones emocionales a corto plazo a los problemas de la vida cotidiana. Puede conducir a graves problemas de salud, mala adaptación social, bajo rendimiento y aprendizaje. En los peores casos, puede llevar al suicidio.
Anualmente, alrededor de 800,000 personas mueren como resultado del suicidio, la segunda causa principal de muerte entre las personas de 15 a 29 años.
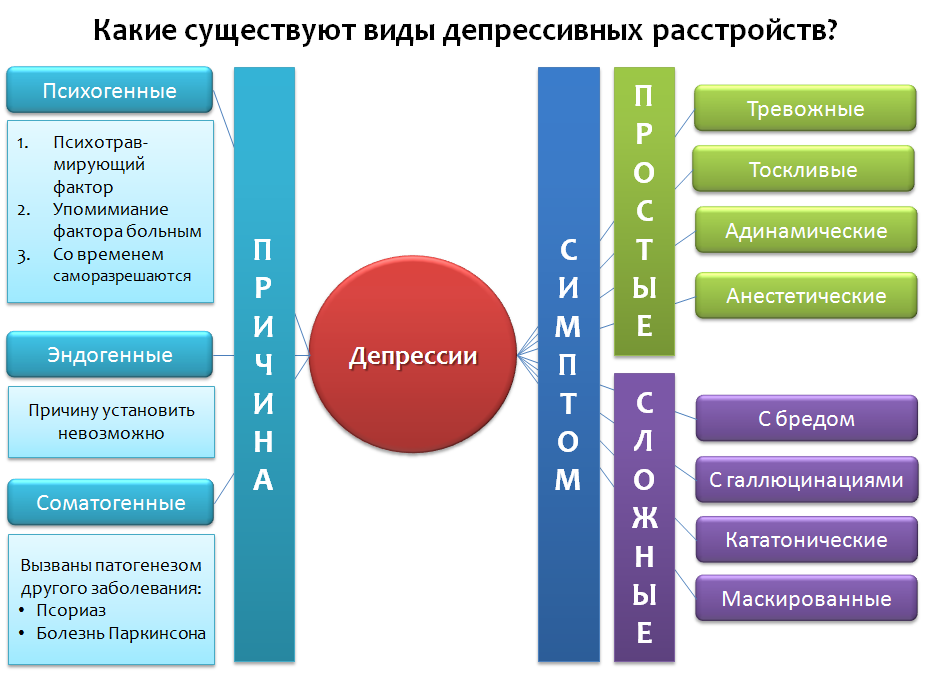 Fig. 1 Depresión: El tratamiento y manejo de la depresión en adultos (edición actualizada). Leicester (Reino Unido): Sociedad Británica de Psicología, 2010.
Fig. 1 Depresión: El tratamiento y manejo de la depresión en adultos (edición actualizada). Leicester (Reino Unido): Sociedad Británica de Psicología, 2010.Echemos un vistazo a la clasificación simplificada de los trastornos depresivos (Fig. 1), que no es absoluta, pero incluye ejemplos básicos. La depresión puede clasificarse por la razón que los causó (etiología) y el predominio de ciertos síntomas, así como sus diversas combinaciones.
En el primer caso, se pueden distinguir tres categorías:
1. Depresión
psicógena (reactiva) causada por un factor traumático. Este factor aparece en el discurso del paciente. Como regla, tales depresiones pueden resolverse por sí solas con el tiempo, el cese del factor - "el tiempo cura".
2.
Endógeno : depresiones causadas por factores internos que no se pueden establecer.
3.
Somatogénico : causado por la patogénesis (mecanismo del desarrollo de la enfermedad) de diversas enfermedades. Es importante no confundirlos con los psicógenos. Por ejemplo, si una persona tiene depresión debido a la
conciencia de la presencia de una enfermedad, es depresión psicógena (reactiva). Somatogénicas son aquellas depresiones causadas por el mecanismo de otra enfermedad. Por ejemplo, en la enfermedad de Parkinson, las células nerviosas que producen dopamina mueren, lo que a su vez juega un papel importante en la respuesta emocional. La deficiencia de dopamina en las áreas del cerebro responsables de la respuesta emocional conduce a la depresión. Un segundo ejemplo es la psoriasis, que puede conducir a una disminución en la producción de serotonina (un importante regulador del estado de ánimo) en el sistema nervioso central y, por lo tanto, aumentar el riesgo de desarrollar trastornos depresivos.
De acuerdo con el síntoma predominante de depresión, puede haber: ansioso, triste, adinámico, anestésico (experimentar falta de emociones, "anestesia emocional"), estos son ejemplos de
"depresión simple" .
Las "depresiones complejas" combinan los síntomas de la depresión y otras psicopatologías: depresión con delirios, alucinaciones, catatónicas, enmascaradas: los síntomas se disfrazan como enfermedades de los órganos internos o "somatizan" de una manera diferente: dolores de cabeza, dolores abdominales, corazón, etc.
La complejidad del tratamiento de los trastornos depresivos es la falta de recuperación total en el caso de formas severas o complicadas de trastornos depresivos. Pero la auto resolución de esta enfermedad también es posible, si el curso no es severo, no hay complicaciones en forma de síntomas de otras psicopatologías, etc.
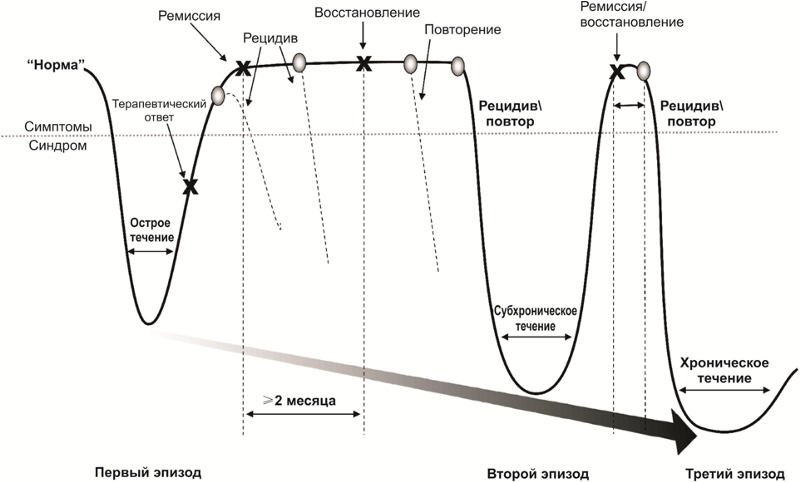 La naturaleza del curso de los trastornos depresivos.
La naturaleza del curso de los trastornos depresivos.Después de un curso exitoso de drogas y psicoterapia, comienza un período de remisión, que se acompaña de un debilitamiento (remisión parcial) o una desaparición completa de los síntomas (remisión completa) de la enfermedad. Durante el período de tratamiento activo y remisión parcial o completa, el riesgo de regresar los síntomas de la enfermedad - recaída - permanece.
Además, existen riesgos de episodios repetidos de depresión después de una recuperación completa del primer episodio. Los episodios repetidos pueden caracterizarse por un conjunto de otros síntomas y un curso más severo. La enfermedad puede adquirir un curso crónico. A menudo, el primer episodio de un trastorno depresivo es psicógeno (reactivo), y los episodios repetidos (en caso de que el problema sea insoluble, el factor traumático sea demasiado fuerte o prolongado) son endógenos.
Serotonina, Norepinefrina y Dopamina
La Figura 2 resume los principales parámetros de la teoría de la depresión de las monoaminas.
Las fórmulas de
monoamina se dan para explicar el nombre de este grupo de sustancias: contienen solo un grupo amino (-NH2).
El papel de las monoaminas en el desarrollo de síntomas depresivos.
 Fig. 2 Teoría de la depresión de monoamina* Otro grupo NH de serotonina no es un grupo amino, es parte del heterociclo indol.
Fig. 2 Teoría de la depresión de monoamina* Otro grupo NH de serotonina no es un grupo amino, es parte del heterociclo indol.Se cree que el papel de las monoaminas en la formación de síntomas individuales de depresión es heterogéneo. Entonces,
para un sentimiento de culpa e inutilidad, ideas suicidas, así como una pérdida de apetito , la deficiencia de serotonina puede ser responsable.
La dopamina y la noradrenalina son responsables de la
apatía, la disfunción ejecutiva y la fatiga .
Una deficiencia de
todas las monoaminas en el complejo indica un
estado de ánimo deprimido, disfunción psicomotora y trastornos del sueño.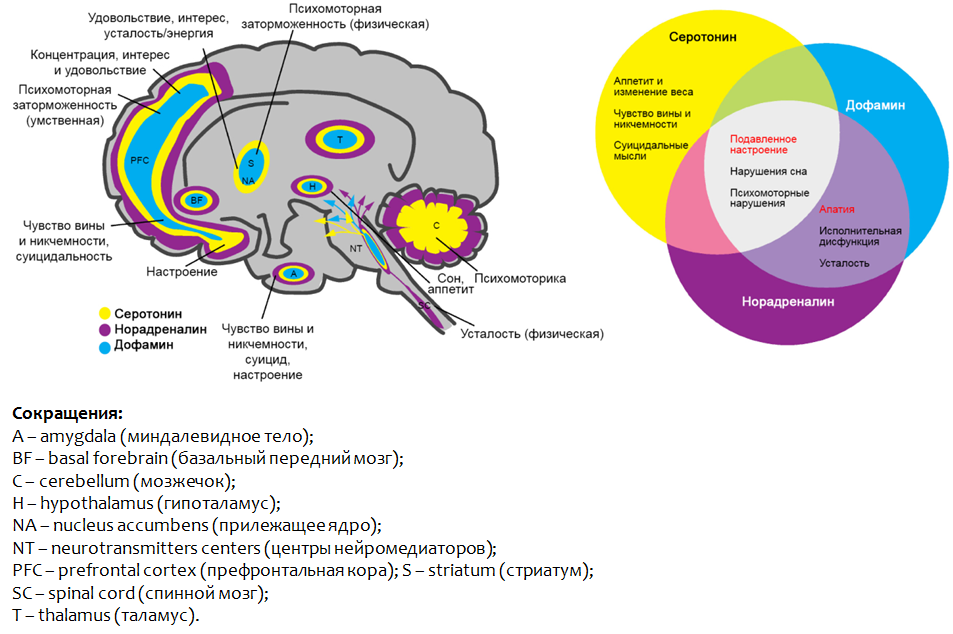 Fig.3. Saltiel PF, Silvershein DI Trastorno depresivo mayor: prescripción basada en mecanismos para medicina personalizada // Neuropsychiatr Dis Treat. 2015. 11. P. 875–88.
Fig.3. Saltiel PF, Silvershein DI Trastorno depresivo mayor: prescripción basada en mecanismos para medicina personalizada // Neuropsychiatr Dis Treat. 2015. 11. P. 875–88.La Figura 3 muestra las partes del cerebro donde la disfunción de las monoaminas presentadas conduce al desarrollo de síntomas depresivos.
Como ya dijimos, todos los antidepresivos clínicamente efectivos modernos se crean en el marco de la teoría de la depresión de las monoaminas.
Antidepresivos
Condicionalmente, el principio de acción de los antidepresivos se puede dividir en dos grupos:
1. Medios que
aumentan la concentración de monoaminas (principalmente serotonina y noradrenalina) en el cerebro;
2. Medios que
asumen la función de monoaminas (principalmente serotonina), estimulando receptores específicos.
 Fig. 4
Fig. 4Consideremos con más detalle los principales grupos de mecanismos moleculares de los antidepresivos. La Figura 5 muestra el contacto sináptico entre dos células nerviosas: arriba está la terminación nerviosa de una neurona (
sinapsis ), debajo está otra célula nerviosa que recibe una señal.
Los principales mecanismos moleculares de los antidepresivos en el contexto de la hipótesis de la monoamina de la depresión.
 Fig. 5. Terapia farmacológica de los trastornos de depresión y ansiedad. Goodman and Gilman's The Pharmacological Basis of Therapeutics. Duodécima Edición. 2011. Stahl SM Psicofarmacología básica de antidepresivos. Parte 1: Los antidepresivos tienen siete mecanismos de acción distintos // The Journal of Clinical Psychiatry. 1998. 59. Supl. 4. P. 5-14.
Fig. 5. Terapia farmacológica de los trastornos de depresión y ansiedad. Goodman and Gilman's The Pharmacological Basis of Therapeutics. Duodécima Edición. 2011. Stahl SM Psicofarmacología básica de antidepresivos. Parte 1: Los antidepresivos tienen siete mecanismos de acción distintos // The Journal of Clinical Psychiatry. 1998. 59. Supl. 4. P. 5-14.La síntesis de neurotransmisores (serotonina y noradrenalina) se lleva a cabo en las células nerviosas, con la ayuda de las cuales las células se transmiten una señal a la otra. El material de partida para la síntesis son los aminoácidos esenciales: L-triptófano y L-fenilalanina. Después de la síntesis, los neurotransmisores se empaquetan en gránulos especiales:
vesículas , en las que se mueven hacia las terminaciones nerviosas (
sinapsis ) y se depositan allí.
Después de que la célula
recibe un estímulo específico, los
mediadores se liberan desde la terminación nerviosa (sinapsis) hacia la
hendidura sináptica , la brecha entre dos células nerviosas. En la superficie de la célula señalizadora "receptora" hay formaciones de proteínas especiales:
receptores (en este caso, serotonina y receptores adrenérgicos) que se unen al mediador. Después de la unión, el mediador activa (estimula) el receptor correspondiente, lo que conduce a un cambio en los procesos metabólicos dentro de la célula y, en consecuencia, cambia su función (mejora o suprime).
Después de realizar con éxito su función, el 80% del mediador es capturado nuevamente dentro de la célula nerviosa, donde parte de la mediación es destruida por la enzima
monoamino oxidasa tipo A (MAO-A), y otra parte se empaqueta nuevamente en vesículas para su reutilización. La recaptura del mediador puede reducir significativamente los costos de energía para la síntesis del mediador a partir de aminoácidos.
 Fig. 6 Contras superan y justifican la búsqueda de nuevas hipótesis y objetivos.
Fig. 6 Contras superan y justifican la búsqueda de nuevas hipótesis y objetivos.Brevemente sobre cómo actúan los antidepresivos

1. Violar la recaptación del neurotransmisor en la terminación nerviosa, aumentando así su concentración en la hendidura sináptica y mejorando su efecto sobre los receptores. Quizás una violación separada de la recaptación de serotonina (fluoxetina, fluvoxamina, paroxetina) y norepinefrina (reboxetina, atomoxetina), y una violación simultánea de la captura de ambos mediadores (amitriptilina).
2. Aumentar la liberación de mediadores de las terminaciones nerviosas (mirtazapina y tianeptina
actualmente prohibida ).
3. Suprima la actividad de la enzima MAO-A y por lo tanto preserva el mediador de la destrucción (moclobemida).
4. Se estimulan los receptores de serotonina del primer subtipo (Vilazodona), cuya activación se asocia con el alivio de los síntomas depresivos (receptores "buenos").
5. Bloquee los receptores de serotonina de tipo 2 (receptores "malos"), que son responsables del desarrollo de la ansiedad y los síntomas depresivos (trazodona).
Depresión y estrés
Actualmente, al estrés se le asigna el papel de uno de los mecanismos desencadenantes (desencadenantes) de los trastornos afectivos (trastornos de la esfera emocional, afecto), incluidos los depresivos. Se cree que es peligroso no solo un evento estresante grave y de una sola vez, sino un efecto menos intenso y constante del estrés, especialmente los eventos estresantes impredecibles cotidianos. Es imposible adaptarse a tales efectos estresantes, y conduce a la activación crónica de los mecanismos de defensa y adaptación con su posterior agotamiento.
Uno de los componentes más importantes de la respuesta fisiológica del cuerpo al estrés es el eje hipotalámico-pituitario-adrenal (Fig. 7).
 Fig. 7. Varghese FP y Brown ES El eje hipotalámico-hipofisario-adrenal en el trastorno depresivo mayor: una breve introducción para los médicos de atención primaria // Compañero de atención primaria del Journal of Clinical Psychiatry. 2001.3 (4). P. 151-155.
Fig. 7. Varghese FP y Brown ES El eje hipotalámico-hipofisario-adrenal en el trastorno depresivo mayor: una breve introducción para los médicos de atención primaria // Compañero de atención primaria del Journal of Clinical Psychiatry. 2001.3 (4). P. 151-155.La activación sucesiva del estrés de las estructuras centrales (amígdalas - hipotálamo - glándula pituitaria) conduce al desarrollo de hormonas de la corteza suprarrenal - glucocorticoides (cortisol) - hormonas del estrés. Estos últimos pueden actuar sobre la estructura del cerebro (responsable de la respuesta al estrés emocional (corteza prefrontal e hipocampo)) e interrumpir los procesos de neuroplasticidad.
Trastornos de la neuroplasticidad *
Las violaciones de la neuroplasticidad conducen a una violación de la conexión normal entre las estructuras del cerebro (responsable de la respuesta emocional).
* La neuroplasticidad es la capacidad del cerebro para adaptarse a los cambios a través de la reorganización, en condiciones normales de desarrollo y en condiciones de patología.
 Fig. 8 Fuchs E., Flügge G. Neuroplasticidad del adulto: más de 40 años de investigación // Plasticidad neuronal. 2014. ID del artículo 541870. Doi: 10.1155 / 2014/541870; Joyce Sh. Neuroplasticidad y práctica clínica: construcción del poder cerebral para la salud // Frontiers in Psychology. 7 (2016): 1118. PMC. Web 7 de mayo de 2017. Zilles K. La plasticidad neuronal como una propiedad adaptativa del sistema nervioso central // Annals of Anatomy. 1992. vol. 174. No. 5. P. 383–391.
Fig. 8 Fuchs E., Flügge G. Neuroplasticidad del adulto: más de 40 años de investigación // Plasticidad neuronal. 2014. ID del artículo 541870. Doi: 10.1155 / 2014/541870; Joyce Sh. Neuroplasticidad y práctica clínica: construcción del poder cerebral para la salud // Frontiers in Psychology. 7 (2016): 1118. PMC. Web 7 de mayo de 2017. Zilles K. La plasticidad neuronal como una propiedad adaptativa del sistema nervioso central // Annals of Anatomy. 1992. vol. 174. No. 5. P. 383–391.Los más importantes en el contexto de los trastornos depresivos son la corteza prefrontal, las amígdalas y el hipocampo.
La interacción de las estructuras cerebrales es normal.
 Fig. 9. Gorman JM, Docherty JP Un papel hipotético para el remodelado dendrítico en la etiología de los trastornos del estado de ánimo y la ansiedad // The Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22: 3. P. 256–264
Fig. 9. Gorman JM, Docherty JP Un papel hipotético para el remodelado dendrítico en la etiología de los trastornos del estado de ánimo y la ansiedad // The Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22: 3. P. 256–264Normalmente, cuando hay una conexión completa entre las neuronas de estas estructuras, la corteza prefrontal procesa la información recibida del hipocampo (memoria, coloración emocional de recuerdos y eventos). La amígdala es la estructura responsable de la sensación de miedo. Normalmente, la corteza prefrontal suprime la actividad excesiva de esta estructura.
Fig. 10Se sabe que, en el contexto de los trastornos depresivos, se interrumpen los procesos de neuroplasticidad, en particular, el número de contactos entre las células nerviosas disminuye, la velocidad de la transmisión de impulsos cambia y el número de neuronas disminuye. Además, en el contexto de la depresión, se observa una disminución en el volumen del hipocampo y la corteza prefrontal. Tales cambios contribuyen a la interrupción de la relación funcional normal entre las estructuras presentadas.
Los síntomas depresivos, aparentemente, pueden estar mediados por estos cambios: la ansiedad no controlada que a menudo ocurre en pacientes con depresión puede deberse a la falta de inhibición de la amígdala por la corteza prefrontal.
La interacción de las estructuras cerebrales en la depresión (teoría)
 Fig.11. Gorman JM, Docherty JP Un papel hipotético para el remodelado dendrítico en la etiología de los trastornos del estado de ánimo y la ansiedad. La Revista de Neuropsiquiatría y Neurociencias Clínicas. 2010.22 (3). P. 256–64. Kudryashov N.V. Un estudio experimental de la actividad psicotrópica de los derivados de pirazolo [c] piridina GIZh-72 y pirrolodiazepina GMAL-24 en condiciones de estrés moderado crónico imprevisible / Disertación del candidato de Ciencias Biológicas. 14/03/06. M., 2016. 198 p.
Fig.11. Gorman JM, Docherty JP Un papel hipotético para el remodelado dendrítico en la etiología de los trastornos del estado de ánimo y la ansiedad. La Revista de Neuropsiquiatría y Neurociencias Clínicas. 2010.22 (3). P. 256–64. Kudryashov N.V. Un estudio experimental de la actividad psicotrópica de los derivados de pirazolo [c] piridina GIZh-72 y pirrolodiazepina GMAL-24 en condiciones de estrés moderado crónico imprevisible / Disertación del candidato de Ciencias Biológicas. 14/03/06. M., 2016. 198 p.La incapacidad de evaluar adecuadamente la situación y utilizar la experiencia positiva previa es el resultado de una violación de la conexión entre la corteza prefrontal y el hipocampo. Una disminución en el volumen del hipocampo puede explicar un estado de ánimo patológicamente reducido.
Los mecanismos de regulación de la neuroplasticidad en el contexto de los trastornos depresivos.
Fig. 12Un regulador importante de los procesos de neuroplasticidad es el
factor neurotrófico cerebral (BDNF -
factor neurotrófico derivado del cerebro ), cuyos niveles disminuyen debido al estrés y la depresión.
Las hormonas del estrés, como el cortisol, un glucocorticosteroide producido por la corteza suprarrenal, también pueden actuar como reguladores negativos de la neuroplasticidad. Es bien sabido que la mayoría de los antidepresivos utilizados (en uso crónico) pueden aumentar los niveles de BDNF y, aparentemente, esto es parte de su efecto terapéutico.
Propiedades del factor neurotrófico cerebral (BDNF *) y la posibilidad de su uso como antidepresivo
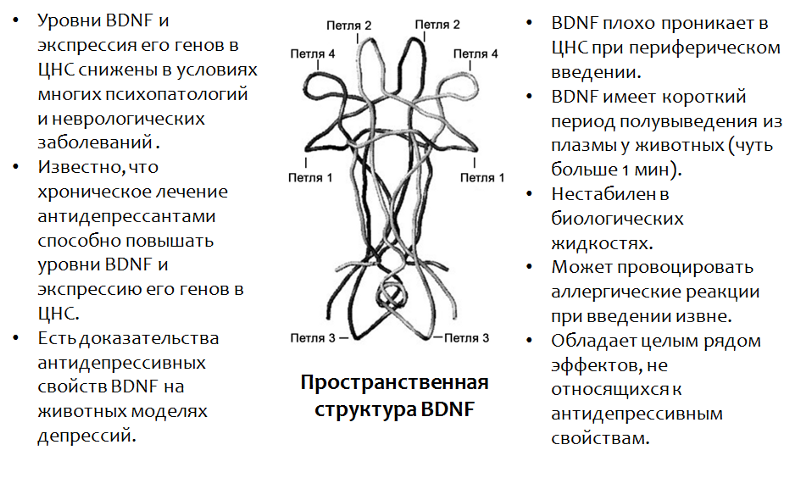 Fig.13. Castrén E., Rantamäki T. El papel del BDNF y sus receptores en la depresión y la acción de los antidepresivos: reactivación de la plasticidad del desarrollo // Neurobiología del desarrollo. 2010.70 (5). P. 289–97.
Fig.13. Castrén E., Rantamäki T. El papel del BDNF y sus receptores en la depresión y la acción de los antidepresivos: reactivación de la plasticidad del desarrollo // Neurobiología del desarrollo. 2010.70 (5). P. 289–97.* BDNF juega un papel importante en muchas psicopatologías, incluyendo y depresión El uso de BDNF en sí no es posible debido a una serie de razones (que se enumeran en la figura).
Además de los antidepresivos, existen otros factores que contribuyen a un aumento en los niveles de BDNF en el sistema nervioso central y coinciden con estímulos positivos de neuroplasticidad: entrenamiento, ejercicio, nueva experiencia, dieta, etc. Además, a menudo estos factores pueden complementar la terapia farmacológica para los trastornos depresivos.
La Figura 14 presenta datos sobre un estudio de las propiedades antidepresivas del BDNF en modelos animales (ratas). Como el BDNF en sí mismo no puede penetrar en el cerebro (a través de la barrera hematoencefálica) durante la administración periférica, en los experimentos se inyectó BDNF directamente en el cerebro.
El estudio de las propiedades antidepresivas del factor neurotrófico cerebral (BDNF) en modelos animales
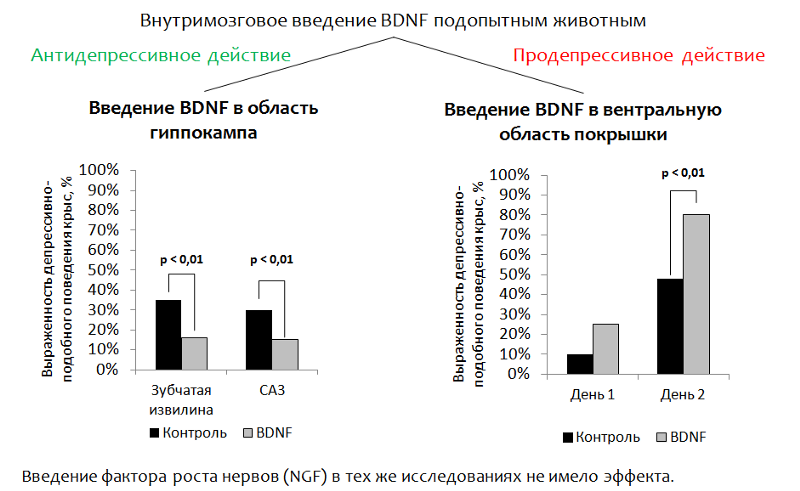 Fig. 14 Eisch AJ, Bolaños CA, de Wit J. et al. Factor neurotrófico derivado del cerebro en la vía ventral del núcleo medio del cerebro accumbens: un papel en la depresión // Psiquiatría biológica. 2003.54 (10). P. 994-1005; Shirayama Y., Chen AC, Nakagawa S., Russell DS, Duman RS El factor neurotrófico derivado del cerebro produce efectos antidepresivos en modelos conductuales de depresión. Revista de Neurociencia. 2002,22 (8). P. 3251–61.
Fig. 14 Eisch AJ, Bolaños CA, de Wit J. et al. Factor neurotrófico derivado del cerebro en la vía ventral del núcleo medio del cerebro accumbens: un papel en la depresión // Psiquiatría biológica. 2003.54 (10). P. 994-1005; Shirayama Y., Chen AC, Nakagawa S., Russell DS, Duman RS El factor neurotrófico derivado del cerebro produce efectos antidepresivos en modelos conductuales de depresión. Revista de Neurociencia. 2002,22 (8). P. 3251–61.1.
Introducción al hipocampo . La idea principal era la introducción selectiva de BDNF en el área del cerebro responsable de la neurogénesis (el giro dentado del hipocampo es uno de los llamados
"nichos neurogénicos" ). Después de la administración, se evaluó el comportamiento depresivo de los animales.
(Se evalúa el componente disfórico de la depresión. Los animales (ratas o ratones) se colocan en un cilindro con agua de la que es imposible salir por su cuenta. Después de un tiempo, los intentos activos del animal para salir del cilindro son reemplazados por un "estado de desesperación" (el animal está en el agua prácticamente sin movimientos).La reducción de la inmovilidad (inmovilización) del animal se considera como un correlato del efecto antidepresivo. BDNF tuvo un efecto antidepresivo después de la inserción en la circunvolución dentada (nicho neurogénico) y la zona CA3 del hipocampo (las neuronas en esta zona proporcionan interacción de la circunvolución dentada con otras áreas del hipocampo).
2.
Cuando se introdujo BDNF en la región ventral del neumático (la zona responsable de la producción de dopamina y de los trastornos depresivos), se registró el efecto contrario: un aumento en el comportamiento depresivo.
Miméticos
Como no es posible usar BDNF como medicamento, se está desarrollando un medicamento basado en este factor. En particular, las regiones activas de la molécula BDNF fueron bien estudiadas (cuya estructura espacial determina el nombre del bucle. Fig. 15).
Actualmente, los miméticos (sustancias que imitan la actividad) de BDNF se están estudiando activamente.
Desarrollo de una nueva generación de fármacos basados en el factor neurotrófico cerebral (BDNF)
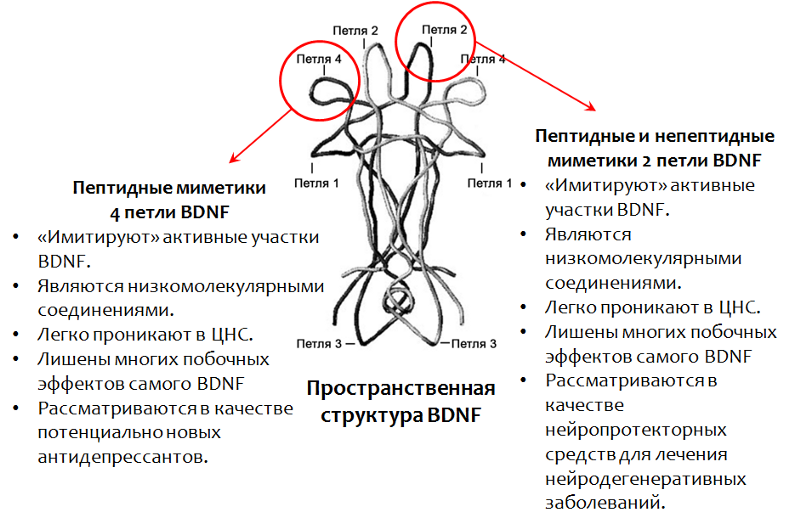 Fig.15. Fletcher JM, Morton CJ, Zwar RA et al. Diseño de un mimético circular conformacionalmente definido y proteolíticamente estable del factor neurotrófico derivado del cerebro // The Journal of Biological Chemistry. 2008.283 (48). P. 33375–83. Massa SM, Yang T., Xie Y. et al. V Los pequeños miméticos de BDNF de molécula activan la señalización de TrkB y previenen la degeneración neuronal en roedores // The Journal of Clinical Investigation. 2010.120 (5). P. 1774-1785. .., .., .. . BDNF, -106 // Acta Naturae. 2013. 4(19). P. 116–120.
Fig.15. Fletcher JM, Morton CJ, Zwar RA et al. Diseño de un mimético circular conformacionalmente definido y proteolíticamente estable del factor neurotrófico derivado del cerebro // The Journal of Biological Chemistry. 2008.283 (48). P. 33375–83. Massa SM, Yang T., Xie Y. et al. V Los pequeños miméticos de BDNF de molécula activan la señalización de TrkB y previenen la degeneración neuronal en roedores // The Journal of Clinical Investigation. 2010.120 (5). P. 1774-1785. .., .., .. . BDNF, -106 // Acta Naturae. 2013. 4(19). P. 116–120.4 (BDNF) — -106
 Fig. 16. Seredenin S.B., Voronina T.A., Gudasheva T.A. et al.Efecto antidepresivo del mimético original de bajo peso molecular BDNF, dipéptido dimérico GSB-106 // Acta Naturae. 2013.4 (19). P. 116-120.GSB-106 - una sustancia de la estructura peptídica, es un BDNF mimético de 4 bucles (desarrollo doméstico). La sustancia tiene un efecto antidepresivo en modelos animales bajo varios modos de administración. Actualmente, se están realizando estudios exhaustivos de las propiedades farmacológicas de este compuesto con el objetivo de crear una nueva generación de antidepresivos sobre la base de este.
Fig. 16. Seredenin S.B., Voronina T.A., Gudasheva T.A. et al.Efecto antidepresivo del mimético original de bajo peso molecular BDNF, dipéptido dimérico GSB-106 // Acta Naturae. 2013.4 (19). P. 116-120.GSB-106 - una sustancia de la estructura peptídica, es un BDNF mimético de 4 bucles (desarrollo doméstico). La sustancia tiene un efecto antidepresivo en modelos animales bajo varios modos de administración. Actualmente, se están realizando estudios exhaustivos de las propiedades farmacológicas de este compuesto con el objetivo de crear una nueva generación de antidepresivos sobre la base de este.Neurogénesis * y depresión.
* La neurogénesis es un proceso de múltiples etapas de la formación de nuevas células nerviosas en el sistema nervioso central maduro, que es una función adaptativa del sistema nervioso.
 Fuchs E., Flügge G. Neuroplasticidad del adulto: más de 40 años de investigación // Plasticidad neuronal. 2014. ID del artículo 541870, doi: 10.1155 / 2014/541870Fig. 17En la Figura 17 mostramos las zonas neurogénicas (nichos) de mamíferos:1) La circunvolución dentada del hipocampo2) Los bulbos olfativos3) La zona subventricularSe cree que el nicho neurogénico principal en los humanos es el hipocampo (circunvolución dentada).El estrés, que se considera uno de los principales desencadenantes de los trastornos depresivos, conduce a una disminución en los niveles de BDNF y a un aumento en el cortisol, que, a su vez, aumenta el efecto del glutamato en el sistema nervioso central.
Fuchs E., Flügge G. Neuroplasticidad del adulto: más de 40 años de investigación // Plasticidad neuronal. 2014. ID del artículo 541870, doi: 10.1155 / 2014/541870Fig. 17En la Figura 17 mostramos las zonas neurogénicas (nichos) de mamíferos:1) La circunvolución dentada del hipocampo2) Los bulbos olfativos3) La zona subventricularSe cree que el nicho neurogénico principal en los humanos es el hipocampo (circunvolución dentada).El estrés, que se considera uno de los principales desencadenantes de los trastornos depresivos, conduce a una disminución en los niveles de BDNF y a un aumento en el cortisol, que, a su vez, aumenta el efecto del glutamato en el sistema nervioso central. Fig. 18 añosEstos cambios, en conjunto, suprimen la neurogénesis del hipocampo y conducen a una disminución en el volumen del hipocampo. Bajo la acción del glutamato, también es posible la apoptosis (muerte programada de las células nerviosas). En violación de la neurogénesis, el cerebro no puede compensar completamente la pérdida y se desarrollan síntomas depresivos.El glutamato es uno de los principales aminoácidos excitadores del sistema nervioso central. La violación de la neuroplasticidad bajo la influencia de la acción excesiva del glutamato, aparentemente, se asocia con una reacción compensatoria. Las neuronas "eliminan" conexiones innecesarias y mueren (apoptosis) para proteger el sistema nervioso central de la sobreexcitación y las consecuentes consecuencias perjudiciales de este proceso.Un hecho bien conocido es la capacidad de los antidepresivos para estimular la neurogénesis, sin embargo, los mecanismos subyacentes a este fenómeno aún no se han estudiado completamente. Se sabe que todos los grupos de antidepresivos actúan sobre el sistema de monoaminas del cerebro y compensan los déficits funcionales o materiales de la serotonina y la noradrenalina. Además, los medicamentos de este grupo farmacológico aumentan los niveles de factor neurotrófico cerebral.
Fig. 18 añosEstos cambios, en conjunto, suprimen la neurogénesis del hipocampo y conducen a una disminución en el volumen del hipocampo. Bajo la acción del glutamato, también es posible la apoptosis (muerte programada de las células nerviosas). En violación de la neurogénesis, el cerebro no puede compensar completamente la pérdida y se desarrollan síntomas depresivos.El glutamato es uno de los principales aminoácidos excitadores del sistema nervioso central. La violación de la neuroplasticidad bajo la influencia de la acción excesiva del glutamato, aparentemente, se asocia con una reacción compensatoria. Las neuronas "eliminan" conexiones innecesarias y mueren (apoptosis) para proteger el sistema nervioso central de la sobreexcitación y las consecuentes consecuencias perjudiciales de este proceso.Un hecho bien conocido es la capacidad de los antidepresivos para estimular la neurogénesis, sin embargo, los mecanismos subyacentes a este fenómeno aún no se han estudiado completamente. Se sabe que todos los grupos de antidepresivos actúan sobre el sistema de monoaminas del cerebro y compensan los déficits funcionales o materiales de la serotonina y la noradrenalina. Además, los medicamentos de este grupo farmacológico aumentan los niveles de factor neurotrófico cerebral.Los antidepresivos pueden estimular la neurogénesis
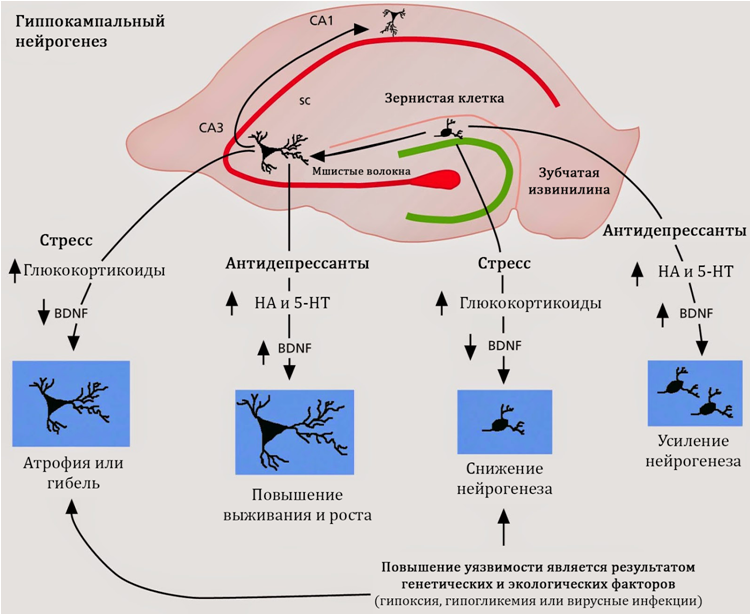 Fig. 19La estimulación de la neurogénesis es característica de los antidepresivos, independientemente de su mecanismo de acción, estructura química o clase. Por lo tanto, la búsqueda de mecanismos de regulación de la neurogénesis debe realizarse en propiedades comunes a todos los antidepresivos. Tales propiedades comunes son la actividad de los antidepresivos contra la serotonina y la noradrenalina.Hoy, se está formando una idea sobre el papel de la serotonina en la regulación de la neurogénesis del hipocampo.
Fig. 19La estimulación de la neurogénesis es característica de los antidepresivos, independientemente de su mecanismo de acción, estructura química o clase. Por lo tanto, la búsqueda de mecanismos de regulación de la neurogénesis debe realizarse en propiedades comunes a todos los antidepresivos. Tales propiedades comunes son la actividad de los antidepresivos contra la serotonina y la noradrenalina.Hoy, se está formando una idea sobre el papel de la serotonina en la regulación de la neurogénesis del hipocampo.Posibles mecanismos de actividad neurogénica de los antidepresivos.
 Fig. 20. Alenina N., Klempin F. El papel de la serotonina en la neurogénesis del hipocampo adulto. Behavioral Brain Research. 2015. 277. P. 49–57.En primer lugar, la circunvolución dentada del hipocampo recibe la regulación de la serotonina desde los núcleos grandes de la sutura (la acumulación de células nerviosas que producen serotonina, ubicadas en el tronco encefálico) tanto directamente como a través de las neuronas intercalares que transportan varios subtipos de receptores de serotonina en su superficie.En segundo lugar, en las propias células madre, se detectaron receptores de serotonina del subtipo 1A , lo que indica la capacidad potencial de la serotonina para regular las células madre del cerebro.
Fig. 20. Alenina N., Klempin F. El papel de la serotonina en la neurogénesis del hipocampo adulto. Behavioral Brain Research. 2015. 277. P. 49–57.En primer lugar, la circunvolución dentada del hipocampo recibe la regulación de la serotonina desde los núcleos grandes de la sutura (la acumulación de células nerviosas que producen serotonina, ubicadas en el tronco encefálico) tanto directamente como a través de las neuronas intercalares que transportan varios subtipos de receptores de serotonina en su superficie.En segundo lugar, en las propias células madre, se detectaron receptores de serotonina del subtipo 1A , lo que indica la capacidad potencial de la serotonina para regular las células madre del cerebro.Los mecanismos de la actividad neurogénica de los antidepresivos.
 Fig. 21Como se muestra en estudios experimentales (en animales y cultivos celulares), los inhibidores selectivos de la recaptación de serotonina (ISRS, un fármaco clásico de este grupo, la fluoxetina) pueden estimular la etapa de proliferación de la neurogénesis en el hipocampo.El mecanismo propuesto es un aumento en la concentración de serotonina (5-HT - serotonina, también conocida como 5-hidroxitriptamina) en el sistema nervioso central y la posterior estimulación (mejorada) de la neurogénesis de la serotonina. Los receptores de serotonina subtipo 1A (receptores 5HT1A) también pueden servir comoobjetivos potenciales para los antidepresivos durante la neurogénesis. Estas suposiciones son consistentes con los datos sobre el efecto positivo (terapéutico) de la activación de los receptores de serotonina 5-HT1A por los antidepresivos (por ejemplo, Vilazodona) en un contexto de trastornos depresivos.Otro argumento que nos permite considerar la estimulación de la neurogénesis como el principal mecanismo de acción de los antidepresivos es la coincidencia en el tiempo entre el tiempo promedio de inicio del efecto terapéutico (de 2 a 7 semanas) y el ciclo completo de neurogénesis (3-7 semanas).Además de estos mecanismos, los antidepresivos ISRS también demuestran la capacidad de aumentar los niveles de BDNF, pero los mecanismos de este efecto siguen siendo desconocidos.
Fig. 21Como se muestra en estudios experimentales (en animales y cultivos celulares), los inhibidores selectivos de la recaptación de serotonina (ISRS, un fármaco clásico de este grupo, la fluoxetina) pueden estimular la etapa de proliferación de la neurogénesis en el hipocampo.El mecanismo propuesto es un aumento en la concentración de serotonina (5-HT - serotonina, también conocida como 5-hidroxitriptamina) en el sistema nervioso central y la posterior estimulación (mejorada) de la neurogénesis de la serotonina. Los receptores de serotonina subtipo 1A (receptores 5HT1A) también pueden servir comoobjetivos potenciales para los antidepresivos durante la neurogénesis. Estas suposiciones son consistentes con los datos sobre el efecto positivo (terapéutico) de la activación de los receptores de serotonina 5-HT1A por los antidepresivos (por ejemplo, Vilazodona) en un contexto de trastornos depresivos.Otro argumento que nos permite considerar la estimulación de la neurogénesis como el principal mecanismo de acción de los antidepresivos es la coincidencia en el tiempo entre el tiempo promedio de inicio del efecto terapéutico (de 2 a 7 semanas) y el ciclo completo de neurogénesis (3-7 semanas).Además de estos mecanismos, los antidepresivos ISRS también demuestran la capacidad de aumentar los niveles de BDNF, pero los mecanismos de este efecto siguen siendo desconocidos.El efecto de la fluoxetina (Prozac) sobre la neurogénesis de los primates no humanos
 Fig. 22. Perera TD, Dwork AJ, Keegan KA, et al. Necesidad de la neurogénesis del hipocampo para la acción terapéutica de los antidepresivos en primates no humanos adultos // PLoS ONE. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Los estudios sobre primates (el modelo animal más relevante) han demostrado la capacidad de la fluoxetina (nombre comercial "Prozac") para estimular la neurogénesis contra el estrés (en este caso, se utilizó un modelo de estrés de aislamiento). La Figura 22 muestra que la fluoxetina aumentó significativamente (estadísticamente significativo) la tasa de proliferación (división) de las células nerviosas madre en el hipocampo de los primates.
Fig. 22. Perera TD, Dwork AJ, Keegan KA, et al. Necesidad de la neurogénesis del hipocampo para la acción terapéutica de los antidepresivos en primates no humanos adultos // PLoS ONE. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Los estudios sobre primates (el modelo animal más relevante) han demostrado la capacidad de la fluoxetina (nombre comercial "Prozac") para estimular la neurogénesis contra el estrés (en este caso, se utilizó un modelo de estrés de aislamiento). La Figura 22 muestra que la fluoxetina aumentó significativamente (estadísticamente significativo) la tasa de proliferación (división) de las células nerviosas madre en el hipocampo de los primates.El efecto de la fluoxetina en la neurogénesis de primates no humanos
 Fig. 23. Perera TD, Dwork AJ, Keegan KA, et al. Necesidad de la neurogénesis del hipocampo para la acción terapéutica de los antidepresivos en primates no humanos adultos // PLoS ONE. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.El efecto del estrés condujo a una disminución en la capa granular de la circunvolución dentada del hipocampo, la principal zona neurogénica del cerebro de los primates. La administración de fluoxetina en un contexto de exposición estresante evitó este cambio y mantuvo el volumen de esta estructura (volumen total) normal.
Fig. 23. Perera TD, Dwork AJ, Keegan KA, et al. Necesidad de la neurogénesis del hipocampo para la acción terapéutica de los antidepresivos en primates no humanos adultos // PLoS ONE. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.El efecto del estrés condujo a una disminución en la capa granular de la circunvolución dentada del hipocampo, la principal zona neurogénica del cerebro de los primates. La administración de fluoxetina en un contexto de exposición estresante evitó este cambio y mantuvo el volumen de esta estructura (volumen total) normal.El efecto de la fluoxetina en la neurogénesis de primates no humanos
Correlación entre anhedonia (comportamiento depresivo) y neurogénesis
Perera TD, Dwork AJ, Keegan KA, et al. Necesidad de la neurogénesis del hipocampo para la acción terapéutica de los antidepresivos en primates no humanos adultos. PLOS UNO. 2011.6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Se encontró que existe una correlación entre la estimulación de la neurogénesis por fluoxetina y la prevención del desarrollo del comportamiento depresivo (anhedonia).
Al estudiar el efecto de la fluoxitina sobre la neurogénesis de los primates no humanos, se estableció una correlación confiable entre una disminución de la neurogénesis (causada por el estrés) y un aumento en el comportamiento depresivo de los primates (anhedonia, que fue determinado por una combinación de trastornos sociales y alimentarios), así como una correlación entre la estimulación de la neurogénesis con fluoxetina y la ausencia de depresión. -como comportamiento.
La norepinefrina es otra monoamina importante que, junto con la serotonina, puede participar en la regulación de la neurogénesis del hipocampo.
Posibles mecanismos de actividad neurogénica de los antidepresivos.
 Figura 25. Jhaveri DJ, Mackay EW, Hamlin AS, et al. La norepinefrina activa directamente los precursores del hipocampo adulto a través de receptores adrenérgicos β3 // The Journal of Neuroscience. 2010.30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.
Figura 25. Jhaveri DJ, Mackay EW, Hamlin AS, et al. La norepinefrina activa directamente los precursores del hipocampo adulto a través de receptores adrenérgicos β3 // The Journal of Neuroscience. 2010.30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.En estudios sobre cultivos de neuronas del hipocampo, se demostró que la noradrenalina (a diferencia de la serotonina) aumentó el número de células madre. La serotonina, como se demostró previamente, no afectó la cantidad, sino la tasa de proliferación.
Además de los cambios cuantitativos, la noradrenalina también causó cambios cualitativos: aumentó el tamaño de las neuroesferas, que se muestra claramente en la imagen del microscopio electrónico (ver Fig. 26).
Posibles mecanismos de actividad neurogénica de los antidepresivos.
 Fig. 26. Jhaveri DJ, Mackay EW, Hamlin AS, et al. La norepinefrina activa directamente los precursores del hipocampo adulto a través de receptores adrenérgicos β3 // The Journal of Neuroscience. 2010.30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.
Fig. 26. Jhaveri DJ, Mackay EW, Hamlin AS, et al. La norepinefrina activa directamente los precursores del hipocampo adulto a través de receptores adrenérgicos β3 // The Journal of Neuroscience. 2010.30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.El papel de las células gliales en la formación de trastornos depresivos.
Examinamos previamente los cambios en las neuronas, pero ignoramos el papel de las células gliales en la formación de trastornos depresivos. Sin embargo, los estudios experimentales y clínicos indican un posible papel de la patología de las células gliales en la patogénesis de la depresión.
El papel de la glía en la formación de trastornos depresivos.
 Fig. 27. Rajkowska G., Miguel-Hidalgo JJ Gliogénesis y patología glial en la depresión // SNC y trastornos neurológicos Objetivos farmacológicos. 2007.6 (3). P. 219-233.
Fig. 27. Rajkowska G., Miguel-Hidalgo JJ Gliogénesis y patología glial en la depresión // SNC y trastornos neurológicos Objetivos farmacológicos. 2007.6 (3). P. 219-233.Los investigadores presentaron un diagrama de la patogenia de los trastornos depresivos que involucran glía (Fig. 27).
Una predisposición genética puede incluir: un factor hereditario (la presencia de un trastorno depresivo en uno de los padres aumenta el riesgo de esta enfermedad en el niño); polimorfismo genético: BDNF, transportador de serotonina (que participa en la recaptación de serotonina en las células nerviosas y gliales), receptores de serotonina, enzimas de síntesis de serotonina (tipo 2 triptófano hidroxilasa).
La vulnerabilidad genética, combinada con factores ambientales y de estrés, crea un ambiente favorable para la formación del trastorno depresivo.Los científicos han descubierto que el papel de las células gliales no es el mismo en pacientes jóvenes y ancianos (Fig. 28). Las células gliales pueden desempeñar un papel importante en la patogénesis de las primeras etapas de los trastornos depresivos, lo que puede causar una disminución pronunciada en el número de neuronas piramidales en la edad adulta.
El papel de las células gliales en la formación de trastornos depresivos no es el mismo en pacientes jóvenes y ancianos.
 Fig. 28. Rajkowska G., Miguel-Hidalgo JJ Gliogénesis y patología glial en la depresión // SNC y trastornos neurológicos Objetivos farmacológicos. 2007.6 (3). P. 219-233.
Fig. 28. Rajkowska G., Miguel-Hidalgo JJ Gliogénesis y patología glial en la depresión // SNC y trastornos neurológicos Objetivos farmacológicos. 2007.6 (3). P. 219-233.En particular, la pérdida de la función de las células gliales a una edad temprana aumenta el riesgo de desarrollar episodios repetidos de depresión en la vejez, pero la deficiencia de las neuronas piramidales en lugar de las células gliales ya prevalecerá.
 Fig. 29. Rajkowska G., Miguel-Hidalgo JJ Gliogénesis y patología glial en la depresión // SNC y trastornos neurológicos Objetivos farmacológicos. 2007.6 (3). P. 219-233.
Fig. 29. Rajkowska G., Miguel-Hidalgo JJ Gliogénesis y patología glial en la depresión // SNC y trastornos neurológicos Objetivos farmacológicos. 2007.6 (3). P. 219-233.Dicha dinámica es consistente con una de las funciones más importantes de las células gliales: la absorción del exceso de glutamato de la hendidura sináptica (contacto entre las células nerviosas). El glutamato es uno de los principales neurotransmisores excitadores del sistema nervioso central y su acción excesiva puede conducir a una alteración de la neuroplasticidad y la excitotoxicidad (neurotoxicidad asociada con la excitación excesiva; parece ser una reacción protectora de las células nerviosas de la sobreexcitación: el número de neuronas y conexiones entre ellas disminuye).
En las células gliales, hay una proteína transportadora que participa en la transferencia de glutamato desde la hendidura sináptica a la célula glial, donde se metaboliza el glutamato.
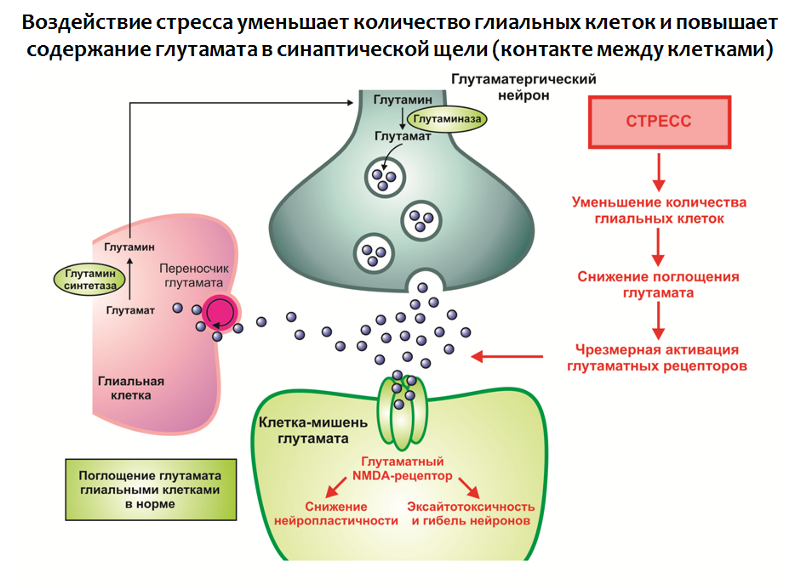 Fig. 30. Rajkowska G., Miguel-Hidalgo JJ Gliogénesis y patología glial en la depresión // SNC y trastornos neurológicos Objetivos farmacológicos. 2007.6 (3). P. 219-233.
Fig. 30. Rajkowska G., Miguel-Hidalgo JJ Gliogénesis y patología glial en la depresión // SNC y trastornos neurológicos Objetivos farmacológicos. 2007.6 (3). P. 219-233.La exposición al estrés en combinación con otros factores conduce a:
1. Una disminución en el número de células gliales en las estructuras del sistema límbico del cerebro;
2. Hiperproducción de glutamato.
Por lo tanto, se forma un exceso de este excitante neurotransmisor, que es un modulador negativo de la neuroplasticidad (se cree que esto puede ser parte de una reacción compensatoria que protege al sistema nervioso de la sobreexcitación).
La función de las células gliales no se limita a la absorción de glutamato, sino que también están involucradas en la producción de neurotrofinas, en particular BDNF (Fig. 31).
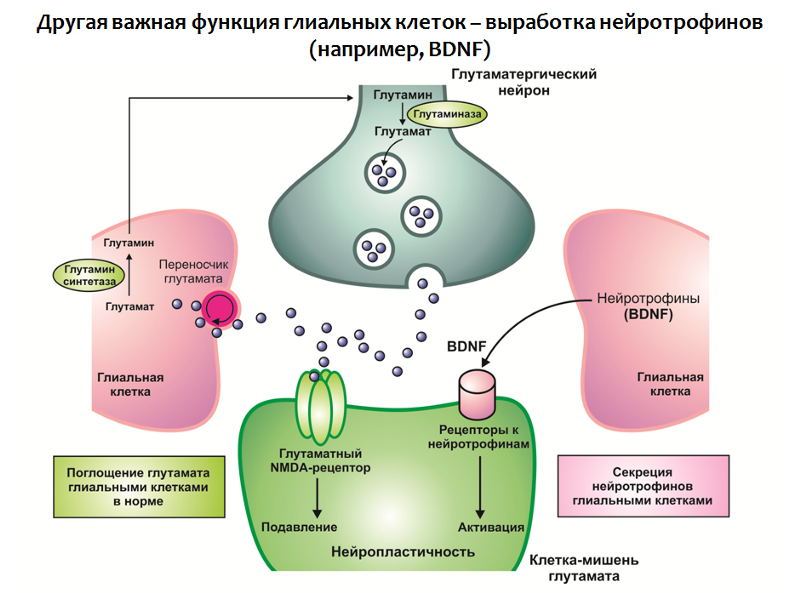 Fig. 31
Fig. 31En conjunto, un déficit de neurotrofinas y un exceso de glutamato conducen a una violación de la neuroplasticidad y a cambios depresivos (una disminución en el volumen del hipocampo y la corteza prefrontal, una violación de la conexión funcional normal entre las estructuras del círculo límbico).
En el contexto de este concepto, también es posible encontrar explicaciones para la eficacia terapéutica de los antidepresivos (Fig. 32):
1. Los antidepresivos pueden "mitigar" el efecto del estrés al normalizar la actividad del eje hipotalámico-pituitario-adrenal;
2. Aumentar la concentración de BDNF en el sistema nervioso central;
3. Estimular los procesos de neuroplasticidad.
 Fig. 32
Fig. 32La Figura 33 muestra un esquema generalizado de trastorno depresivo, que se basa en el concepto de neurodegeneración mediada por el estrés. Se ve que los antidepresivos ocupan el nicho de "correctores de los efectos del estrés". Con todas las ventajas y el potencial terapéutico, los antidepresivos no siempre son efectivos para eliminar los síntomas depresivos.
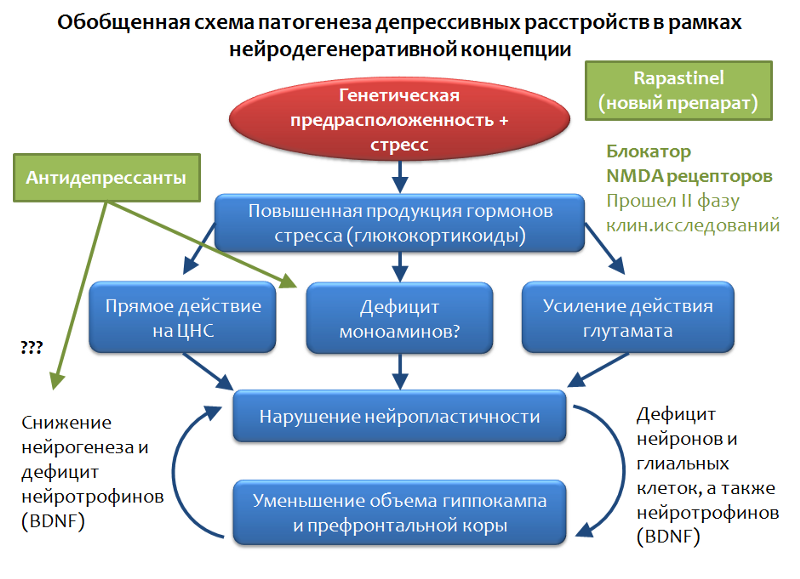 Fig. 33
Fig. 33Existen las denominadas formas de trastornos depresivos resistentes a la farmacoterapia. Intentan explicar este fenómeno con una variedad de factores de estrés, y con diferente fuerza y duración de la exposición al estrés, y con características individuales (mutación de objetivos antidepresivos). Pero solo hay una conclusión de esta situación: es necesaria una búsqueda de objetivos fundamentalmente nuevos para la farmacoterapia de los trastornos depresivos.
Nuevas tendencias en la creación de antidepresivos.
Una dirección prometedora es el efecto sobre el sistema de glutamato, si consideramos este neurotransmisor como uno de los elementos clave en la patogénesis de los trastornos depresivos. Se ha logrado un éxito significativo en esta área: se ha creado un antidepresivo fundamentalmente nuevo, que por su mecanismo es un
bloqueador de los receptores de glutamato NMDA y evita la actividad excesiva de este aminoácido. El antidepresivo Rapasintel ha pasado con éxito la Fase I y II de los ensayos clínicos, donde se ha demostrado que es altamente efectivo y se considera como un tratamiento para las formas persistentes de trastornos depresivos.
En el marco de la teoría glutamatérgica de los trastornos depresivos, se puede considerar el papel del principal mediador inhibidor del sistema nervioso central: el ácido gamma-aminobutírico (GABA o GABA).
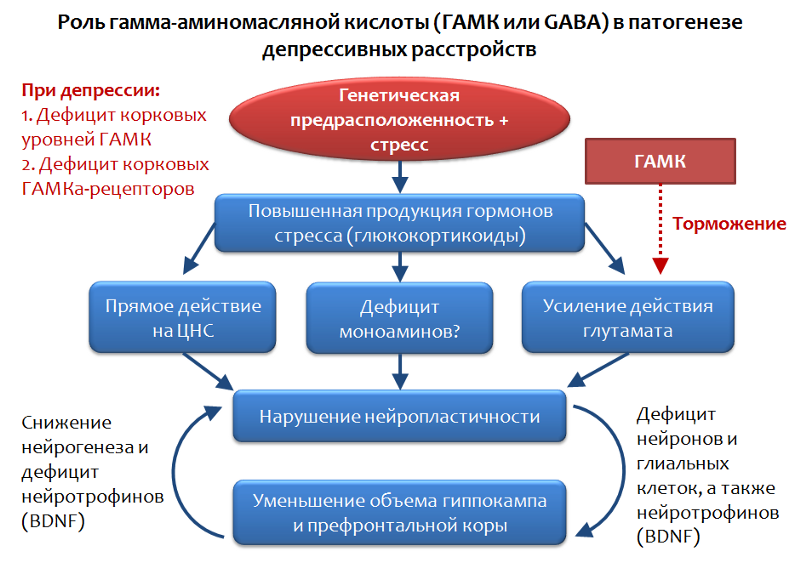 Fig. 34. Möhler H. El sistema GABA en ansiedad y depresión y su potencial terapéutico // Neurofarmacología. 2012. enero 62 (1). P. 42-53.
Fig. 34. Möhler H. El sistema GABA en ansiedad y depresión y su potencial terapéutico // Neurofarmacología. 2012. enero 62 (1). P. 42-53.GABA es el opuesto funcional del glutamato y puede limitar su efecto estimulante, por lo tanto, la evaluación del papel de GABA en los trastornos depresivos parece bastante lógica.
Se ha establecido que, en el contexto de los trastornos depresivos, se observa una deficiencia de los niveles corticales de GABA y sus receptores. En particular, las neuronas piramidales que producen glutamato pueden ser inhibidas por las interneuronas que producen GABA. GABA realiza su efecto inhibitorio al activar el receptor GABA-A.
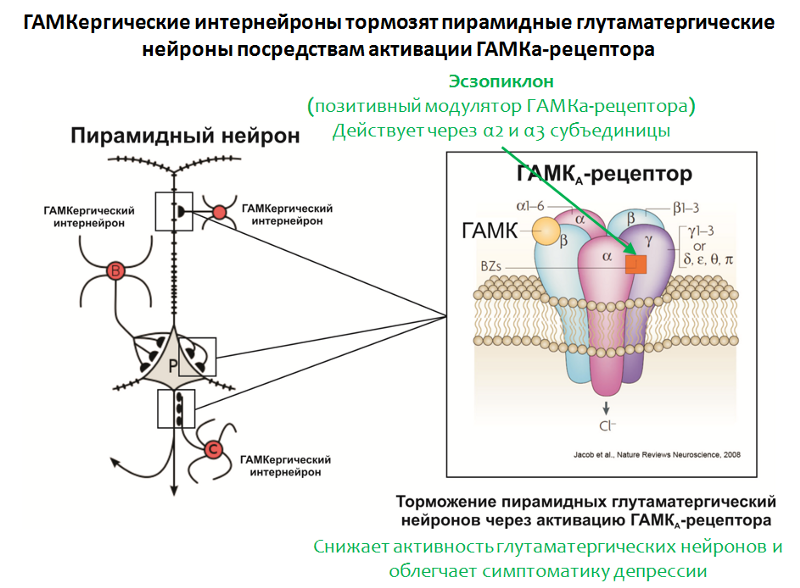 Fig. 35. Möhler H. El sistema GABA en ansiedad y depresión y su potencial terapéutico // Neurofarmacología. 2012. enero 62 (1). P. 42-53.La estructura del receptor GABA-A
Fig. 35. Möhler H. El sistema GABA en ansiedad y depresión y su potencial terapéutico // Neurofarmacología. 2012. enero 62 (1). P. 42-53.La estructura del receptor GABA-A se muestra en la Figura 35. El receptor consta de 5 subunidades (2α, 2β y γ), cada subunidad tiene un subtipo, por ejemplo, se conocen 6 variantes de subunidades α. La combinación de diferentes variantes de subunidades determina el subtipo del receptor GABA-A.
En apoyo del papel de GABA, la efectividad del modulador positivo del receptor GABA-A, el esopiclon, también habla. El objetivo de este medicamento son los receptores GABA-A que transportan subunidades α2 y α3 en su composición.
El eszopiklon a veces se usa en combinación con antidepresivos y alivia significativamente los síntomas depresivos incluso después de la abstinencia de antidepresivos. Se cree que su efecto terapéutico está asociado con una disminución en la función del glutamato. Curiosamente, otros moduladores positivos del receptor GABA-A (que requieren la presencia de otras variantes de las subunidades α, por ejemplo,
zolpidem ) no poseen dicha actividad.
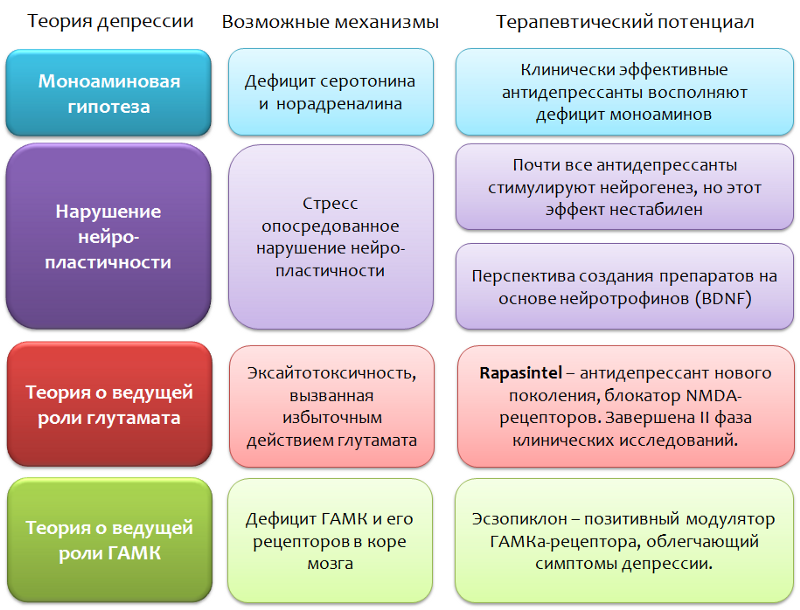 Fig. 36
Fig. 36Y así, en el esquema presentado (Fig. 37) resumimos datos sobre la violación de los procesos de neuroplasticidad y el desarrollo de síntomas depresivos.
1) La supresión de los procesos de neuroplasticidad no es estrictamente específica para los trastornos depresivos, pero también se observa en otras psicopatologías (esquizofrenia, trastorno afectivo bipolar) y enfermedades neurológicas (esclerosis múltiple, enfermedad de Parkinson, enfermedad de Alzheimer).
2) En modelos animales, la supresión de la proliferación de células madre por agentes químicos no bloquea los efectos de los antidepresivos (a diferencia de los rayos X, donde se observa el efecto contrario).
3) El recurso de la neurogénesis puede ser limitado, y la estimulación excesiva puede conducir al agotamiento.
4) Se desconocen los efectos a largo plazo de la estimulación artificial prolongada de la neurogénesis. ¿Existe el riesgo de desarrollar un proceso tumoral?
5) La violación de la neuroplasticidad no es un concepto exhaustivo de los trastornos depresivos. El concepto no puede explicar completamente la presencia de TODOS los síntomas de la enfermedad (por ejemplo, somatización de los síntomas depresivos, cuando los síntomas de la depresión se disfrazan como enfermedades de los órganos internos: dolor de cabeza, dolor en el corazón, abdomen, etc.), la naturaleza del curso (ciclo) y la resistencia. Algunas formas de depresión al tratamiento farmacológico (a pesar de que los antidepresivos activan la neurogénesis y aumentan el BDNF).
Violación de los procesos de neuroplasticidad y trastornos depresivos: defectos en el concepto
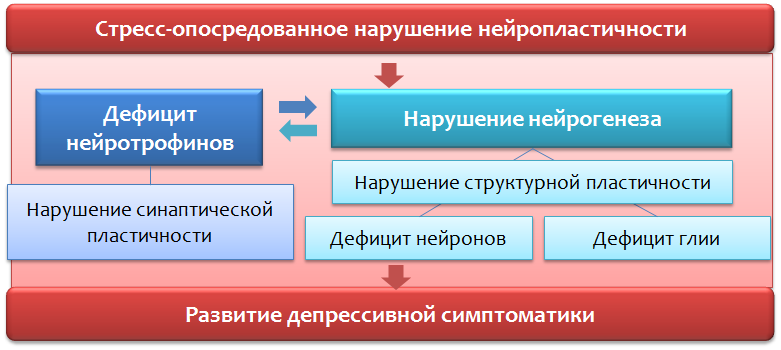 Fig. 37
Fig. 37- La supresión de los procesos de neuroplasticidad no es específica para los trastornos depresivos.
- En modelos animales, la supresión de la proliferación de células madre no siempre bloquea los efectos de los antidepresivos.
- El recurso de la neurogénesis puede ser limitado, y la estimulación excesiva puede conducir al agotamiento.
- Se desconocen las consecuencias a largo plazo de la estimulación "violenta" prolongada de la neurogénesis. ¿Existe el riesgo de desarrollar un proceso tumoral?
- La violación de la neuroplasticidad no es un concepto exhaustivo de los trastornos depresivos.
Las teorías sobre el papel de los aminoácidos neurotransmisores - glutamato y GABA, no son exhaustivas. En primer lugar, los sistemas presentados (glutamatérgicos y GABAérgicos) no pueden considerarse de forma aislada de otros factores, porque de hecho, son un enlace intermedio en la patogénesis de los trastornos depresivos o síntomas individuales. En segundo lugar, los cambios en los sistemas glutamatérgicos y GABAérgicos del cerebro se observan no solo en la depresión, sino también en otros trastornos y afecciones (esquizofrenia, trastornos de ansiedad, ataques de pánico, epilepsia, sensibilidad al dolor, enfermedad de Parkinson, enfermedad de Alzheimer).
 Fig. 38
Fig. 38Si consideramos la intervención farmacológica en el sistema glutamatérgico, entonces es indudablemente prometedora e incluso innovadora, porque anteriormente, todos los antidepresivos actuaban exclusivamente en el sistema monoaminegico del cerebro. Sin embargo, una función tan amplia del glutamato en el sistema nervioso central puede conducir al desarrollo de efectos indeseables y una serie de contraindicaciones. Pero es demasiado pronto para hacer predicciones, el bloqueador del receptor de glutamato aún no ha pasado por los ensayos clínicos de fase III. El medicamento no se considera como un reemplazo de los antidepresivos modernos, sino como un medio de terapia complementaria (por ejemplo, con formas persistentes de depresión).
Los medicamentos que son moduladores positivos de los receptores GABAA no se consideran actualmente antidepresivos independientes, son útiles para eliminar los síntomas individuales de los trastornos depresivos.
Droga "ideal"
Una dirección prometedora para el desarrollo de nuevos antidepresivos efectivos y seguros es el estudio de los mecanismos del estrés en sí mismo, ya que es el factor de estrés (eventos estresantes) el principal desencadenante de la formación de trastornos depresivos.
¿Cómo debería ser una droga prometedora?
La búsqueda y creación de un antidepresivo "ideal" debe basarse en dos principios simples (según Franco Borsini):
1. La droga no debe cambiar la psique de una persona sana
2. La droga debe actuar solo en condiciones de psicopatología.
 Fig. 39. Borsini F. Modelos para la depresión en la detección de drogas y los estudios preclínicos: Direcciones futuras // World Journal of Pharmacology. 2012.1 (1). P. 21–29.
Fig. 39. Borsini F. Modelos para la depresión en la detección de drogas y los estudios preclínicos: Direcciones futuras // World Journal of Pharmacology. 2012.1 (1). P. 21–29.La interrupción de los mecanismos de estrés en las primeras etapas evitaría todos los cambios que se consideraron en el contexto de nuestro artículo. Tal método de corrección, en teoría, parece ser el más efectivo no solo para prevenir el desarrollo de depresión, sino también para una protección confiable contra recaídas y episodios repetidos y más graves.
La farmacoterapia, en sí misma, no es el único medio de corrección de la psicopatología considerada. No se debe dar menos importancia a la comunicación con los pacientes, identificando la causa de la enfermedad. En algunos casos, la efectividad de la psicoterapia también tiene un alto potencial, ya que Ayuda a encontrar soluciones al problema y no combate los síntomas de la enfermedad, deja el problema sin resolver y traduce la depresión en formas subcrónicas y crónicas.