La neurogénesis es un proceso de múltiples etapas de la formación de nuevas células nerviosas en el sistema nervioso central maduro (SNC), que es su función adaptativa.
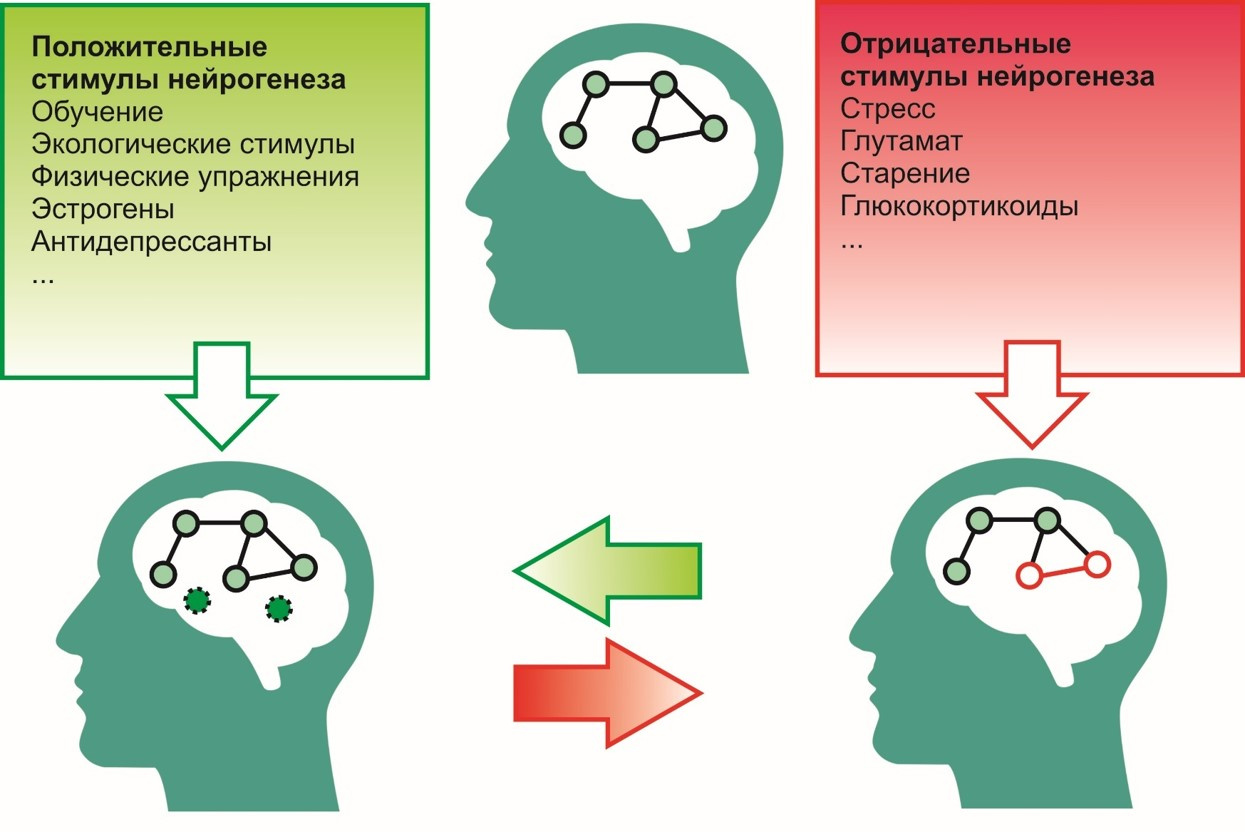
A incentivos positivos, es decir Los incentivos que contribuyen al proceso de neurogénesis incluyen:
- proceso de aprendizaje
- ambiente ecológico (ambiente favorable),
- ejercicios físicos (por ejemplo, correr)
- antidepresivos
- estrógenos etc.
A negativo -
- estrés
- actividad excesiva de glutamato en el sistema nervioso central,
- exposición a glucorticoides (cortisol - hormona del estrés),
- envejecimiento y otros.
Durante muchos años en neurobiología central, hubo dogmas centrales que no permitían la posibilidad misma de neurogénesis.
 La noción de la ausencia de neurogénesis en el cerebro de los vertebrados maduros se basó en cuatro principios:
La noción de la ausencia de neurogénesis en el cerebro de los vertebrados maduros se basó en cuatro principios:- Clínica. Los pacientes que sufren patologías neurológicas con una lesión predominante del sistema nervioso central no experimentan una recuperación funcional. Los trastornos cerebrovasculares, las lesiones traumáticas y las enfermedades neurodegenerativas, como la enfermedad de Parkinson y la enfermedad de Alzheimer, son patologías del sistema nervioso central con progresivo y empeoramiento del estado clínico del paciente. En general, varios métodos de tratamiento solo pueden eliminar los síntomas, pero no detener el desarrollo de la enfermedad.
- Funcional Se basa en el hecho de que el sistema nervioso central controla muchos procesos complejos: la regulación de las emociones, movimientos, reflejos, etc. La gestión de procesos tan complejos requiere un ajuste extremadamente preciso y preciso. Se creía que la formación de nuevas células nerviosas, su diferenciación y migración podrían alterar la organización estructural y funcional de las vías neuronales existentes e interrumpir el sistema nervioso central.
- Asociado a la teoría de la memoria y el aprendizaje. Durante mucho tiempo, se creía que los "recuerdos" son la extracción de información de las redes neuronales formadas durante el proceso de entrenamiento. En este contexto, la formación de nuevas células nerviosas se consideró como un evento incompatible con la memoria.
- Técnico y experimental. Falta de capacidad técnica para descubrir neurogénesis y células madre nerviosas en el sistema nervioso central maduro.
Etapas de formación de ideas sobre la neurogénesis del cerebro maduro.- 60s - Joseph Altman et al. Las células de la circunvolución dentada del hipocampo pueden incluir timidina radioactiva, que está integrada en el ADN de las células en división, lo que permite su visualización. Debido a la falta de marcadores moleculares, fue imposible demostrar que las neuronas estaban etiquetadas.
DOI: 10.1126 / science.135.3509.1127
- Años 70 - Michael Kaplan y James Hinds. Reprodujeron el experimento de Altman y confirmaron por microscopía electrónica que son las neuronas (giro dentado y bulbo olfativo) las que están marcadas.
DOI: 10.1126 / ciencia.887941
- 80s - Fernando Notteboom. Mostró que durante la temporada de apareamiento en los núcleos cerebrales de los canarios responsables de la vocalización y el entrenamiento, el número de neuronas aumenta bruscamente.
DOI: 10.1038 / scientificamerican0289-74
- 90 - Peter Ericsson et al. Por primera vez, se mostró la formación de nuevas neuronas en el hipocampo humano.
DOI: 10.1038 / 3305
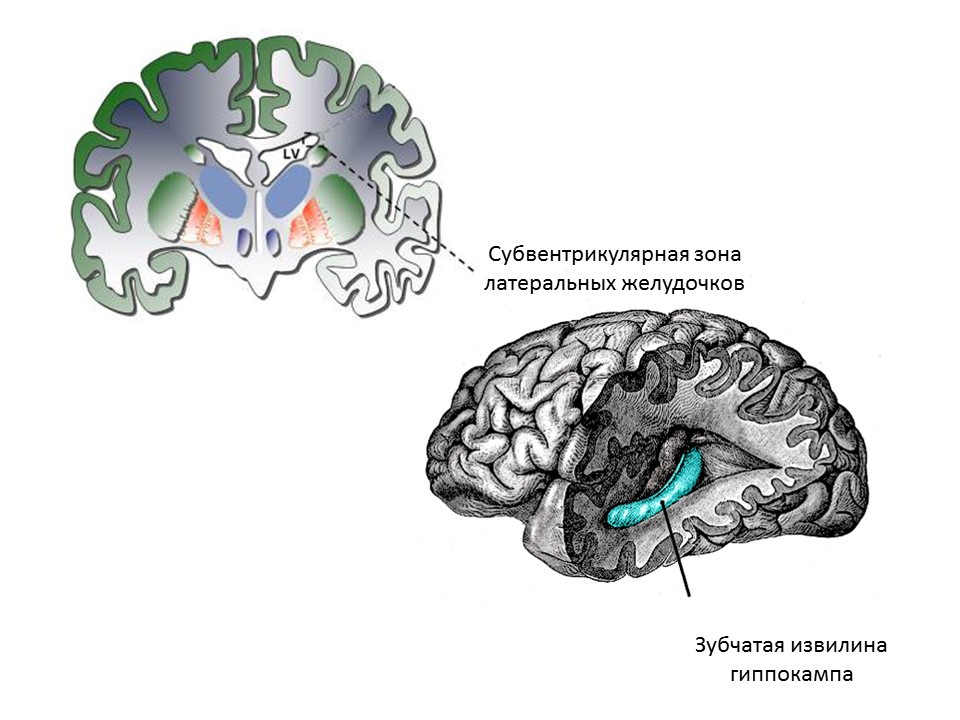
Las principales zonas neurogénicas del cerebro adulto (o maduro) son la circunvolución dentada del hipocampo y la zona subventricular de los ventrículos laterales. Las zonas se muestran en la figura.
 Etapas de la neurogénesis en la circunvolución dentada del hipocampo del cerebro maduro.
Etapas de la neurogénesis en la circunvolución dentada del hipocampo del cerebro maduro.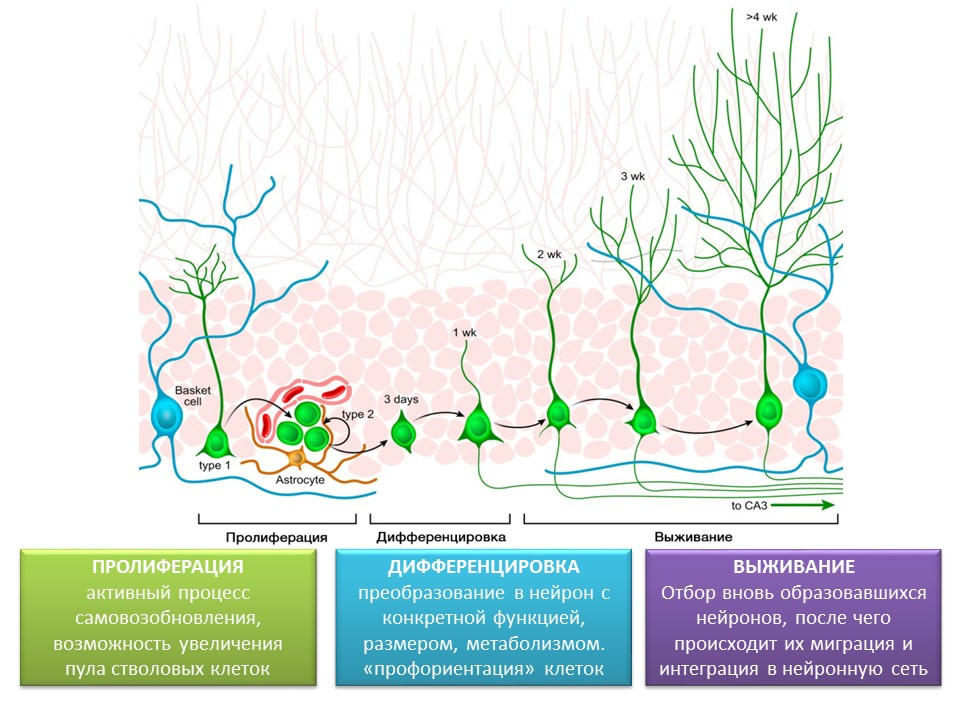
La proliferación es un proceso activo de autorrenovación, la posibilidad de aumentar el conjunto de células madre.
Diferenciación: conversión en una neurona con una función específica, tamaño, metabolismo. De hecho, la "orientación profesional" de las futuras células nerviosas.
La supervivencia es la selección de neuronas recién formadas, después de las cuales migran e integran en la red neuronal. La selección de las células nerviosas es la apoptosis (muerte programada) de una parte de las neuronas formadas. Las células restantes migran a la región correspondiente del cerebro y se integran en la red neuronal.
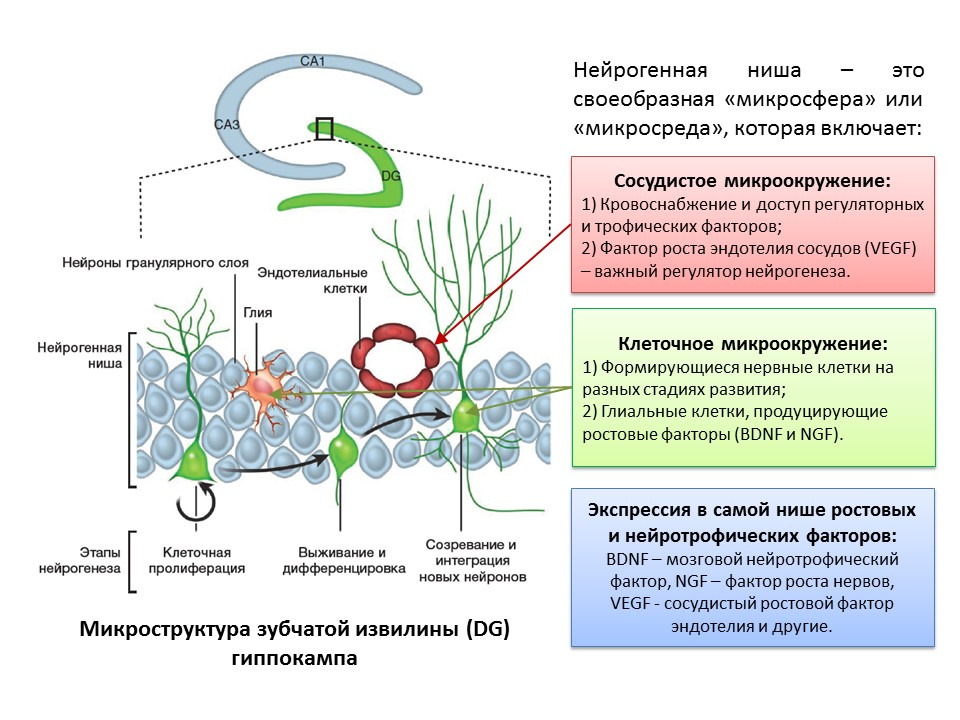
El término "neurogénesis" está inextricablemente relacionado con el concepto de "nicho neurogénico". El "nicho neurogénico" en sí mismo es una "microesfera" en la que tiene lugar el proceso de neurogénesis. El nicho neurogénico incluye:
- microambiente vascular, que, en primer lugar, suministra sangre al nicho en sí mismo y asegura el suministro de diversas moléculas reguladoras (las células madre se forman y transforman muy cerca de los vasos sanguíneos, y en segundo lugar, el factor de crecimiento endotelial vascular (VEGF) es un importante factor regulador no solo en el proceso de angiogénesis (el crecimiento de nuevos vasos en el sistema vascular existente) y vasculogénesis (la formación del sistema vascular embrionario), pero también un regulador directo de la neurogénesis;
- microambiente celular, que incluye células nerviosas en diversas etapas de desarrollo y células gliales que realizan la función trófica (producen factores de crecimiento, por ejemplo, factor neurotrófico cerebral - BDNF y factor de crecimiento nervioso - NGF);
- expresión en el nicho de crecimiento y factores reguladores. Además de las células gliales y otras estructuras maduras del nicho, las células madre son capaces de producir factores reguladores y de crecimiento, realizando así la autorregulación (regulación autocrina).
Evaluación de los procesos de neurogénesis utilizando marcadores específicos.
Un tema importante e interesante que merece especial atención es la cuestión de cómo detectar la neurogénesis en los tejidos cerebrales de los mamíferos maduros.
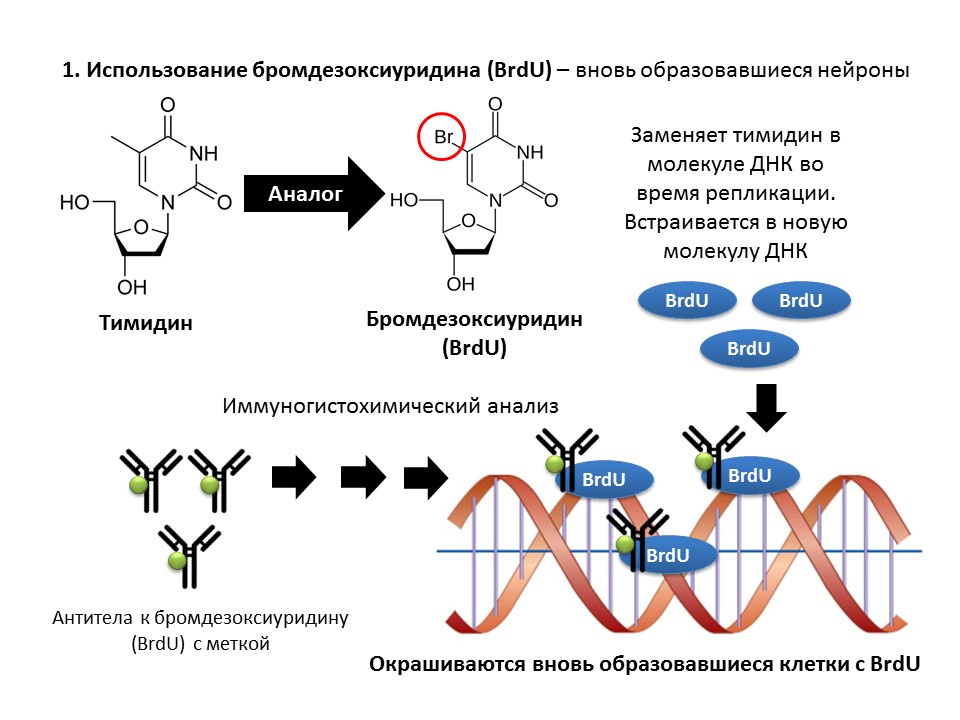
La bromodeoxiuridina (BrdU) es un análogo estructural de la timidina, un componente de la molécula de ADN. Cuando se introduce en el cuerpo, BrdU se inserta en el ADN de las células en división en lugar de la timidina, lo que brinda la oportunidad de detectar células recién formadas y separarlas de las "viejas". Después de obtener una muestra de tejido cerebral, se tratan con anticuerpos contra BrdU (los anticuerpos contienen una etiqueta fluorescente), que se unen a BrdU a través del mecanismo de reacción inmunoquímica antígeno-anticuerpo y permiten la determinación colorimétrica de BrdU. Por lo tanto, en una micropreparación es posible cuantificar las células marcadas con BrdU, las llamadas células positivas de BrdU.
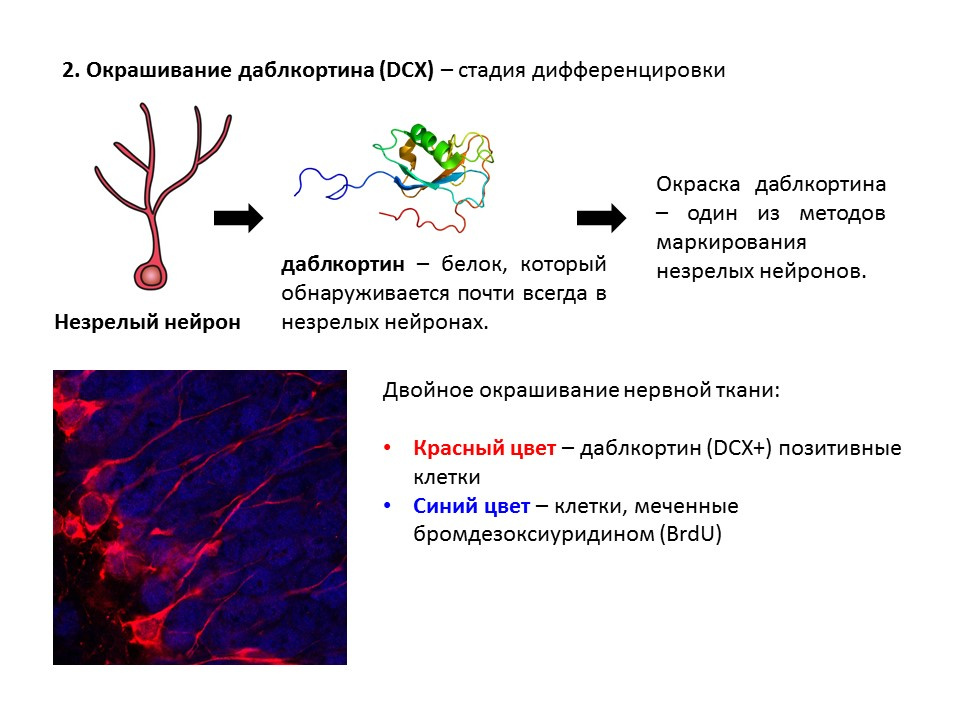
Doublecortin es una proteína que casi siempre se encuentra en neuronas inmaduras y permite detectarlas.
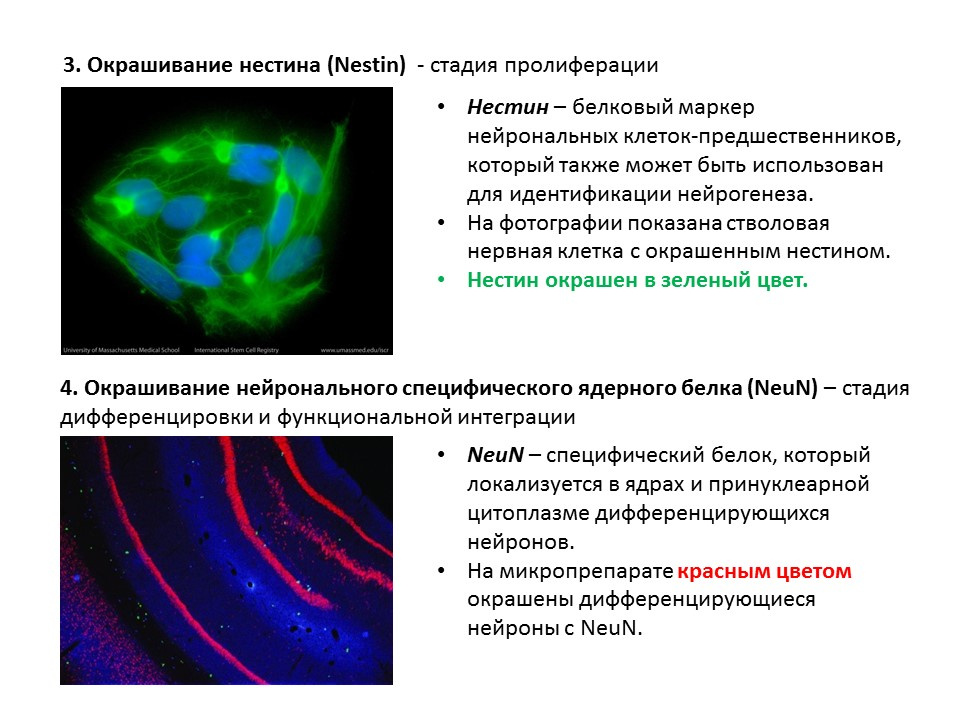
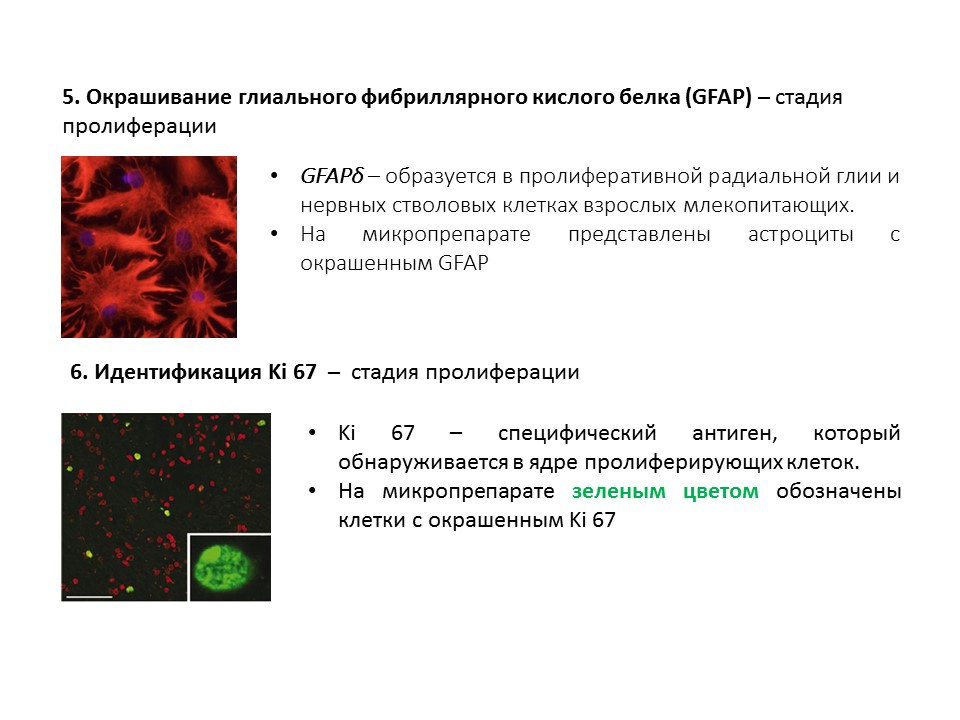 Un diagrama de resumen de los principales métodos para detectar las diversas etapas de la neurogénesis, que resume la información presentada anteriormente.
Un diagrama de resumen de los principales métodos para detectar las diversas etapas de la neurogénesis, que resume la información presentada anteriormente.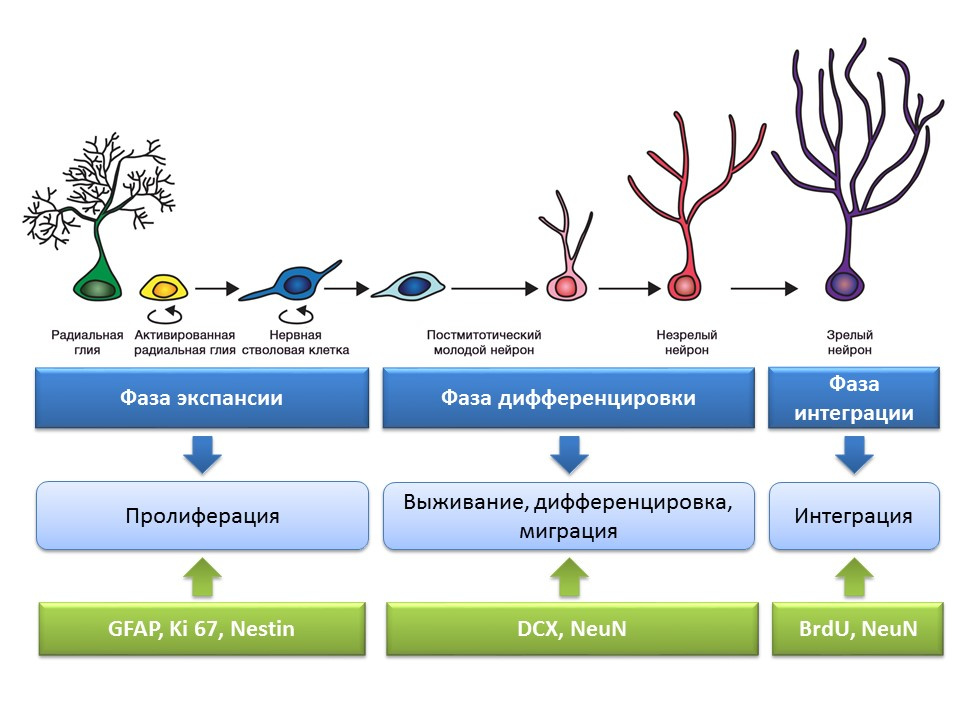
Regulación de la neurogénesis en el cerebro maduro.
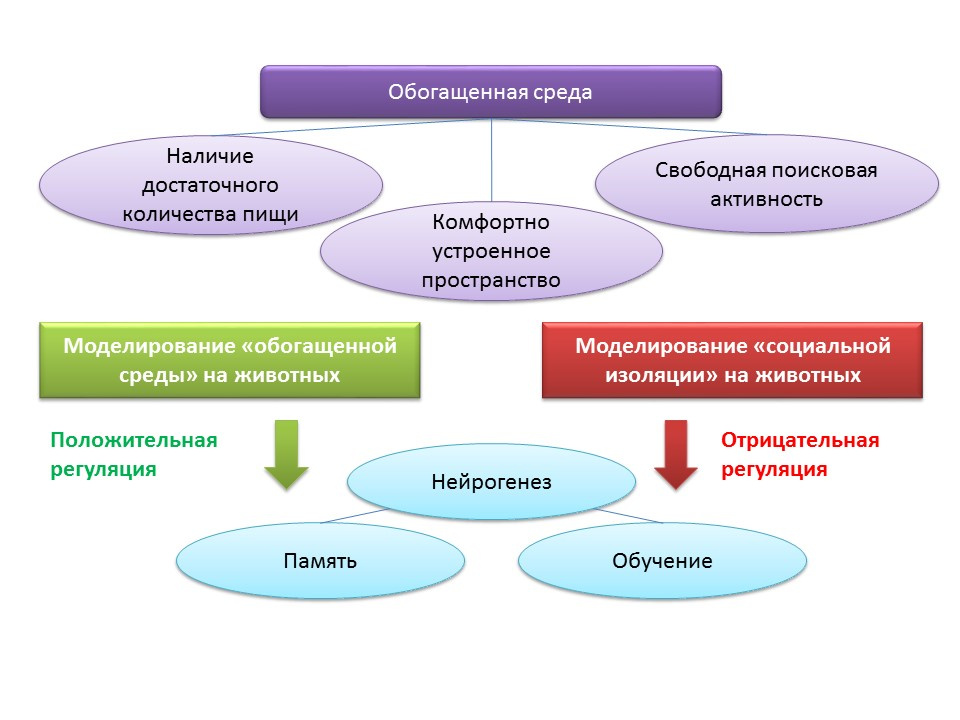
Los factores ambientales de regulación de la neurogénesis están asociados con el concepto de "ambiente enriquecido". El término "entorno enriquecido" en sí mismo incluye un entorno de vida favorable, es decir, la presencia de alimentos suficientes, un espacio confortable y la oportunidad de realizar actividades de búsqueda gratuitas.
 DOI: 10.1002 / hipo.22218DOI: 10.1038 / 386493a0DOI: 10.1016 / j.brainres.2011.08.00.007DOI: 10.1016 / j.neuroscience.2011.10.040PMID: 9547229
DOI: 10.1002 / hipo.22218DOI: 10.1038 / 386493a0DOI: 10.1016 / j.brainres.2011.08.00.007DOI: 10.1016 / j.neuroscience.2011.10.040PMID: 9547229En experimentos con animales, se descubrió que permanecer en un "ambiente enriquecido" tiene un efecto positivo sobre la neurogénesis: la producción de factores de crecimiento y neurotrofinas, el número de células proliferantes y su supervivencia aumentan. El aumento de la neurogénesis se correlaciona con una función cognitiva mejorada en los animales (principalmente con el aprendizaje y la memoria).
Los ratones experimentales C57BL / 6J se mantuvieron durante 2 meses en un espacio protegido bajo las condiciones de una estación biológica (en un claro del bosque), y el grupo de control se mantuvo en condiciones estándar de laboratorio. En animales del grupo experimental, se observó un aumento en el número de sinapsis excitatorias e inhibitorias en comparación con el grupo control. Este experimento muestra que las condiciones ambientales pueden influir favorablemente en la morfología y la función del sistema nervioso central de los roedores ubicados en un ambiente enriquecido.
Mantener a los animales en condiciones de aislamiento social en el laboratorio, por el contrario, actuó como un regulador negativo de la neurogénesis.
Además, la colocación de animales en un "ambiente enriquecido" después de la isquemia cerebral contribuyó al fortalecimiento de los procesos regenerativos en las zonas neurogénicas del cerebro.
Los resultados de tales estudios no son algo extraordinario, ya que en la medicina moderna se utilizan cursos de rehabilitación y vacaciones de bienestar.
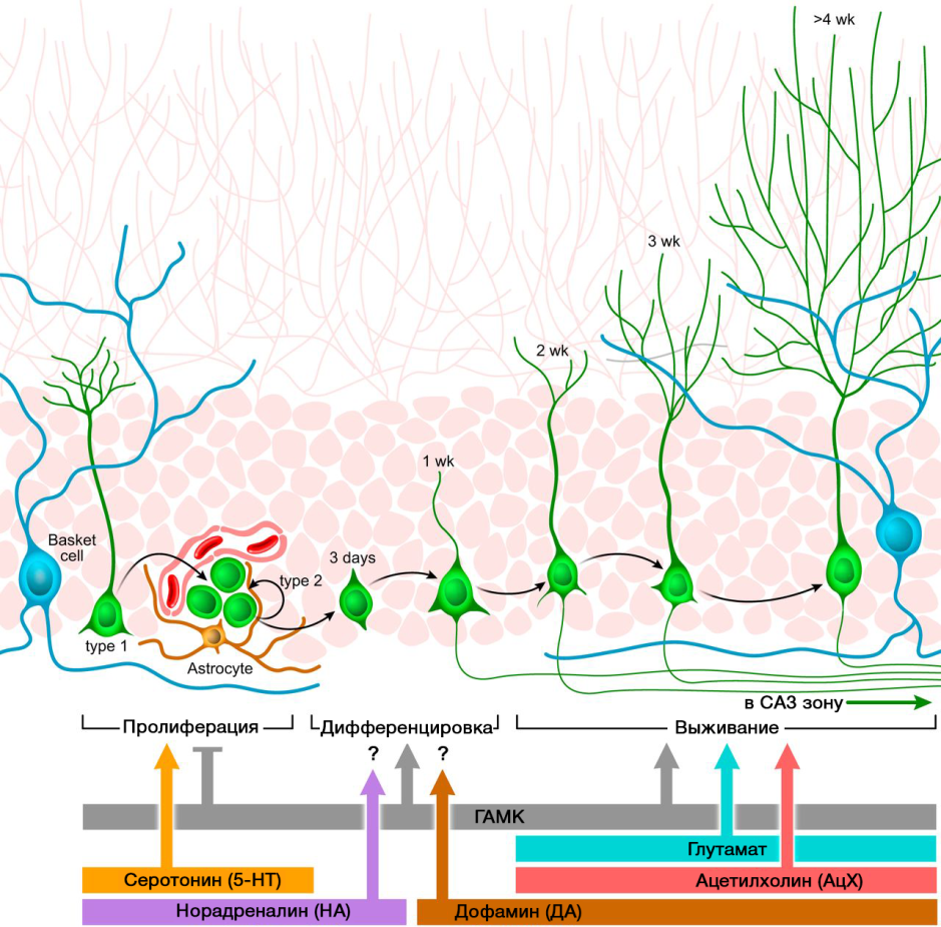
Los neurotransmisores del sistema nervioso central juegan un papel importante en la regulación de la neurogénesis. La imagen muestra un diagrama resumido de dicha regulación.
 DOI: 10.1152 / physrev.00004.2014
DOI: 10.1152 / physrev.00004.2014El papel regulador de los neurotransmisores del SNC presentados en los procesos de neurogénesis se correlaciona con una deficiencia o exceso de estas moléculas en diversas enfermedades del sistema nervioso central asociadas con un cambio en el nivel de neurogénesis.
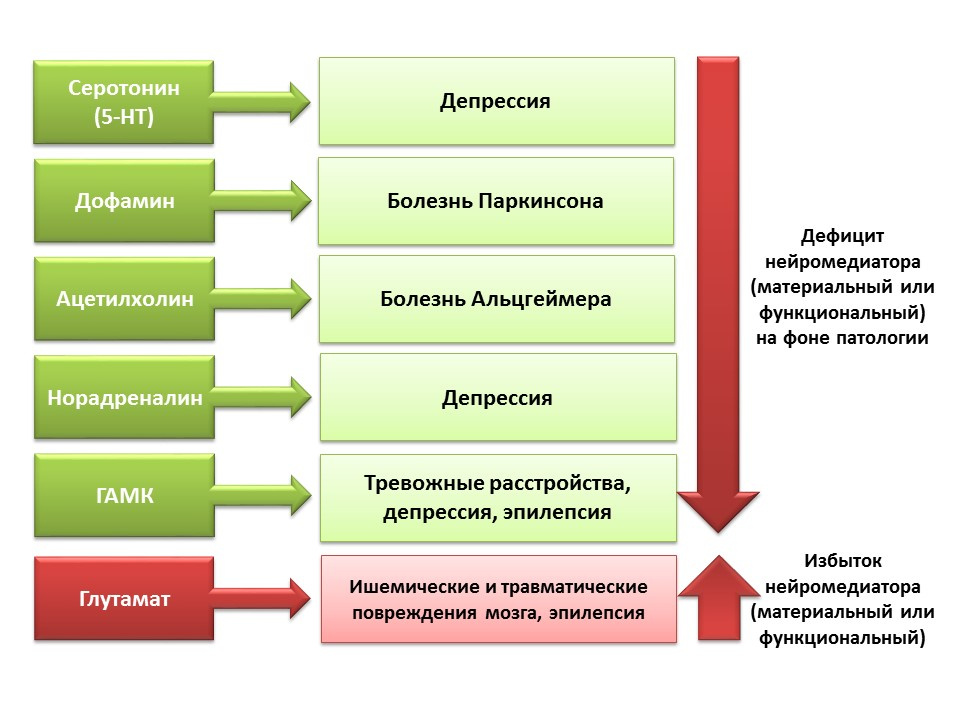
Debido a la posibilidad de manipulación farmacológica de los sistemas de neurotransmisores del sistema nervioso central, podemos evaluar la contribución de un neurotransmisor a las diversas etapas de la neurogénesis del cerebro maduro.
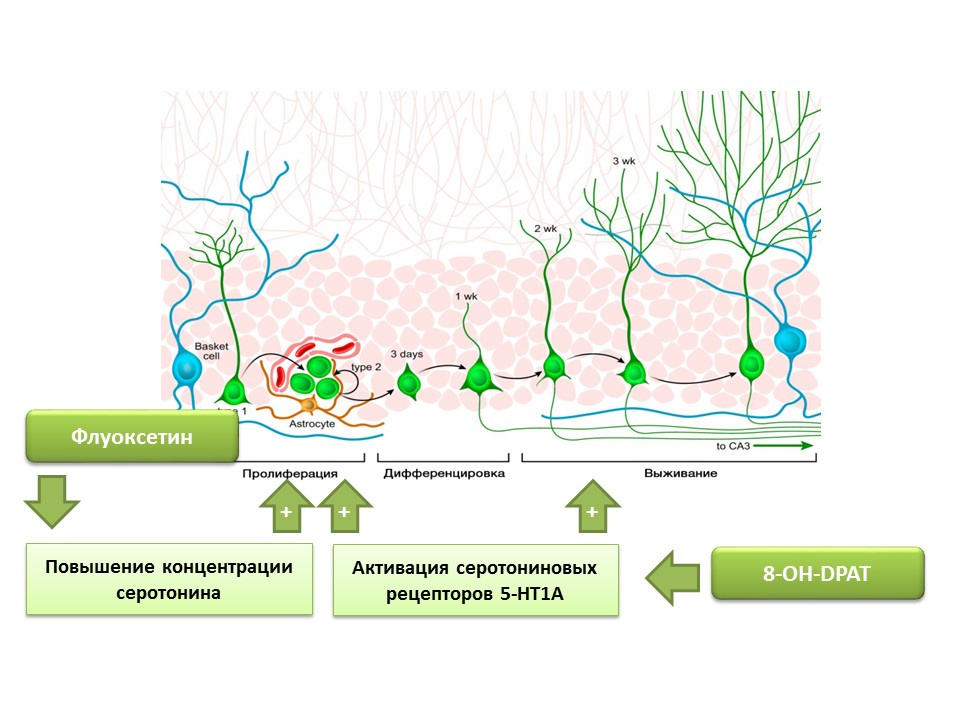
Se estableció que la fluoxetina (un antidepresivo del grupo de inhibidores selectivos de la recaptación de serotonina), que puede aumentar la concentración de serotonina en el sistema nervioso central, aumenta la proliferación de células madre nerviosas en la circunvolución dentada del hipocampo de roedores y primates. Más tarde, se detectaron receptores del subtipo 1A de serotonina (receptores 5-HT1A) en las propias células madre y esto es consistente con la capacidad de la sustancia 8-OH-DPAT (activador selectivo de estos receptores) para estimular la proliferación y supervivencia de nuevas neuronas en la circunvolución dentada del hipocampo de animales experimentales (ratones y ratas)
Los primates fueron expuestos al estrés crónico (aislamiento social), después de lo cual se evaluó el comportamiento depresivo y ansioso, así como la neurogénesis del hipocampo (post-mortal). El estrés crónico condujo a una disminución de la neurogénesis en combinación con déficits conductuales (aumento del comportamiento depresivo y ansioso). El tratamiento con fluoxetina (un antidepresivo que aumenta la concentración de serotonina en el sistema nervioso central al suprimir su recaptación) estimuló la neurogénesis y evitó el comportamiento depresivo y ansioso.
DOI: 10.1371 / journal.pone.0017600
Otro experimento confirma el papel de la serotonina en la regulación de la neurogénesis adulta. La estimulación crónica de los receptores de serotonina 5-HT1A con 8-OH-DPAT en ratas condujo a una mayor proliferación de células madre nerviosas y a la supervivencia de neuronas diferenciadas en el giro dentado del hipocampo y la zona subventricular, así como a un aumento de la gliogénesis.
DOI: 10.1016 / j.euroneuro.2009.11.00.00
Los experimentos presentados confirman el importante papel regulador de la serotonina en los procesos de neurogénesis en el cerebro adulto.
 DOI: 10.4161 / cc.8.18.9512DOI: 10.1016 / j.neuropharm.2011.01.026
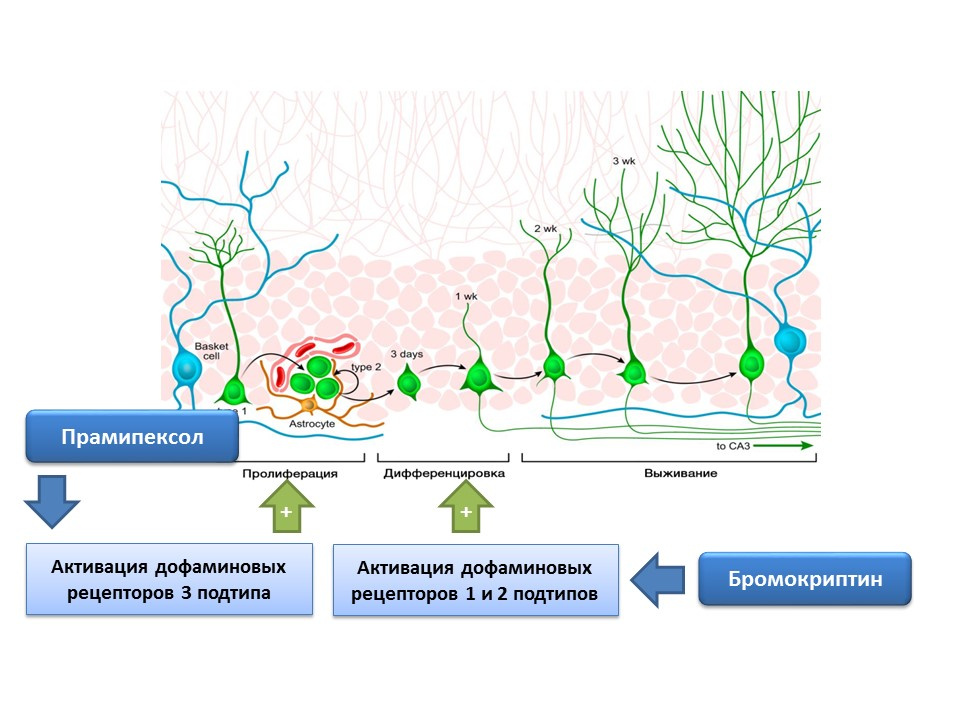
DOI: 10.4161 / cc.8.18.9512DOI: 10.1016 / j.neuropharm.2011.01.026La dopamina también participa activamente en la regulación de la neurogénesis. Se ha demostrado que la activación de los receptores de dopamina de tipo 1 y 2 (D1 y D2) con bromocriptina mejora el proceso de diferenciación de las células madre nerviosas, mientras que la estimulación de los receptores D3 con pramipexol conduce a una mayor proliferación.
El pramipexol, un agonista del receptor de dopamina con una mayor afinidad por los receptores D3 que D2, se usa en la enfermedad de Parkinson, eliminando efectivamente los síntomas de esta enfermedad. Además, el medicamento tiene actividad neuroprotectora. En un experimento, se evaluó el efecto del pramipexol sobre la neurogénesis en un cultivo celular de ratones. Se demostró que el tratamiento del cultivo celular con pramipexol condujo a un aumento en el tamaño de las neuroesferas (grupos de células madre recién formadas) y las células que contienen doublecortin (neuronas inmaduras). El efecto estimulante del pramipexol sobre la neurogénesis fue eliminado por los bloqueadores del receptor de dopamina - U99194A y sulpirida. Además, se ha demostrado que el pramipexol mejora la liberación de BDNF. Los resultados presentados sugieren que la efectividad del pramipexol en la enfermedad de Parkinson se asocia no solo con la reposición de la deficiencia funcional de dopamina, sino también con un efecto estimulante sobre la neurogénesis, y también indica un papel regulador importante de la dopamina en la etapa de proliferación de las células madre nerviosas.
DOI: 10.1016 / j.neuropharm.2011.01.026
Se confirmó experimentalmente la presencia de receptores de dopamina de los subtipos 1 y 2 en las células madre nerviosas, y también se demostró el importante papel regulador de la dopamina en la proliferación y diferenciación en el cultivo de células nerviosas. En particular, el tratamiento del cultivo celular de la zona subventricular con bromocriptina (un estimulador de los subtipos de receptores de dopamina D1 y D2) en condiciones de daño por neurotoxina MPTP (modelado de la enfermedad de Parkinson en el cultivo celular) condujo a una mayor proliferación y diferenciación celular.
DOI: 10.4161 / cc.8.18.9512
La norepinefrina puede aumentar el número de precursores de células madre neurales mediante la activación de receptores adrenérgicos beta-3. Este efecto se mostró usando un agonista selectivo de beta-3-adrenoreceptor (activador) - sustancia BRL37344.
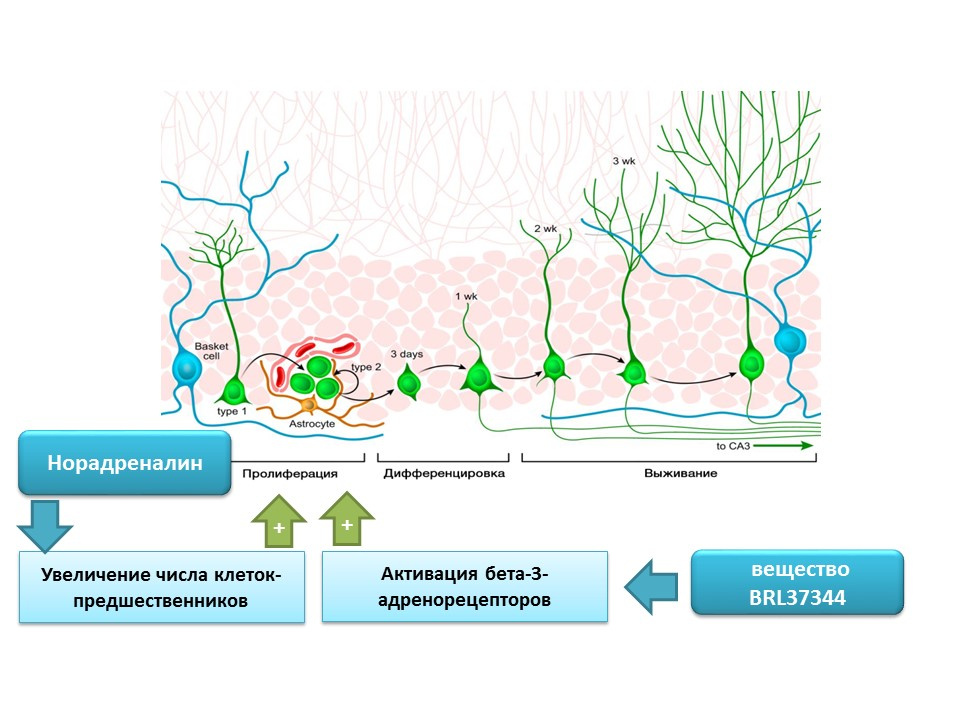
El papel regulador de la noradrenalina en los procesos de neurogénesis madura se evaluó en un estudio exhaustivo in vitro (en cultivo celular) in vivo (en ratones). La adición de noradrenalina al cultivo celular condujo a un aumento en el tamaño de las neuroesferas (acumulaciones de células madre nerviosas). La administración sistémica de un agonista selectivo de receptores beta-3-adrenérgicos condujo a una mayor proliferación de células madre nerviosas en el hipocampo de ratones. Estos estudios confirman la presencia de receptores adrenérgicos en las células nerviosas inmaduras y también indican el papel regulador de la noradrenalina, que aparentemente se realiza a través de los receptores beta-3-adrenérgicos.
DOI: 10.1523 / JNEUROSCI.3780-09-09Las células madre nerviosas, como se mencionó anteriormente, son capaces de producir factores reguladores por sí mismas. Uno de estos factores es el ácido gamma-aminobutírico (GABA), el principal mediador inhibidor del sistema nervioso central. En particular, en un cultivo de precursores de células nerviosas murinas, se demostró que las células madre nerviosas mejoran la síntesis de GABA, que a su vez aumenta la proliferación activando la glía radial (da lugar a células madre) y contribuye a un aumento en el tamaño de las neuroesferas (acumulación de células madre) en el experimento.
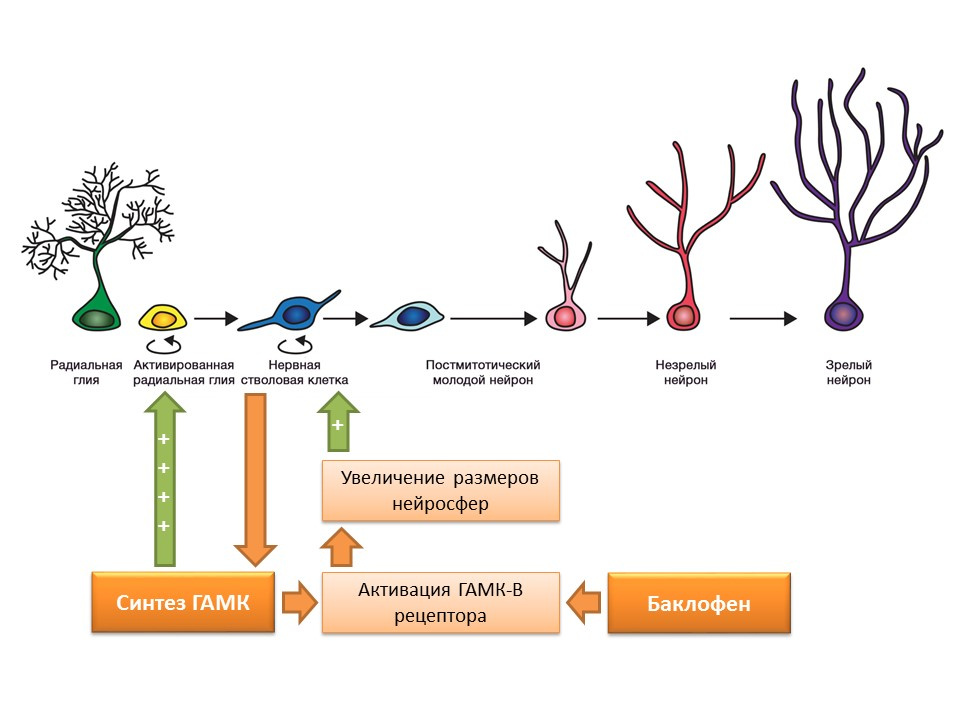
Se descubrió que este efecto de GABA se realiza a través de los receptores GABA-B. Los estudios utilizaron un agonista selectivo del receptor GABA-B: baclofeno.
DOI: 10.1002 / jcp.21422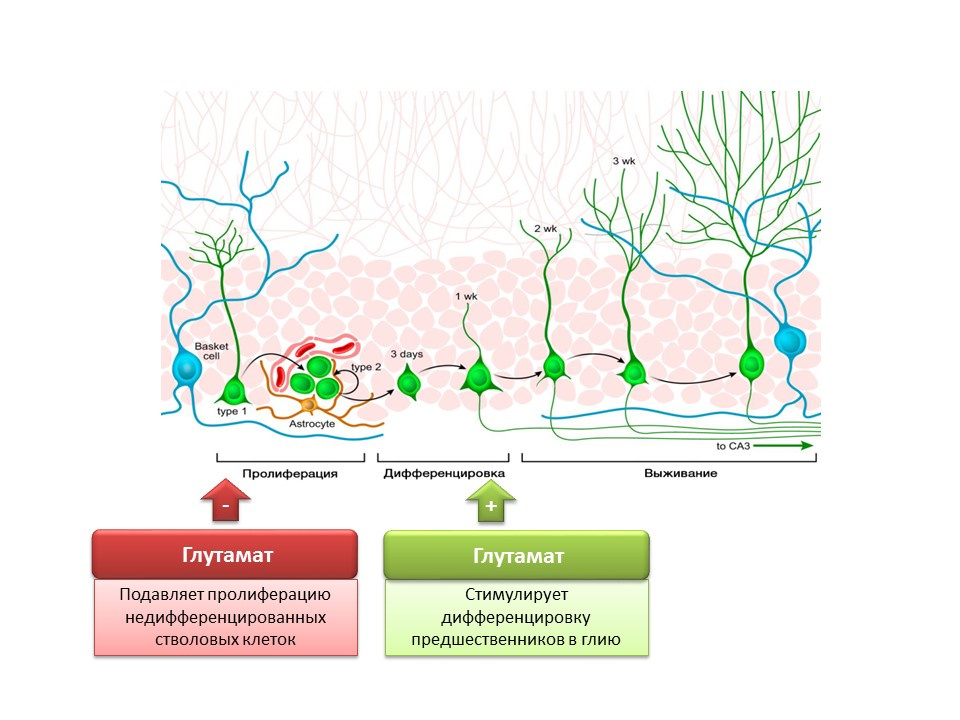 Nakamichi N, Takarada T, Yoneda Y. Neurogénesis mediada por ácido gamma-aminobutírico y señalización de glutamatos. J. Pharmacol Sci. 2009; 110 (2): 133-49
Nakamichi N, Takarada T, Yoneda Y. Neurogénesis mediada por ácido gamma-aminobutírico y señalización de glutamatos. J. Pharmacol Sci. 2009; 110 (2): 133-49El papel del principal mediador emocionante en el sistema nervioso central es doble. Por un lado, el glutamato inhibe la proliferación de células madre indiferenciadas. Por otro lado, estimula la diferenciación de precursores en la línea glial. Se cree que ciertas proporciones de glutamato y GABA son necesarias para regular la diferenciación de las células madre nerviosas en ciertos tipos de neuronas. Por ejemplo, el glutamato, como ya se mencionó, promueve la formación de células gliales (astrocitos), y GABA promueve la formación de neuronas que sintetizan GABA (neuronas GABAérgicas).
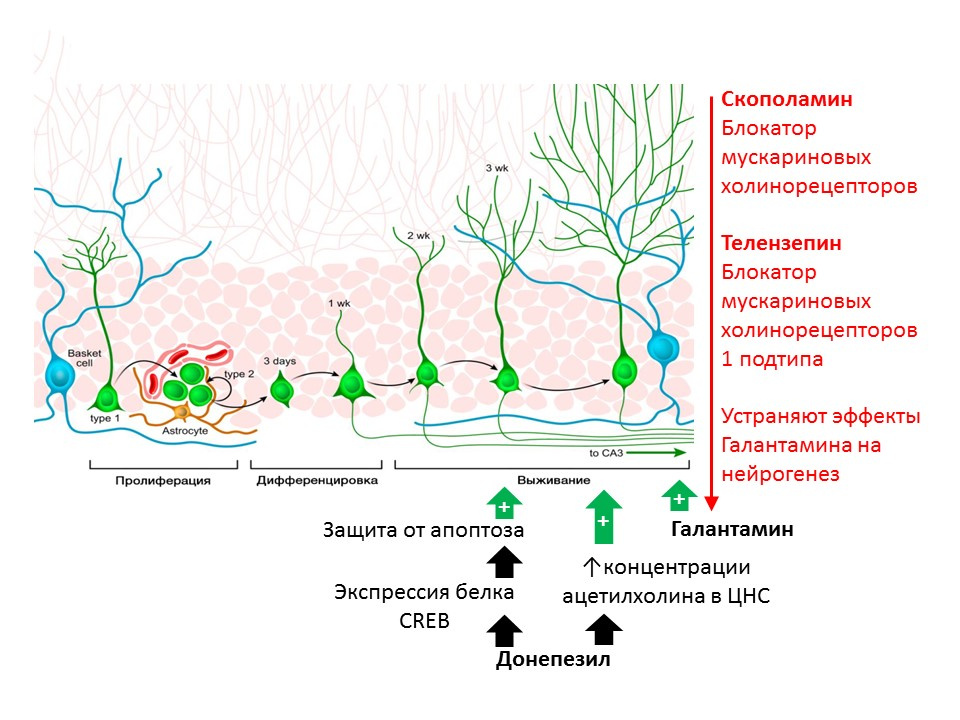 Kotani S y col. H. Donepezil, un inhibidor de la acetilcolinesterasa, mejora la neurogénesis del hipocampo adulto. Chem Biol Interact. 2008; 175 (1-3): 227-30
Kotani S y col. H. Donepezil, un inhibidor de la acetilcolinesterasa, mejora la neurogénesis del hipocampo adulto. Chem Biol Interact. 2008; 175 (1-3): 227-30
Kita Y y col. La galantamina promueve la neurogénesis del hipocampo adulto a través de los receptores nicotínicos muscarínicos y α7 en ratones. Int J Neuropsychopharmacol.2014; 17 (12): 1957-68.El papel regulador de la acetilcolina (ACX) se ha demostrado en ratas que usan sustancias que evitan su destrucción (inhibidores de la acetilcolinesterasa, una enzima que descompone el ACX). El donepezilo y la galantamina aumentan la concentración de ACX en el sistema nervioso central (el donepezilo también aumenta la expresión de la proteína CREB, un factor de transcripción, lo que aumenta la protección de las neuronas inmaduras contra la apoptosis) y aumenta la supervivencia de las neuronas inmaduras. El efecto positivo de la galantamina sobre la neurogénesis es eliminado por la escopolamina (bloqueador de todos los subtipos de receptores colinérgicos muscarínicos) y telenzepina (bloqueador del subtipo 1 de los receptores colinérgicos muscarínicos), lo que sugiere la realización de los efectos ACh en la neurogénesis mediante la activación de los receptores muscarínicos tipo 1 (
Kotani S et al. inhibidor, mejora la neurogénesis del hipocampo adulto. Chem Biol Interact. 2008; 175 (1-3): 227-30; Kita Y et al. Galantamina promueve la neurogénesis del hipocampo adulto a través de receptores nicotínicos Muscarínicos y α7 en ratones. Int J Neuropsychopharmacol. 2014; 17 (12): 1957-68. ).
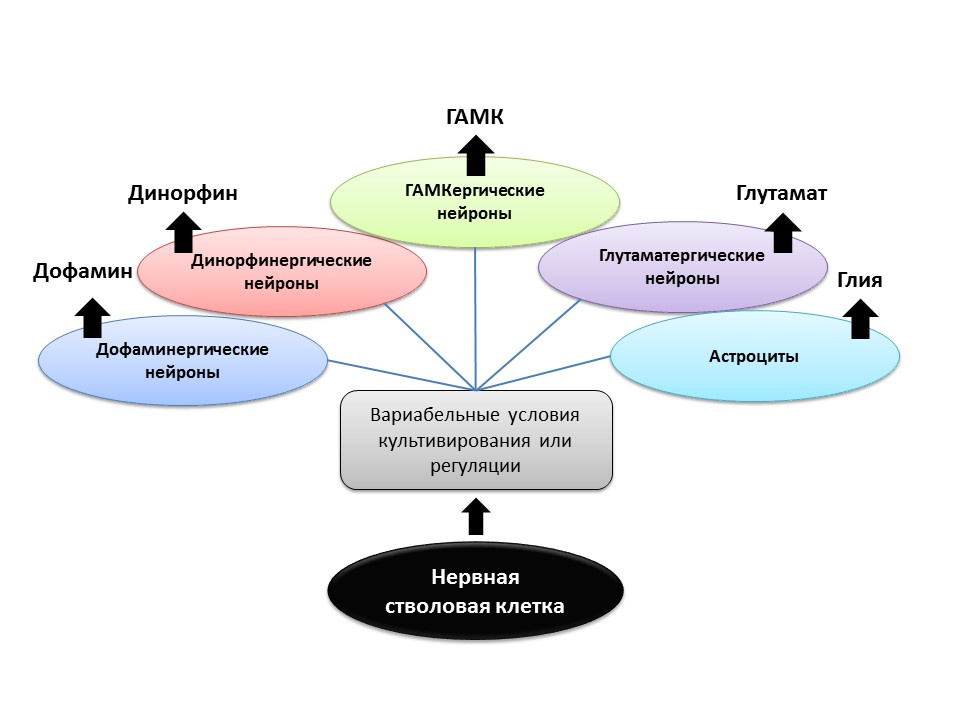
FuentesShetty AK. Las células progenitoras de la región CA3 del hipocampo de rata del día 19 embrionario generan fenotipos neuronales específicos de la región in vitro. Hipocampo 2004; 14 (5): 595-614
Gómez-Lira G y cols. Fenotipo programado e inducido de las células granulares del hipocampo. J Neurosci. 2005; 25 (30): 6939-46
Nakamichi N, Takarada T, Yoneda Y. Neurogénesis mediada por ácido gamma-aminobutírico y señalización de glutamato. J. Pharmacol Sci. 2009; 110 (2): 133-49
Arenas E. Ingeniería de un fenotipo dopaminérgico en células madre / precursoras: papel de Nurr1, señales derivadas de glía y Wnts. Ann NY Acad Sci. 2005; 1049: 51-66
En las condiciones experimentales (en animales o en cultivo celular), se demostró que al cambiar la proporción de factores reguladores y agregar los neurotransmisores a las propias células madre nerviosas, el fenotipo neurotransmisor (es decir, la función de la célula futura) de las neuronas recién formadas puede ser "programado". Entonces, por ejemplo, cultivar células madre con astrocitos le permite obtener una población de neuronas glutamatérgicas (neuronas que producen glutamato), y con dopamina - dopaminérgicas.
Es posible que dicha acción dirigida en el futuro pueda usarse para la formación selectiva de células nerviosas de un determinado fenotipo. Por ejemplo, si sabemos qué tipo se pierde en una enfermedad en particular (con la enfermedad de Parkinson, los dopaminérgicos mueren, con Alzheimer, colinérgicos). , , ( ).
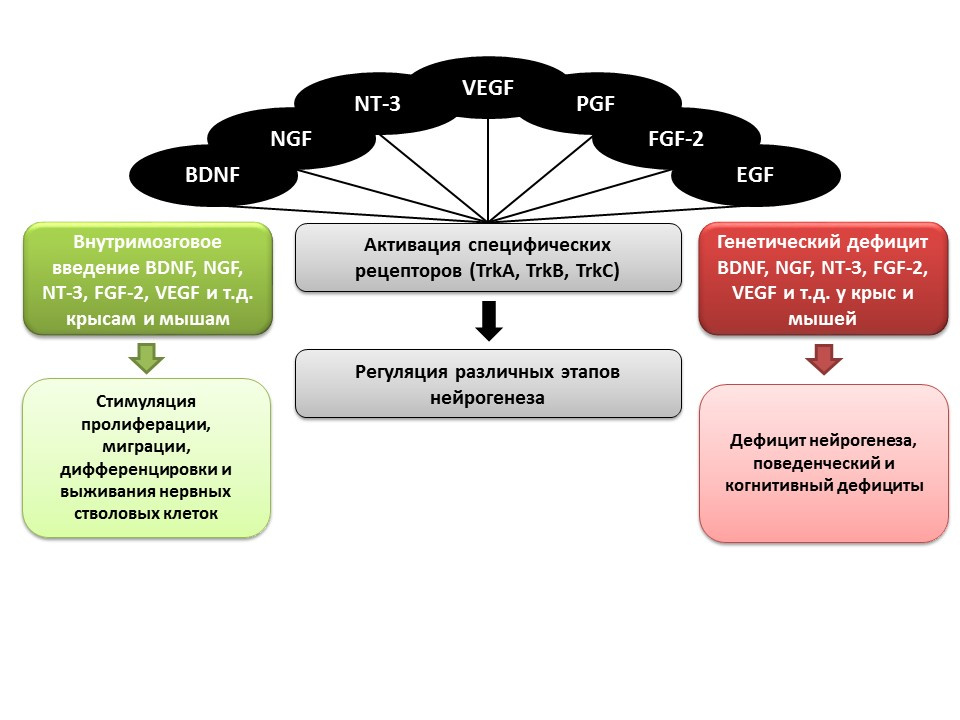
Pencea V et al. Infusion of BDNF into the lateral ventricle of the adult rat leads to new neurons in the parenchyma of the striatum, septum, thalamus, and hypothalamus. J.Neurosci. 2001;21:6706–6717
Bath KG et al. Variant brain-derived neurotrophic factor (Val66Met) alters adult olfactory bulb neurogenesis and spontaneous olfactory discrimination. J Neurosci. 2008; 28:2383–2393
Gascon E, Vutskits L, Zhang H, et al. Sequential activation of p75 and TrkB is involved in dendritic development of subventricular zone-derived neuronal progenitors in vitro. Eur J Neurosci. 2005;21:69–80
Kahn MA, Kumar S, Liebl D, et al. Mice lacking NT-3, and its receptor TrkC, exhibit profound deficiencies in CNS glial cells. Glia. 1999;26:153–165
Shimazu K, Zhao M, Sakata K, et al. NT-facilitates hippocampal plasticity and learning and memory by regulating neurogenesis. Learn Mem. 2006; 13(3):307-15)
Zhao M, Li D, Shimazu K, et al. Fibroblast growth factor receptor-1 is required for long-term potentiation, memory consolidation, and neurogenesis. Biol Psychiatry. 2007;62:381–390
, , , :
- (BDNF)
- (NGF)
- -3 (NT-3)
- (VEGF)
- (PGF)
- -2 (FGF-2)
- (EGF)
( ) , . ( ) , . .
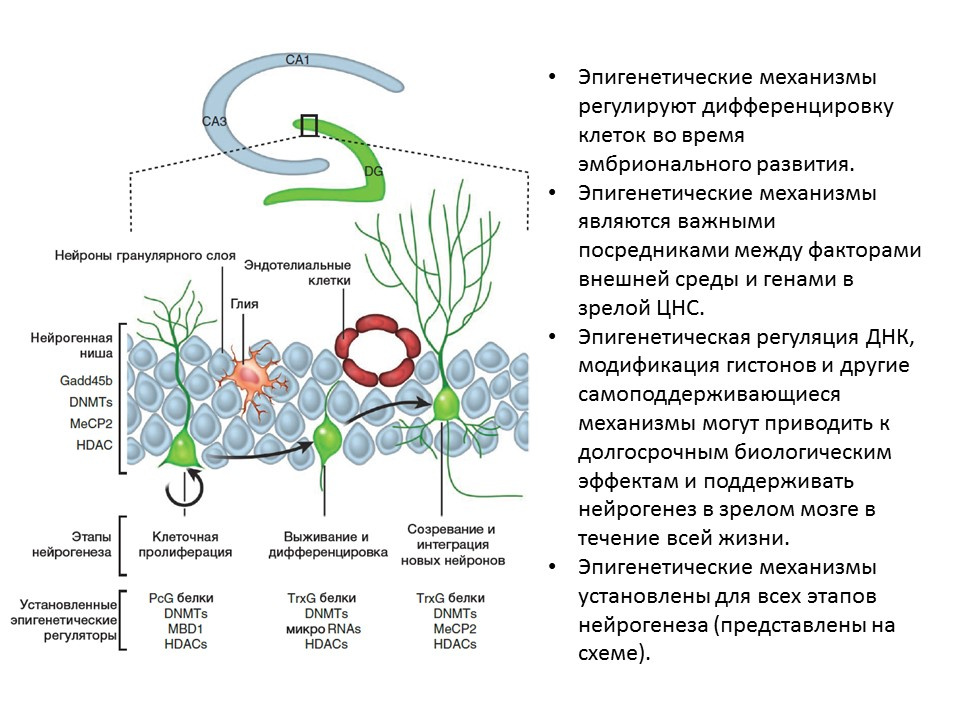 Ma DK, Marchetto MC, Guo JU, Ming GL, Gage FH, Song H. Epigenetic choreographers of neurogenesis in the adult mammalian brain. Nat Neurosci.2010;13(11):1338-44.
Ma DK, Marchetto MC, Guo JU, Ming GL, Gage FH, Song H. Epigenetic choreographers of neurogenesis in the adult mammalian brain. Nat Neurosci.2010;13(11):1338-44., :
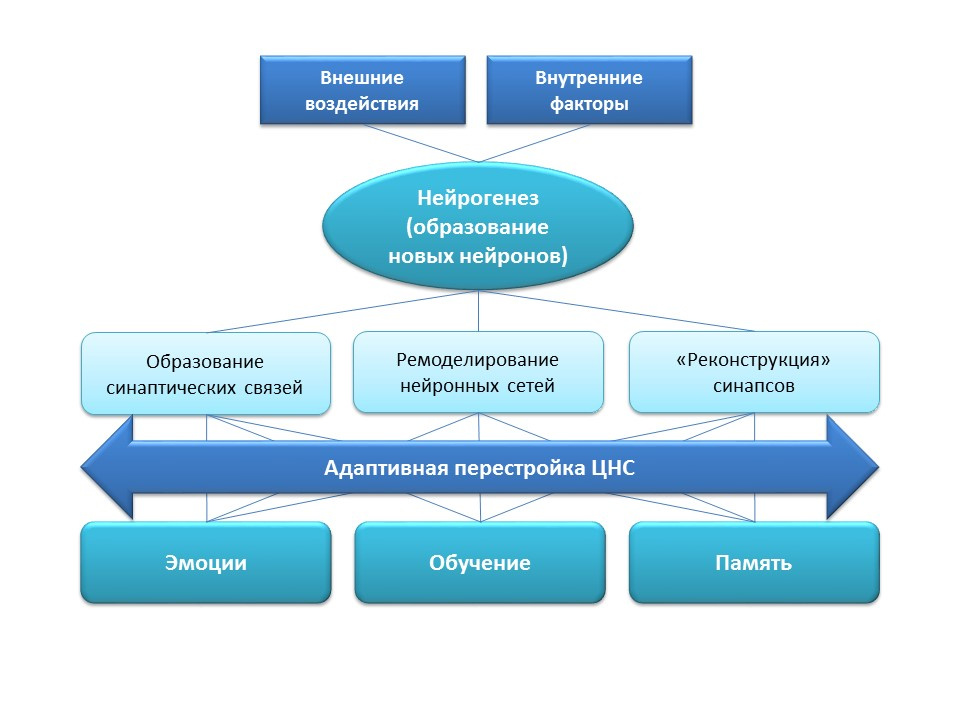
Coras R, Siebzehnrubl FA, Pauli E, et al. Low proliferation capacities of adult hippocampal stem cells correlate with memory dysfunction in humans. Brain. 2010;133(11):3359-72
Cheyne JE, Grant L, Butler-Munro C, et al. Synaptic integration of newly generated neurons in rat dissociated hippocampal cultures. Mol Cell Neurosci. 2011;47(3):203-14
Hernández-Rabaza V, et al. Neuroscience. 2009;159(1):59-68).
Mochizuki N, Moriyama Y, Takagi N, et al. Intravenous injection of neural progenitor cells improves cerebral ischemia-induced learning dysfunction. Biol Pharm Bull. 2011;34(2):260-5
Sahay A., Hen R. Hippocampal neurogenesis and depression. Novartis Found Symp. 2008;289:152-60
Toni N, Laplagne DA, Zhao C, et al. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nat Neurosci. 2008; 11:901–7
, ( ), () (, , ..), «» ( ).
, . «», .
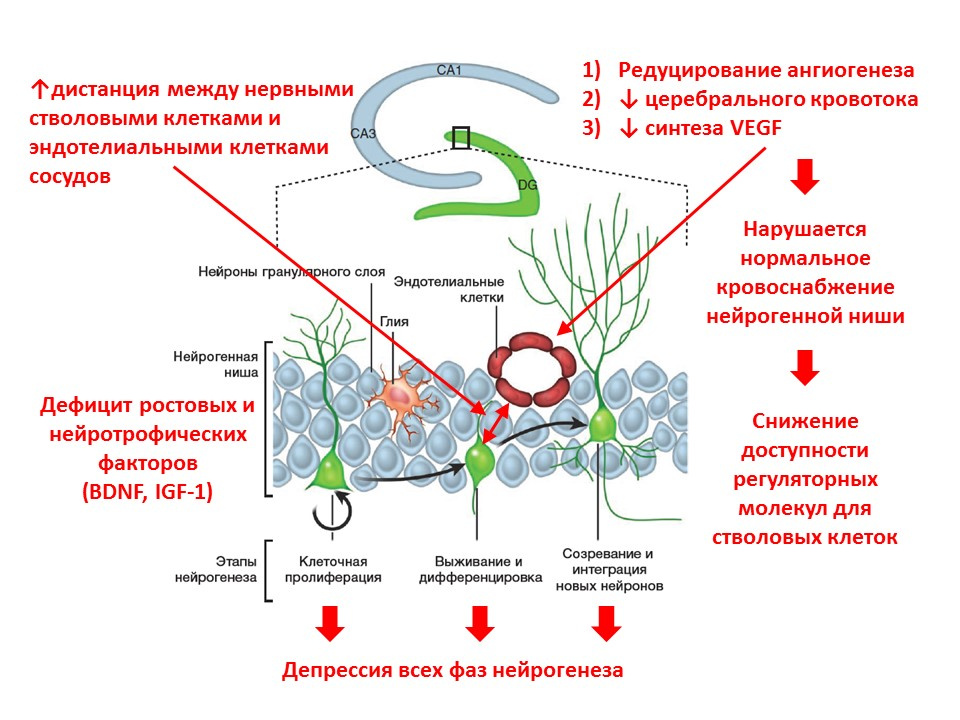
Lichtenwalner RJ et al. Neuroscienc 2001;107, 603–613
Luo J, et al. Aging Cell. 2006;5(2):139-52
Cuppini R et al. Hippocampus. 2006;16(2):141-8;
Shetty AK, Hattiangady B, Shetty GA. Glia 2005; 51, 173–186
Drapeau E, Nora Abrous D. Aging Cell. 2008;7(4): 569-89
Hattiangady B, Shetty AK. Neurobiol. Aging.2008; 29: 129–177
. :
- — ;
- ( , );
- ;
- ( , — VEGF), ;
- ( , ).
, .
- , , .. (Jakubs K et al. Inflammation regulates functional integration of neurons born in adult brain. J Neurosci. 2008 Nov 19;28(47):12477-88).
- , . . (Bachstetter AD et al. Fractalkine and CX3CR1 regulate hippocampal neurogenesis in adult and aged rats. Neurobiol Aging. 2011;32(11):2030-44).
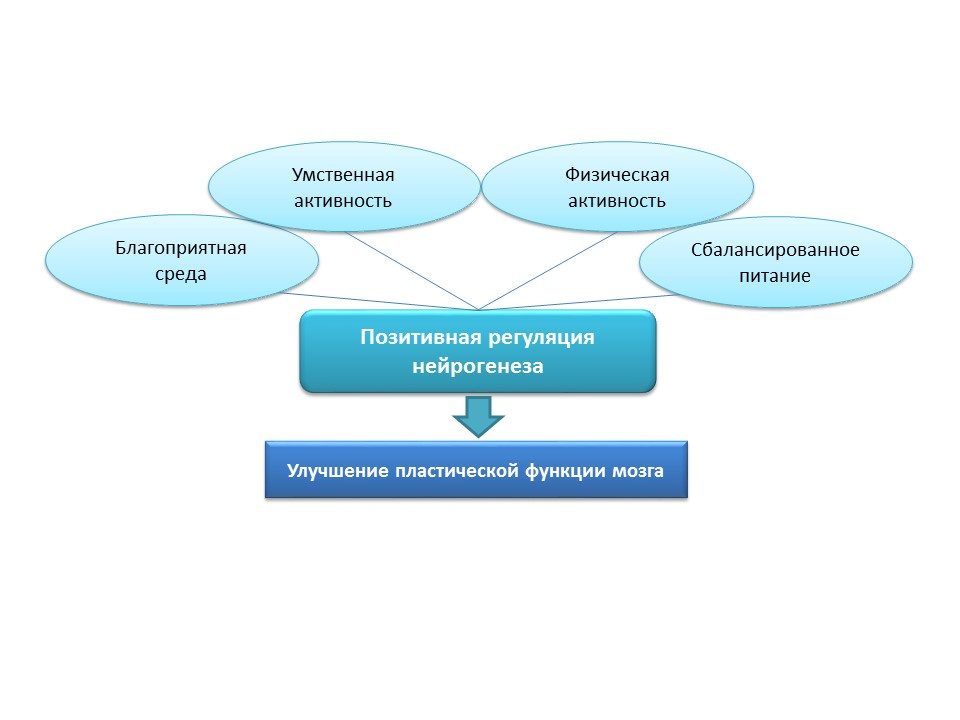
La imagen muestra información sobre la estimulación de la neurogénesis en ratas viejas mediante la inducción de neuroinflamación y la administración de proteína fractalina. Estos datos demuestran el hecho de que el cerebro conserva la función adaptativa que conlleva la neurogénesis.
Para la estimulación natural de la neurogénesis en las personas mayores, estas estrategias parecen demasiado agresivas, por lo que los estímulos positivos naturales deben considerarse factores de neurogénesis de "entrenamiento" y "de apoyo": ambiente favorable, actividad mental, actividad física, nutrición equilibrada.
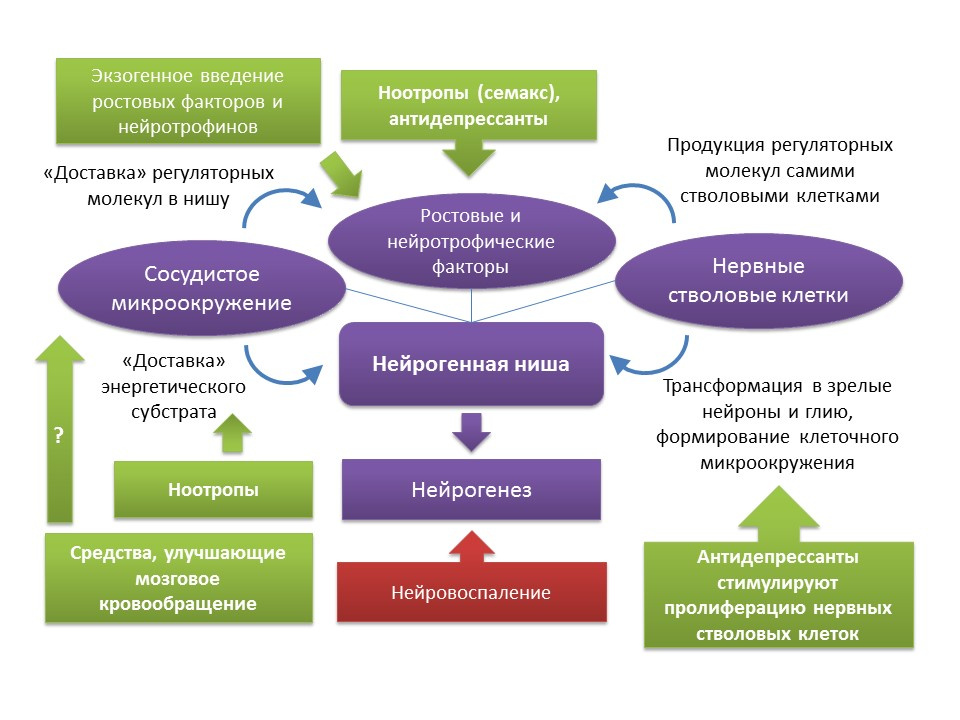 Medvedeva, EV, Dmitrieva, VG, Stavchansky, VV y col. Int J Pept Res Ther (2016) 22: 197.
Medvedeva, EV, Dmitrieva, VG, Stavchansky, VV y col. Int J Pept Res Ther (2016) 22: 197.
Jakubs K y col. La inflamación regula la integración funcional de las neuronas nacidas en el cerebro adulto. J Neurosci. 19 de noviembre de 2008; 28 (47): 12477-88
Taupin P. Los agentes nootrópicos estimulan la neurogénesis. Opinión de expertos Ther Pat. Mayo de 2009; 19 (5): 727-30.Como se mencionó anteriormente, a pesar de los cambios relacionados con la edad que sufre el nicho neurogénico, la función de la neurogénesis se puede restaurar si hay ciertos incentivos. Cabe señalar que la tasa de envejecimiento y los cambios relacionados con la edad en la neurogénesis asociada con este proceso son heterogéneos y están determinados por las características individuales del cuerpo. En particular, se cree que las personas con un nivel inicialmente más alto de neurogénesis tienen un mayor nivel de neuroplasticidad cerebral y, por lo tanto, son más resistentes a los cambios relacionados con la edad en el sistema nervioso central. Sin embargo, actualmente no hay forma de tener un efecto integral en todo el nicho neurogénico. Como se mencionó anteriormente, el nicho neurogénico en sí mismo es un tipo de microambiente que incluye muchos elementos (microambiente vascular y celular, un conjunto de factores neurotróficos y de crecimiento). Por un lado, existe una experiencia farmacológica bastante sólida en la regulación de la neurogénesis debido al efecto en los componentes individuales de este "microambiente" (introducción o inducción de moléculas reguladoras endógenas; estimulación por fármacos de proliferación, diferenciación y supervivencia de neuronas recién formadas; mejora de la circulación cerebral y el metabolismo energético en el sistema nervioso central). Por otro lado, es un hecho conocido que las propias células madre producen factores neurotróficos y de crecimiento: BDNF, NGF, VEGF, etc. (
Guzman R. Terapia de accidente cerebrovascular celular: desde el reemplazo celular hasta el soporte trófico. Revisión experta de terapia cardiovascular, 2009; 7 (10 ): 1187-1190 ). Esto puede llevar a la conclusión de que, para restaurar la función de un nicho neurogénico, se puede utilizar, por ejemplo, la terapia con células madre o con agentes que puedan estimular la proliferación de células madre nerviosas. Para tales medios, como ya se mencionó, son antidepresivos de varios grupos farmacológicos. La evidencia clínica de un riesgo reducido de demencia senil después de un curso (complicación frecuente después de la depresión a una edad más temprana) del tratamiento antidepresivo puede confirmar indirectamente tal conclusión. Cabe señalar que los datos sobre el efecto de los antidepresivos sobre el riesgo de demencia son controvertidos. Por lo tanto, se descubrió que el uso de antidepresivos tricíclicos se asocia con un riesgo reducido de demencia, mientras que los inhibidores de la MAO (monoamina oxidasas), los antidepresivos heterocíclicos y los ISRS (inhibidores selectivos de la recaptación de serotonina), por el contrario, pueden aumentar el riesgo o no tener ningún efecto sobre el desarrollo de la demencia. (
Kessing LV, Forman JL, Andersen PK. ¿Los antidepresivos continuos protegen contra la demencia en pacientes con trastorno depresivo severo? Int Clin Psychopharmacol. 2011; 26 (6): 316-22; Lee CW et al. Tratamiento antidepresivo y riesgo de demencia: un estudio retrospectivo de casos y controles basado en la población. J Clin Psychiatry. 2016 Jan; 77 (1): 117-22; quiz 122 ). Sin embargo, estos datos clínicos requieren precaución al interpretar, ya que estas revisiones clínicas no tienen en cuenta una serie de factores (antecedentes de tabaquismo de los pacientes, consumo de alcohol, gravedad y formas de trastornos depresivos, patologías concomitantes, etc.).
Otro grupo interesante de medicamentos que pueden considerarse como posibles agentes neurogénicos son los nootrópicos. Los fármacos nootrópicos tienen una serie de características específicas: 1) actúan solo en el contexto de la patología de las funciones mnestic; 2) tener una naturaleza acumulativa de la acción; 3) diversos en sus mecanismos de acción y estructura química; 4) actúan como psicoestimulantes, pero no tienen los efectos secundarios inherentes; 5) hasta la fecha, no hay datos convincentes sobre la efectividad clínica de los nootrópicos. Se cree que los medicamentos nootrópicos tienen un efecto complejo en el sistema nervioso central: mejoran la circulación cerebral, el metabolismo energético, interactúan con los receptores de la mayoría de los neurotransmisores (GABA, glutamato, acetilcolina). En estudios experimentales, se ha demostrado la capacidad potencial de ciertos nootrópicos para estimular la neurogénesis. En particular, piracetam mejoró el proceso de diferenciación en un cultivo de células madre nerviosas humanas (
Taupin P. Los agentes nootrópicos estimulan la neurogénesis. Expert Opin Ther Pat. 2009 mayo; 19 (5): 727-30 ), otro medicamento nootrópico Semax mejoró la expresión génica de más de 20 crecimientos y factores neurotróficos en el cerebro de ratas después de la administración intraperitoneal en condiciones de modelado de accidente cerebrovascular isquémico (
Medvedeva, EV, Dmitrieva, VG, Stavchansky, VV et al. Int J Pept Res Ther (2016) 22: 197 ), que también indica el posible efecto proneirogénico del fármaco . En vista del escaso conocimiento de los nootrópicos, es difícil hablar sobre el mecanismo específico de su actividad neurogénica, en la que pueden participar tanto su efecto complejo sobre el sistema nervioso central como algún componente específico. Obviamente, este problema requiere más estudios más detallados.
Otro grupo de medicamentos que podrían estimular la neurogénesis son los correctores de la circulación cerebral (por ejemplo, nimodipina o pentoxifilina). Sin embargo, los datos sobre el efecto de estos medicamentos en la neurogénesis son escasos. En experimentos con ratas, se demostró que el tratamiento con pentoxifilina mejoró la memoria a corto plazo y disminuyó la apoptosis de las neuronas del hipocampo en condiciones de isquemia cerebral, lo que puede indicar sus propiedades neuroprotectoras (
Park JH et al. La pentoxifilina alivia el deterioro de la memoria a corto plazo inducido por isquemia hipóxica perinatal Suprimiendo la apoptosis en el hipocampo de cachorros de rata. Int Neurourol J 2016; 20 (2): 107-113 ). La nimodipina, por el contrario, mostró la capacidad de suprimir la neurogénesis estimulada por isquemia en el hipocampo de ratones (Luo CX et al. El bloqueo del canal de Ca controlado por voltaje tipo L inhibe la neurogénesis inducida por isquemia regulando negativamente la expresión de iNOS en ratones adultos. Journal of neurochemistry, 2005) , que aparentemente está asociado con su mecanismo de acción directo: el bloqueo de los canales de calcio tipo L.
Para obtener una imagen completa de la manipulación farmacológica de un nicho neurogénico en condiciones de cambios relacionados con la edad, se requieren estudios más detallados que amplíen la comprensión de la actividad de los medicamentos neurogénicos en condiciones relevantes y nos permitan concluir que hay direcciones prometedoras para crear medicamentos que prevengan y corrijan la disminución relacionada con la edad en la actividad neurogénica cerebral.
El papel de la neurogénesis en diversas patologías del sistema nervioso central.
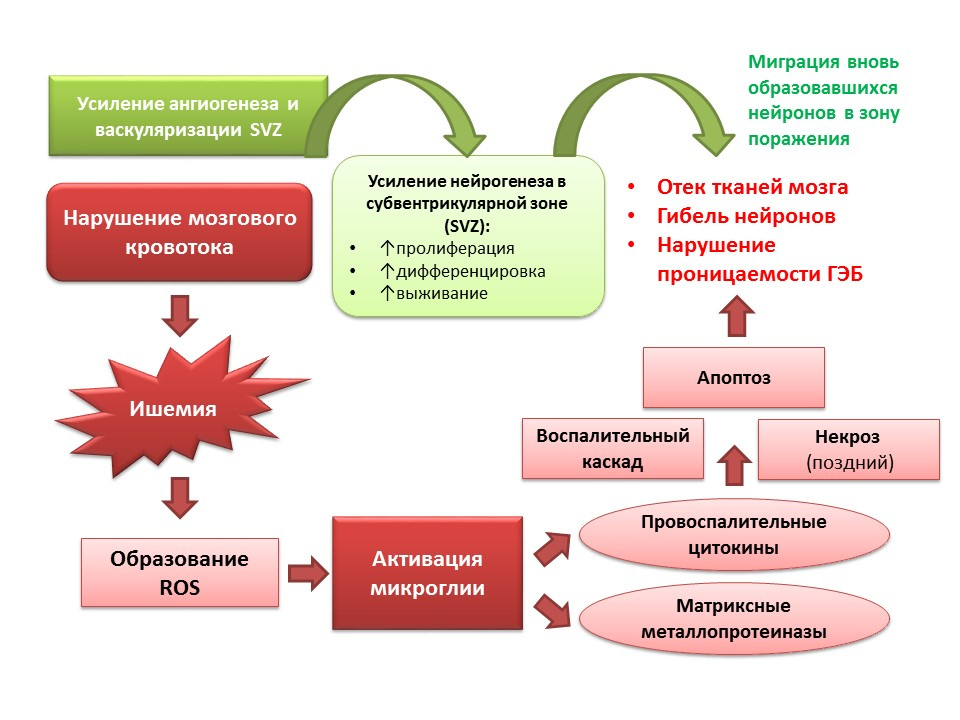
FuentesBordt, EA, Polster, BM (2014). Especies reactivas de oxígeno reactivo derivadas de NADPH oxidasa y mitocondrias en la activación microglial proinflamatoria: ¿un asunto bipartidista? Radic Free Biol Med, 34–46
Liu J, Solway K, Messing RO, Sharp FR. Aumento de la neurogénesis en el giro dentado después de la isquemia global transitoria en los jerbos. J Neurosci. 1998; 18 (19): 7768-78
Zhang ZG, Zhang L, Jiang Q, et al. VEGF mejora la angiogénesis y promueve la fuga de la barrera hematoencefálica en el cerebro isquémico. J Clin Invest. 2000; 106: 829–38
Nakayama D, Matsuyama T, Ishibashi-Ueda H, et al. Células madre / progenitoras neurales inducidas por lesiones en la corteza cerebral humana posterior al accidente cerebrovascular. Eur J Neurosci. 2010; 31 (1): 90-8)
Minger SL, Ekonomou A, Carta EM, et al. Neurogénesis endógena en el cerebro humano después de un infarto cerebral. Regen Med. 2007; 2 (1): 69-74).
La neurogénesis también realiza una función adaptativa en el contexto de las patologías del SNC. En particular, el accidente cerebrovascular isquémico conduce a la muerte de las células nerviosas (en la diapositiva se muestra un esquema simplificado de la patogénesis). Sin embargo, con la isquemia, una pequeña cantidad de neuronas mueren rápidamente (minutos): este es el llamado núcleo de la isquemia. La mayoría de las neuronas tienen deficiencia de glucosa y oxígeno, pero siguen siendo viables durante varias horas (una ventana terapéutica para ayudar): esta es la llamada penumbra o penumbra de la isquemia. Bajo las condiciones de daño cerebral isquémico, la neurogénesis se activa en la zona subventricular de los ventrículos laterales y las neuronas recién formadas migran a la zona de penumbra.
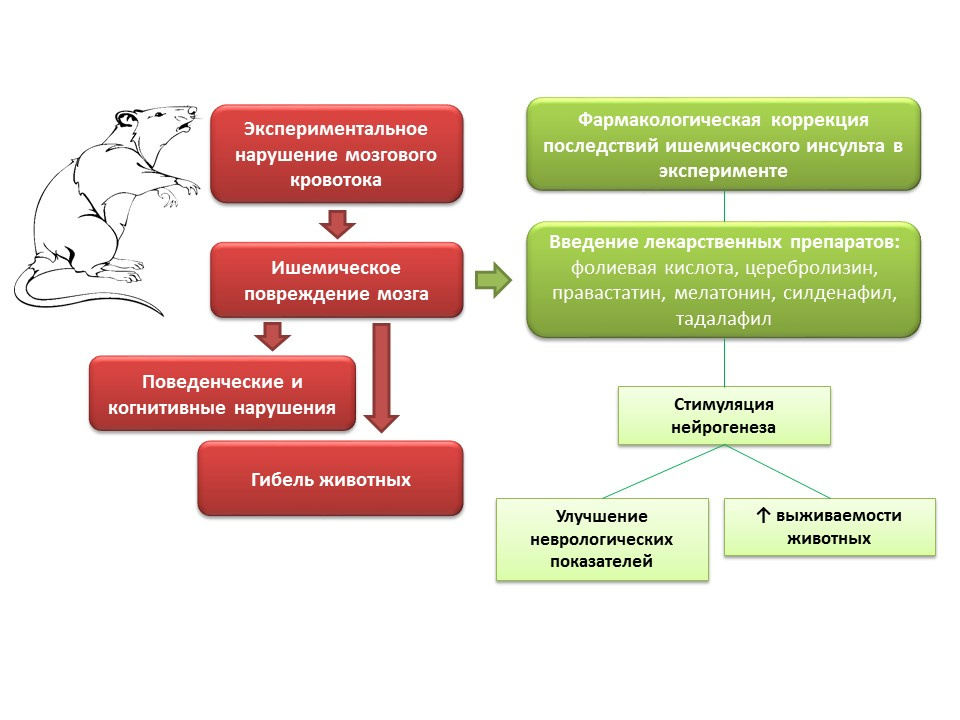
FuentesZhang, RL, Zhang, ZG y Chopp, M. (2013). Dirigido al óxido nítrico en el tratamiento restaurador subagudo del accidente cerebrovascular isquémico. Opinión de expertos sobre medicamentos en investigación, 22 (7), 843–851.
Chern CM, Liao JF, Wang YH, Shen YC. La melatonina mejora la función neural al promover la neurogénesis endógena a través del receptor de melatonina MT2 en ratones con accidente cerebrovascular isquémico. Radic libre Biol Med. 2012; 52 (9): 1634-47
Zhang X, Huang G, Liu H, y col. El ácido fólico mejora la señalización de Notch, la neurogénesis del hipocampo y la función cognitiva en un modelo de isquemia cerebral en ratas. Nutr Neurosci. 2012; 15 (2): 55-61
Zhang C, Chopp M, Cui Y, et al. Cerebrolisina mejora la neurogénesis en el cerebro isquémico y mejora el resultado funcional después del accidente cerebrovascular. J Neurosci Res. 15 de noviembre de 2010; 88 (15): 3275-81
Zhang RL, Zhang Z, Zhang L, y col. El tratamiento retrasado con sildenafil mejora la neurogénesis y mejora la recuperación funcional en ratas ancianas después de una isquemia cerebral focal. J Neurosci Res. 2006; 83 (7): 1213-9
Zheng Z, Chen B. Efectos de la pravastatina sobre la neuroprotección y la neurogénesis después de la isquemia cerebral en ratas. Neurosci Bull. 2000; 23 (4): 189-97
En experimentos con animales, al modelar trastornos del flujo sanguíneo cerebral, se observan trastornos neurológicos (déficits cognitivos y de comportamiento), así como un gran porcentaje de muertes de animales. La introducción de medicamentos a estos animales con un mecanismo de acción diferente, pero con una característica común: la capacidad de estimular la neurogénesis (ácido fólico, cerebrolisina, pravastatina, melatonina, sildenafil, tadalafil), mejorando los parámetros neurológicos de los animales y reduciendo significativamente la mortalidad.
¿Cuáles son las perspectivas para manipular la neurogénesis para el daño cerebral isquémico?- La posibilidad de usar ciertos medicamentos del grupo de neuroprotectores (cerebrolisina) como parte del complejo tratamiento del accidente cerebrovascular isquémico agudo para prevenir la muerte de las neuronas en la penumbra.
- Para muchos medicamentos que han demostrado la capacidad de estimular la neurogénesis y mejorar el estado neurológico de los animales después de modelar un accidente cerebrovascular isquémico, este efecto no es básico, por lo tanto, su uso clínico se complica por la presencia de sus propios efectos, que pueden ser indeseables.
- Por otro lado, el estudio de los mecanismos subyacentes a los efectos neuroprotectores es una tarea importante, ya que puede proporcionar la base para el desarrollo de fármacos fundamentalmente nuevos y altamente efectivos para la terapia restauradora del accidente cerebrovascular isquémico.
- La regulación farmacológica de la neurogénesis, en el contexto del daño cerebral isquémico, abre la posibilidad de crear un nuevo grupo de medicamentos que reducen la mortalidad y mejoran la calidad de vida de los pacientes después de un accidente cerebrovascular isquémico.
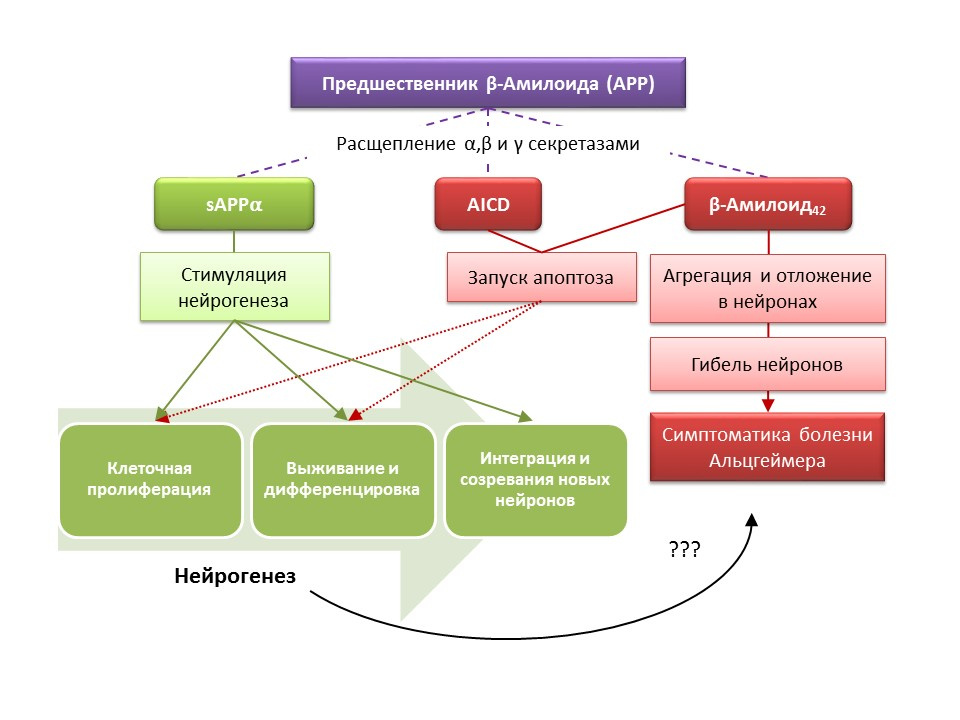
FuentesYu Y y col. Aumento de la neurogénesis del hipocampo en la etapa progresiva del fenotipo de la enfermedad de Alzheimer en un modelo de ratón transgénico doble APP / PS1. Hipocampo 2009; 19 (12): 1247-53
Ghosal K, Stathopoulos A, Pimplikar SW. El dominio intracelular de APP deteriora la neurogénesis adulta en ratones transgénicos al inducir neuroinflamación. Plos uno. 2010; 5 (7): e11866
Mu Y, Gage FH. Neurogénesis del hipocampo adulto y su papel en la enfermedad de Alzheimer. Mol neurodegener. 2011; 6: 85
Jin K, Peel AL, Mao XO, et al. Aumento de la neurogénesis del hipocampo en la enfermedad de Alzheimer. Proc Natl Acad Sci Estados Unidos. 2004; 101 (1): 343–347
La enfermedad de Alzheimer (EA) es una enfermedad neurodegenerativa acompañada de la muerte de neuronas colinérgicas (neuronas que producen acetilcolina). Las causas de la enfermedad de Alzheimer actualmente no están establecidas con precisión, la enfermedad se considera multifactorial. La patogenia de la EA se basa en una violación del metabolismo de la proteína beta-amiloide, cuyas fracciones individuales se depositan en las neuronas del sistema nervioso central y conducen a su muerte. Las fracciones amiloides afectan la neurogénesis de diferentes maneras, por lo que el precursor amiloide-alfa soluble (sAPPα) estimula todas las etapas de la neurogénesis, mientras que el dominio intracelular del precursor amiloide (AICD) y el beta-amiloide-42 causan apoptosis de las células madre nerviosas, reduciendo la proliferación y tasa de supervivencia La activación de la neurogénesis ya se registra en las primeras etapas de la EA, cuando todavía no hay una neurodegeneración y demencia pronunciadas. Aparentemente, la neurogénesis contra AD también juega una función adaptativa. En la mayoría de los modelos animales de AD (ratones transgénicos con metabolismo beta-amiloide alterado) y material post-mortem de pacientes con AD, se registró un aumento en el número de células BrdU-positivas. Sin embargo, hay evidencia de una falta de cambios en la neurogénesis en algunos modelos animales de AD y el material post mortem de algunos pacientes con AD. Finalmente, la pregunta sigue abierta sobre la capacidad de las células recién formadas para reemplazar las neuronas que murieron en AD.
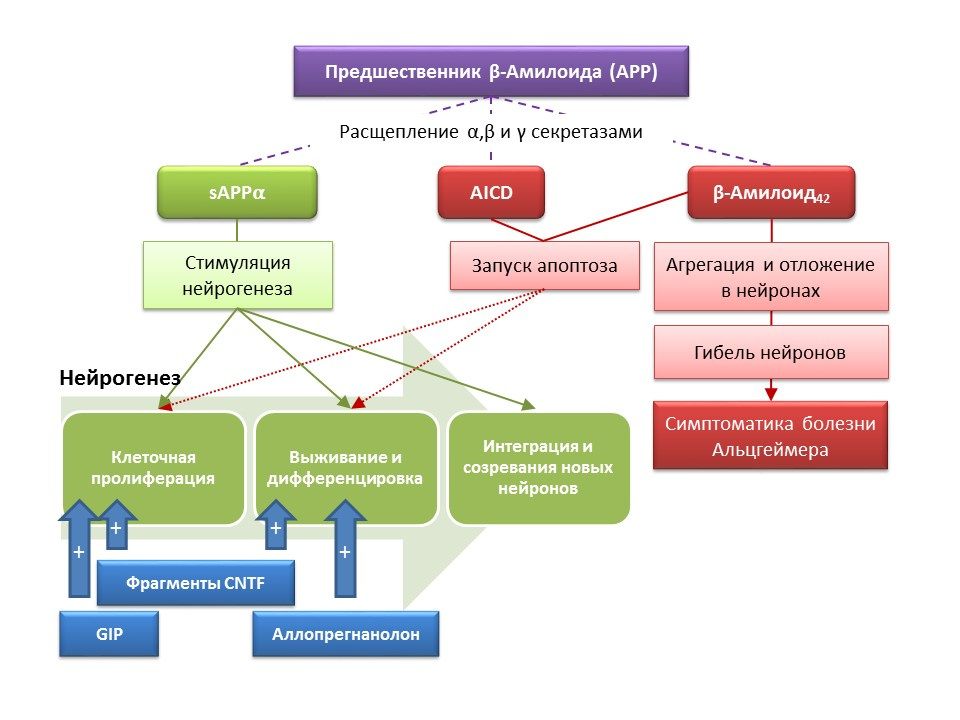 DOI: 10.3233 / JAD-2011-110914DOI: 10.1016 / j.ejphar.2011.11.007DOI: 10.1371 / journal.pone.0024293
DOI: 10.3233 / JAD-2011-110914DOI: 10.1016 / j.ejphar.2011.11.007DOI: 10.1371 / journal.pone.0024293Los estudios experimentales sobre nuevos enfoques para la corrección farmacológica de la enfermedad de Alzheimer han demostrado la capacidad de varias sustancias para estimular la neurogénesis en ratones transgénicos (en ratones, el metabolismo normal de beta-amiloide es un modelo animal de la enfermedad de Alzheimer) en combinación con reacciones conductuales mejoradas (una reacción de investigación orientativa, aprendizaje y memoria):
- La introducción de fragmentos funcionales de péptidos de neurotrofina ciliar CNTF 6 y 6A estimuló la formación de nuevas células madre y la supervivencia de neuronas recién formadas en la zona subventricular, giro dentado del hipocampo y bulbos olfativos (Rockenstein E, Ubhi K, Doppler E, et al. Comparación regional de los efectos del neurógeno de péptidos derivados de CNTF y cerebrolisina en ratones transgénicos AβPP. J Alzheimers Dis. 2011; 27 (4): 743-52)
- La administración de un péptido insulinotrópico dependiente de glucosa (GIF) con propiedades de factor de crecimiento condujo a una mayor proliferación de células madre nerviosas en la circunvolución dentada del hipocampo (Faivre E, Hamilton A, Hölscher C. Efectos de la administración aguda y crónica de GIP comparativa sobre cognición, plasticidad sináptica y neurogénesis en ratones. Eur J Pharmacol. 2012; 674 (2-3): 294-306)
- La administración crónica y subcrónica del esteroide neuroactivo alopregnanolona contribuyó a la supervivencia de las neuronas recién formadas (Chen S, Wang JM, Irwin RW, et al. La allopregnanolona promueve la regeneración y reduce la carga de β-amiloide en un modelo preclínico de la enfermedad de Alzheimer. PLoS One.2011; 6 ( 8): e24293; Singh C, Liu L, Wang JM, et al. Neurobiol Aging. 2012; 33 (8): 1493-506)
Los resultados indican las perspectivas para el uso de sustancias que estimulan la neurogénesis para aliviar los síntomas de la enfermedad de Alzheimer, así como para reducir la tasa de progresión de la neurodegeneración, lo que representa un enfoque fundamentalmente nuevo para la corrección farmacológica de esta enfermedad.
Perspectivas para la manipulación de la neurogénesis en la enfermedad de Alzheimer- La etiología exacta de la enfermedad de Alzheimer sigue siendo desconocida hoy en día, lo que hace que sea difícil encontrar nuevos medicamentos destinados a la causa de la enfermedad.
- Los datos obtenidos durante el modelado genético de la enfermedad de Alzheimer en animales y el estudio de material posmortal en personas con EA son contradictorios.
- Al mismo tiempo, en modelos animales de la enfermedad de Alzheimer, se demostró que ya se observa un aumento de la neurogénesis en las primeras etapas de la enfermedad (antes de la función cognitiva deteriorada). Se cree que esta mejora puede considerarse como una reacción de protección adaptativa del sistema nervioso central.
- En modelos animales de la enfermedad de Alzheimer, se demostró que una serie de sustancias (fragmentos activos de neutrotropina ciliar - CNTF, péptido insulinotrópico dependiente de glucosa - GIP y alopregnanolona) pueden estimular la neurogénesis y mejorar el patrón de comportamiento de los roedores.
- Un inconveniente significativo de estas manipulaciones es el hecho de que una violación de la neurogénesis, aparentemente, no es la causa de la enfermedad de Alzheimer, sino solo un síntoma. Sin embargo, las perspectivas de dicha terapia pueden ser retrasar la progresión de la enfermedad y retrasar el desarrollo de la demencia.
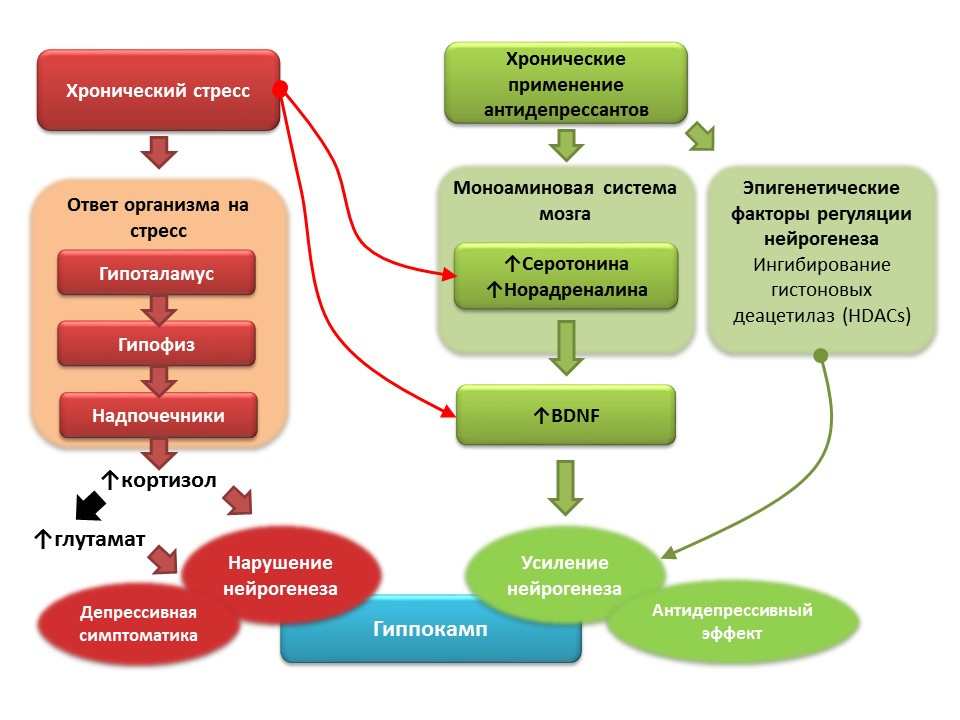 DOI: 10.1016 / j.pharma.2013.02.02.006PMID: 11124987DOI: 10.1186 / s13045-017-0499-7
DOI: 10.1016 / j.pharma.2013.02.02.006PMID: 11124987DOI: 10.1186 / s13045-017-0499-7En el contexto de la depresión clínica (trastorno depresivo mayor), también se registra una disminución en la neurogénesis y una disminución en el volumen del hipocampo, que se restaura después de un curso de antidepresivos. Se cree que el estrés crónico desempeña el papel de un factor desencadenante en la patogénesis de los trastornos depresivos, lo que desencadena una cascada de reacciones dependientes del estrés que resultan en la producción excesiva de cortisol y un aumento en la concentración de glutamato en el sistema nervioso central. Estos factores interrumpen la plasticidad del cerebro (y la neurogénesis en particular) y contribuyen al desarrollo de síntomas depresivos). El uso crónico de antidepresivos, por el contrario, estimula la neurogénesis, aumentando la concentración en el sistema nervioso central de las monoaminas (serotonina y noradrenalina), un factor neurotrófico cerebral. Algunos antidepresivos también tienen mecanismos adicionales para regular la neurogénesis. Por ejemplo, la amitriptilina puede inhibir las desacetilasas de histonas, que desempeñan el papel de reguladores epigenéticos de la neurogénesis, y de ese modo estimulan la proliferación de células madre nerviosas.
Perspectivas para manipular la neurogénesis en la depresión- La mayoría de los antidepresivos, independientemente del grupo y mecanismo de acción, pueden estimular la neurogénesis en condiciones de modelar la depresión en modelos animales.
- En personas con depresión, el uso crónico de antidepresivos restaura el volumen del hipocampo, una disminución que generalmente se observa en los trastornos depresivos.
- El mecanismo de acción general de todos los antidepresivos es el efecto sobre el sistema de monoaminas, en particular, la capacidad de aumentar las concentraciones de serotonina y norepinefrina en el sistema nervioso central.
- Numerosos estudios experimentales han demostrado el importante papel de las monoaminas (serotonina y norepinefrina) en la regulación de la neurogénesis del hipocampo en el cerebro adulto.
- Una dirección prometedora parece ser un estudio más detallado de los mecanismos de regulación de la neurogénesis por serotonina y norepinefrina, cuya comprensión puede ayudar en el desarrollo de nuevos medios de corrección farmacológica de la depresión.
- , , .
- , . , .
- (BDNF) ( NMDA-).
1. .
2. : ?
3. .
4. , :