 Fig. 1
Fig. 1El núcleo de un átomo es pequeño; su radio es 10,000–100,000 veces más pequeño que el átomo total. Cada núcleo contiene un cierto número de protones (lo denotamos por Z) y un cierto número de neutrones (lo denotamos por N), unidos entre sí en forma de una bola, cuyo tamaño no es mucho mayor que la suma de sus tamaños. Tenga en cuenta que los protones y los neutrones juntos a menudo se llaman "nucleones", y Z + N a menudo se llama A - el número total de nucleones en el núcleo. También Z, el "número atómico" es el número de electrones en un átomo.
Una imagen típica de dibujos animados de un átomo (Fig. 1) exagera extremadamente el tamaño del núcleo, pero representa más o menos correctamente el núcleo como un grupo de protones y neutrones descuidadamente conectados.
Contenido del núcleo
¿Cómo sabemos lo que hay en el núcleo? Estos pequeños objetos son fáciles de caracterizar (y fue solo históricamente) gracias a tres hechos de la naturaleza.
1. El protón y el neutrón difieren en masa solo en una milésima, por lo que si no necesitamos una precisión extrema, podemos decir que todos los nucleones tienen la misma masa, y la llamamos masa de nucleón, m
nucleón :
m
protón ≈ m
neutrón ≈ m
nucleón(≈ significa "aproximadamente igual")
2. La cantidad de energía requerida para mantener unidos protones y neutrones en el núcleo es relativamente pequeña, del orden de una milésima parte de la energía de masa (E = mc
2 ) de protones y neutrones, de modo que la masa del núcleo es casi igual a la suma de las masas de sus nucleones:
M
núcleo ≈ (Z + N) × m
nucleón3. La masa del electrón es 1/1835 de la masa del protón, de modo que casi toda la masa del átomo está contenida en su núcleo:
Átomo M
core núcleo M
Esto implica la presencia de un cuarto hecho importante: todos los átomos de cierto isótopo de cierto elemento son iguales, como todos sus electrones, protones y neutrones.
Dado que el isótopo de hidrógeno más común contiene un electrón y un protón:
M
hidrógeno ≈ m
protón ≈ m
nucleónmasa atómica M, el
átomo de un cierto isótopo es simplemente igual a Z + N veces la masa del átomo de hidrógeno
M
átomo ≈ M
núcleo ≈ (Z + N) × m
nucleón ≈ (Z + N) × M
hidrógenoy el error de estas ecuaciones es aproximadamente 0.1%.
Como los neutrones son eléctricamente neutros, la carga eléctrica Q del
núcleo es simplemente igual al número de protones multiplicado por la carga eléctrica del protón ("e"):
Q
núcleo = Z × Q
protón = Z × e
A diferencia de las ecuaciones anteriores, esta ecuación es precisa.
Para resumir:
Z = Q
núcleo / e
A = Z + N ≈ M
átomo / M
hidrógenoEstas ecuaciones se ilustran en la fig. 2
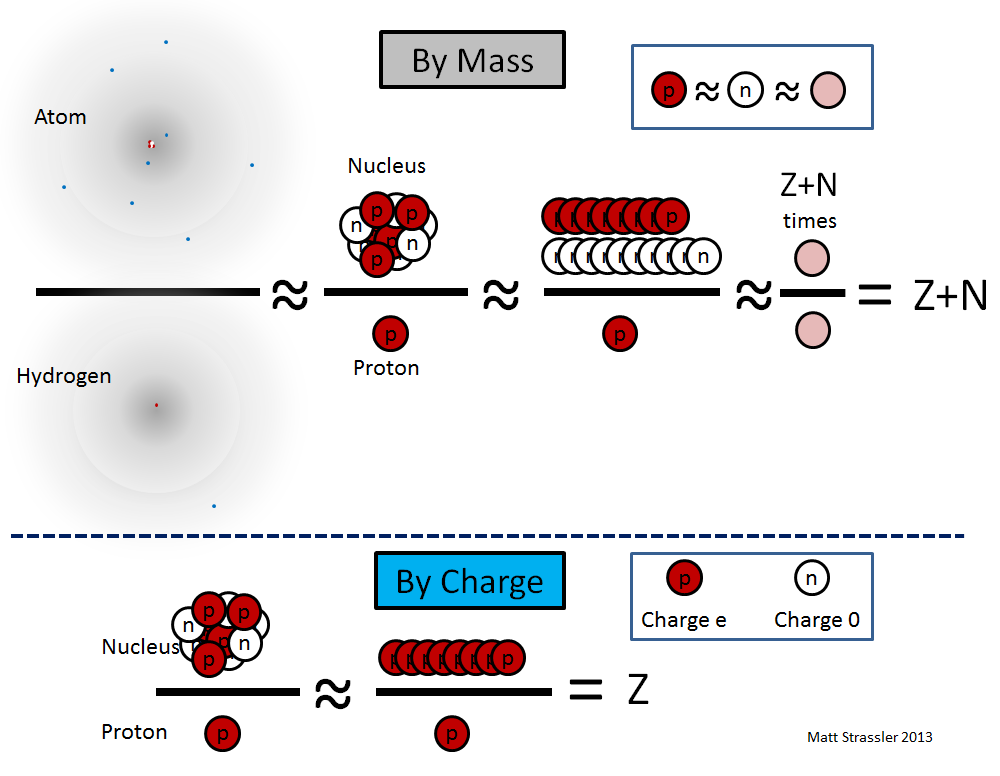 Fig. 2
Fig. 2Utilizando los descubrimientos de las últimas décadas del siglo XIX y las primeras décadas del siglo XX, los físicos sabían cómo medir en el experimento los dos valores rojos: la carga nuclear en e y la masa de cualquier átomo en los átomos de hidrógeno. Entonces, estos valores ya se conocían en la década de 1910. Sin embargo, solo pudieron interpretarse correctamente en 1932, cuando James Chadwick determinó que el neutrón (cuya idea fue propuesta por Ernest Rutherford en 1920) es una partícula separada. Pero tan pronto como quedó claro que existen neutrones, y que su masa es casi igual a la masa de un protón, inmediatamente quedó claro cómo interpretar los números Z y N: el número de protones y neutrones. Y también nació un nuevo acertijo: por qué los protones y los neutrones tienen casi la misma masa.
Honestamente, los físicos de la época tuvieron la suerte científica de que todo esto fuera tan fácil de instalar. Las leyes de masa y cargas son tan simples que incluso los acertijos más largos se descubrieron inmediatamente después del descubrimiento del neutrón. Si incluso uno de los hechos de la naturaleza que he enumerado resulta estar equivocado, entonces tomaría mucho más tiempo entender lo que está sucediendo dentro de los átomos y sus núcleos.
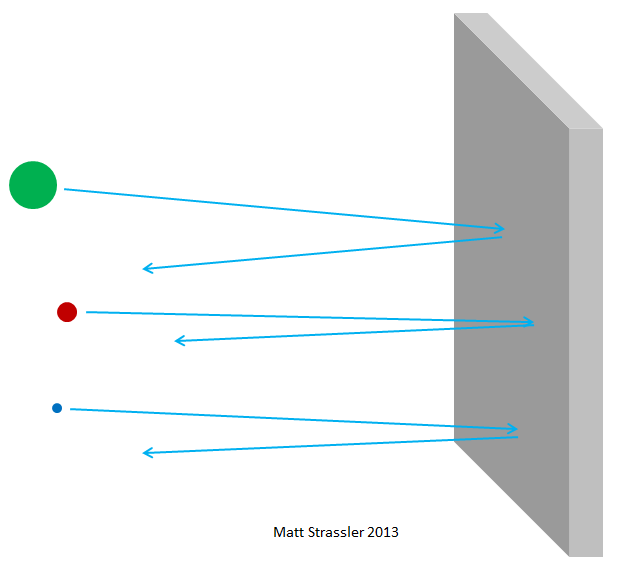 Fig. 3
Fig. 3Desafortunadamente, desde otros puntos de vista, sería mucho mejor si todo resultara más complicado. No fue posible captar el peor momento para este avance científico. El descubrimiento del neutrón y la comprensión de la estructura del átomo coincidieron con la crisis económica mundial, conocida como la Gran Depresión, y la aparición de varios gobiernos autoritarios y expansionistas en Europa y Asia. La carrera de los principales poderes científicos en el campo de la comprensión y la obtención de energía y armas del núcleo de un átomo comenzó rápidamente. Los reactores que producen energía nuclear se obtuvieron en solo diez años, y en trece - armas nucleares. Y hoy tenemos que vivir con las consecuencias de esto.
¿Cómo sabemos que el núcleo de un átomo es pequeño?
Una cosa es convencerse a sí mismo de que cierto núcleo de cierto isótopo contiene Z protones y N neutrones; el otro es convencerse de que los núcleos atómicos son pequeños y que los protones con neutrones, al estar juntos, no se unen en gachas y no se rompen en un desorden, sino que conservan su estructura, como nos dice la imagen de la caricatura. ¿Cómo se puede confirmar esto?
Ya mencioné que los átomos están prácticamente vacíos. Esto es fácil de verificar. Imagine papel de aluminio; nada es visible a través de él. Como es opaco, puede decidir que los átomos de aluminio:
1. Tan grande que no hay espacios entre ellos,
2. Tan denso y duro que la luz no los atraviesa.
En cuanto al primer punto, tendrás razón; en materia sólida casi no hay espacio libre entre dos átomos. Esto se puede observar en imágenes de átomos obtenidos usando microscopios especiales; Los átomos son como pequeñas esferas (cuyos bordes son los bordes de las nubes electrónicas), y están bastante densos. Pero con el segundo punto te equivocas.
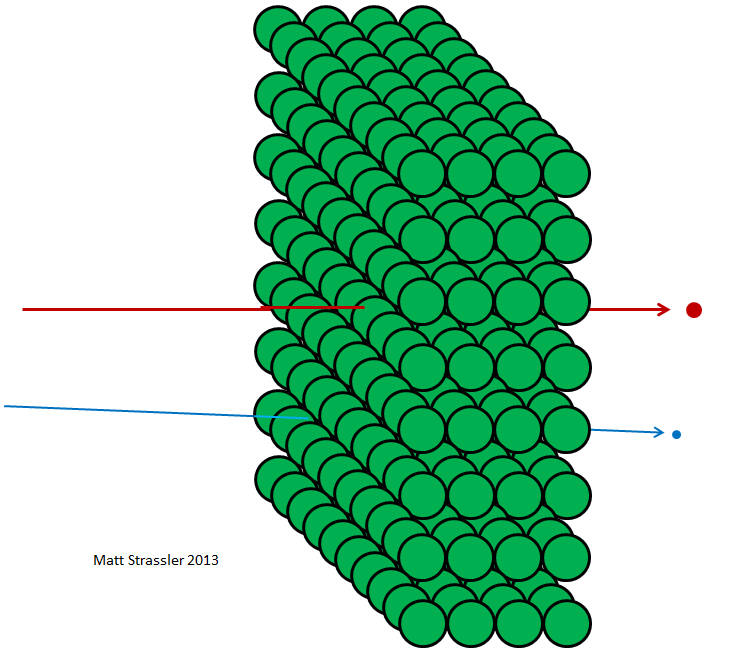 Fig. 4 4
Fig. 4 4Si los átomos fueran impenetrables, entonces nada podría pasar a través del papel de aluminio, ni fotones de luz visible, ni fotones de rayos X, ni electrones, ni protones, ni núcleos atómicos. Todo lo que apunte hacia el papel de aluminio se quedaría atascado o rebotaría, al igual que cualquier objeto arrojado debería rebotar o atascarse en una pared de yeso (Fig. 3). Pero, de hecho, los electrones de alta energía pueden pasar fácilmente a través de una lámina de aluminio, como fotones de rayos X, protones de alta energía, neutrones de alta energía, núcleos de alta energía, etc. Los electrones y otras partículas, casi todo, para ser más precisos, pueden pasar a través de un material sin perder energía ni impulso en colisiones con cualquier cosa contenida dentro de los átomos. Solo una pequeña parte de ellos golpeará el núcleo atómico o el electrón, en cuyo caso pueden perder la mayor parte de su energía de movimiento inicial. Pero la mayoría de los electrones, protones, neutrones, rayos X y todo ese tipo de cosas pasan con calma (Fig. 4). No es como tirar piedras a la pared; Esto es similar a tirar piedras en una cerca de malla (Fig. 5).
 Fig. 5 5
Fig. 5 5Cuanto más gruesa sea la lámina, por ejemplo, si apila cada vez más láminas de lámina, es más probable que las partículas lanzadas en ella choquen con algo, pierdan energía, reboten, cambien de dirección o incluso se detengan. Lo mismo sería cierto si aplicara una malla de alambre en capas una tras otra (Fig. 6). Y, como comprenderá, a partir de cuán lejos puede penetrar el guijarro medio a través de las capas de la cuadrícula y qué tan grandes son los espacios en la cuadrícula, los científicos pueden calcular en función de la distancia recorrida por electrones o núcleos atómicos qué tan vacío está el átomo.
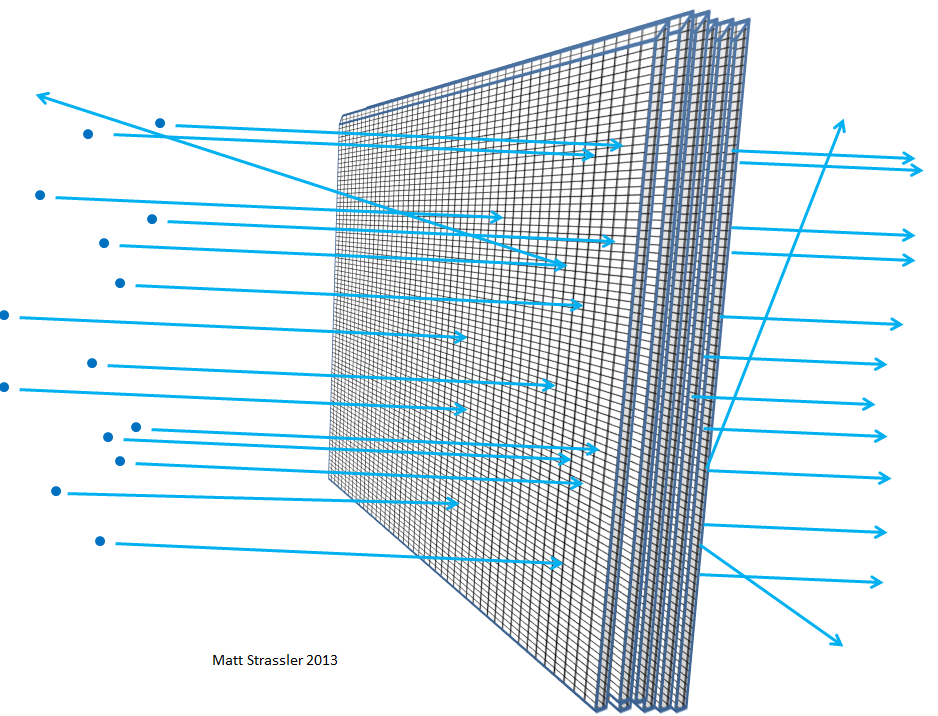 Fig. 6 6
Fig. 6 6A través de tales experimentos, los físicos a principios del siglo XX descubrieron que nada dentro del átomo, ni el núcleo atómico ni los electrones, puede ser mayor que una milésima de una millonésima de millonésima de metro, es decir, 100,000 veces más pequeña que el átomo. El hecho de que el núcleo alcanza tal tamaño y los electrones son al menos 1000 veces más pequeños, lo establecemos en otros experimentos, por ejemplo, en la dispersión de electrones de alta energía entre sí o desde los positrones.
Para ser aún más precisos, debe mencionarse que algunas partículas pierden parte de su energía en el proceso de ionización, en el que las fuerzas eléctricas que actúan entre la partícula voladora y el electrón pueden sacar el electrón del átomo. Este es un efecto de largo alcance, y no es realmente una colisión. La pérdida total de energía es significativa para los electrones voladores, pero no para un núcleo volador.
Podrías pensar en cómo las partículas atraviesan la lámina, cómo pasa la bala por el papel, empujando los pedazos de papel hacia un lado. ¿Quizás las primeras partículas simplemente separan los átomos, dejando grandes aberturas a través de las cuales pasan las siguientes? Sabemos que esto no es así, porque podemos realizar un experimento en el que las partículas entran y salen de un recipiente de metal o vidrio, dentro del cual hay un vacío. Si una partícula que pasa a través de las paredes de un recipiente crea agujeros de mayor tamaño que los átomos, entonces las moléculas de aire entrarían rápidamente y el vacío desaparecería. ¡Pero en tales experimentos, el vacío permanece!
También es bastante fácil determinar que el núcleo no es un montón particularmente estructurado, dentro del cual los nucleones retienen su estructura. Esto ya se puede adivinar por el hecho de que la masa del núcleo está muy cerca de la suma de las masas de los protones y neutrones contenidos en él. Esto es cierto tanto para los átomos como para las moléculas: sus masas son casi iguales a la suma de las masas de sus contenidos, a excepción de una pequeña corrección para la energía de unión, y esto se refleja en el hecho de que las moléculas son bastante fáciles de romper en átomos (por ejemplo, calentándolas para que chocaron entre sí) y eliminan electrones de los átomos (de nuevo, por calentamiento). Del mismo modo, es relativamente fácil dividir los núcleos en partes, y este proceso se llamará fisión, o ensamblará el núcleo a partir de núcleos y nucleones más pequeños, y este proceso se llamará síntesis. Por ejemplo, los protones de movimiento relativamente lento o los núcleos pequeños que chocan con un núcleo más grande pueden romperlo en pedazos; Las partículas que chocan no necesitan moverse a la velocidad de la luz.
 Fig. 7 7
Fig. 7 7Pero para entender que esto no es inevitable, mencionaré que los protones y los neutrones en sí mismos no poseen estas propiedades. La masa del protón no es igual a la suma aproximada de las masas de los objetos contenidos en él; el protón no puede dividirse en partes; y para que el protón demuestre algo interesante, se necesitan energías comparables a la energía de masa del propio protón. Las moléculas, los átomos y los núcleos son relativamente simples; Los protones y los neutrones son extremadamente complejos.