Expresión génica y terapia génica
El concepto de terapia génica ha existido durante los últimos veinte a treinta años. Consiste en el hecho de que la forma más radical de combatir las enfermedades es destruir la causa genética de la enfermedad y no sus consecuencias.
La razón puede ser una violación de cierto gen (mutación), que se transmitió de los padres durante enfermedades hereditarias, o una mutación genética que ya se encuentra en el organismo adulto, causando, por ejemplo, cáncer. Además, la causa puede ser simplemente una actividad demasiado alta (o, por el contrario, baja) del gen normal, lo que aumenta el riesgo de una enfermedad crónica, como diabetes o aterosclerosis.
La forma de lidiar con estos cambios es introducir nueva información genética en la célula para corregir la que está asociada con la enfermedad.
Primero, un poco más profundo en la teoría. La molécula de ADN, el ácido desoxirribonucleico, es el portador del código que controla el desarrollo y el funcionamiento de todos los seres vivos. El ADN contiene un programa que permite la transformación de una sola célula fuente en un organismo que funciona armoniosamente, que consiste en numerosas células combinadas en una variedad de tejidos y órganos.
Descifrar la estructura del ADN en 1953 fue uno de los puntos de inflexión en la historia de la biología. Para este descubrimiento, los científicos
James Watson, Francis Crick y Maurice Wilkins recibieron el Premio Nobel de Fisiología o Medicina de 1962.
El ADN es una molécula enorme que consta de miles de moléculas pequeñas: nucleótidos, cuatro tipos diferentes: guanina (G), citosina (C), timina (T) y adenina (A). Los nucleótidos se unen entre sí, formando una cadena; La molécula de ADN consiste en 2 de tales cadenas retorcidas en una doble hélice.

Al conectar 2 cadenas, se cumplen las siguientes reglas: la adenina siempre se conecta con la timina y la guanina, con la citosina. Por lo tanto, opuesto a la timina de una cadena siempre habrá adenina de otra.
Este arreglo nos permitió explicar los mecanismos de copia del ADN durante la división celular. Los dos hilos de una espiral divergen, y luego se agrega una copia exacta de su antiguo "compañero" en espiral a cada uno de ellos. Sobre el mismo principio que con el negativo en la foto, imprimen positivo.
La próxima revolución en el estudio del ADN ocurrió 50 años después, en 2003, cuando se completó el gran proyecto "Genoma humano". Nos permitió descifrar los 19,000 genes de nuestro cuerpo y abrió oportunidades sin precedentes para la medicina.
Un gen es una porción de una molécula de ADN en la que se codifica un polipéptido (parte de una molécula de proteína) o un ARN funcional. Por lo general, tiene varios cientos de nucleótidos de largo, pero hay excepciones. Los genes más pequeños del genoma humano, los genes de ARN de transporte, constituyen solo 76 pares de nucleótidos, y el gen más grande, el gen de la proteína distrofina, 2.4 millones.
En los organismos más desarrollados, incluidos los humanos, los genes a menudo están separados por fragmentos de ADN "no codificante" sin sentido. El ADN humano está envuelto alrededor de un esqueleto molecular de proteínas, con el cual forma un cromosoma. Todo el ADN humano se encuentra en 46 cromosomas.
Si comparamos la célula con la planta, entonces el ADN será un poco de información del disco duro almacenado en la oficina de la planta. Para que la planta comience a funcionar, esta información debe transmitirse a todos los dispositivos en las tiendas de la planta; esta función en la célula es desempeñada por los ácidos ribonucleicos (ARN). Y finalmente, los productos que comienzan a recolectarse en las tiendas de la planta bajo este programa son proteínas celulares.
El proceso de lectura de información del ADN se llama "expresión génica".
Si el ADN es información codificada sobre todos los procesos del cuerpo, las proteínas son los principales ejecutores y controladores de estos procesos. Hay una gran cantidad de diferentes clases de proteínas involucradas en todos los procesos importantes para el cuerpo.
Hay proteínas que acortan el curso de las reacciones químicas en el cuerpo; realizar una función de construcción: como una especie de refuerzo, dan forma a las células y sus partes; proteger el cuerpo neutralizando toxinas, bacterias y virus patógenos; Regulan la lectura de información del ADN y la síntesis de las proteínas correspondientes.
También hay proteínas que transmiten señales entre células, tejidos y órganos, transportan diversas moléculas a través de células y diferentes sistemas; la energía se almacena en proteínas; las proteínas son receptores: desencadenan una cascada de eventos celulares en respuesta a ciertas señales del entorno externo o de los sistemas internos del cuerpo; pueden realizar una función motora: proporcionar movimientos corporales, por ejemplo, contracción muscular.

La terapia génica es una intervención en el trabajo de una "planta" celular para la producción de proteínas. Le permite activar el trabajo de los genes necesarios y "desactivar" los dañinos. En el primer caso, se entrega un gen a la célula, a partir del cual comienza a leerse la proteína necesaria para el tratamiento de la enfermedad. Y en el segundo, se introducen ARN reguladores en la célula que bloquean la expresión del gen "dañino".
Muy a menudo, el bloqueo de genes se logra debido al hecho de que se envían pequeños ARN interferentes (siRNA) a la célula, que se unen al ARN del gen que necesita desactivarse. La unión de ARNip y ARN bloquea la síntesis de proteínas y finalmente conduce a la degradación del ARN.
Este proceso se llama interferencia de ARN. Fue descubierto en 1998 por los científicos estadounidenses
Andrew Fire y Craig Mello y fue reconocido tan importante que ya en 2006 el Premio Nobel de fisiología y medicina fue otorgado por su descubrimiento.
Terapia génica: éxitos y tendencias.
La terapia génica surgió hace más de 25 años. El primer estudio clínico exitoso (en humanos) se realizó en 1989 sobre la terapia génica de la inmunodeficiencia combinada severa. Actualmente, la terapia génica está en auge.
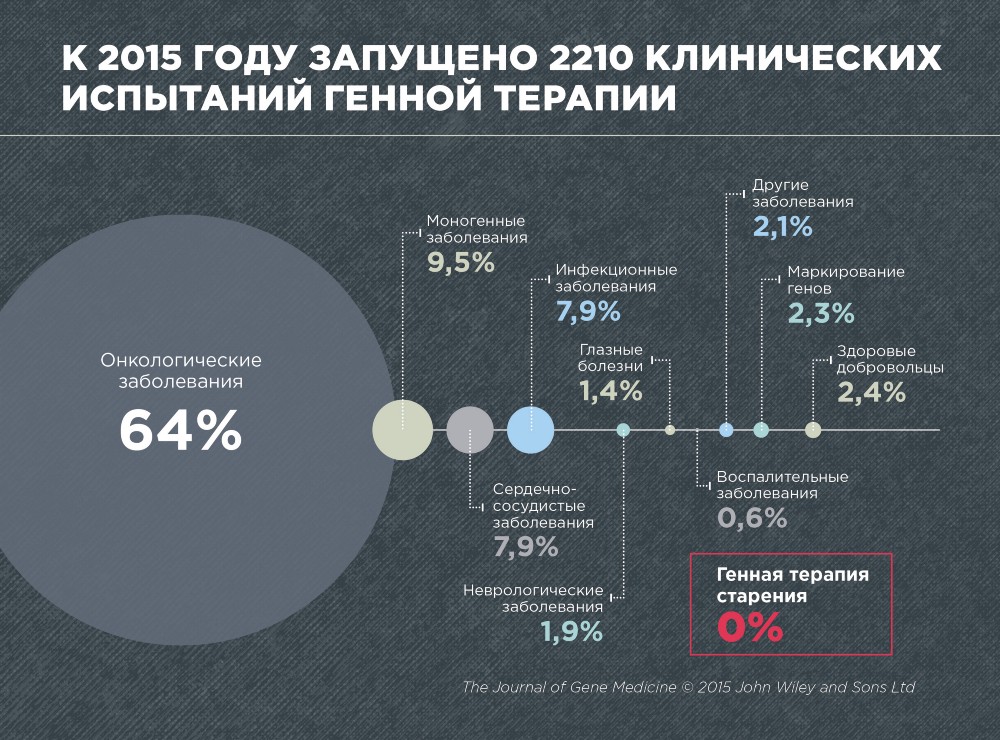
Según la revista Gene Medicine, en 2015, se realizaron 2210 ensayos clínicos sobre la terapia génica de diversas enfermedades. Estos son principalmente cáncer (64%), enfermedades monogénicas causadas por mutaciones en un gen (9,5%), cardiovasculares (7,9%) e infecciosas (7,9%).
No se han realizado ensayos clínicos sobre la terapia génica del envejecimiento, lo cual no es sorprendente, ya que el envejecimiento todavía no se reconoce como una enfermedad. Además, la terapia génica para el envejecimiento sigue siendo un campo muy joven y en desarrollo.
Para una serie de enfermedades, la terapia génica ha tenido bastante éxito. Entre ellos, las enfermedades hereditarias del sistema inmune: inmunodeficiencia combinada severa, síndrome de Wiskott-Aldrich y enfermedad granulomatosa crónica; una enfermedad hereditaria asociada con trastornos metabólicos: adrenoleucodistrofia; Enfermedad hereditaria de la retina: amaurosis de Leber y algunas formas de cáncer.
Hasta la fecha, 4 medicamentos de terapia génica han sido aprobados para la venta. En 2003, Gendicine, un medicamento para el tratamiento del carcinoma de células escamosas de cabeza y cuello basado en el gen p53, se lanzó en China, y Oncorine, un virus oncolítico para tratar el carcinoma nasofaríngeo, en 2006. En Europa, en 2012, se lanzó la producción de la preparación Glybera, destinada al tratamiento de la deficiencia hereditaria de lipoproteína lipasa (LPL) mediante la entrega del mismo gen. Y en Rusia, el medicamento "Neovasculgen" está aprobado para la venta para el tratamiento de enfermedades de las arterias periféricas. Es un gen VEGF (factor de crecimiento endotelial vascular).
El principal problema de la terapia génica es cómo administrar un gen terapéutico (o ARN) a las células objetivo. Por lo general, los vectores de entrega (portadores de construcciones genéticas) se utilizan para esto. No permiten que el ADN se descomponga en la sangre, proporcionan la salida del ADN de los capilares (pequeños vasos sanguíneos) a los tejidos y la penetración en las células y en el núcleo celular.
Muy a menudo, los virus se usan como vectores, ya que tienen mecanismos muy efectivos para la penetración de las células animales por la evolución perfeccionada. Al infectar una célula en la naturaleza, el virus entrega su material genético al núcleo de esta célula y comienza a reproducirse y producir sus propias proteínas utilizando los mecanismos de expresión génica de la célula huésped.
Los científicos han simplificado los virus al eliminar genes involucrados en la patogénesis y causar la respuesta inmune del cuerpo, y los han convertido en vectores para la entrega de material genético.

Los virus más populares utilizados en la terapia génica son los adenovirus (se utilizan en el 22,2% de los ensayos clínicos), así como los retrovirus (representan el 18,4% del trabajo). Solo los vectores más nuevos están ganando popularidad: virus adenoasociados (6% de los ensayos clínicos) y lentivirus (5% de los estudios).
Los más prometedores para la terapia génica son los vectores adenoasociados (AAV) y lentivirales. El primero permitirá administrar el constructo genético al cuerpo de manera sistémica (es decir, a una serie de tejidos y órganos) sin efectos secundarios. Es cierto que no incorporan material genético en el genoma, por lo que el gen liberado puede perderse con el tiempo.
Si es necesario asegurar una alta eficiencia de entrega e integración de la construcción entregada en el genoma, se deben usar vectores lentivirales. Sin embargo, no son adecuados para el suministro sistémico y se usan para inyección local en un área pequeña de tejido o en células in vitro. Además, pueden causar efectos secundarios debido a la incorporación a partes indeseables del genoma (por ejemplo, en protooncogenes y causar cáncer).

El uso de la tecnología de edición del genoma CRISPR / Cas9 abre nuevas posibilidades en la terapia génica. CRISPR / Cas9 le permite cambiar de manera muy precisa y segura el ADN de las células. Y si combina la tecnología CRISPR / Cas9 con la entrega mediante virus adenoasociados, esto, aparentemente, le permitirá afectar sistémicamente al cuerpo y cambiar completamente el genoma de una gran cantidad de células. Es decir, su uso le permite combinar las ventajas de los vectores adenoasociados y lentivirales.
En la naturaleza, este sistema se encuentra en bacterias y arqueas. Se utiliza para proteger contra bacteriófagos (virus bacterianos) u otros elementos genéticos extraños. En el caso de una infección celular, el sistema CRISPR / Cas reconoce las secuencias de ADN extraño y lo corta. El sistema CRISPR / Cas se descubrió por primera vez en 1987, pero sus funciones se han estudiado activamente, solo desde 2005.
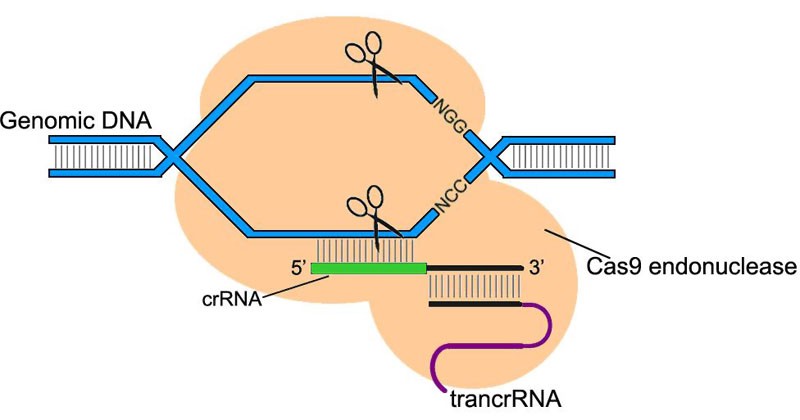
Dado que CRISPR / Cas reconoce y corta con precisión el ADN, los científicos decidieron adaptarlo para editar el genoma de los mamíferos. El uso de CRISPR / Cas superó todas las expectativas. Con un número mínimo de errores, permitió tanto "desactivar" los genes requeridos como incrustar nuevos genes en partes estrictamente definidas del genoma.
El sistema CRISPR / Cas9 consiste en la endonucleasa Cas9, una enzima que corta el ADN y dirige el ARN que se une solo a una secuencia genómica estrictamente definida. Tal sistema permite encontrar y cortar secciones del genoma en el lugar correcto, apuntando a la guía de ARN.
Los investigadores mismos seleccionan la guía de ARN, de modo que el sistema CRISPR / Cas9 pueda dirigirse a cualquier parte deseada del genoma.
Y más recientemente, en diciembre de 2015, el grupo científico Feng Jang modificó este sistema para que quedara completamente libre de errores, que fue publicado en la principal revista científica Science. Los científicos reemplazaron 3 aminoácidos (el "ladrillo" que forma la proteína) en la endonucleasa Cas9, después de lo cual el número de errores en dicho sistema se redujo a casi cero.
El uso de CRISP / Cas9 es especialmente relevante para la terapia génica del envejecimiento, donde se requiere que influya en las rutas de longevidad comunes a la mayoría de las células del cuerpo.
Tipos de vectores de entrega y sus propiedades.Los adenovirus (AV) y los virus adenoasociados (AAV) se pueden usar tanto para el suministro selectivo de material genético a ciertos tejidos como para el suministro sistémico al cuerpo (es decir, a una gran cantidad de órganos y tejidos). Entregan el material genético de manera muy eficiente, penetrando los núcleos de las células en división y no división.
Una característica importante de estos virus es que no integran los genes entregados en el genoma. Es cierto que, en el caso de los vectores adenoasociados, se demostró que <1% de los casos se incrustan (integran) en una región específica del genoma del huésped.
La falta de integración aleatoria de genes en el genoma es una gran ventaja en términos de seguridad de estos vectores. En este caso, no hay riesgo de que el gen se integre accidentalmente en la secuencia del protooncógeno y cause cáncer. Por otro lado, si un gen no está integrado en el genoma, puede perderse con el tiempo, por ejemplo, en la división celular. Por lo tanto, el efecto terapéutico en el caso del uso de tales vectores puede ser temporal.
Aunque los adenovirus se usan con mucha más frecuencia en la terapia génica, los virus adenoasociados son mucho más prometedores debido a su mayor seguridad. El hecho es que cuando se introducen en el cuerpo, los adenovirus pueden causar una fuerte respuesta inmune y una reacción inflamatoria.
En las primeras etapas del desarrollo de la terapia génica, el uso de vectores adenovirales incluso condujo a la muerte del paciente. Jesse Jelsinger padecía una deficiencia de ornitina transcarbamilasa, una enfermedad genética del hígado. A la edad de 18 años, participó en un ensayo clínico para terapia génica y murió debido a una respuesta inflamatoria sistémica en respuesta a la introducción de la construcción viral.
Por el contrario, la introducción de virus adenoasociados en el cuerpo solo conduce a una respuesta inmune insignificante, ya que en la naturaleza estos virus no causan enfermedades de mamíferos y apenas son reconocidos por el sistema inmune humano.
Otros vectores virales, retrovirus y lentivirus, incorporan material genético en el genoma y proporcionan un efecto terapéutico estable. Sin embargo, la integración accidental en el genoma puede conducir a la activación de mecanismos de cáncer, lo que ya ha sucedido varias veces en la historia de la terapia génica.
Los retro y lentivirus se usan casi exclusivamente para la entrega dirigida a ciertos tejidos y sus sitios, o a las células in vitro, porque a diferencia de AV y AAV, transfieren material a "distancias" mucho más cortas. El inconveniente de los retrovirus es que solo pueden penetrar en las células en división. Por lo tanto, los lentivirus son mucho más prometedores, ya que también infectan las células que no se dividen.
Además, los métodos no virales para el suministro de ADN y ARN, como los liposomas, a menudo se usan en la terapia génica. Son muy inferiores a los vectores virales en eficiencia, pero son más seguros y más baratos.
 Análisis comparativo de vectores para la entrega de material genético a la célula.
Análisis comparativo de vectores para la entrega de material genético a la célula. Estado y perspectivas de la terapia génica del envejecimiento.
Por el momento, la terapia génica para el envejecimiento se está desarrollando rápidamente, pero aún se encuentra en una etapa preclínica de desarrollo (es decir, aún no se han realizado experimentos en humanos). Entre los 2210 ensayos clínicos para terapia génica que se han lanzado hasta la fecha, no hay ninguno para tratar el envejecimiento. Esto se debe en parte a cuestiones legales: el envejecimiento todavía no se considera una enfermedad. Pero este campo de investigación en sí ha surgido muy recientemente. El primer trabajo sobre la terapia génica del envejecimiento en ratones se realizó hace menos de 5 años.
Ahora todos los estudios sobre la terapia génica del envejecimiento se llevan a cabo en ratones modelo, ratas, monos y cultivos de células humanas, células in vitro.
Todos los enfoques de la terapia génica del envejecimiento se dividen en aquellos en los que el gen de la longevidad se administra al cuerpo y aquellos en los que se introducen pequeños ARN para "desactivar" el gen o la vía del envejecimiento. Es decir, en el primer caso, se introduce algo útil para la longevidad, y en el segundo, se desactiva lo dañino.
En el sentido estricto de la investigación sobre la terapia génica del envejecimiento en mamíferos, solo se han realizado dos. En estos trabajos, los ratones fueron inyectados con el gen terapéutico y observaron cómo afectaba el envejecimiento y la longevidad. El primer trabajo fue realizado por un grupo de Maria Blasco en 2012, en el que lograron extender la vida de los ratones en un 20%. Y el segundo es la terapia del hipotálamo con el genoma del inhibidor de NF-kB, que Dongsheng Kai y sus colegas realizaron en 2013. En él, la vida de los ratones aumentó en un 10%. Ambos trabajos son muy alentadores: la terapia fue muy efectiva y sin efectos secundarios.

Mucho más trabajo modela la terapia génica en ratones transgénicos. En tales estudios, el gen terapéutico no se administra al cuerpo de un ratón adulto, y los ratones se crean mediante ingeniería genética, cuyo genoma se cambia desde el nacimiento. Al igual que la terapia génica, esto le permite explorar cómo un aumento o disminución en la actividad de diferentes genes afecta la esperanza de vida y el envejecimiento del cuerpo.
Hay muchos estudios en los que la terapia génica para el envejecimiento se basa en líneas celulares. Tales trabajos generalmente buscan ver si la administración de un gen terapéutico ralentizará el envejecimiento celular in vitro o no. Pero este enfoque da resultados mixtos, ya que la terapia, que prolonga la vida de las células, no siempre extiende la vida del cuerpo y viceversa. Por ejemplo, el aumento de la actividad del gen de la longevidad y la respuesta al estrés FOXO prolonga la vida del modelo Drosophila. Y en experimentos con células madre de la piel, el envejecimiento celular se ralentizó cuando el gen FOXO3, por el contrario, se "apagó".
Actualmente, se están desarrollando enfoques de terapia génica con respecto a todos los mecanismos básicos de longevidad conocidos hoy en día: aumentar la estabilidad del genoma, rejuvenecer el hipotálamo, destruir las células senescentes, aumentar la resistencia al estrés, mejorar el funcionamiento de las mitocondrias y mantener las células madre de nicho.Sin embargo, se están realizando muchas más investigaciones sobre la terapia génica de ciertas patologías dependientes de la edad, por ejemplo, el desgaste muscular relacionado con la edad y el deterioro cognitivo. Por sí mismos, no son enfermedades, sin embargo, empeoran la calidad de vida y pueden conducir a un mayor riesgo de muchas enfermedades relacionadas con la edad.En total, se llevaron a cabo aproximadamente 46 estudios sobre terapia génica de patologías dependientes de la edad en ratas modelo, ratones e incluso monos. Estos son trabajos sobre terapia génica en el "sentido clásico": los animales modelo (con mayor frecuencia los viejos) fueron inyectados con un gen como parte de un vector de entrega. Y después de la terapia, analizaron cómo esto afectó la aparición de patología relacionada con la edad. Desafortunadamente, la gran mayoría de estos trabajos no analizaron los efectos secundarios.La mayoría de los estudios se dedicaron a patologías del sistema nervioso central, alrededor de 10 trabajos. Hubo 6 estudios para trastornos del corazón y los vasos sanguíneos, 7 para el sistema reproductivo, 6 para la patología del cartílago, 4 para la obesidad, 7 para el tejido óseo, 3 para la visión deteriorada, 3 para el sistema inmunitario y 3 para el sistema inmunitario.En conclusión, quiero señalar que, a pesar del hecho de que se han realizado relativamente pocos experimentos sobre la terapia génica del envejecimiento con un efecto máximo de prolongación de la vida - 20%, ya tiene una gran ventaja en comparación con otros enfoques para prolongar la vida (por ejemplo, geroprotectores o limitación nutrición, prolongando la vida hasta un 30-50%). ¡Es suficiente llevar a cabo la terapia génica solo una vez en la vida!Por ejemplo, en un artículo de 2001 de Andrzej Bartke, la restricción de alimentos extendió la vida de los ratones en un 30%. Sin embargo, los ratones consumieron una dieta baja en calorías por hasta 670 días seguidos, ¡es decir, todos los días, durante la mitad de sus vidas! Y en el experimento de 2012 Maria Blasco sobre terapia génica, la terapia génica de la telomerasa tuvo un efecto ligeramente menor: los ratones comenzaron a vivir más en un 20%. Sin embargo, en este trabajo, ¡los ratones recibieron solo 1 inyección de la droga en la sangre en toda la vida! Aquí debe averiguar dónde está la ingeniería, dónde está la terapia.Por lo tanto, si estamos hablando de transmitir estudios sobre la prolongación de la vida por persona, entonces la terapia génica tiene una ventaja absoluta, ya que no reduce la calidad de vida debido a la necesidad de un tratamiento constante: siga una dieta diaria o use geroprotectores u otras drogas constantemente.
Aquí debe averiguar dónde está la ingeniería, dónde está la terapia.Por lo tanto, si estamos hablando de transmitir estudios sobre la prolongación de la vida por persona, entonces la terapia génica tiene una ventaja absoluta, ya que no reduce la calidad de vida debido a la necesidad de un tratamiento constante: siga una dieta diaria o use geroprotectores u otras drogas constantemente.Terapia génica con telomerasa
El descubrimiento de la telomerasa es una revolución en el estudio del envejecimiento.
La idea es usar la telomerasa para prolongar la vida por más de 30 años. El descubrimiento de la telomerasa en 1985 causó una sensación real entre los investigadores del envejecimiento, y recibió una calificación tan alta que Elizabeth Blackburn, Carol Grader y Jack Shostak recibieron el Premio Nobel en 2004 por ello.La historia de la investigación de la telomerasa se basa en 1961. El investigador estadounidense Leonard Hayflick cultivó fibroblastos de embriones humanos in vitro y notó que no pueden compartir más de 50 veces, después de lo cual envejecen. Y si tomamos las células de donantes mayores, entonces se dividen aún menos. El científico sugirió que hay un cierto contador de división en las células, lo que limita su número total.Después de 10 años, el científico ruso Alexei Olovnikov propuso un mecanismo hipotético para el funcionamiento de este contador. Olovnikov sugirió que durante la división celular, los extremos de los cromosomas, llamados telómeros, se contraen ligeramente. Y cuando los telómeros alcanzan una longitud crítica, la célula deja de dividirse y envejece. En las células sin edad (por ejemplo, madre reproductiva y embrionaria), por el contrario, debe haber una enzima que alargue los telómeros, permitiendo que las células se dividan casi hasta el infinito.Esta hipótesis se confirmó completamente con el descubrimiento de la enzima telomerasa en 1985. Los datos comenzaron a acumularse sobre el papel de los telómeros y la telomerasa no solo en el envejecimiento de las células, sino también en el envejecimiento de todo el organismo. Además, se demostró que el daño al gen de la telomerasa reduce en gran medida la vida de los animales modelo y conduce a la aparición del síndrome de envejecimiento prematuro: la progeria.Después del descubrimiento de la telomerasa, docenas de científicos dispararon para curar la vejez sobre la base. Parece que la "inclusión" de la telomerasa en todas las células puede hacer que el cuerpo sea inmortal.Sin embargo, pronto surgieron temores debido al hecho de que la síntesis activa de telomerasa también se observa en el 90% de los tumores cancerosos. Surgió la pregunta: ¿la activación de la telomerasa conduciría a un riesgo de transformación maligna? Además, resultó que el envejecimiento celular está lejos de estar siempre acompañado por la contracción de los telómeros. Por ejemplo, en el caso de las células epiteliales de la mucosa oral o la córnea del ojo humano. Esto sugiere que la activación de la telomerasa por sí sola puede no ser suficiente para rejuvenecer todo el cuerpo.A pesar de las dudas causadas por el uso terapéutico de la telomerasa, los experimentos comenzaron en líneas celulares y animales modelo. Se han realizado docenas de estudios y los resultados han superado todas las expectativas.Terapia génica de telomerasa de línea celular
En varios estudios, la actividad de la telomerasa se ha activado in vitro en células humanas. Tales trabajos, por un lado, le permiten aprender más sobre las propiedades de la telomerasa y, por otro lado, son el primer paso para desarrollar un medicamento que prolongue la vida.Para esto, el gen de la subunidad catalítica de la telomerasa (TERT) se inserta en el ADN de las células. Es ella quien realiza el alargamiento de los telómeros en la célula.El primer estudio exitoso de entrega de genes TERT fue realizado en 1998 por Andreai Bodnar y sus colegas. Resultó que tras la activación de la telomerasa, los fibroblastos humanos, que normalmente se dividen no más de 75-80 veces, pueden compartir 280. Sin embargo, no muestran signos de envejecimiento, patología o malignidad (degeneración cancerosa). Incluso si estas células se trasplantan en ratones atímicos, completamente inmunes y más susceptibles al cáncer, todavía no tienen tumores.En los años siguientes, se realizaron docenas de estudios en los que el gen de la telomerasa se introdujo en una amplia variedad de tipos de células humanas. La entrega del gen TERT a las células en división aumentó su potencial de proliferación, y la entrega a las células viejas condujo al "rejuvenecimiento" y a la reanudación de la división.Se llevaron a cabo experimentos exitosos en células madre mesenquimales, células madre óseas (osteoblastos), miosatélites (precursores de tejido muscular), condrocitos articulares (precursores de tejido cartilaginoso), así como en células de disco intervertebral, linfocitos T, hepatocitos (células hepáticas), células bulbos olfativos, etc.Es importante tener en cuenta que en la gran mayoría de los casos, la entrega del gen de la telomerasa fue absolutamente segura. Las células conservaron sus funciones y no hubo signos de formación de tumores. Sin embargo, en algunos estudios, la introducción del gen TERT condujo a un aumento en la frecuencia de reordenamientos cromosómicos (roturas de cromosomas, adhesión y desplazamiento de secciones de un cromosoma a otro). Esto, por supuesto, es un factor de riesgo para el cáncer, pero puede no tener consecuencias negativas.En general, la investigación indica que la actividad de la telomerasa en el cultivo de células humanas ralentiza significativamente el envejecimiento y no necesariamente causa cáncer. Es decir, la telomerasa se ve privada de las propiedades oncógenas que se le atribuyen. Aparentemente, la propiedad principal de la telomerasa es la regulación de la división celular, y se necesitan mutaciones y factores adicionales para la aparición del crecimiento tumoral.Terapia génica de la telomerasa: de experimentos con ratones a humanos
Los primeros experimentos sobre la terapia génica del envejecimiento fueron llevados a cabo en 2012 por la investigadora española Maria Blasco utilizando el gen de la telomerasa (TERT). Los primeros resultados obtenidos fueron muy, muy impresionantes. ¡La terapia génica no solo en adultos sino también en ratones viejos prolonga la vida hasta en un 20%! Si imaginamos que tales resultados se pueden lograr en humanos, ¡salvaremos 14 años de vida humana!
Antes de proceder a la terapia génica, se estudiaron los efectos de la telomerasa en ratones transgénicos. Resultó que si activa el gen TERT en todas las células del ratón, ¡la esperanza de vida aumenta en un 40%! Sin embargo, la actividad constante de la telomerasa también aumentó el riesgo de cáncer.
Por lo tanto, la pregunta era cómo activar la telomerasa por un tiempo más corto.
Esto es exactamente lo que se hizo en el trabajo de Maria Blasco 2012. El gen de la telomerasa se entregó al ratón utilizando un virus adenoasociado (AAV9), capaz de administrar la entrega sistémica. Los virus adenoasociados son altamente seguros: no integran el gen entregado en el genoma del huésped y, por lo tanto, no conducen a mutagénesis. Además, casi no causan una respuesta inmune.
El gen de la telomerasa se ha entregado a una amplia gama de tejidos y órganos, incluidos el hígado, los riñones, los pulmones, el corazón, el cerebro y los músculos. Se detectó telomerasa en estos tejidos incluso 8 meses después del procedimiento. En los animales, mejoraron varios parámetros relacionados con la edad: aumentó la sensibilidad a la insulina, mejoró la coordinación neuromuscular, disminuyó el riesgo de osteoporosis (agotamiento óseo) y el contenido de marcadores moleculares del envejecimiento. Además, la terapia génica TERT era completamente segura: el riesgo de cáncer en ratones no aumentó.
Y, lo más importante, la terapia génica ha extendido significativamente la vida de los ratones. La mediana de la esperanza de vida (la edad a la que sobrevive más de la mitad de los individuos en el grupo) aumentó en ratones adultos (1 año) y viejos (2 años) en un 24% y 13%, respectivamente. La esperanza de vida máxima también aumentó: en un 13% en adultos y en un 20% en ratones viejos.
En un estudio posterior, Maria Blasco demostró que administrar el gen TERT al corazón de los ratones después de un infarto de miocardio mejora significativamente la función cardíaca y reduce el riesgo de insuficiencia cardíaca y mortalidad en un 17%.
Gracias a estos experimentos, la terapia génica con telomerasa tiene una reputación brillante. Y en septiembre de 2015, se realizó el primer experimento del mundo sobre la terapia génica del envejecimiento en humanos. La estadounidense Elizabeth Perrish introdujo el gen de la telomerasa en combinación con el gen inhibidor de la miostatina (para estimular el crecimiento muscular). Este estudio acaba de comenzar, por lo que es demasiado pronto para hablar sobre los resultados, pero hasta ahora, Elizabeth se siente bien. Elizabeth hizo una promesa de proporcionar material para análisis a cualquier instituto de investigación médica que lo solicite. Sin embargo, dado que solo una persona participó en este experimento, sus resultados no permitirán extraer conclusiones confiables y estadísticamente significativas.
Sin embargo, el hecho mismo de que los ensayos en humanos hayan comenzado sugiere que un medicamento basado en TERT está en camino. Es sin duda el candidato número uno para la lucha contra el envejecimiento con terapia génica.
Terapia génica para rejuvenecer el hipotálamo
Una de las formas de prolongar la vida es un efecto estrechamente dirigido sobre las estructuras que regulan el envejecimiento de todo el organismo. Estudios recientes muestran que dicha estructura es parte del cerebro: el hipotálamo.
En 2013, científicos estadounidenses dirigidos por Donsheng Kai prolongaron significativamente la vida de los ratones al rejuvenecer el hipotálamo con la ayuda de la terapia génica. Los investigadores suprimieron la inflamación que ocurre con la edad en el hipotálamo, como resultado de lo cual el número de patologías relacionadas con la edad ha disminuido y la esperanza de vida ha aumentado en un 10%.

El envejecimiento se asocia en gran medida con una violación de la homeostasis: la autorregulación del cuerpo, su capacidad para mantener su estado interno. En el estado "joven", el cuerpo reacciona al efecto perturbador mediante un complejo de medidas que lo devuelven con éxito a su estado original, "saludable". Por ejemplo, con un aumento en la temperatura corporal, el cuerpo inicia una serie de procesos de termorregulación (por ejemplo, sudoración), como resultado de lo cual la temperatura disminuye al nivel inicial. Sin embargo, con el envejecimiento, la capacidad de mantener la homeostasis se ve afectada, lo que conduce a un "desequilibrio" del cuerpo.
El hipotálamo es uno de los principales centros del cuerpo que regula la homeostasis. A pesar de que no representa más del 5% del cerebro, es él quien une los mecanismos nerviosos y hormonales para mantener la homeostasis en un solo sistema.
Con la edad, el trabajo del hipotálamo se deteriora enormemente, en particular, disminuye la producción de la hormona más importante, la gonadoliberina. La función "clásica" de esta hormona es regular la función sexual. Pero para el envejecimiento, juega un papel secundario o incluso terciario. Es importante que la gonadoliberina también active la neurogénesis, la formación de nuevas células nerviosas en el hipotálamo, así como en varias otras áreas del cerebro.
Una de las principales causas del deterioro del hipotálamo relacionado con la edad es la inflamación. Con la edad, los factores de transcripción NF-kB e IKK-b, moléculas reguladoras que activan toda la cascada de genes responsables de la inflamación, se activan en el hipotálamo.
Para rejuvenecer y reducir la inflamación en el hipotálamo, Dongsheng Kai y sus colegas utilizaron un gen que inhibe el trabajo de NF-kB - IkB-a. El gen IkB-a se introdujo en ratones adultos mediante inyección en el hipotálamo. Para que el gen penetre en los núcleos de las células y se integre en el genoma, se utilizaron vectores lentivirales.
La terapia tuvo un efecto muy fuerte sobre el envejecimiento. ¡La vida útil máxima de los ratones aumentó en un 10%! La salud de los ratones también ha mejorado significativamente. Incluso 6 meses después de la inyección, los ratones tuvieron un mejor rendimiento mental y los músculos funcionaron mejor. Un análisis de la estructura del tejido también mostró que los músculos, la piel y los huesos de los ratones estaban en un estado más "joven".
Por lo tanto, el hipotálamo es un centro importante para regular el envejecimiento sistémico. Su rejuvenecimiento conduce a una extensión de la vida del cuerpo, aparentemente, tanto mejorando sus propias funciones reguladoras del hipotálamo y secretando hormonas sexuales, como estimulando la neurogénesis y, como resultado, mejorando el funcionamiento de otras partes del cerebro.
Terapia génica para aumentar la resistencia al estrés.
Entre las formas de extender la vida, estudiadas hasta la fecha, la más poderosa es aumentar la resistencia al estrés. Debido a los impactos en este camino, se han establecido todos los registros actuales de extensión de vida. Robert Schmuckler-Rice logró extender la vida del nematodo 10 veces, y Andrzej Bartka la vida del ratón - 1.8.
A lo largo de la vida, el cuerpo se enfrenta constantemente a una variedad de factores dañinos: hambre, sed, frío, sustancias tóxicas, radiación dañina, estrés psicológico. La resistencia a estos factores se llama resistencia al estrés.
Puede producirse una mayor tolerancia al estrés en todos los niveles: desde las moléculas hasta todo el organismo. Sin embargo, se han estudiado principalmente mecanismos moleculares. El aumento de la resistencia al estrés se acompaña de un aumento en la estabilidad de la proteína; si ya hay violaciones en la estructura de las moléculas de proteínas, entonces se corrigen y la célula se deshace de las moléculas completamente destruidas, se desmantela en ladrillos y se digiere.
El aumento de la tolerancia al estrés se puede lograr de varias maneras.
La primera forma más conocida es limitar la nutrición. Al mismo tiempo, la operación del complejo MTOR está "desactivada". MTOR es una especie de "interruptor" molecular. Pone a la célula en un estado de crecimiento activo y reproducción. Al mismo tiempo, se suprimen los mecanismos de resistencia al estrés que consumen energía. Si el MTOR está apagado, la célula, por el contrario, pasará al modo de protección contra el estrés.
La segunda forma, también bien estudiada, de aumentar la tolerancia al estrés es bloquear la señalización de la insulina y el factor de crecimiento similar a la insulina 1 (IGF-1). Se entiende que señalización (o señalización) significa una cascada de procesos moleculares que se producen en la célula en respuesta a la acción de las hormonas. La insulina y el IGF-1 le indican a la célula la presencia de un nutriente de glucosa en la sangre. Como resultado, se inician procesos de crecimiento en la célula, se activa la vía MTOR y se suprimen los procesos de resistencia al estrés.
Inhibición de la vía MTOR o insulina: lanza una cascada completa de genes de respuesta al estrés, que también resultaron ser genes de longevidad: FOXO, NRF2, AMPK, HIF-1, SIRT1 y SIRT6, etc. Por lo tanto, la tercera forma de aumentar la resistencia al estrés es la activación artificial genes de respuesta al estrés.

Todos estos enfoques están siendo investigados activamente para la terapia génica del envejecimiento. En algunos trabajos, actúan por separado en el hipotálamo, la estructura que regula el envejecimiento, en otros, sistémicamente, en la mayoría de las células del cuerpo. Existen muy pocos estudios genuinos sobre terapia génica donde un gen terapéutico se toma en un animal adulto, o más bien, solo uno. En la mayoría de los estudios, la terapia génica se basa en animales transgénicos o líneas celulares (en células in vitro).
Activación del gen neuropéptido Y en el hipotálamoEl primer y único trabajo en terapia génica para aumentar la resistencia al estrés se realizó en ratones hace menos de un año. Actuó sobre el regulador del envejecimiento sistémico: el hipotálamo.
 Luís Pereira de Almeida, Janete Cunha Santos y Cláudia Cavadas
Luís Pereira de Almeida, Janete Cunha Santos y Cláudia CavadasUn grupo de científicos portugueses y alemanes liderados por Luís Pereira de Almeida y Cláudia Cavadas realizó un experimento en 2015, donde activaron el gen del neuropéptido Y (NPY) en el hipotálamo de rata.
El neuropéptido Y es una de las moléculas de señalización más importantes del hipotálamo. En los últimos años, han aparecido muchos datos sobre el papel de esta sustancia en el envejecimiento. Por ejemplo, el trabajo del gen NPY es necesario para que la restricción calórica prolongue la vida. Y en las ratas transgénicas que produjeron más de este neuropéptido, la mediana de la esperanza de vida (la edad a la que vivía la mitad de los individuos en el grupo) incluso aumentó.
Es sorprendente que hace unos años no se sabía una palabra sobre el papel de NPY en el envejecimiento. Y el neuropéptido Y se mencionó solo en relación con su papel en la obesidad y su capacidad para estimular el hambre. ¡Es sorprendente cómo estas funciones se combinan con la capacidad de prolongar la vida!
Los científicos entregaron el gen NPY a través del virus adenoasociado al hipotálamo. Como resultado, se estimuló el mecanismo más importante de resistencia al estrés en las células del hipotálamo: la autofagia (el proceso de autolimpieza celular de moléculas y estructuras celulares dañadas por su digestión).
No se estudiaron otros efectos de la terapia génica NPY sobre la longevidad en este trabajo, pero los investigadores lo harán en el futuro.
Sin embargo, ya se puede suponer que la terapia inventada por De Almeida y Cavadas retrasará el envejecimiento al rejuvenecer el hipotálamo (un regulador del envejecimiento sistémico). Por otro lado, es posible que el neuropéptido Y estimule la autofagia no solo en el hipotálamo, sino también en otras células del cuerpo, lo que también conducirá a una desaceleración del envejecimiento.
Activación del gen UCP2 en el hipotálamoEn 2006, científicos estadounidenses dirigidos por Tamás Bártfai realizaron otro elegante experimento, donde también actuaron sobre el hipotálamo. ¡La exposición condujo a una ligera disminución de la temperatura corporal y, inesperadamente, a una mayor esperanza de vida!
Este no fue un experimento en terapia génica: se utilizaron ratones transgénicos, cuyo genoma cambió desde el nacimiento. Pero, dada la efectividad de los métodos actuales para administrar genes al cuerpo, la traducción de estos estudios a la terapia génica no presenta ningún problema en particular.
Los ratones transgénicos en los experimentos de Tamás Bártfai produjeron una mayor cantidad de proteína de desacoplamiento 2 (UCP2) en el hipotálamo. Esta es una proteína mitocondrial, que durante el trabajo reduce la eficiencia de la síntesis de ATP y promueve el calor. Como resultado, la temperatura del hipotálamo aumentó ligeramente. Y un aumento de la temperatura en el termorregulador del cuerpo principal condujo al hecho de que la temperatura corporal total se redujo ligeramente, de 0.3 ° a 0.5 ° C.
Una ligera disminución en la temperatura corporal causó un efecto similar en los ratones a la restricción de alimentos, a pesar de que los ratones comieron todo lo que quisieron. Además, la mediana de vida de los ratones aumentó significativamente: en los machos en un 12% y en las hembras en un 20%.
En otros trabajos, la resistencia al estrés aumentó, actuando sistémicamente en la mayoría de las células del cuerpo.
Inactivación de la ruta de envejecimiento MTORToren Finkel y sus colegas aumentaron la resistencia al estrés y la longevidad de los ratones al desactivar la vía de envejecimiento MTOR más conocida.
En los experimentos, se utilizaron ratones transgénicos con una mutación en el locus MTOR (regiones en el cromosoma donde se encuentran los genes correspondientes), que tenían un 75% menos de proteína MTOR en las células. Resultó que tales ratones viven un 20% más.

Además, la mutación en el locus MTOR mejoró significativamente muchos indicadores de la salud del ratón: varios órganos y tejidos estaban en una condición "más joven" y mejor, había menos agregados de proteínas (proteínas adherentes) y daños en los tejidos. Además, la memoria, la coordinación motora y el pensamiento espacial de estos ratones funcionaron mejor.
Sin embargo, "desactivar" la vía MTOR también estuvo acompañada de efectos secundarios: la condición de los huesos empeoró, los ratones a menudo sufrían enfermedades infecciosas de la boca, la piel y los ojos. Además, los ratones eran más pequeños. Por lo tanto, un apagado prolongado de los genes del complejo MTOR es aparentemente bastante traumático para el cuerpo, y el tiempo de inactivación del MTOR debería reducirse o combinarse con otro efecto que compense los efectos secundarios negativos.
Activación del gen PTENOtro objetivo prometedor de la terapia génica es el gen PTEN: "desactiva" la vía de insulina del envejecimiento. PTEN inhibe el trabajo de la fosfatidilinositol-3-quinasa tipo I (PI3K), una molécula necesaria para la transmisión de una señal de insulina a la célula.
Científicos españoles dirigidos por Manuel Serrano investigaron ratones transgénicos con sobreexpresión (aumento de la actividad) del gen PTEN. Estos ratones estaban mucho mejor protegidos contra el cáncer y su esperanza de vida máxima era un 16% más larga. Los ratones transgénicos eran más sensibles a la insulina, protegidos de la diabetes y la esteatosis: la acumulación patológica de grasa en el hígado, tenían menos daño en el ADN en la vejez.

Se descubrió otro mecanismo en el trabajo (además de la inactivación de la vía de la insulina) por el cual PTEN afecta la longevidad. La activación de PTEN condujo al hecho de que el tejido adiposo marrón comenzó a liberar mucha energía en forma de calor, lo que provocó un mayor gasto de energía de todo el organismo. Y, como se sabe de trabajos anteriores, la esperanza de vida depende directamente de la intensidad del consumo de energía.
Apagado del gen AC5Otra forma menos conocida de aumentar la tolerancia al estrés es bloquear la transmisión de la señal de la hormona del estrés: la adrenalina a la célula. La adrenalina es una hormona que causa una reacción de huida o lucha; comienza a destacarse activamente cuando siente peligro, miedo, lesiones, quemaduras, conmoción y en situaciones límite, movilizando el cuerpo para eliminar la amenaza. Al mismo tiempo, la adrenalina es una hormona del estrés muy poderosa, con una exposición prolongada daña las células y los tejidos enteros, lo que lleva al agotamiento del cuerpo.
El investigador estadounidense Stephen F. Vatner y sus colegas crearon ratones transgénicos con el gen de la adenilato ciclasa tipo 5 "desactivado" (AC5), una molécula necesaria para que la señal de adrenalina se transmita a las células a través de uno de sus tipos de receptores, los receptores β-adrenérgicos. Es importante tener en cuenta que dichos receptores están presentes en casi todas las células del cuerpo.
El "apagado" del gen AC5 inesperadamente tuvo un efecto muy fuerte en la salud y la longevidad. Los ratones transgénicos vivieron hasta un 30% más que los ratones normales y fueron menos susceptibles a las patologías óseas y cardíacas.
A nivel molecular, estos efectos estaban relacionados con el hecho de que la inactivación de AC5 desencadenaba el camino de la resistencia al estrés: Raf / MEK / ERK. Como resultado, la célula produjo un conjunto completo de moléculas protectoras, desencadenó los mecanismos de supervivencia celular.
Además, de estudios anteriores se sabe que la acción de la adrenalina en la célula a través de los receptores β2-adrenérgicos causa directamente daño al ADN. Por lo tanto, se puede suponer que el "apagado" del gen AC5 de los ratones también contribuyó a una mayor estabilidad del genoma.
Activación de genes de sirtuinaOtros participantes importantes en los mecanismos de tolerancia al estrés y la longevidad son las sirtuinas. En particular, se estudiaron las sirtuinas 1 y 6 (SIRT1 y SIRT6). Las sirtuinas son desacetilasas de histonas: alteran la densidad de empaquetamiento del ADN e inhiben la expresión (disminución de la actividad) de los genes.
Las histonas son moléculas que proporcionan un empaquetamiento espacial del ADN: el ADN se enrolla a su alrededor como un hilo en una bobina, y las bobinas están apretadas. Si las bobinas están demasiado apretadas, es casi imposible leer la información genética de ellas. Las desacetilasas solo aumentan la densidad del empaque de ADN, lo que lo hace inaccesible para la lectura. Como resultado de la activación de sirtuinas, se inhibe la expresión de un conjunto completo de genes.
Sirtuin 1Sirtuin 1 regula una serie de procesos de longevidad: inhibe la inflamación, promueve la supervivencia celular, desencadena la división de las estaciones de energía celular (mitocondrias) y activa el gen más importante de resistencia al estrés y longevidad: FOXO. Varios estudios en ratones transgénicos han demostrado que la activación del gen SIRT1 tiene un efecto positivo en la salud. En el primer estudio de 2010 realizado por científicos españoles dirigido por Manuel Serrano, el gen SIRT1 se activó en todo el cuerpo de los ratones. Como resultado, sus células envejecían más lentamente, había menos daño en el ADN y el cáncer se desarrollaba con menos frecuencia. Y después de 3 años, Shin-ichiro Imai de la Universidad de Washington activó el gen SIRT1 no en todo el cuerpo, sino solo en el cerebro de los ratones, lo que llevó a una extensión significativa de su vida. Las hembras transgénicas vivieron un 16% más y los machos un 9%.Además, hasta la fecha, se ha realizado mucho trabajo donde la terapia con el gen SIRT1 se ha modelado en líneas celulares humanas. La administración del gen SIRT1 rejuveneció las células humanas madre y diferenciadas (funcionalmente especializadas), aumentó el número de divisiones y ralentizó la aparición del envejecimiento celular.Sirtuin 6Otro jugador clave en la longevidad es Sirtuin 6 (SIRT6). Previene la inflamación, modifica las señales del factor de crecimiento 1 similar a la insulina IGF1, activa las vías de reparación del ADN y algunos otros mecanismos de estabilidad del genoma.El aumento de la expresión del gen SIRT6 promueve la longevidad, que se demostró en 2 estudios en ratones transgénicos.En 2012, científicos estadounidenses e israelíes dirigidos por Haim Y. Cohen aumentaron la expresión de SIRT6 en todo el cuerpo de los ratones, lo que extendió la vida de los machos (pero no de las hembras) en un 10-14.5%. Sorprendentemente, a pesar de la longevidad, los ratones transgénicos no tenían enfermedades menos seniles, pero incluso con enfermedades como el cáncer, los ratones transgénicos vivieron mucho más tiempo. Y después de varios años en el trabajo de los mismos científicos (según datos no publicados), la activación del gen SIRT6 aumentó la vida no solo de los hombres, sino también de las mujeres. Sin embargo, debe tenerse en cuenta que la activación de SIRT6 está lejos de ser útil en todos los tejidos. En el cerebro, su mayor producción, por el contrario, predispone a enfermedades neurodegenerativas.Se han realizado varios estudios exitosos sobre la terapia con el gen SIRT6 en líneas celulares humanas. Se demostró que su suministro rejuvenece las células del revestimiento de los bronquios y los vasos sanguíneos y el cartílago.Curiosamente, la terapia génica SIRT6 aún no se usa para el envejecimiento, pero ya se usa para la patología del cartílago relacionada con la edad: la osteoartritis. Se han realizado estudios sobre terapia génica tanto en células como en ratones. Después de que el gen SIRT6 se introdujo en la rodilla, el cartílago funcionó mucho mejor y aparecieron muchos menos cambios patológicos.
Y después de 3 años, Shin-ichiro Imai de la Universidad de Washington activó el gen SIRT1 no en todo el cuerpo, sino solo en el cerebro de los ratones, lo que llevó a una extensión significativa de su vida. Las hembras transgénicas vivieron un 16% más y los machos un 9%.Además, hasta la fecha, se ha realizado mucho trabajo donde la terapia con el gen SIRT1 se ha modelado en líneas celulares humanas. La administración del gen SIRT1 rejuveneció las células humanas madre y diferenciadas (funcionalmente especializadas), aumentó el número de divisiones y ralentizó la aparición del envejecimiento celular.Sirtuin 6Otro jugador clave en la longevidad es Sirtuin 6 (SIRT6). Previene la inflamación, modifica las señales del factor de crecimiento 1 similar a la insulina IGF1, activa las vías de reparación del ADN y algunos otros mecanismos de estabilidad del genoma.El aumento de la expresión del gen SIRT6 promueve la longevidad, que se demostró en 2 estudios en ratones transgénicos.En 2012, científicos estadounidenses e israelíes dirigidos por Haim Y. Cohen aumentaron la expresión de SIRT6 en todo el cuerpo de los ratones, lo que extendió la vida de los machos (pero no de las hembras) en un 10-14.5%. Sorprendentemente, a pesar de la longevidad, los ratones transgénicos no tenían enfermedades menos seniles, pero incluso con enfermedades como el cáncer, los ratones transgénicos vivieron mucho más tiempo. Y después de varios años en el trabajo de los mismos científicos (según datos no publicados), la activación del gen SIRT6 aumentó la vida no solo de los hombres, sino también de las mujeres. Sin embargo, debe tenerse en cuenta que la activación de SIRT6 está lejos de ser útil en todos los tejidos. En el cerebro, su mayor producción, por el contrario, predispone a enfermedades neurodegenerativas.Se han realizado varios estudios exitosos sobre la terapia con el gen SIRT6 en líneas celulares humanas. Se demostró que su suministro rejuvenece las células del revestimiento de los bronquios y los vasos sanguíneos y el cartílago.Curiosamente, la terapia génica SIRT6 aún no se usa para el envejecimiento, pero ya se usa para la patología del cartílago relacionada con la edad: la osteoartritis. Se han realizado estudios sobre terapia génica tanto en células como en ratones. Después de que el gen SIRT6 se introdujo en la rodilla, el cartílago funcionó mucho mejor y aparecieron muchos menos cambios patológicos. Activación del gen NRF2Un enfoque alternativo para aumentar la tolerancia al estrés es influir en el factor de transcripción NRF2. Esta vía es altamente activa en las células de animales de larga vida: la rata topo desnuda y los ratones enanos Snell.NRF2 es un factor de transcripción, una molécula que regula la actividad de cientos de otros genes. Comienza a funcionar en respuesta a los efectos tóxicos y lanza el trabajo de más de 200 genes que protegen a las células del daño, la inflamación y aumentan la estabilidad de las proteínas.Este camino fue adoptado inmediatamente por científicos involucrados en el tratamiento de enfermedades neurodegenerativas (en particular, la enfermedad de Alzheimer), y ya han realizado varios trabajos sobre terapia génica y de células génicas en ratones.Muchos investigadores están inclinados a tratar enfermedades neurodegenerativas mediante el suministro de células madre al cerebro. Sin embargo, con tales enfermedades, se observa un alto nivel de estrés oxidativo en el cerebro y las células madre mueren durante la inyección. Y la entrega previa del gen NRF2 hace que estas células sean más resistentes al estrés, de modo que no mueran después de ser introducidas en el cerebro.En otros estudios, el gen NRF2 se entregó directamente al cerebro de los ratones con Alzheimer. La introducción del gen NRF2 en el hipocampo (la estructura cerebral responsable de la memoria) mejoró la memoria y el aprendizaje espacial. Y en otro trabajo, la entrega del gen NRF2 al cerebro lo hizo más resistente al hambre de oxígeno (hipoxia) y mejoró las capacidades mentales de los ratones.En general, para aumentar la resistencia al estrés, se lleva a cabo la mayor parte de la investigación científica sobre terapia génica. Todos los principales participantes en las vías de señalización son probados: moléculas que inhiben las vías de envejecimiento de IGF-1 y MTOP, así como aquellas que están involucradas en diversas vías de resistencia al estrés. Es un aumento en la resistencia al estrés que conduce al efecto máximo de prolongar la vida en ratones transgénicos, hasta 1,8 veces. Sin embargo, todavía hay muy pocos trabajos "clásicos" sobre la terapia génica de la tolerancia al estrés (donde el gen terapéutico se entrega al animal modelo), o más bien, solo uno. Pero cuando los científicos recurren a la terapia génica a partir de experimentos con animales transgénicos, hay muchas posibilidades de esperar un éxito sin precedentes para extender la vida.
Activación del gen NRF2Un enfoque alternativo para aumentar la tolerancia al estrés es influir en el factor de transcripción NRF2. Esta vía es altamente activa en las células de animales de larga vida: la rata topo desnuda y los ratones enanos Snell.NRF2 es un factor de transcripción, una molécula que regula la actividad de cientos de otros genes. Comienza a funcionar en respuesta a los efectos tóxicos y lanza el trabajo de más de 200 genes que protegen a las células del daño, la inflamación y aumentan la estabilidad de las proteínas.Este camino fue adoptado inmediatamente por científicos involucrados en el tratamiento de enfermedades neurodegenerativas (en particular, la enfermedad de Alzheimer), y ya han realizado varios trabajos sobre terapia génica y de células génicas en ratones.Muchos investigadores están inclinados a tratar enfermedades neurodegenerativas mediante el suministro de células madre al cerebro. Sin embargo, con tales enfermedades, se observa un alto nivel de estrés oxidativo en el cerebro y las células madre mueren durante la inyección. Y la entrega previa del gen NRF2 hace que estas células sean más resistentes al estrés, de modo que no mueran después de ser introducidas en el cerebro.En otros estudios, el gen NRF2 se entregó directamente al cerebro de los ratones con Alzheimer. La introducción del gen NRF2 en el hipocampo (la estructura cerebral responsable de la memoria) mejoró la memoria y el aprendizaje espacial. Y en otro trabajo, la entrega del gen NRF2 al cerebro lo hizo más resistente al hambre de oxígeno (hipoxia) y mejoró las capacidades mentales de los ratones.En general, para aumentar la resistencia al estrés, se lleva a cabo la mayor parte de la investigación científica sobre terapia génica. Todos los principales participantes en las vías de señalización son probados: moléculas que inhiben las vías de envejecimiento de IGF-1 y MTOP, así como aquellas que están involucradas en diversas vías de resistencia al estrés. Es un aumento en la resistencia al estrés que conduce al efecto máximo de prolongar la vida en ratones transgénicos, hasta 1,8 veces. Sin embargo, todavía hay muy pocos trabajos "clásicos" sobre la terapia génica de la tolerancia al estrés (donde el gen terapéutico se entrega al animal modelo), o más bien, solo uno. Pero cuando los científicos recurren a la terapia génica a partir de experimentos con animales transgénicos, hay muchas posibilidades de esperar un éxito sin precedentes para extender la vida.Terapia génica para destruir células viejas
Otra estrategia para prolongar la vida es la destrucción de las viejas células senescentes. Las células viejas se acumulan en el cuerpo con la edad y contribuyen al envejecimiento de todo el organismo. Especialmente se encuentran muchas células senescentes en los focos de las patologías relacionadas con la edad: úlceras, placas ateroscleróticas, articulaciones enfermas y el cerebro en la enfermedad de Alzheimer.Las células se vuelven seniles cuando pierden la capacidad de compartir y cumplir sus funciones. Una vez que se vuelven sensoriales, comienzan a secretar un montón de sustancias nocivas (SASP), que interrumpen la estructura y la función de los tejidos vecinos, y también contribuyen a la transformación cancerosa de las células.Aparentemente, la formación evolutiva de tales células en el cuerpo surgió como un mecanismo protector contra el cáncer. Para no volverse cancerosas, las células dañadas pierden su capacidad de dividirse, pasando a una condición especial llamada senessence. Y las sustancias liberadas por ellos (SASP) señalan a otras células que se ha producido un daño y estimulan la reparación de tejidos y la cicatrización de heridas.Según una investigadora del Instituto de Bak (California) Judy Campisi, el envejecimiento celular es un fenómeno útil en la juventud, pero muy dañino en la vejez. En la juventud, la aparición de una pequeña cantidad de tales células protege al cuerpo del cáncer, y las sustancias secretadas por ellas contribuyen a un cambio en la estructura y reparación de los tejidos. Sin embargo, la acumulación de una gran cantidad de tales células en la vejez conduce al hecho de que hay demasiados factores secretados por ellas. Esto da como resultado una inflamación crónica, que, a su vez, contribuye a todas las patologías relacionadas con la edad, desde la neurodegeneración hasta el cáncer.Por primera vez, el investigador estadounidense Jan M. van Deursen aplicó la destrucción de las células senescentes para retrasar el envejecimiento. El estudio fue publicado en 2011 en la mejor revista mundial Nature. Los experimentos se realizaron en ratones transgénicos con envejecimiento prematuro. Se insertó un gen suicida en el genoma de dichos ratones, que solo comenzó a funcionar en células viejas. En las células restantes, permaneció inactivo. Fue posible causar la muerte de células senescentes en tales ratones en cualquier momento introduciendo AP20187 en ratones. La enzima codificada en el gen suicida convirtió esta sustancia en tóxica, que mató a las células senescentes.Los resultados mostraron que si las células senescentes se destruyen durante toda su vida a medida que surgen, las patologías relacionadas con la edad (tejido adiposo, músculos, ojos y muchos otros órganos) ocurren en ratones mucho más tarde. Sin embargo, puede comenzar a destruir células viejas en organismos viejos, cuando todas estas patologías ya han surgido. En este caso, la condición patológica es mucho más fácil.Desde entonces, el grupo de investigación Jan M. van Deursen ha progresado significativamente en su investigación. A principios de 2016, publicaron un artículo, nuevamente en la revista Nature, donde mostraron que la destrucción de las células senescentes ralentiza el envejecimiento en ratones normales con envejecimiento normal (no acelerado). ¡La terapia ralentizó la aparición del cáncer, evitó la aparición de patologías del corazón, los riñones y el tejido adiposo y, además, prolongó la vida en un 17-35%!Terapia génica para mejorar la función mitocondrial
Con la edad, hay un fuerte deterioro en el trabajo de las mitocondrias, lo que contribuye al envejecimiento de las células y de todo el organismo.Las mitocondrias son plantas de energía celular, proporcionan a la célula energía básica. La "respiración celular" tiene lugar en ellos: producción de energía debido a la oxidación de nutrientes y su almacenamiento en forma de moléculas de ATP de alta energía.De particular interés es el origen de las mitocondrias. Son los descendientes de bacterias tragadas por células primitivas hace 1.5–2 mil millones de años. Durante la existencia de las mitocondrias dentro de la célula, se volvieron mucho más simples, se volvieron dependientes de la célula, pero aún conservaron su autonomía. Por ejemplo, las mitocondrias tienen su propio ADN, así como sus propias "máquinas" moleculares para la síntesis de ARN y proteínas.Con el envejecimiento, disminuyen tanto el número de mitocondrias como su calidad. En el proceso de "respiración celular", las mitocondrias comienzan a secretar mucho más subproducto: especies de oxígeno activo que dañan la célula y también producen significativamente menos energía. Como resultado, la célula no tiene suficiente energía para llevar a cabo los procesos de reparación y regeneración.Por el momento, solo se está estudiando activamente un enfoque para la terapia génica de las mitocondrias en la vejez: la activación del gen PGC-1. Este gen es el regulador más importante del número de mitocondrias en mamíferos, así como el gen de la longevidad.Drosophila demostró que su sobreexpresión en las células intestinales prolonga la vida en un 33-37%. En humanos, el gen PGC-1 está involucrado en la aparición de una serie de patologías relacionadas con la edad. La deficiencia de PGC-1 contribuye a la neurodegeneración y la diabetes tipo 2, y la introducción de PGC-1 restaura el campo de daño renal.El gen PGC-1 aún no se ha utilizado directamente para la terapia del envejecimiento, pero se usa activamente para tratar diversas patologías relacionadas con la edad. Se han llevado a cabo varios estudios tanto en células como en ratones modelo.Investigadores chinos, liderados por Wei-Jia Kong, han usado el gen PGC-1 para tratar la sordera en un modelo celular. La introducción de este gen desaceleró el envejecimiento de las células de rata responsables de la percepción de los sonidos. En otro estudio, el científico chino Bing Chen y sus colegas utilizaron con éxito la entrega del gen PGC-1 a las células madre para aumentar su resistencia al estrés. Y Pei-Qing Liu introdujo el gen PGC-1 en las células del corazón, que las protegió de la hipertrofia (proliferación patológica).Varios experimentos ya se han llevado a cabo en ratones. Científicos de Boston, liderados por Zolt Arany, entregaron el gen PGC-1 a ratones viejos con enfermedad arterial periférica. La terapia restableció con éxito el suministro de sangre a los músculos. Y los investigadores Hollinger y Selsby utilizaron la terapia génica PGC-1 para tratar una enfermedad muscular hereditaria: la miodistrofia de Duchenne, que, sin embargo, no está relacionada con la edad. Sin embargo, la terapia también tuvo éxito en este caso: la administración del gen PGC-1 mejoró significativamente la función muscular en ratones con patología.Terapia génica para mantener la estabilidad del genoma y del epigenoma
Un rasgo característico y, aparentemente, una de las principales causas del envejecimiento es la acumulación de daño en el ADN. Además, numerosas enfermedades de envejecimiento prematuro, la progeria, también surgen como resultado de la acumulación excesiva de daño genómico.Por lo tanto, una de las formas más prometedoras de extender la vida es reparar el daño y aumentar la estabilidad del genoma.A lo largo de la vida, varias influencias dañan constantemente el ADN. Desde el ambiente externo, la temperatura, la radiación UV, los mutágenos químicos y los virus actúan sobre él. Pero los procesos internos de la célula también aumentan la inestabilidad genómica: el ADN está dañado por las especies reactivas de oxígeno de las mitocondrias, y los sistemas de replicación (duplicación del ADN) y reparación a menudo funcionan de manera incorrecta y cometen errores.Como resultado, con la edad, se acumula todo un espectro de trastornos en el ADN: roturas, mutaciones puntuales, movimiento de piezas de ADN de un lugar a otro, agrupamiento de cromosomas, incrustación de virus y transposones en el genoma. Si hay demasiado daño, la célula se ve obligada a seguir uno de estos tres caminos: iniciar el proceso de suicidio celular (apoptosis), volverse senescente o convertirse en cáncer. Todos estos procesos (si muchas células están expuestas a ellos) son extremadamente dañinos para el cuerpo.La forma más estudiada de aumentar la estabilidad del genoma es la activación de los sistemas de reparación de ADN. Este enfoque se utiliza en la mayoría de los trabajos sobre terapia génica.Activación de reparación de ADNLa reparación del ADN es la tarea más importante para las células, ya que le permite guardar la información más valiosa incrustada en el ADN. No es casualidad que varios sistemas mutuamente complementarios para la detección del daño del ADN y su curación se formaron en la evolución de la célula. Estas son, por ejemplo, formas de reconocer roturas de ADN de 2 y 1 cadenas; varios sistemas de reparación de ADN: reparación por escisión, que permite eliminar bases nitrogenadas dañadas, conexión no homóloga de extremos y recombinación homóloga, cura roturas de ADN de 2 cadenas, reparación activada por replicación, etc. Cientos de proteínas están involucradas en estos sistemas, cuyas funciones están entrelazadas por una red compleja y extraña. . Potencialmente, cada uno de estos genes es un candidato para la terapia génica para el envejecimiento, pero los estudios en esta área apenas están comenzando. En 2013, científicos italianos dirigidos por Gemma Calamandre investigaron ratones transgénicos con activación del gen MTH1. La proteína MTH1 está involucrada en la reparación del daño de ADN y ARN causado por especies reactivas de oxígeno. Corrige los nucleótidos defectuosos: las guanidinas oxidadas en el octavo átomo de carbono (de las cuatro letras en las que está escrito el ADN, esto se indica con "G").Resultó que una mayor expresión de MTH1 prolonga la vida de los ratones transgénicos al 22%. Además, el daño genómico no se acumuló con la edad en tales ratones. Su comportamiento también cambió: los ratones se volvieron menos ansiosos y más curiosos.En otro estudio, Johannes Grillari y cols. Realizaron terapia génica de otra proteína reparadora, SNEV, en células in vitro. SNEV "parches" ADN se rompe, y también participa en la destrucción de proteínas dañadas y la limpieza celular.La entrega del gen SNEV a las células del revestimiento vascular (endotelial) humano disminuyó significativamente su envejecimiento: las células compartieron 2 veces más antes de envejecer y dejar de dividirse. Además, se volvieron más resistentes al estrés.La supresión de la actividad de los retrotransposonesEl daño del ADN también puede causar sus propias secuencias genómicas: los retrotransposones. Estos son residuos de ADN de retrovirus, que en la antigüedad se integraron en el genoma, ¡y ahora ocupan alrededor del 42% del genoma humano!Por lo general, los retrotransposones están inactivos en las células, pero se activan con la edad, y el ARN comienza a leerse de ellos. Esto conduce a daños en el ADN y reordenamientos cromosómicos, y también puede causar una respuesta autoinmune, ya que la célula decide que está infectada con virus. Todos estos procesos contribuyen al envejecimiento celular.
En 2013, científicos italianos dirigidos por Gemma Calamandre investigaron ratones transgénicos con activación del gen MTH1. La proteína MTH1 está involucrada en la reparación del daño de ADN y ARN causado por especies reactivas de oxígeno. Corrige los nucleótidos defectuosos: las guanidinas oxidadas en el octavo átomo de carbono (de las cuatro letras en las que está escrito el ADN, esto se indica con "G").Resultó que una mayor expresión de MTH1 prolonga la vida de los ratones transgénicos al 22%. Además, el daño genómico no se acumuló con la edad en tales ratones. Su comportamiento también cambió: los ratones se volvieron menos ansiosos y más curiosos.En otro estudio, Johannes Grillari y cols. Realizaron terapia génica de otra proteína reparadora, SNEV, en células in vitro. SNEV "parches" ADN se rompe, y también participa en la destrucción de proteínas dañadas y la limpieza celular.La entrega del gen SNEV a las células del revestimiento vascular (endotelial) humano disminuyó significativamente su envejecimiento: las células compartieron 2 veces más antes de envejecer y dejar de dividirse. Además, se volvieron más resistentes al estrés.La supresión de la actividad de los retrotransposonesEl daño del ADN también puede causar sus propias secuencias genómicas: los retrotransposones. Estos son residuos de ADN de retrovirus, que en la antigüedad se integraron en el genoma, ¡y ahora ocupan alrededor del 42% del genoma humano!Por lo general, los retrotransposones están inactivos en las células, pero se activan con la edad, y el ARN comienza a leerse de ellos. Esto conduce a daños en el ADN y reordenamientos cromosómicos, y también puede causar una respuesta autoinmune, ya que la célula decide que está infectada con virus. Todos estos procesos contribuyen al envejecimiento celular. En 2011, Victoria Luniak, del Instituto de Tanques de EE. UU., Realizó un estudio sobre terapia génica, donde suprimió la actividad de los retrotransposones en las células madre humanas viejas. Para esto, se introdujeron lentivirus en células viejas, de las cuales se leyeron pequeños ARN (shRNA), que suprimen la lectura de información de los retrotransposones.La terapia génica fue exitosa y condujo al rejuvenecimiento de las células viejas; nuevamente comenzaron a dividirse.Mayor estabilidad del epigenomaPara prolongar la vida, es extremadamente importante mantener la estabilidad no solo del genoma, sino también del epigenoma. El hecho es que con la edad, ocurren cambios que no afectan la secuencia de ADN, pero que, sin embargo, cambian la actividad de los genes. Tales cambios se llaman epigenéticos. Su característica es que no solo pueden permanecer en una serie de divisiones celulares, sino que también pueden transmitirse a las próximas generaciones.Hay alrededor de 18,000 genes en el genoma humano, pero no todos funcionan en las células. Las células de la gran mayoría de los tejidos tienen un genoma casi idéntico, sin contar un cierto número de mutaciones que ocurren a medida que el cuerpo se desarrolla. Sin embargo, las diferencias en la estructura y funciones de los diferentes tejidos no están determinadas por estas pequeñas desviaciones. El hecho es que la célula de cada tejido tiene un conjunto muy específico de genes que funcionan y que están "desactivados".En parte, este conjunto, el perfil de expresión génica, está determinado por el trabajo de numerosas proteínas (por ejemplo, activadores y represores del trabajo genético). Pero en gran medida, se asocia con el estado epigenético de la célula (principalmente, la densidad del "empaque" del ADN). Por lo tanto, ¡mantener la estabilidad de un epigenoma es un proceso de suma importancia!Con la edad, sin embargo, se producen cambios epigenéticos que interrumpen los perfiles de trabajo de genes, lo que afecta negativamente los procesos celulares y acelera el envejecimiento celular. Por ejemplo, con la edad, se activa un conjunto completo de genes y secuencias genómicas que normalmente no deberían funcionar (por ejemplo, retrotransposones).La actividad genética está regulada por muchos factores. Una de ellas es la densidad del "empaquetamiento" del ADN, que determina su disponibilidad para las enzimas que llevan a cabo la síntesis de ARN. El ADN en el núcleo está siempre en un estado "empaquetado" alrededor de las proteínas, las histonas. Como un hilo a la canilla. Si el gen está "empaquetado" demasiado apretado, es inaccesible para las enzimas y no se produce la síntesis de ARN. Si el "empaque" está suelto, las enzimas se asientan fácilmente y comienzan a funcionar.La activación de genes durante el envejecimiento se debe precisamente al hecho de que disminuye la densidad del "empaquetamiento" del ADN.A este respecto, varios investigadores decidieron desarrollar una terapia génica que aumenta globalmente la densidad del "empaque" de ADN en la célula.Stephen L. Helfand y sus colegas activaron el gen de metilasa Suv39, una enzima que modifica las histonas, aumentando la densidad de empaquetamiento del ADN. Los experimentos se realizaron en moscas de la fruta, Drosophila, que como resultado de la exposición comenzó a vivir más tiempo.Y los científicos canadienses Igor Kovalchuk y Olga Kovalchuk utilizaron el mismo enfoque, pero en células humanas. En su trabajo, descubrieron que la actividad del gen Suv39h1 disminuye en la vejez. Introdujeron el gen Suv39h1 en células de fibroblastos humanos (tejido conectivo), lo que condujo a su rejuvenecimiento y división estimulada.Debe entenderse que este enfoque es un efecto extremadamente grosero en el epigenoma. Sin duda, ralentizar el envejecimiento requiere un efecto mucho más "de joyería" y cambios epigenéticos en un conjunto estrecho de ciertos genes. Sin embargo, por ahora, el conocimiento sobre el papel de la epigenética en el envejecimiento es muy incompleto y aproximado.Actualmente, la terapia génica para aumentar la estabilidad del genoma y el epigenoma es un área extremadamente joven. La mayor parte del trabajo se llevó a cabo ni siquiera en animales transgénicos, sino en células in vitro, y los éxitos logrados son bastante limitados. Sin embargo, debe entenderse que hasta ahora la investigación básica ha afectado solo una pequeña capa de lo que realmente sucede en la vejez con el genoma y el epigenoma y ha revelado muy pocas formas (bastante toscas) de contrarrestar esto.¡Sin embargo, este tema es extremadamente prometedor y ciertamente conlleva muchas más sorpresas y tiene un gran potencial para la terapia génica!
En 2011, Victoria Luniak, del Instituto de Tanques de EE. UU., Realizó un estudio sobre terapia génica, donde suprimió la actividad de los retrotransposones en las células madre humanas viejas. Para esto, se introdujeron lentivirus en células viejas, de las cuales se leyeron pequeños ARN (shRNA), que suprimen la lectura de información de los retrotransposones.La terapia génica fue exitosa y condujo al rejuvenecimiento de las células viejas; nuevamente comenzaron a dividirse.Mayor estabilidad del epigenomaPara prolongar la vida, es extremadamente importante mantener la estabilidad no solo del genoma, sino también del epigenoma. El hecho es que con la edad, ocurren cambios que no afectan la secuencia de ADN, pero que, sin embargo, cambian la actividad de los genes. Tales cambios se llaman epigenéticos. Su característica es que no solo pueden permanecer en una serie de divisiones celulares, sino que también pueden transmitirse a las próximas generaciones.Hay alrededor de 18,000 genes en el genoma humano, pero no todos funcionan en las células. Las células de la gran mayoría de los tejidos tienen un genoma casi idéntico, sin contar un cierto número de mutaciones que ocurren a medida que el cuerpo se desarrolla. Sin embargo, las diferencias en la estructura y funciones de los diferentes tejidos no están determinadas por estas pequeñas desviaciones. El hecho es que la célula de cada tejido tiene un conjunto muy específico de genes que funcionan y que están "desactivados".En parte, este conjunto, el perfil de expresión génica, está determinado por el trabajo de numerosas proteínas (por ejemplo, activadores y represores del trabajo genético). Pero en gran medida, se asocia con el estado epigenético de la célula (principalmente, la densidad del "empaque" del ADN). Por lo tanto, ¡mantener la estabilidad de un epigenoma es un proceso de suma importancia!Con la edad, sin embargo, se producen cambios epigenéticos que interrumpen los perfiles de trabajo de genes, lo que afecta negativamente los procesos celulares y acelera el envejecimiento celular. Por ejemplo, con la edad, se activa un conjunto completo de genes y secuencias genómicas que normalmente no deberían funcionar (por ejemplo, retrotransposones).La actividad genética está regulada por muchos factores. Una de ellas es la densidad del "empaquetamiento" del ADN, que determina su disponibilidad para las enzimas que llevan a cabo la síntesis de ARN. El ADN en el núcleo está siempre en un estado "empaquetado" alrededor de las proteínas, las histonas. Como un hilo a la canilla. Si el gen está "empaquetado" demasiado apretado, es inaccesible para las enzimas y no se produce la síntesis de ARN. Si el "empaque" está suelto, las enzimas se asientan fácilmente y comienzan a funcionar.La activación de genes durante el envejecimiento se debe precisamente al hecho de que disminuye la densidad del "empaquetamiento" del ADN.A este respecto, varios investigadores decidieron desarrollar una terapia génica que aumenta globalmente la densidad del "empaque" de ADN en la célula.Stephen L. Helfand y sus colegas activaron el gen de metilasa Suv39, una enzima que modifica las histonas, aumentando la densidad de empaquetamiento del ADN. Los experimentos se realizaron en moscas de la fruta, Drosophila, que como resultado de la exposición comenzó a vivir más tiempo.Y los científicos canadienses Igor Kovalchuk y Olga Kovalchuk utilizaron el mismo enfoque, pero en células humanas. En su trabajo, descubrieron que la actividad del gen Suv39h1 disminuye en la vejez. Introdujeron el gen Suv39h1 en células de fibroblastos humanos (tejido conectivo), lo que condujo a su rejuvenecimiento y división estimulada.Debe entenderse que este enfoque es un efecto extremadamente grosero en el epigenoma. Sin duda, ralentizar el envejecimiento requiere un efecto mucho más "de joyería" y cambios epigenéticos en un conjunto estrecho de ciertos genes. Sin embargo, por ahora, el conocimiento sobre el papel de la epigenética en el envejecimiento es muy incompleto y aproximado.Actualmente, la terapia génica para aumentar la estabilidad del genoma y el epigenoma es un área extremadamente joven. La mayor parte del trabajo se llevó a cabo ni siquiera en animales transgénicos, sino en células in vitro, y los éxitos logrados son bastante limitados. Sin embargo, debe entenderse que hasta ahora la investigación básica ha afectado solo una pequeña capa de lo que realmente sucede en la vejez con el genoma y el epigenoma y ha revelado muy pocas formas (bastante toscas) de contrarrestar esto.¡Sin embargo, este tema es extremadamente prometedor y ciertamente conlleva muchas más sorpresas y tiene un gran potencial para la terapia génica!Terapia génica para activar la hormona klotho
Hace casi 20 años, en 1997, científicos japoneses y estadounidenses liderados por Yo-ichi Nabeshima descubrieron un nuevo gen de la longevidad y le dieron un nombre en honor a la diosa griega del destino, tejiendo el hilo de la vida: Klotho. Su "parada" en ratones transgénicos causó el síndrome de envejecimiento acelerado. Y después de 7 años, los mismos investigadores descubrieron que la activación de klotho prolonga significativamente la vida de los ratones (machos en un 20-30% y hembras) hasta en un 19%. Y en 2014, se demostró que ciertas variantes en el gen klotho (SNP Rs9536314) están asociadas con la longevidad y las altas capacidades mentales en las personas.Es producido por klotho en los riñones y los vasos sanguíneos del cerebro y es transportado por la sangre por todo el cuerpo, como una hormona. Afecta sistémicamente a la mayoría de las células del cuerpo: se une a los receptores en su superficie e inhibe la señalización de insulina e IGF-1 (una de las principales vías de envejecimiento).Solo 3 años después del descubrimiento del gen klotho, en 2000, se realizó el primer trabajo sobre terapia génica, aunque no por envejecimiento, sino por enfermedad vascular crónica: aterosclerosis. Ryozo Nagai y sus colegas introdujeron sistemáticamente este gen en ratas y lograron una mejora en el estado de los vasos sanguíneos y una reducción de la presión.Desde entonces, se han llevado a cabo entre 4 y 5 estudios exitosos sobre el tratamiento del gen klotho en ratas y ratones modelo. Es cierto que todos están dedicados no al envejecimiento, sino a diversas patologías relacionadas con la edad del sistema cardiovascular y los riñones. Esta presión arterial alta: hipertensión, enfermedad renal, enfermedad de las arterias coronarias y diabetes.
Y en 2014, se demostró que ciertas variantes en el gen klotho (SNP Rs9536314) están asociadas con la longevidad y las altas capacidades mentales en las personas.Es producido por klotho en los riñones y los vasos sanguíneos del cerebro y es transportado por la sangre por todo el cuerpo, como una hormona. Afecta sistémicamente a la mayoría de las células del cuerpo: se une a los receptores en su superficie e inhibe la señalización de insulina e IGF-1 (una de las principales vías de envejecimiento).Solo 3 años después del descubrimiento del gen klotho, en 2000, se realizó el primer trabajo sobre terapia génica, aunque no por envejecimiento, sino por enfermedad vascular crónica: aterosclerosis. Ryozo Nagai y sus colegas introdujeron sistemáticamente este gen en ratas y lograron una mejora en el estado de los vasos sanguíneos y una reducción de la presión.Desde entonces, se han llevado a cabo entre 4 y 5 estudios exitosos sobre el tratamiento del gen klotho en ratas y ratones modelo. Es cierto que todos están dedicados no al envejecimiento, sino a diversas patologías relacionadas con la edad del sistema cardiovascular y los riñones. Esta presión arterial alta: hipertensión, enfermedad renal, enfermedad de las arterias coronarias y diabetes.Terapia génica para patologías relacionadas con la edad.
En la vejez, la condición de casi todos los tejidos y sistemas del cuerpo empeora (el tono de los vasos sanguíneos y el corazón disminuye, el timo se degenera), el órgano más importante del sistema inmune, el hueso, el cartílago y el tejido muscular se agotan, se producen numerosas alteraciones cognitivas, y esto es solo el comienzo de la lista.
La mayoría de estas patologías no se consideran enfermedades, pero aumentan significativamente su riesgo. Por ejemplo, la presión arterial alta (hipertensión) es un poderoso factor de riesgo de accidente cerebrovascular, ataque cardíaco e insuficiencia cardíaca. Además, en la vejez, estas patologías se desarrollan de manera integral, lo que reduce significativamente la calidad de la vida humana y conduce a la decrepitud.
Es con tales trastornos que lucha la terapia génica de las patologías relacionadas con la edad.
Sin embargo, a diferencia de la terapia génica para el envejecimiento, siempre se limita a un solo tejido o sistema: el tratamiento de la obesidad, la degeneración de la retina o los trastornos del centro de memoria: el hipotálamo. La terapia génica del envejecimiento, por el contrario, busca rejuvenecer todas las células y tejidos del cuerpo, sin excepción.
Y si la terapia génica para el envejecimiento afecta las formas conservadoras de envejecimiento que son comunes a la mayoría de las células del cuerpo, entonces la terapia génica para las patologías relacionadas con la edad generalmente se limita a los mecanismos de influencia específicos de un tejido en particular. Muy a menudo, estos son caminos "secundarios" o "terciarios" regulados por mecanismos de longevidad más profundos y fundamentales.
Está claro que el tratamiento de patologías relacionadas con la edad es mucho más simple que el envejecimiento; para esto no hay necesidad de un conocimiento profundo de los mecanismos moleculares del envejecimiento. Por lo tanto, no es sorprendente que la terapia génica de las patologías relacionadas con la edad sea un área mucho más desarrollada. Si para el envejecimiento no se han llevado a cabo más de 2-3 estudios sobre terapia génica en mamíferos, entonces, para trastornos relacionados con la edad, ¡más de 40!
El objetivo de dicha terapia es devolver el tejido o sistema antiguo a un estado indistinguible de los animales jóvenes. Naturalmente, es imposible hacer frente al envejecimiento en general. Si el paciente se salva de un ataque cardíaco, después de un tiempo desarrollará, por ejemplo, diabetes. Incluso hay estudios que muestran que si pudiéramos curar completamente todas las enfermedades del cáncer (y esta es una de las principales causas de muerte), esto ampliaría la esperanza de vida promedio de las personas en solo tres años. Entonces, en general, este enfoque es mucho menos efectivo que la terapia génica para el envejecimiento, que rejuvenece muchos sistemas al mismo tiempo y, además, prolonga la vida.
Sin embargo, se ha llevado a cabo una gran cantidad de trabajo de alta calidad en animales modelo (ratones, ratas, conejos e incluso monos) en la terapia génica de patologías relacionadas con la edad. Esta es la terapia génica en el "sentido clásico": se introduce un gen terapéutico en animales modelo como parte de un vector de entrega y se analiza cómo esto afectará la aparición de patologías relacionadas con la edad. Además, el valor del estudio aumenta significativamente si se usan animales viejos. Intentamos analizar exactamente ese trabajo.
Los enfoques desarrollados son un poderoso medio de prevención de enfermedades y tratamiento de la senilidad. Sin embargo, parece tener sentido usarlos solo si el paciente tiene una clara predisposición a uno u otro tipo de enfermedad: cardiovascular, neurodegenerativa, etc.
Sistema cardiovascularSobre la terapia génica de las patologías del sistema cardiovascular relacionadas con la edad, se realizaron aproximadamente 7 estudios en ratones y ratas viejas. Esta es una de las áreas más emocionantes: dado que hoy las enfermedades cardiovasculares son la principal causa de muerte en el mundo, representan aproximadamente el 30% de todas las muertes, 17.3 millones de personas anualmente. Sin embargo, la aparición de estas enfermedades está precedida por varias patologías que pueden diagnosticarse y tratarse; esto es una violación de la formación de nuevos vasos sanguíneos, una disminución del tono muscular de los vasos sanguíneos y el corazón, e hipertensión. Fueron elegidos como objetivos para la terapia génica.
En la mayoría de los trabajos sobre terapia génica, utilizaron genes muy específicos que mejoran el trabajo de solo el corazón y los vasos sanguíneos, ninguno de ellos también era un gen de longevidad. Por ejemplo, para el tratamiento de la hipertensión arterial (hipertensión), el gen BNP (péptido natriurético tipo B) fue entregado al cuerpo, que es secretado por el corazón bajo un mayor estrés y dilata los vasos sanguíneos, estabilizando la presión arterial. Y para la patología cardíaca senil, la pérdida de la capacidad de relajarse, utilizaron el gen para las bombas de calcio que bombean calcio desde el citoplasma de las células musculares y relajan los músculos.
Todos estos enfoques fueron exitosos, pero no condujeron a un rejuvenecimiento radical; Además, no se han investigado efectos secundarios en ningún trabajo.
El estudio más interesante es, sin duda, el trabajo del científico francés Alain-Pierre Gadeau, donde se utilizó el gen de la cascada de señalización embrionaria: desert hedgehog (dh) como agente terapéutico. Además de su importante papel en el desarrollo embrionario, este gen también se "activa" después de lesiones isquémicas (con falta de suministro de sangre), proporcionando la formación de nuevos vasos sanguíneos. La introducción de este gen en ratones viejos después de la isquemia fue muy exitosa: ¡el suministro de sangre, así como la densidad de los nervios en las extremidades en ratones viejos enfermos se volvieron iguales que en los jóvenes!
OsteoporosisSe llevaron a cabo alrededor de 7 trabajos sobre la terapia génica de la osteoporosis: el agotamiento del tejido óseo en la vejez, lo que lleva a la fragilidad y fracturas. Sin embargo, solo dos de ellos se llevaron a cabo en animales viejos. En el resto, la osteoporosis fue inducida artificialmente.
En todos los estudios, se eligieron mecanismos específicos del hueso como objetivos. Por ejemplo, en 2 estudios, se utilizó la administración de genes BMP que promueven la formación de hueso. Y en varios otros estudios, se administraron genes de osteoprotegerina (OPG) u omentina 1 que evitan la destrucción ósea. La efectividad de todos estos enfoques fue moderada: la condición del tejido óseo mejoró, pero solo parcialmente; y los efectos secundarios no han sido investigados.
Quizás la única excepción fue el trabajo de científicos estadounidenses liderados por Xiao-Bing Zhanga, sobre la terapia de osteoporosis con células genéticas. Los científicos administraron el gen PDGFB, un factor de crecimiento que estimula la formación de hueso, a las células madre del ratón in vitro, después de lo cual las células se introdujeron en el cuerpo. Resultó ser extremadamente efectivo: la estructura ósea mejoró y la fuerza aumentó en un 45%. Es importante que en este trabajo, se investigaron los efectos secundarios, y no se encontró nada. Sin embargo, todos los experimentos se llevaron a cabo en ratones adultos sanos (y la condición de sus huesos mejoró aún más), por lo tanto, no está claro cómo funcionará la terapia en el caso de animales viejos y enfermos.
CartílagoMás de 5 trabajos sobre terapia génica se dedican a las patologías del cartílago relacionadas con la edad (degeneración de los discos intervertebrales y osteoartritis), trastornos asociados con la deformación y el agotamiento del cartílago, lo que provoca dolor crónico. Es importante tener en cuenta que todo el trabajo se realizó en adultos, no en animales viejos, en los que las patologías fueron causadas quirúrgicamente, dañando el cartílago.
Varios trabajos tuvieron como objetivo mejorar la estructura del cartílago. Por ejemplo, el gen Sox9 fue entregado al cuerpo, estimulando la producción de la molécula estructural más importante: el colágeno tipo 2. En otros trabajos, suprimieron la inflamación en la osteoartritis. Por ejemplo, se administraron miARN que inhiben la actividad del gen proinflamatorio NF-κB. Todos estos enfoques ralentizaron el desarrollo de patologías, pero no lo detuvieron.
Sin embargo, una de las obras merece especial atención. En este estudio, realizado por el científico chino Wang, se utilizó el gen de la longevidad, SIRT6. La introducción de este gen en el área del cartílago dañado ralentizó tanto la inflamación como el envejecimiento de las células y la aparición de osteoartritis. Cabe señalar que en este trabajo actuaron sobre el mecanismo de longevidad común a la mayoría de las células. Este gen puede usarse no solo para el tratamiento de patologías locales relacionadas con la edad, sino también para el rejuvenecimiento de todo el organismo.
MúsculoEl agotamiento del tejido muscular es una de las principales causas de debilidad y decrepitud senil; así como el hecho de que una persona comienza a parecerse a un anciano. Pura debilidad y miseria que alcanzan la vergüenza. Exactamente cómo se llama la vida está torcido en un cuerno de carnero. Por lo tanto, su tratamiento efectivo es relevante no solo para la medicina, sino también para la cosmetología.
Hoy, en la terapia génica de las patologías musculares seniles, solo se está desarrollando un enfoque, que, sin embargo, es muy efectivo. Esta es una supresión de la actividad del gen de la miostatina, que inhibe el crecimiento muscular. Su "apagado" se puede lograr, por ejemplo, administrando el gen del inhibidor de miostatina, el péptido MyoPPT. Según Ketan Patel, su introducción a ratones viejos conduce a resultados brillantes: no solo la masa muscular aumenta significativamente, sino que los genes de longevidad (por ejemplo, FOXO) también se "activan".
 Elizabeth Perrish
Elizabeth PerrishVale la pena mencionar que Elizabeth Perrish, la mujer que fue la primera en el mundo en someterse a una terapia génica para el envejecimiento, además del gen de la telomerasa, introdujo específicamente el gen inhibidor de la miostatina para mejorar la función muscular.
Sistema inmuneLos cambios relacionados con la edad afectan el sistema inmunitario: el cuerpo se vuelve más sensible a las infecciones virales y bacterianas; la mortalidad por ellos está aumentando y la prevención de enfermedades, la vacunación, ya no ayuda. Sin embargo, a pesar de la importancia del problema, solo hay 3 trabajos sobre terapia génica, y ninguno de ellos puede considerarse lo suficientemente exitoso. Esto no es sorprendente dada la escasez de conocimiento sobre los mecanismos moleculares y genéticos subyacentes al envejecimiento del sistema inmune.
Dos trabajos están dedicados al tratamiento de la degeneración del timo relacionada con la edad, el órgano central del sistema inmune en el que maduran los linfocitos T (participantes clave en la inmunidad adquirida). En uno de ellos, el gen para el factor de transcripción FoxN1, que regula el desarrollo del timo y la formación de células T allí, fue entregado al timo. Y en el otro, mejoraron el suministro de sangre al timo al administrar el gen VEGF, un factor de crecimiento endotelial vascular. Sin embargo, en ambos casos, los científicos lograron lograr solo una ligera desaceleración en la degradación del timo.
Y en el tercer trabajo, con la ayuda de la terapia génica, intentaron mejorar la efectividad de la vacunación en la vejez. Para hacer esto, el gen IL-2, el mediador más importante de la inflamación y la inmunidad, se introdujo en el cuerpo, lo que realmente mejoró ligeramente la respuesta inmune sistémica a la vacunación. Sin embargo, seguía siendo significativamente más débil en comparación con los ratones jóvenes.
Hasta la fecha, la farmacología cuenta con el mayor éxito en el campo del rejuvenecimiento del sistema inmunitario. ¡El gigante de la granja Novartis incluso ha realizado ensayos clínicos del análogo de rapamicina (inhibidor del envejecimiento mTOR) para mejorar la respuesta a la vacuna en los ancianos! El hecho es que la supresión de la inflamación crónica no es solo una de las formas de rejuvenecer el sistema inmunitario, sino que también ralentiza el envejecimiento de todo el cuerpo.
Sistema nervioso centralLa terapia génica de las patologías seniles del sistema nervioso central (SNC) es un área de investigación activa y de rápido desarrollo. ¡Ya se han dedicado más de 10 trabajos! Y se llevaron a cabo no solo en ratas y ratones viejos, sino incluso en primates: monos rhesus. Esto no es sorprendente, dado que las enfermedades neurodegenerativas (enfermedad de Alzheimer y Parkinson) se encuentran entre las 10 principales causas de muerte en el mundo, y el tratamiento de las patologías del SNC senil es una prevención efectiva de estas enfermedades.
La mayor parte del trabajo tiene como objetivo rejuvenecer el hipocampo, la antigua estructura del cerebro responsable de la formación de la memoria. Todos los enfoques "apuntan" a mecanismos muy específicos para las células nerviosas: las neuronas. Los científicos están tratando de mejorar la estructura de las neuronas mediante la introducción del gen de la proteína estructural Homer1c. O haga que la transmisión de señal entre las células nerviosas sea más eficiente (usando el gen PkcD involucrado en la sinapsis). Tenga en cuenta que los genes se entregan al hipocampo mediante inyección directa en esta área del cerebro. En la mayoría de los estudios, la terapia ha mejorado la memoria y el aprendizaje espacial en ratones o ratas viejas, a veces incluso al nivel de animales jóvenes. Desafortunadamente, solo se investigaron los efectos a muy corto plazo de dicha terapia, por lo que su efectividad real sigue siendo desconocida.
El más prometedor fue Matthew J. Durante el trabajo, no en la terapia, sino en la prevención del deterioro cognitivo. El gen para el factor de transcripción CREB (que está involucrado en la formación de la memoria a largo plazo) se introdujo en el hipocampo de las ratas jóvenes, y cuando estas ratas envejecieron, ¡resultó que su memoria estaba en mejores condiciones!
¡Es interesante que, en paralelo con la terapia génica, en Los Ángeles, se están desarrollando desarrollos para crear un hipocampo de rata artificial! Tal hipocampo se modela como un conjunto de redes nerviosas y está destinado a la implantación en el cerebro en lugar de uno dañado. ¡Ya ha sido probado en ratas vivas, lo que efectivamente restauró su deterioro de la memoria, y el Gerente de Proyecto Theodore Berger está entusiasmado y promete crear un hipocampo humano artificial para 2025!
Un trabajo sobre terapia génica está dedicado al rejuvenecimiento de otra estructura cerebral: la sustancia negra, o mejor dicho, su departamento de Pars compacta. Esta parte del cerebro, en primer lugar, es responsable de controlar los movimientos, sin embargo, otra de sus funciones es la síntesis de un neurotransmisor (una sustancia que asegura la transmisión de una señal de una neurona a otra) de dopamina.
La dopamina es parte del "sistema de recompensa" del cerebro; se produce durante una experiencia positiva (sexo, ingesta de deliciosas comidas o drogas) y causa placer. Sin embargo, no es menos importante para cambiar la atención de una etapa de actividad cognitiva a otra, y su insuficiencia conduce a una mayor inercia del pensamiento.
Para rejuvenecer Pars compacta, la sustancia negra ha activado el camino de la longevidad y la resistencia al estrés: ¡ha aumentado la estabilidad de las proteínas en la célula! A las ratas adultas se les inyectó el gen chaperona GRP78, que permite el plegamiento de proteínas o proteínas plegadas incorrectamente después de la degradación. Luego, monitorearon la condición de los animales hasta que eran muy viejos y descubrieron que la terapia génica protegía a las neuronas de la muerte, incluso si estaban afectadas por sustancias dañinas (alfa sinucleína).
Y finalmente, se llevaron a cabo 3 trabajos muy interesantes, donde la terapia génica se utilizó para el rejuvenecimiento sistémico de todo el cerebro. Para el parto sistémico, se inyectaron construcciones genéticas en el líquido cefalorraquídeo, lavando varias partes del cerebro.
En un estudio, la inflamación se suprimió sistémicamente en el cerebro al inhibir las sustancias proinflamatorias citocinas IL-12 e IL-23 con ARNip, que mejoró con bastante éxito las capacidades cognitivas de los ratones. Es cierto que los experimentos se realizaron en animales con envejecimiento acelerado. En otro trabajo, el cerebro de ratas muy viejas fue rejuvenecido sistemáticamente por el gen del factor de crecimiento similar a la insulina-1 (IGF-1). Como saben, el IGF-1 desencadena una de las principales formas de envejecimiento en el cuerpo, pero su papel en el sistema nervioso central es completamente diferente: es un neuroprotector. El suministro sistémico del gen IGF-1 al cerebro mejoró significativamente la actividad motora en ratas, pero no al nivel de ratas jóvenes.
Y en un notable estudio, Mark H. Tuszynski realizó una terapia génica en el cerebro de viejos monos rhesus con el gen NGF, un factor de crecimiento nervioso que también es un neuroprotector. La introducción de este gen fue muy efectiva: ¡la cantidad y el tamaño de las células nerviosas (neuronas colinérgicas) se convirtieron, como en los monos jóvenes! Además, el efecto de la terapia duró mucho tiempo, más de un año.
Cabe señalar que el gen NGF tiene una muy buena reputación: durante más de 15 años se ha estudiado con éxito en ensayos clínicos en humanos de la enfermedad de Alzheimer.
Todos estos enfoques muestran cómo mejorar la actividad cerebral en la vejez de diversas maneras. Aparentemente, el uso de enfoques combinados para la terapia génica del cerebro puede incluso conducir a su rejuvenecimiento.
Sistema reproductivoSe dedica mucho trabajo a la terapia génica de los trastornos sexuales en la vejez. En los hombres, esta es una disfunción eréctil, según la cual, según el Estudio de Envejecimiento Masculino de Massachusetts, el 39% de los hombres de 40 años y el 67% de los de 70 años sufren. Y en las mujeres, el cese del período reproductivo, la menopausia, que ocurre en promedio a los 50 años y conduce a la infertilidad. Todo el trabajo sobre terapia génica se realizó en animales viejos: ratas o ratones.
Se han desarrollado unos 6 enfoques para el tratamiento de la disfunción eréctil, sin embargo, todos son muy uniformes: actúan sobre los mecanismos específicos de los músculos lisos del pene. En varios trabajos, activaron la molécula de señalización NO necesaria para la relajación muscular (eNOS, ecSOD, genes siRNA contra la arginasa), y en otros, introdujeron los genes de los canales iónicos necesarios para el trabajo muscular (CATF, Maxi-K). Aparentemente, el más efectivo fue el suministro del gen KATF: canales de potasio dependientes de ATP, necesarios para el tono muscular normal. En este caso, el rejuvenecimiento alcanzó el nivel de los animales jóvenes.
Aparentemente, en cualquier caso, el tratamiento de la disfunción eréctil será más efectivo si se acompaña de una normalización del equilibrio hormonal.
Solo se ha realizado un trabajo para la terapia génica del sistema reproductor femenino, ¡pero es muy interesante! Actuó sobre el principal regulador hormonal: el hipotálamo, y el gen IGF-1, un factor de crecimiento similar a la insulina, se introdujo allí. Esto merece una atención especial porque, como ya dijimos, a nivel de todo el organismo, el IGF-1 comienza a envejecer, pero es un neuroprotector en el sistema nervioso central. IGF-1 también participa en la regulación de las hormonas sexuales (en particular, controla la liberación de la hormona liberadora de gonadotropina (GnRH) en respuesta a los estrógenos).El gen IGF-1 se inyectó en ratas hembras de mediana edad en el hipotálamo, y después de unos meses, su ciclo de celo mejoró y sus ovarios se mantuvieron en mejores condiciones. Quizás las mejoras estaban relacionadas con el aumento de la producción de IGF-1 y su regulación de las hormonas sexuales. ¡Pero es posible que tal terapia conduzca al rejuvenecimiento del hipotálamo y, como resultado, al rejuvenecimiento del cuerpo y sus sistemas!En general, los enfoques desarrollados son bastante interesantes, pero están poco explorados. Esto se refiere principalmente a la terapia génica del sistema reproductor masculino, donde no se han estudiado los efectos a largo plazo de la terapia, así como los posibles efectos secundarios.Obesidad edadOtra patología dependiente de la edad es un aumento en el peso corporal, o más bien en el volumen de grasa. La obesidad, por un lado, empeora en gran medida el estado de salud (por ejemplo, aumenta el riesgo de diabetes) y, por otro lado, hace que una persona sea fea. Entonces, la terapia génica de esta patología abre nuevas perspectivas para la medicina y la cosmetología.Solo se han realizado 3 trabajos sobre terapia génica para la obesidad en la vejez, y todos ellos son muy interesantes. En 2 estudios para reducir el peso actuó en los centros reguladores del cerebro.En uno de los trabajos, el gen para el factor neurotrófico GDNF se introdujo en la región de la materia negra, lo que contribuye a la supervivencia de las neuronas. Como resultado, los viejos ratones grasos perdieron mucho peso, lo que se debe en parte al hecho de que los ratones comen menos y en parte al hecho de que la terapia génica condujo a la activación de las neuronas hipotalámicas que secretan corticotropina (CRH).En otro estudio, el gen Pomc, la proopiomelanocortina, el precursor de las melanocortinas, que son importantes para regular el equilibrio energético y el metabolismo de la glucosa, se introdujo en el hipotálamo. Los experimentos se llevaron a cabo en ratas grasas viejas, que, después de la terapia, perdieron mucho peso. Es interesante que al principio su apetito disminuyó significativamente, pero se recuperó después de un mes, lo que no evitó una mayor pérdida de peso. La pérdida de peso se debió en parte al hecho de que la terapia aumentó el gasto de energía en el tejido adiposo; se disipó en forma de calor. También es importante que las ratas también mejoraron una serie de parámetros de salud: se normalizó el equilibrio de lípidos y glucosa y aumentó la sensibilidad a la insulina.Y finalmente, en uno de los estudios, la obesidad muscular se trató con la administración sistémica del gen Wnt, que controla el desarrollo embrionario temprano, y en los tejidos adultos, es necesario mantener las células madre y regular su diferenciación (transformación en células especializadas). El gen Wnt se inyectó en ratas adultas en los músculos y se controló su salud a lo largo del tiempo. Curiosamente, la terapia inesperadamente condujo a muy buenos resultados: las ratas no solo perdieron peso, aunque comieron alimentos muy grasosos, sino que también redujeron el riesgo de patologías relacionadas con la edad. Su metabolismo de glucosa se normalizó, disminuyó el nivel de triglicéridos en la sangre y, lo más interesante, ¡incluso aumentó la densidad mineral de los huesos!En general, quiero señalar que los enfoques para la terapia génica de la obesidad son muy prometedores: además de la pérdida de peso, también observaron marcadores de rejuvenecimiento sistémico: ¡normalización del metabolismo de la glucosa y las grasas, e incluso una mejora del tejido óseo! Aparentemente, esto se debe al hecho de que en todos ellos trataron de tratar la obesidad con efectos sistémicos: rejuvenecer el sistema nervioso, normalizar el equilibrio hormonal o afectar la vía de las células madre.VisiónLos métodos de terapia génica también se están desarrollando para la discapacidad visual en la vejez, en particular, la degeneración macular relacionada con la edad (AMD), una de las causas más comunes de pérdida de visión después de los 65 años. Sin embargo, debe tenerse en cuenta que la AMD se considera no solo una patología relacionada con la edad, sino también oficialmente reconocido como una enfermedad. Se asocia con una proliferación excesiva de vasos sanguíneos y la muerte de las células visuales: fotorreceptores de la retina.Todos los tratamientos para la AMD que usan terapia génica están destinados a suprimir la formación de vasos sanguíneos: la angiogénesis. Para esto, como regla, inhiben el trabajo del principal estimulador de la angiogénesis - VEGF - factor de crecimiento endotelial vascular.Por ejemplo, una sección del gen receptor de VEGF, sFlt1, que suprime VEGF, se entrega a las células. Este enfoque se desarrolló mejor que todos los demás: no solo se han llevado a cabo estudios en ratones, sino que se han lanzado las primeras etapas de ensayos clínicos en personas con AMD.En un estudio publicado en 2015, participaron 8 pacientes de ambos sexos, de 71 a 86 años. El gen sFlt01.19 se introdujo en la región del ojo, y después de 52 semanas, la agudeza visual mejoró en todos los pacientes. No se observaron efectos secundarios en este estudio, lo que abre perspectivas para más ensayos clínicos y la introducción de medicamentos en la práctica clínica.Otro enfoque de la terapia génica de AMD también tiene como objetivo suprimir el crecimiento vascular, pero utilizando otros genes: angiostatina y endostatina. Y también fue eficaz en las pruebas tanto en conejos como en macacos.Por lo tanto, la terapia génica AMD es muy efectiva, y ya se encuentra en la etapa de traducción a la clínica. Sin embargo, como objetivo, utiliza una vía bastante específica de angiogénesis e inflamación: VEGF, que es poco probable que sea interesante para la terapia sistémica del envejecimiento. Es interesante que se use para tratar otras patologías relacionadas con la edad, por ejemplo, trastornos del sistema cardiovascular. Sin embargo, en su caso, ¡VEGF, por el contrario, debe activarse!En general, la terapia génica para patologías relacionadas con la edad es un área bastante desarrollada en comparación con la terapia génica para el envejecimiento, pero es incomparablemente menos popular que la terapia génica para todo tipo de enfermedades. Recuerde que si bien se iniciaron alrededor de 1415 ensayos clínicos sobre terapia génica contra el cáncer, solo se realizaron 40-45 estudios sobre terapia génica para patologías relacionadas con la edad, y luego en ratones, ratas y monos. (Es cierto que se realizan ensayos clínicos en pacientes con AMD, pero esto se debe a que la AMD se reconoce oficialmente como una enfermedad). Tal "negligencia" de la terapia génica para las patologías relacionadas con la edad, aparentemente, está asociada con el enfoque general de la medicina, no en la prevención de enfermedades, sino en el tratamiento de enfermedades que ya existen.Con respecto a los trabajos sobre terapia génica de patologías relacionadas con la edad, se puede observar que hay trabajos prometedores y de alta calidad, pero no representan más de una cuarta parte de todos los estudios realizados. En la mayoría de los trabajos, la terapia génica conduce a una mejora bastante moderada en el estado de salud (y, por regla general, no alcanza el nivel de animales jóvenes), no se estudia la duración del efecto terapéutico y no se estudian los efectos secundarios.Sin embargo, también son muy prometedores, se distinguen por la calidad del trabajo. En particular, gran parte de este trabajo se ha realizado en la terapia génica de los trastornos cerebrales. ¡Esto es, por ejemplo, la terapia génica del cerebro de viejos monos rhesus con el gen NGF, un factor de crecimiento nervioso que restableció el número de células nerviosas (neuronas colinérgicas) al nivel de los animales jóvenes! Se han realizado muchos estudios prometedores sobre la terapia génica de la obesidad relacionada con la edad. No solo condujeron a la pérdida de peso, sino que también mejoraron un conjunto completo de indicadores de salud.En general, la terapia génica de patologías relacionadas con la edad me parece una forma efectiva de prevenir enfermedades y combatir la senilidad. Aparentemente, es especialmente prometedor combinarlo con terapia génica para el envejecimiento, como, por ejemplo, Elizabeth Perrish introdujo un gen de telomerasa junto con un gen inhibidor de miostatina para el rejuvenecimiento muscular.
Conclusión
En conclusión, se puede observar que, aunque la terapia génica del envejecimiento sigue siendo un campo muy joven de la ciencia, se está desarrollando activamente en varias direcciones y ya inspira una gran promesa.Todos los estudios aún se encuentran en la etapa preclínica de la prueba (en animales modelo o células in vitro), sin embargo, la terapia génica del envejecimiento ya está alcanzando efectos tan potentes y que prolongan la vida como la restricción dietética y los geroprotectores (por ejemplo, rapamicina o metformina).Al observar toda la variedad de objetivos y enfoques de la terapia génica, quiero compararlos e intentar resaltar las áreas más prometedoras del desarrollo.En primer lugar, es mucho más efectivo llevar a cabo la terapia génica del envejecimiento que apuntar a patologías individuales relacionadas con la edad. De hecho, en todos los trabajos sobre la terapia génica del envejecimiento, no solo hay una extensión de la vida, sino también una desaceleración en el desarrollo de una serie de patologías relacionadas con la edad. Entonces, en el trabajo de Maria Blasco sobre la terapia génica con telomerasa, la vida de los ratones viejos no solo aumentó en un 20%, sino que también aumentó la sensibilidad a la insulina, mejoró la coordinación neuromuscular, disminuyó el riesgo de osteoporosis y el contenido de marcadores moleculares del envejecimiento.Y Dongsheng Kai, utilizando la terapia hipotalámica con el gen NF-kb, ha logrado no solo una extensión de vida del 10% en ratones, sino que también ha mejorado el rendimiento mental y la función muscular. Además, la estructura de los músculos, la piel y los huesos de dichos ratones también estaba en un estado más joven, en comparación con los animales de control (sin terapia).Y el tratamiento de una patología separada relacionada con la edad solo reduce el riesgo de un cierto grupo de enfermedades, pero no puede prevenir la muerte por otras enfermedades relacionadas con la edad.El segundo punto notable: entre los enfoques de la terapia génica del envejecimiento, podemos distinguir aquellos que afectan la mayoría de las células del cuerpo y requieren un suministro sistémico, y aquellos que se centran en las estructuras que regulan el envejecimiento (por ejemplo, el hipotálamo). El segundo es mucho más fácil y conveniente de usar, y en este momento parece más fácil de implementar.El hecho es que la exposición sistémica es muy difícil de lograr incluso con el estado actual de los sistemas de administración viral. Se requiere un vector introducido en la sangre para ingresar a una porción significativa de células en todo el cuerpo. Y aunque tuvo un éxito brillante para Maria Blasco, hay evidencia de que otros laboratorios no pueden repetir su éxito.Y en el caso de la terapia hipotalámica, es necesario que el gen solo ingrese en un área pequeña del tejido cerebral. Y esto se puede lograr fácilmente inyectando un vector con el gen en la región correspondiente.En tercer lugar, para lograr resultados más significativos en la terapia génica del envejecimiento, es necesario combinar diferentes enfoques. Existe mucha evidencia de que el impacto en varios caminos de longevidad a la vez da un mayor efecto en la esperanza de vida que el impacto en ellos individualmente. Por ejemplo, si desactiva el gen de la hormona del crecimiento en ratones, viven un 50% más. Y si dichos ratones también tienen una nutrición limitada, el efecto aumentará al 80%. Y el extraordinario longevo, la rata topo desnuda, el roedor, que vive 10 veces más que el ratón, se diferencia de él por la activación de un conjunto completo de caminos de longevidad: estos incluyen una mayor resistencia al estrés, protección contra el cáncer, estabilidad de las moléculas de proteínas, protección contra la neurodegeneración, etc.Por lo tanto, para desarrollar una terapia génica que prolongue drásticamente la vida, es necesario actuar simultáneamente en muchos caminos de la longevidad. Es decir, combinar los enfoques de terapia génica que se están desarrollando ahora para aumentar la estabilidad del genoma, rejuvenecer el hipotálamo, destruir células senescentes, aumentar la resistencia al estrés, mejorar la función mitocondrial, mantener células madre de nicho, etc.Si ahora la terapia con un gen no conduce a un aumento de la esperanza de vida Más del 20%, esperamos que en el futuro, debido a la compleja terapia del envejecimiento, sea posible lograr resultados realmente fantásticos.Autor Anastasia ShubinaLiteratura1.
http://www.wiley.com//legacy/wileychi/genmed/clinical/2. Slaymaker IM, Gao L, Zetsche B, Scott DA, Yan WX, Zhang F. Diseñaron racionalmente nucleasas Cas9 con especificidad mejorada. Ciencia. 2016 1 de enero; 351 (6268): 84–8. doi: 10.1126 / science.aad5227. Epub 2015 1 de diciembre.
3. Anderson WF, Blaese RM, Culver K. El protocolo clínico de terapia génica humana ADA: puntos para considerar la respuesta con el protocolo clínico // Hum Gene Ther. - 1990. - v. 1 (3). - P.331-362.
4. Edelstein ML, Abedi MR, Wixon J., Edelstein RM Ensayos clínicos de terapia génica en todo el mundo 1989–2004: una descripción general // J Gene Med. - 2004. - v.6. - P.597-602.
5. Kay MA terapias basadas en genes de vanguardia: el camino por delante // Nat Rev Genet. - 2011. - v. 12 (5) - P. 316–28.
6. Greider, CW y Blackburn, EH (1985) "Identificación de una actividad de transferasa terminal de telómero específica en extractos de Tetrahymena". Cell v. 43, (2 Pt. 1) pp. 405-413.
7. Egan CA1, Savre-Train I, Shay JW, Wilson SE, Bourne WM. Análisis de longitudes de telómeros en células endoteliales corneales humanas de donantes de diferentes edades. Invest Ophthalmol Vis Sci. 1998 Mar; 39 (3): 648–53.
8. Kang MK, Guo W, Park NH. La senescencia replicativa de los queratinocitos orales humanos normales se asocia con la pérdida de la actividad de la telomerasa sin acortar los telómeros. El crecimiento celular difiere. Enero de 1998; 9 (1): 85–95.
9. Ilmonen P, Panda B, Janina S, Dustin PJ, Michaela Th. Genética de la longitud de los telómeros en ratones domésticos derivados de la naturaleza. Genética de la longitud de los telómeros en ratones domésticos derivados de la naturaleza. 21 al 23 de agosto de 2014, Santa Clara, EE. UU.
10. Bodnar AG, Ouellette M., Frolkis M., Holt SE, Chiu CP, Morin GB, Harley CB, Shay JW, Lichtsteiner S., Wright WE Extensión de la vida útil mediante la introducción de telomerasa en células humanas normales // Ciencia . - 1998 .-- v.279 (5349). - P.349-52.
11. Jiang XR., Jiménez G., Chang E., Frolkis M., Kusler B., Sage M., Beeche M., Bodnar A., Wahl G., Tlsty T., Chiu CP. La expresión de telomerasa en células somáticas humanas no induce cambios asociados con un fenotipo transformado // Nat. Genet - 1999. - v. 21. - P. 111-114.
12. Chung SA, Wei AQ, Connor DE, Webb GC, Molloy T., Pajic M., Diwan AD Nucleus pulposus longevidad celular mediante terapia génica con telomerasa // Spine. - 2007 .-- v.32 (11). - P.1188–96.
13. Bernardes de Jesus B., Vera E., Schneeberger K., Tejera AM, Ayuso E., Bosch F., Blasco MA La terapia génica de la telomerasa en ratones adultos y viejos retrasa el envejecimiento y aumenta la longevidad sin aumentar el cáncer // EMBO Mol Med . - 2012.- .v.4 (8). - P.691–704.
14. Tomás-Loba A., Flores I., Fernández-Marcos PJ, Cayuela ML, Maraver A., Tejera A., Borrás C, Matheu A., Klatt P., Flores JM, Viña J., Serrano M., La transcriptasa inversa Blasco MA Telomerasa retrasa el envejecimiento en ratones resistentes al cáncer // Cell. - 2008 .-- v.135 (4). - P.609-22.
15. Bär C, Bernardes de Jesus B, Serrano R, Tejera A, Ayuso E, Jimenez V, Formentini I, Bobadilla M, Mizrahi J, de Martino A, Gomez G, Pisano D, Mulero F, Wollert KC, Bosch F, Blasco MA. La expresión de telomerasa confiere cardioprotección en el corazón del ratón adulto después de un infarto agudo de miocardio. Nat Commun. 18 de diciembre de 2014; 5: 5863. doi: 10.1038 / ncomms6863.
16. Zhang G, Li J, Purkayastha S, Tang Y, Zhang H, Yin Y, Li B, Liu G, Cai D. Programación hipotalámica del envejecimiento sistémico que involucra IKK-β, NF-κB y GnRH. Naturaleza. 2013.v.497 (7448). P.211-6.
17. Michalkiewicz M, Knestaut KM, Bytchkova EY, Michalkiewicz T (2003) Hipotensión y catecolaminas reducidas en ratas transgénicas neuropéptidas Y. Hipertensión 41 (5): 1056-1062.
18. Aveleira CA, Botelho M, Carmo-Silva S, Pascoal JF, Ferreira-Marques M, Nóbrega C, Cortes L, Valero J, Sousa-Ferreira L, Álvaro AR, Santana M, Kügler S, Pereira de Almeida L, Cavadas C.El neuropéptido Y estimula la autofagia en las neuronas hipotalámicas Proc Natl Acad Sci US A. 31 de marzo de 2015; 112 (13): E1642-51. doi: 10.1073 / pnas.1416609112. Epub 2015 16 de marzo.
19. Baranowska B, y col. (2006) Control neuroendocrino de la homeostasis metabólica en centenarios polacos. J Physiol Pharmacol 57 (Supl 6): 55–61.
20. Conti B, Sánchez-Alavez M, Winsky-Sommerer R, Morale MC, Lucero J, Brownell S, Fabre V, Huitron-Resendiz S, Henriksen S, Zorrilla EP, de Lecea L, Bartfai T. Ratones transgénicos con una reducción La temperatura corporal central tiene una mayor vida útil. Ciencia. 2006. v314 (5800). P825-8.
21. Wu JJ, Liu J, Chen EB, Wang JJ, Cao L, Narayan N, Fergusson MM, Rovira II, Allen M, Springer DA, Lago CU, Zhang S, DuBois W, Ward T, deCabo R, Gavrilova O, Simulacro B, Finkel T. Aumento de la vida útil de los mamíferos y una desaceleración segmentaria y específica del tejido del envejecimiento después de la reducción genética de la expresión de mTOR. Rep. Celular 12 de septiembre de 2013; 4 (5): 913–20. doi: 10.1016 / j.celrep.2013.07.0.030. Epub 2013 29 de agosto.
22. Yan L, Vatner DE, O'Connor JP, Ivessa A, Ge H, Chen W, Hirotani S, Ishikawa Y, Sadoshima J, Vatner SF. La interrupción de la adenilil ciclasa tipo 5 aumenta la longevidad y protege contra el estrés. Celda 27 de julio de 2007; 130 (2): 247–58.
23. Yamashita et.al. (2012) SIRT1 previene la senescencia replicativa de fibroblastos del cordón umbilical humano normal al potenciar la transcripción del gen de la transcriptasa inversa de la telomerasa humana. Comunicaciones de investigación bioquímica y biofísica. 417: 630-634.
24. Yuan et.al. (2012) SIRT1 es necesario para el crecimiento a largo plazo de células madre mesenquimales humanas. J Mol Med. 90: 389-400
25. Herranz y col. (2010) "Sirt1 mejora el envejecimiento saludable y protege del cáncer asociado al síndrome metabólico". Nat Commun 1: 3
26. Satoh y col. (2013) "Sirt1 prolonga la vida útil y retrasa el envejecimiento en ratones mediante la regulación de Nk2 homeobox 1 en DMH y LH". Cell Metab. 18 (3): 416-430
27. Ortega-Molina A, Efeyan A, Lopez-Guadamillas E, Muñoz-Martin M, Gómez-López G, Cañamero M, Mulero F, Pastor J, Martinez S, Romanos E, Mar Gonzalez-Barroso M, Rial E, Valverde AM, Bischoff JR, Serrano M. Pten regula positivamente la función adiposa marrón, el gasto de energía y la longevidad. Cell Metab. 2012 7 de marzo; 15 (3): 382–94. doi: 10.1016 / j.cmet.2012.02.00.001.
28. Wu y col. (2015) La sobreexpresión de Sirtuin 6 suprime la senescencia celular y las respuestas inflamatorias mediadas por NF-κB en el desarrollo de la osteoartritis. Sci rep. 5: 17602.
29. Leiser SF, Miller RA. Señalización de Nrf2, un mecanismo para la resistencia al estrés celular en ratones de larga vida. Mol Cell Biol. Febrero de 2010; 30 (3): 871–84. doi: 10.1128 / MCB.01145–09. Epub 2009 23 de noviembre.
30. Li y col. (2005) La estabilización de Nrf2 por tBHQ confiere protección contra la muerte celular inducida por estrés oxidativo en células madre neurales humanas. Toxicol Sci. 83 (2): 313–328.
31. Kanninen et.al. (2009) La inyección intrahippocampal de un vector lentiviral que expresa Nrf2 mejora el aprendizaje espacial en un modelo de ratón de la enfermedad de Alzheimer. Proc Natl Acad Sci US A. 106 (38): 16505–16510.
32. Wang y col. (2014) La regulación positiva de CD36 mediada por el tratamiento intranasal de LV-NRF2 mitiga la progresión inducida por hipoxia de la patogénesis de tipo Alzheimer. Señal redox antioxidante. 21 (16): 2208-2230.
33. Minagawa et.al. (2011) Senescencia acelerada de células epiteliales en IPF y el papel inhibidor de SIRT6 en la senescencia inducida por TGF-β de células epiteliales bronquiales humanas. Am J Physiol Células Pulmonares Mol Physiol. 300 (3): L391-401.
34. Takasaka y col. (2014) .La inducción de la autofagia por SIRT6 a través de la atenuación de la señalización del factor de crecimiento similar a la insulina está implicada en la regulación de la senescencia de las células epiteliales bronquiales humanas. J Immunol. 192 (3): 958–968.
35. Liu y col. (2014) El estrés oxidativo induce la senescencia de las células endoteliales a través de la regulación negativa de Sirt6. Biomed Res Int. 2014: 902842.
36. Mao y col. (2012) Sirtuin 6 (SIRT6) rescata la disminución de la reparación de recombinación homóloga durante la senescencia replicativa. Proc Natl Acad Sci Estados Unidos. 109 (29): 11800-5.
37. Xu y col. (2015) SIRT6 rescata la disminución relacionada con la edad en la reparación de la escisión de la base de una manera dependiente de PARP1. Ciclo celular 14 (2): 269–276.
38. Chung y col. (2015) Información molecular sobre la protección SIRT1 contra la senescencia de fibroblastos cutáneos inducidos por los rayos UV mediante la supresión del estrés oxidativo y la acetilación de p53. J Gerontol A Biol Sci Med Sci. 70 (8): 959–968.
39. Conti B, Sánchez-Alavez M, Winsky-Sommerer R, Morale MC, Lucero J, Brownell S, Fabre V, Huitron-Resendiz S, Henriksen S, Zorrilla EP, de Lecea L, Bartfai T. Ratones transgénicos con una reducción La temperatura corporal central tiene una mayor vida útil. Ciencia. 2006. v314 (5800). P825-8.
40. Kanfi Y, Naiman S, Amir G, Peshti V, Zinman G, Nahum L, Bar-Joseph Z, Cohen HY. El sirtuin SIRT6 regula la vida útil en ratones machos. Naturaleza. 22 de febrero de 2012; 483 (7388): 218–21. doi: 10.1038 / nature10815.
41. Campisi J. Envejecimiento, senescencia celular y cáncer. Annu Rev Physiol. 2013; 75: 685–705. doi: 10.1146 / annurev-fisiol-030212-183653. Epub 2012 8 de noviembre.
42. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. La eliminación de las células senescentes p16Ink4a-positivas retrasa los trastornos asociados al envejecimiento. Naturaleza. 2 de noviembre de 2011; 479 (7372): 232–6. doi: 10.1038 / nature10600.
43. Rera y col. (2011) "Modulación de la longevidad y la homeostasis de los tejidos por el homólogo Drosophila PGC-1". Cell Metab. 14 (5): 623-634.
44. Zhao et.al. (2013) El efecto de la sobreexpresión de PGC-1a en la deleción común de mtDNA4834 en un modelo de senescencia de células marginales cocleares de rata. Investigación auditiva. 296: 13-24
45. Jiang XY, Lu DB, Jiang YZ, Zhou LN, Cheng LQ, Chen B. PGC-1α previene la apoptosis en células madre derivadas de tejido adiposo al reducir la producción de especies reactivas de oxígeno en un microambiente diabético. Diabetes Res Clin Pract. Junio de 2013; 100 (3): 368–75. doi: 10.1016 / j.diabres.2013.03.03.036. Epub 2013 22 de abril.
46. Liu XP, Gao H, Huang XY, Chen YF, Feng XJ, He YH, Li ZM, Liu PQ. El alfa-coactivador 1 del receptor activado por proliferador de peroxisomas protege a los cardiomiocitos de la hipertrofia al suprimir el factor nuclear de calcineurina de la vía de señalización de las células T activadas c4. Transl Res. Noviembre de 2015; 166 (5): 459–473.e3. doi: 10.1016 / j.trsl.2015.06.06.003. Epub 2015 9 de junio.
47. Hollinger K, Selsby JT. La transferencia del gen PGC-1α mejora la función muscular en el músculo distrófico después del progreso prolongado de la enfermedad. Exp Physiol. 2015 Oct; 100 (10): 1145–58. doi: 10.1113 / EP085339. Epub 2015 8 de septiembre.
48. De Luca G, Ventura I, Sanghez V, Russo MT, Ajmone-Cat MA, Cacci E, Martire A, Popoli P, Falcone G, Michelini F, Crescenzi M, Degan P, Minghetti L, Bignami M, Calamandrei G. Vida útil prolongada con comportamiento exploratorio mejorado en ratones que sobreexpresan el nucleósido trifosfatasa oxidado hMTH1. Envejecimiento celular. 2013 agosto; 12 (4): 695–705. doi: 10.1111 / acel.12094. Epub 2013 30 de mayo.
49. Wang J, Geesman GJ, Hostikka SL, Atallah M, Blackwell B, Lee E, Cook PJ, Pasaniuc B, Shariat G, Halperin E, Dobke M, Rosenfeld MG, Jordan IK, Lunyak VV. La inhibición de la transcripción perinetromérica activada SINE / Alu en células madre adultas senescentes humanas restablece la autorrenovación. Ciclo celular 1 de septiembre de 2011; 10 (17): 3016-30. Epub 2011 1 de septiembre.
50. La sobreexpresión de SNEV extiende la vida útil de las células endoteliales humanas. Voglauer R, Chang MW, Dampier B, Wieser M, Baumann K, Sterovsky T, Schreiber M, Katinger H, Grillari J. Exp Cell Res. 1 de abril de 2006; 312 (6): 746–59. Epub 2006 4 de enero.
51. Wood J, Nan Jiang, Brian C Jones, Stephen L Helfand Mantener la heterocromatina represiva extiende la vida útil de la drosophila. Resúmenes de trabajos presentados en la reunión de 2014 sobre genética molecular del envejecimiento, 29 de septiembre - 3 de octubre de 2014, Cold Spring Harbor, EE. UU.
52. Sidler y col. (2014) Un papel para la trimetilación de H3K9 mediada por SUV39H1 en el control de la estabilidad y la senescencia del genoma en fibroblastos de pulmón diploides humanos WI38. Envejecimiento 6 (7): 545-563.
53. Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, McGuinness OP, Chikuda H, Yamaguchi M, Kawaguchi H, Shimomura I, Takayama Y, Herz J, Kahn CR, Rosenblatt KP, Kuro-o M. Supresión del envejecimiento en ratones por la hormona Klotho. Ciencia. 16 de septiembre de 2005; 309 (5742): 1829–33. Epub 2005 25 de agosto.
54. Kuro-o M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugi T, Ohyama Y, Kurabayashi M, Kaname T, Kume E, Iwasaki H, Iida A, Shiraki-Iida T, Nishikawa S, Nagai R , Nabeshima YI. La mutación del gen klotho del ratón conduce a un síndrome parecido al envejecimiento. Naturaleza. 6 de noviembre de 1997; 390 (6655): 45-51.
55. Wang Y, Kuro-o M, Sun Z. La entrega del gen Klotho suprime la expresión de Nox2 y atenúa el estrés oxidativo en células de músculo liso aórtico de rata a través de la vía cAMP-PKA. Envejecimiento celular. Junio de 2012; 11 (3): 410–7. doi: 10.1111 / j.1474–9726.2012.00796.x. Epub 2012 22 de febrero.
56. Wang y col. (2009) El suministro de genes Klotho previene la progresión de la hipertensión espontánea y el daño renal. Hipertensión 54 (4): 810.
57. Zhou y col. (2015) Klotho mejora las lesiones renales y la fibrosis y normaliza la presión arterial al enfocar el sistema renina-angiotensina. Soy J Pathol. 185 (12): 3211–3223.
58. El suministro de genes Deng M, Luo Y, Li Y, Yang Q, Deng X, Wu P, Ma H. Klotho mejora la hipertrofia renal y la fibrosis en ratas diabéticas inducidas por estreptozotocina al suprimir la vía de señalización de la quinasa en espiral enrollada asociada a Rho. Mol Med Rep. Julio de 2015; 12 (1): 45–54. doi: 10.3892 / mmr.2015.3367. Epub 2015 17 de febrero.
59. Shu L, Chen M, Wen M, Huang C, Xu J. Estudio de la transferencia del gen klotho para el efecto protector de la coronaria de ratas diabéticas. Pak J Pharm Sci. 2014 noviembre; 27 (6 supl.): 2095–9.
60. Dena B. Dubal et al., Life Extension Factor Klotho Enhances Cognition, Cell Reports, 2014, DOI: 10.1016 / j.celrep.2014.03.03.076
61. Saito Y, Nakamura T, Ohyama Y, Suzuki T, Iida A, Shiraki-Iida T, Kuro-o M, Nabeshima Y, Kurabayashi M, Nagai R. La entrega in vivo del gen klotho protege contra la disfunción endotelial en el síndrome de factor de riesgo múltiple . Biochem Biophys Res Commun. 24 de septiembre de 2000; 276 (2): 767–72.
62. Brown KA, Chu Y., Lund DD, Heistad DD, Faraci FM La transferencia génica de superóxido dismutasa extracelular protege contra la disfunción vascular con el envejecimiento // Am J Physiol Heart Circ Physiol. - 2006 .-- v.290 (6). - H2600-5.
63. Schmidt U., del Monte F., Miyamoto MI, Matsui T., Gwathmey JK, Rosenzweig A., Hajjar RJ Restauración de la función diastólica en corazones de ratas senescentes a través de la transferencia génica adenoviral del retículo sarcoplasmático Ca (2 +) - ATPase / / Circulación. - 2000.- v. 101 (7). - P. 790–6.
64. Schmidt U., Zhu X., Lebeche D., Huq F., Guerrero JL, Hajjar RJ La transferencia génica in vivo de parvalbúmina mejora la función diastólica en corazones de rata envejecidos // Cardiovasc Res. - 2005 .-- v.66 (2). - P.318-23.
65. Wang H., Keizer JA, Olszewski B., Rosebury W., Robertson A., Kovesdi I., Gordon D. Angiogénesis retrasada en ratas envejecidas y efecto terapéutico de la transferencia de genes adenovirales de VEGF // Int J Mol Med. - 2004 .-- v.13 (4). - P.581–7.
66.
https://www.heart.org/idc/groups/ahamah-public/@wcm/@sop/@smd/documents/downloadable/ucm_470704.pdf67. Renault et.al. (2013) La regulación dependiente del erizo de la angiogénesis y la miogénesis se ve afectada en ratones envejecidos. Arteriosclerosis, trombosis y biología vascular. 33: 2858–2866
68. Tonne y col. (2014) La administración del gen BNP cardíaco prolonga la supervivencia en ratas hipertensas espontáneamente envejecidas con cardiopatía hipertensiva manifiesta. Envejecimiento (Albany NY). 6 (4): 311–319.
69. Wang QL., Han QL., Kang J., Gou S.-H., Wang L.-Zh. La transfección génica BMP-7 mediada por polietilenimina promueve la curación de fracturas en ratas ancianas // Academic Journal of Second Military Medical University. - 2008 .-- v.28 (5). - P.514-518.
70. Yue B., Lu B., Dai KR, Zhang XL, Yu CF, Lou JR, terapia génica Tang TT BMP2 en la reparación de defectos óseos de ratas envejecidas // Calcif Tissue Int. - 2005 .-- v.77 (6). - P.395–403.
71. Liu B, Tang J, Ji J, Gu J. Prevención de la osteoporosis en ratones ovariectomizados por transferencia génica electroporacional de la hormona paratiroidea. Biotechnol Lett. Diciembre de 2003; 25 (24): 2117–22.
72. Xie H, Xie PL, Luo XH, Wu XP, Zhou HD, Tang SY, Liao EY. Omentin-1 ejerce un efecto conservador de hueso en ratones ovariectomizados. Osteoporos Int. Abril de 2012; 23 (4): 1425–36. doi: 10.1007 / s00198–011–1697–8. Epub 2011 14 de julio.
73. Chen W, Baylink DJ, Brier-Jones J, Neises A, Kiroyan JB, Rundle CH, Lau KH, Zhang XB. La terapia génica de células madre basada en PDGFB aumenta la resistencia ósea en el ratón. Proc Natl Acad Sci US A. 21 de julio de 2015; 112 (29): E3893–900. doi: 10.1073 / pnas.1501759112. Epub 2015 6 de julio.
74. Kostenuik et.al. (2004) La terapia génica con osteoprotegerina recombinante humana revierte la osteopenia establecida en ratones ovariectomizados. Bone 34: 656-664.
75. Yin y col. (2015) La sobreexpresión mediada por vectores adenovirales de osteoprotegerina acelera la osteointegración de implantes de titanio en ratas ovariectomizadas. Gene Ther. 22 (8): 636–644.
76. Paul y col. (2003) Uso potencial de la terapia génica Sox9 para la enfermedad degenerativa del disco intervertebral. Columna vertebral (Phila Pa 1976). 28 (8): 755–763.
77. Chen y col. (2008) Supresión de la osteoartritis experimental temprana mediante la administración in vivo del ARNip específico de NF-kBp65 mediado por vector adenoviral. Osteoartritis y cartílago. 16: 174-184
78. Hsieh et.al. (2010) La transferencia intraarticular de genes de trombospondina-1 suprime la progresión de la enfermedad de la osteoartritis experimental. J Orthop Res. 28 (10): 1300-1306.
79. Chu y col. (2013) Efecto protector del ARNsi mediado por lentivirus dirigido a ADAMTS-5 sobre la degradación del cartílago en un modelo de osteoartritis en ratas. REVISTA INTERNACIONAL DE MEDICINA MOLECULAR 31: 1222–1228.
80. Pi y col. (2015) Suministro intraarticular de anti-Hif-2α siRNA por nanopartículas de referencia de condrocitos para prevenir la degeneración del cartílago en ratones artríticos. Terapia génica. 22 (6): 439-448.
81. Wu y col. (2015) La sobreexpresión de Sirtuin 6 suprime la senescencia celular y las respuestas inflamatorias mediadas por NF-κB en el desarrollo de la osteoartritis. Sci rep. 5: 17602.
82. Collins-Hooper y col. (2014) La inhibición de miostatina mediada por propéptidos aumenta la masa muscular a través de la inhibición de las vías proteolíticas en ratones de edad avanzada. J Gerontol A Biol Sci Med Sci. 69 (9): 1049-1059.
83. Sun y col. (2010) La disminución de la expresión de un solo gen autónomo de células epiteliales acelera la involución tímica relacionada con la edad. Envejecimiento celular. 9 (3): 347–357.
84. Chung y col. (2014) Ingeniería del microambiente tímico humano para soportar la timpopoyesis in vivo. Células madre 32 (9): 2386–2396.
85. Fayad R., Zhang H., Quinn D., Huang Y., Qiao L. La administración oral con pseudovirus del virus del papiloma que codifica IL-2 restaura completamente las respuestas inmunes sistémicas y de la mucosa a las vacunas en ratones envejecidos // J Immunol. - 2004 .-- v. 173 (4). –P.2692–8.
86. Gerstein H., Lindstrom MJ, Burger C. La entrega genética de Homer1c rescata el aprendizaje espacial en un modelo de roedores de envejecimiento cognitivo // Neurobiol Aging. - 2013.- v. 34 (8). - P. 1963–70.
87. Zhang GR, Liu M., Cao H., Kong L., Wang X., O'Brien JA, Wu SC, Cook RG, Geller AI Mejora el aprendizaje espacial en ratas ancianas por activación genética de la proteína quinasa C en pequeños grupos de neuronas del hipocampo // Hipocampo. - 2009 .-- v.19 (5). - P. 413-23.
88. Sun M., Kong L., Wang X., Holmes C., Gao Q., Zhang W., Pfeilschifter J., Goldstein DS, Geller AI Coexpresión de tirosina hidroxilasa, GTP ciclohidrolasa I, aminoácidos aromáticos descarboxilasa y El transportador 2 de monoamina vesicular de un vector HSV-1 libre de virus auxiliar apoya la corrección bioquímica y conductual de alto nivel a largo plazo de un modelo de rata de la enfermedad de Parkinson // Hum Gene Ther. - 2004. - v.15. –P.1177–1196.
89. Mouravlev A., Dunning J., Young D., durante la transferencia de genes somáticos MJ de la proteína de unión al elemento de respuesta cAMP atenúa el deterioro de la memoria en ratas envejecidas // Proc Natl Acad Sci US A. - 2006. - v. 103 (12 ) - P.4705-10.
90. Pertusa M., García-Matas S., Mammeri H., Adell A., Rodrigo T., Mallet J., Cristòfol R., Sarkis C., Sanfeliu C. La expresión del transgen GDNF en astrocitos mejora los déficits cognitivos en ancianos ratas // Neurobiol Envejecimiento. - 2008 .-- v.29 (9). - P.1366–79.
91. Nishida F., Morel GR, Hereñú CB, Schwerdt JI, Goya RG, Portiansky EL Efecto restaurador de la terapia génica intracerebroventricular del factor de crecimiento similar a la insulina I sobre el rendimiento motor en ratas ancianas // Neurociencia. - 2011 .-- v.177. - P.195–206.
92. Nagahara AH, Bernot T., Moseanko R., Brignolo L., Blesch A., Conner JM, Ramirez A., Gasmi M., Tuszynski MH Reversión a largo plazo del deterioro neuronal colinérgico en primates no humanos envejecidos por lentivirales Entrega de genes NGF // Exp Neurol. - 2009 .-- v.215 (1). - P.153–9.
93. Rodríguez SS, Schwerdt JI, Barbeito CG, Flamini MA, Han Y., Bohn MC, Goya RG La terapia génica hipotalámica IGF-I prolonga la ciclicidad del estro y protege la estructura ovárica en ratas hembras de mediana edad // Endocrinología. - 2013 .-- v.154 (6). - P.2166–73.
94. Bivalacqua TJ, Armstrong JS, Biggerstaff J., Abdel-Mageed AB, Kadowitz PJ, Hellstrom WJ, Champion HC La transferencia de genes de SOD extracelular al pene reduce el O2- * y mejora la función eréctil en ratas envejecidas // Am J Physiol Heart Circ Physiol. - 2003 .-- v.284 (4). - H1408-21.
95. Bivalacqua TJ, Deng W., Kendirci M., Usta MF, Robinson C., Taylor BK, Murthy SN, Champion HC, Hellstrom WJG, Kadowitz PJ Células madre mesenquimatosas solas o gen ex vivo modificado con óxido nítrico sintasa endotelial. disfunción eréctil asociada // Am J Physiol Heart Circ Physiol. - 2007. - v.292. - H1278 - H1290.
96. Bivalacqua TJ, Burnett AL, Hellstrom WJ, Champion HC La sobreexpresión de arginasa en el pene de ratón envejecido deteriora la función eréctil y disminuye la actividad eNOS: influencia de la terapia génica in vivo de anti-arginasa // Am J Physiol Heart Circ Physiol. - 2007 .-- v.292 (3). - H1340-51. a.
97. Bivalacqua TJ, Champion HC, Mehta YS, Abdel-Mageed AB, Sikka SC, Ignarro LJ, Kadowitz PJ, Hellstrom WJ La transferencia del gen adenoviral de óxido nítrico sintetasa endotelial (eNOS) al pene mejora la disfunción eréctil relacionada con la edad en la rata // Int J Impot Res. - 2000. - Supl. 3: S8 - S17.
98. Entonces I., Chae MR, Lee SW La transferencia de genes del canal K (ATP) restaura la disfunción eréctil relacionada con la edad en ratas // BJU Int. - 2007 .-- v.100 (5). - P.1154-60.
99. Melman A., Biggs G., Davies K., Zhao W., Tar MT, Christ GJ La transferencia de genes con un vector que expresa Maxi-K de un promotor específico de músculo liso restaura la función eréctil en la rata envejecida // Gene Ther . - 2008 .-- v.15 (5). - P.364–70.
100. Tümer N., Scarpace PJ, Dogan MD, Broxson CS, Matheny M., Yurek DM, Peden CS, Burger C., Muzyczka N., Mandel RJ El suministro de genes GDNF hipotalámico mediado por rAAV mejora la obesidad relacionada con la edad // Neurobiol Envejecimiento - 2006 .-- v.27 (3). - P.459–70.
101. Boghossian S., Ueno N., Dube MG, Kalra P., Kalra S. La transferencia de genes de leptina en el hipotálamo aumenta la longevidad en ratones mutantes monogénicos adultos en ausencia de leptina circulante // Neurobiol Aging. - 2007 .-- v.28 (10). - P.1594-604.
102. Aslanidi G1, Kroutov V, Philipsberg G, Lamb K, Campbell-Thompson M, Walter GA, Kurenov S, Ignacio Aguirre J, Keller P, Hankenson K, Macdougald OA, Zolotukhin S. La expresión ectópica de Wnt10b disminuye la adiposidad y mejora la glucosa homeostasis en ratas obesas. Am J Physiol Endocrinol Metab. Septiembre de 2007; 293 (3): E726–36. Epub 2007 19 de junio.
103. Manfredsson FP1, Tumer N, Erdos B, Landa T, Broxson CS, Sullivan LF, Rising AC, Foust KD, Zhang Y, Muzyczka N, Gorbatyuk OS, Scarpace PJ, Mandel RJ. La sobreexpresión de GDNF mediada por rAAV nigrostriatal induce una pérdida de peso robusta en un modelo de rata de obesidad relacionada con la edad. Mol ther. Junio de 2009; 17 (6): 980–91. doi: 10.1038 / mt.2009.45. Epub 2009 10 de marzo.
104. MacLachlan y col. (2011) Evaluación preclínica de seguridad de AAV2-sFLT01: una terapia génica para la degeneración macular relacionada con la edad. La Sociedad Estadounidense de Terapia Genética y Celular. 19 (2): 326–334
105. Binley y col. (2012) Seguridad y biodistribución de una terapia génica basada en el virus de la anemia infecciosa equina, RetinoStat, para la degeneración macular relacionada con la edad. TERAPIA DE GENES HUMANOS. 23: 980–991
106. Rakoczy y col. (2015) Terapia génica con vectores recombinantes adenoasociados para la degeneración macular neovascular relacionada con la edad: 1 año de seguimiento de un ensayo clínico aleatorizado de fase 1. Lanceta
107. Hwangbo DS, Gershman B, Tu MP, Palmer M, Tatar M. Drosophila dFOXO controla la vida útil y regula la señalización de insulina en el cerebro y el cuerpo gordo. Naturaleza. 3 de junio de 2004; 429 (6991): 562-6.
Liu et.al. (2015) Senescencia de precursores derivados de la piel humana regulados por la señalización Akt-FOXO3-p27KIP1 / p15INK4b. Celda M