El medicamento de terapia génica Luxturna, desarrollado por Spark Therapeutics, ayuda a restaurar la visión en pacientes con ceguera hereditaria.
La dosis de virus llenos de ADN inyectados directamente en los ojos es lo que parece la primera terapia génica permitida en los Estados Unidos para tratar una enfermedad genética. La resolución de tal medicamento es un momento significativo para el área plagada de altibajos, ya que el primer estudio de terapia génica comenzó hace casi tres décadas.
Luxturna es la tercera terapia génica aprobada este año. En agosto, la agencia aprobó Kymriah de Novartis (inmunoterapia con células CAR-T, en la que se extraen las células inmunes de un paciente, se modifican fuera del cuerpo y luego se devuelven al torrente sanguíneo para combatir la leucemia). La segunda inmunoterapia con células CAR-T aprobada fue Yescarta de Gilead Sciences. A diferencia de los nombrados, Luxturna es el primer medicamento que corresponde a la percepción "tradicional" de la terapia génica, cuando los virus llenos de ADN se introducen directamente en el cuerpo. Hasta la fecha, se están llevando a cabo más de 600 ensayos clínicos que usan terapia génica en los Estados Unidos.
Los orígenes de Luxturna comenzaron con los estudios de Jean Bennet en la Universidad de Pennsylvania en la década de 1990. En 2000, probó la terapia génica para tratar enfermedades genéticas de la retina en perros. Sin embargo, hubo dificultades para obtener más fondos después de muertes de pacientes ampliamente publicitadas en otros ensayos clínicos de terapia génica. Más tarde, Bennett se asoció con el Philadelphia Children's Hospital, que decidió comercializar la tecnología al proporcionar $ 50 millones para lanzar Spark Therapeutics en 2013.
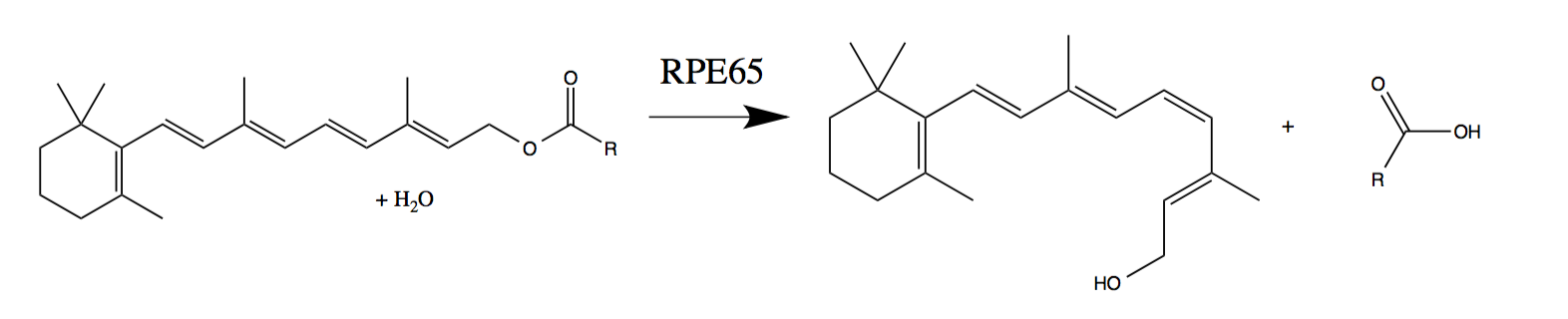
Luxturna mejora la visión en personas con una mutación en el gen RPE65, que codifica una enzima importante para la visión.
La exposición a la luz conduce a la transición de una retina cis "exprimida" a una transretiniana "descomprimida". Este cambio físico dispara la señal al cerebro. Para comenzar el ciclo nuevamente, la enzima RPE65 devuelve el trans-retinal de regreso al cis-retinal. Sin embargo, las personas que tienen una mutación genética que inhibe la producción de RPE65 no pueden "ciclar". Esto conduce a una discapacidad visual, que generalmente comienza en la infancia o la niñez y conduce a una ceguera casi total.
Regeneración de células fotosensibles con una enzima RPE65 que funciona normalmente (fototransducción de trans-retinol en 11-cis-retinal -
wiki ):
Aunque muchas mutaciones en RPE65 pueden conducir a la ceguera, en teoría Luxturna debería tratarlas a todas. El producto contiene una copia completa de RPE65, empaquetado en un virus adenoasociado, necesario para transferir ADN a las células de la retina para obtener una enzima completamente funcional.
La herramienta está diseñada para una terapia de una sola vez, cuando el cirujano inyecta una solución que contiene aproximadamente 150 mil millones de partículas virales de ADN lleno directamente debajo de la retina de cada ojo. Las pruebas en obstáculos con diferentes niveles de iluminación mostraron que el tratamiento mejoró la vista de los pacientes.
Según la FDA, hay entre 1,000 y 2,000 pacientes con mutaciones RPE65 en los Estados Unidos que pueden beneficiarse de Luxturna. Sin embargo, el alto precio del medicamento puede ser un problema para que incluso un pequeño número de pacientes reciban terapia. El precio aún no se ha revelado, pero según la declaración del CEO de Spark, el costo de la terapia puede superar los $ 1 millón por paciente.
Además, video antiguo con demostración animada de la administración de drogas:
MásLo que las personas con esta forma de ceguera pueden ver:
Jean Bennett y una demostración del éxito de la terapia en el ejemplo de un niño con problemas de trabajo RPE65: