Con esta revisión, comenzamos una serie de artículos que describen posibles biomarcadores para el panel de diagnóstico de envejecimiento SENS.
El concepto de SENS (Estrategias para la senescencia insignificante de ingeniería, una estrategia para lograr un envejecimiento insignificante mediante métodos de ingeniería) fue propuesto por el gerontólogo británico Aubrey di Gray. La idea del concepto es la necesidad de desarrollar y aplicar tecnologías para combatir el envejecimiento y las enfermedades relacionadas con la edad con el fin de "reparar" el daño acumulado en el cuerpo. El objetivo de nuestra revisión de biomarcadores potenciales es crear un panel de diagnóstico SENS para el envejecimiento.
¿Por qué necesito el diagnóstico SENS?
- Permitir a una persona evaluar objetivamente lo que le sucede a su cuerpo durante el envejecimiento desde el punto de vista de SENS.
- Vea los riesgos individuales de ciertos tipos de daños asociados con el envejecimiento.
- Evaluar la efectividad de los métodos desarrollados de rejuvenecimiento. Vea cómo la actividad física, la dieta, la rutina diaria, los suplementos nutricionales y los medicamentos funcionan en términos de una estrategia para retrasar el envejecimiento.
- Compare con otros paneles de diagnóstico de envejecimiento y complemente su desarrollo.
- Proporcionar datos sobre cambios de parámetros para la investigación.
- Tome una decisión sobre la financiación de la investigación basada en los riesgos más interesantes y sensibles.
- Encuentre personas con ideas afines para resolver problemas biológicos que surgieron como resultado de comprender su propio estado del cuerpo en términos de SENS.
El concepto SENS incluye 7 secciones. El primer elemento a considerar, elegimos la disfunción mitocondrial (o MitoSENS).
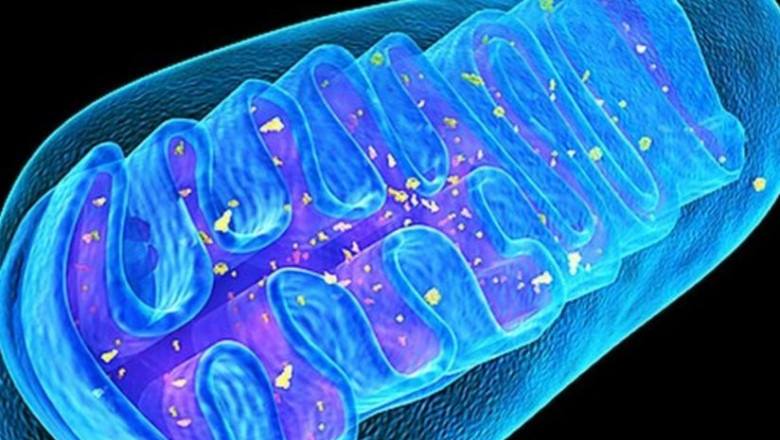
Las mitocondrias son pequeños orgánulos de organismos eucariotas (con la excepción de la lamblia que habita los intestinos de las chinchillas), que generan energía para todos los procesos bioquímicos. Según la versión más popular, las mitocondrias fueron unidades de vida independientes, bacterias fotosintéticas de color púrpura, pero en el proceso de evolución fueron absorbidas por microorganismos antiguos, arqueas, y comenzaron a generar energía para ellos. Cada célula puede contener más de mil mitocondrias, por ejemplo, las células del músculo cardíaco tienen hasta 5000 mitocondrias. Los motores moleculares, las ATP sintasas, incorporados en la membrana interna de las mitocondrias, rotan y sintetizan la principal fuente de energía, el ácido trifosfórico de adenosina, ATP, bajo la influencia de un flujo de protones. Se estima que el cuerpo adulto sintetiza y consume alrededor de 40 kg de ATP por día.
Las mitocondrias, a diferencia de otros orgánulos, tienen sus propias 2-10 copias de ADN, ADNmt. En el proceso de producción de energía, las mitocondrias generan “desechos” tóxicos: especies reactivas de oxígeno (ROS), que pueden dañar tanto otras moléculas como diversas estructuras celulares y, sobre todo, las propias mitocondrias, que pueden causar mutaciones en el ADN mitocondrial y afectar negativamente al conjunto Balance energético del cuerpo. Por lo tanto, los ADNmt que tienen deleciones (pérdida de sitios) pueden multiplicarse rápidamente y llenar el espacio celular consigo mismos, causando sarcopenia y neurodegeneración. Las mitocondrias "corruptas" comienzan a producir cantidades aún mayores de ROS, lo que lleva a un aumento del estrés oxidativo, que, a su vez, puede causar el desarrollo de diversas patologías, envejecimiento prematuro y muerte celular.
Un hecho interesante relacionado con el estrés oxidativo. Se descubrió que existe una clara correlación entre el nivel de saturación de ácidos grasos en las membranas y la vida útil de los animales: cuanto más ácidos insaturados hay en la membrana, menor es la vida útil del animal. Los biólogos españoles rastrearon dicha secuencia, mostrando un aumento en la esperanza de vida al tiempo que reducen el contenido de ácido graso docosahexaenoico ω-3 en las membranas: ratón → rata → conejo → humano → ballena [1].
Este patrón es fácil de explicar, porque los ácidos grasos insaturados son las principales "víctimas" de la peroxidación lipídica. Por lo tanto, la composición lipídica de las membranas celulares de los animales, que se caracterizan por una vida útil más larga, demuestra el significado dorado: una pequeña cantidad de ácidos grasos docosahexaenoicos 22: 6 ω-3 completamente insaturados y el predominio de ácidos grasos linolénicos menos insaturados 18:03 ω-3, que crea el mismo equilibrio que brinda protección contra los efectos de ROS y la preservación de la fluidez necesaria de la membrana.
Además de la composición lipídica de las membranas celulares de los animales, la proporción de guanina y citosina termodinámicamente más estables entre todos los residuos de nucleótidos de ADNmt también se correlaciona con la vida útil máxima de las especies de mamíferos [2].
Los creadores del concepto SENS ven una solución al problema de la disfunción mitocondrial mediante la transferencia de "copias de respaldo" de genes mitocondriales al núcleo, donde no pueden ser dañados por las ROS generadas en las mitocondrias. Por lo tanto, incluso si los genes originales en el ADNmt están dañados, las copias de seguridad en el ADN nuclear podrán suministrar las proteínas necesarias para mantener la producción de energía normal. Este enfoque se llama expresión alotópica de proteínas. El ADNmt humano contiene un total de 37 genes, de los cuales solo 13 codifican las proteínas necesarias para las mitocondrias, las proteínas restantes (más de 1000) que coordinan el trabajo de las mitocondrias están codificadas en el ADN nuclear. Según los autores de SENS, la transferencia de los principales genes mitocondriales al núcleo se llevó a cabo por la evolución precisamente para este propósito, para protegerlos del efecto dañino de ROS.
La idea de los autores de SENS sobre la transferencia evolutiva de ADN mitocondrial a nuclear para proteger el ADNmt de factores dañinos y, por lo tanto, prolongar la vida, se confirma en estudios dedicados al análisis de NUMT (segmento de ADN mitocondrial nuclear). El término NUMT se refiere a fragmentos de ADNmt transferidos al ADN nuclear. Un análisis comparativo de 17 especies animales con genomas mitocondriales y nucleares completamente secuenciados mostró una correlación positiva significativa entre la esperanza de vida y el número de secuencias NUMT [3]. Ahora queda por encontrar una solución de ingeniería para transferir copias de seguridad de los restantes 13 genes de ADNmt.
Pero hay enfoques alternativos para mejorar la función mitocondrial. Y uno de ellos es el trasplante de mitocondrias desde el exterior. Se describe la exitosa "subpoblación" de mitocondrias extrañas en experimentos con animales. Por lo tanto, la transferencia mitocondrial se utilizó en modelos animales para daño pulmonar agudo, enfermedad cardiovascular y enfermedad de Parkinson. La implantación mitocondrial se puede lograr de varias maneras: en primer lugar, la inyección directa de mitocondrias aisladas (inyección local), cuando las mitocondrias aisladas se inyectan directamente en las células del área dañada; En segundo lugar, la administración sistémica, cuando las mitocondrias se introducen en el torrente sanguíneo general, y luego se distribuyen por todo el cuerpo. Los resultados obtenidos indican las perspectivas del trasplante mitocondrial en el tratamiento de una serie de enfermedades [4].
Junto con esto, sería lógico encontrar biomarcadores potenciales para determinar el estrés oxidativo causado por la disfunción mitocondrial.
El estrés oxidativo es un desequilibrio entre los oxidantes (especies reactivas de oxígeno) y la defensa antioxidante en el cuerpo hacia los agentes oxidantes. En las células, los oxidantes interactúan activamente con las biomoléculas (fosfolípidos, proteínas y ácidos nucleicos). Como resultado, estas biomoléculas están irreversiblemente dañadas, lo que conduce a la disfunción celular y, como resultado, a varias patologías en el cuerpo y la muerte celular. Una de las teorías más populares sobre el envejecimiento, el radical libre propuesto por D. Harman en la década de 1950, ve esto como el principal mecanismo del envejecimiento.
Las moléculas formadas durante la oxidación pueden servir como biomarcadores. Su análisis se utiliza para cuantificar el estrés oxidativo en humanos. Las altas concentraciones de biomarcadores de estrés oxidativo se determinan no solo en enfermedades relacionadas con la edad o degenerativas, como la enfermedad de Alzheimer, hipertensión, diabetes tipo 2 o varios tipos de cáncer, sino también en la enfermedad pulmonar obstructiva crónica, fumar y vivir en áreas ecológicamente desfavorecidas.
Uno de los biomarcadores más importantes del estrés oxidativo es la 8-iso prostaglandina F2α (8-isoprostano). El 8-isoprostano se forma durante la oxidación no enzimática de los fosfolípidos de las biomembranas celulares, a saber, el ácido araquidónico. Esta sustancia similar a la prostaglandina causa el estrechamiento de los vasos sanguíneos y los bronquios, reduce el flujo sanguíneo en los riñones, afecta la agregación plaquetaria y, por lo tanto, participa en la patología de varias enfermedades. Los valores normales de 8-isoprostano en personas sanas se consideran 11 ± 4 pg / ml [5].
También se reconoce como un biomarcador de oxidación lipídica el malondialdehído (MDA), que se forma por la peroxidación lipídica por los radicales libres y la descomposición de las moléculas de ácidos grasos poliinsaturados. Un aumento de la concentración de MDA en el suero sirve como marcador no solo del estrés oxidativo, sino también del grado de intoxicación endógena. Por lo tanto, se observa un aumento en la concentración de MDA en plasma en los fumadores, así como en las personas que abusan del alcohol. La MDA forma bases de Schiff con grupos amino de la proteína, lo que resulta en la formación de complejos de lípidos-proteínas insolubles (pigmentos de desgaste o lipofuscina). La MDA se determina en muestras de muchos fluidos biológicos: suero, plasma, orina, condensado de aliento exhalado. La concentración de MDA en suero en personas sanas (normal) es inferior a 1 μmol / L [6].
Durante la oxidación de los aminoácidos que forman las proteínas, se forman una serie de biomarcadores potenciales de estrés oxidativo: o-tirosina, 3-clorotirosina y 3-nitrotirosina.
Fisiológicamente en el cuerpo, la tirosina endógena se forma por la oxidación enzimática de la fenilalanina por la fenilalanina hidroxilasa. La o-tirosina (o-Tyr) y la m-tirosina (m-Tyr) se forman durante la oxidación por las formas activas de la fenilalanina de oxígeno. o-Tyr y m-Tyr no son aminoácidos naturales y se consideran biomarcadores del estrés oxidativo. Se encontraron altas concentraciones de o-Tyr y m-Tyr en pacientes con cataratas, y se encontró o-Tyr elevado en el plasma sanguíneo y la orina de pacientes con diabetes tipo 2. La 3-clorotirosina (3-ClTyr) se forma en procesos de radicales libres durante la reacción del ácido hipocloroso (HClO, un derivado del peróxido de hidrógeno) y la p-tirosina.
La formación de 3-ClTyr juega un papel importante en el sistema cardiovascular, ya que está asociada con el desarrollo de la aterosclerosis. 3-ClTyr promueve la migración de células del músculo liso aórtico humano (el mecanismo principal para la formación de lesiones vasculares), y los niveles elevados de 3-ClTyr en condiciones de inflamación pueden contribuir a las enfermedades vasculares. La 3-nitrotirosina (3-Notyr) se forma durante el estrés oxidativo por nitración de tirosina con una proteína fagocítica agresiva mieloperoxidasa (MPO). Tal nitración afecta negativamente la función de la proteína. Se encontraron concentraciones más altas de 3-Notyr en el líquido cefalorraquídeo de pacientes con enfermedad de Alzheimer (11.4 ± 5.4 nM en pacientes y 1.6 ± 0.4 nM en el grupo de voluntarios sanos), así como en personas con artritis, aterosclerosis y hipertensión [5].
Además, bajo la acción de ROS y HClO sobre las proteínas, se forman diversos productos de oxidación de proteínas (AOPP). Dichas proteínas no cumplen sus funciones y pueden causar un daño significativo. Los AOPP son producidos por el sistema de mieloperoxidasa-peróxido de hidrógeno. Se encontraron concentraciones más altas de AOPP en el plasma u orina de pacientes con síndrome coronario agudo o colitis ulcerosa activa. Los niveles plasmáticos de 60-70 nM se consideran indicadores normales de AORP en personas sanas [5].
Los biomarcadores bien conocidos para la oxidación de ácidos nucleicos son 8-hidroxiguanosina (8-OHG) y 8-hidroxi-2'-desoxiguanosina (8-OHdG). 8-OHdG es el producto principal de la oxidación del ADN. 8-OHG se forma por la oxidación de ARN. Se encuentra una mayor concentración de 8-OHdG en pacientes con enfermedad de Alzheimer, artritis, aterosclerosis, cataratas, hipertensión, osteoporosis y diabetes tipo 2. 8-OHdG también se considera un posible biomarcador de cáncer relacionado con el tabaquismo (por ejemplo, cáncer de pulmón). Se puede encontrar 8-OHG en pacientes con enfermedad de Alzheimer, y se ha demostrado que el daño oxidativo del ARN es mayor que el daño del ADN. Las concentraciones de 8-OHdG en sangre en personas sanas son 1.09 ± 0.52 nM, y los niveles de 8-OHG (en el líquido cefalorraquídeo) son 97 ± 32 pM [5].
Otro biomarcador que determina la disfunción mitocondrial y el estrés oxidativo es la cantidad de copias de ADNmt celular (también hay ADNmt extracelular que ingresa al torrente sanguíneo cuando las células se descomponen y su nivel aumenta con la edad). Por lo tanto, se sabe que con la edad, la cantidad de ADNmt celular disminuye, además, en los hombres más que en las mujeres. Un recuento de ADNmt más bajo también se asocia significativamente con el desarrollo de astenia senil (senilidad, fragilidad). El número de copias de ADNmt también puede ser un marcador pronóstico efectivo de mortalidad por todas las causas, desde enfermedades cardiovasculares, oncológicas y respiratorias [7].
Los antioxidantes endógenos, como el glutatión, la cisteína, el ácido úrico y el ubiquinol, también tienen el potencial de utilizar la disfunción mitocondrial y el estrés oxidativo como biomarcadores. Al interactuar con especies reactivas de oxígeno, los antioxidantes endógenos se oxidan, pero luego se restauran nuevamente usando enzimas especiales. Por lo tanto, en el cuerpo, las moléculas antioxidantes están presentes en dos formas: forma reducida (antioxidante) u oxidada (después de la reacción con oxidantes). Utilizando el método cromatográfico, es posible fijar la proporción de formas reducidas y oxidadas de antioxidantes y así determinar el grado de estrés oxidativo [8].
Biomarcadores de disfunción mitocondrial y estrés oxidativo:
1.8-isoprostano.
2. Malondialdehído
3. O-tirosina, 3-clorotirosina, 3-nitrotirosina.
4. Productos de oxidación de proteínas (AOPP).
5.8-hidroxiguanosina (8-OHG)
6. 8-hidroxi-2'-desoxicoguanosina (8-OHdG).
7. ADNmt celular (su número y la presencia de variantes mutadas con deleciones)
8. Antioxidantes endógenos (glutatión, cisteína, ácido úrico, ubiquinol).
Autores de la revisión: Denis Odinokov, Alexey Rzheshevsky.
Lista de literatura utilizada:1. Pamplona, R., Portero_Otn, M., Ruiz, C., Gredilla, R., Herrero, A. y Barja, G. (2000) El contenido de doble enlace de fosfolípidos y la peroxidación de lípidos se correlacionan negativamente con la máxima longevidad en el corazón de mamíferos, Mech. Envejecimiento Dev., 112, 169-183.
2. Lehmann G1, Segal E, Muradian KK, Fraifeld VE. ¿Se complementan el ADN mitocondrial y la tasa metabólica en la determinación de la longevidad máxima de los mamíferos? Rejuvenecimiento Res. Abril de 2008; 11 (2): 409-17.
3. Muradian KK1, Lehmann G, Fraifeld VE. NUMT ("nuevo poderoso") hipótesis de longevidad. Rejuvenecimiento Res. 2010 abril-junio; 13 (2-3): 152-5.
4. Gollihue, Jenna L., Samir P. Patel y Alexander G. Rabchevsky. Estrategias de trasplante mitocondrial como posibles terapias para el trauma del sistema nervioso central. Investigación de regeneración neural 13.2 (2018): 194.
5. Kamila Syslová, Adéla Böhmová, Miloš Mikoška, Marek Kuzma, Daniela Pelclová y Petr Kačer. Cribado multimarcador del estrés oxidativo en el envejecimiento. Oxid Med Cell Longev. 2014; 562860. Publicado en línea el 16 de julio de 2014.
6. Yashin A., Yashin Y. Cromatografía líquida de alto rendimiento de marcadores de estrés oxidativo. 2011. Análisis. No. 1, 34-43.
7. Foram N. y col. Asociación de los niveles de ADN mitocondrial con fragilidad y mortalidad por todas las causas. J Mol Med (Berl). Febrero de 2015; 93 (2): 177-186.
8. Goon A.A. Subbotina T.F., Alekseevskaya E.S., Moiseeva O.M., Gavrilyuk N.D., Irtyuga O.B. Marcadores metabólicos y proteicos de disfunción mitocondrial en pacientes con enfermedad cardiovascular Diagnóstico clínico de laboratorio. 2015; 60 (7): 35–41.