Las proteínas juegan un papel crucial en todos los organismos vivos, realizando muchas funciones diferentes. Como sabes, están compuestos de aminoácidos. Para cumplir con sus funciones, las proteínas no deben ser solo una cadena de ciertos aminoácidos, sino que deben tener una determinada forma espacial, es decir, encajar adecuadamente en el espacio. Por varias razones, puede ocurrir un mal funcionamiento en el plegamiento normal de la proteína en la estructura deseada. Luego, en lugar de proteínas mal plegadas, que tienden a unirse en grupos, los agregados de proteínas son fibrillas amiloides. El más famoso de estos agregados es el β-amiloide (Aβ, Abeta), presumiblemente asociado con el desarrollo de neuropatologías, así como algunos tipos de cáncer y una de las causas de demencia en personas con síndrome de Down.
Dichas estructuras de proteínas tienen un diámetro de aproximadamente 5–10 nm y una longitud de hasta 800 nm, y consisten en dos o más filamentos multidireccionales paralelos que forman una estructura específica: la conformación cruzada del pliegue beta. Es esta estructura la que determina la propiedad óptica específica del amiloide: la capacidad de birrefringencia. Y el descubrimiento de esta propiedad es la base para el diagnóstico de amiloidosis. La microscopía de preparaciones teñidas con colorante rojo Congo en amiloide de luz polarizada cambia el color rojo a un resplandor verde [1].
Los autores del concepto SENS denominan “acumuladores extracelulares” (basura extracelular) a los acumuladores de proteínas anormales y determinan una de las causas del envejecimiento, lo que parece bastante justo. Las fibrillas amiloides, debido a su estructura, no están sujetas a la acción de enzimas especiales que descomponen las proteínas (proteasas) y, por lo tanto, tienen la propiedad de acumularse en los tejidos del cuerpo, interrumpiendo su trabajo. Las propiedades estructurales y químico-físicas del amiloide dependen de la proteína precursora principal, cuyo contenido en la fibrilla es de aproximadamente el 80%, y esto determina un rasgo específico para cada tipo de amiloidosis. El término amiloidosis se refiere a un grupo de enfermedades hereditarias o adquiridas asociadas con el depósito extracelular de fibrillas de proteínas insolubles que causan trastornos estructurales del tejido y disfunciones orgánicas. Actualmente, se conocen más de 20 proteínas precursoras amiloidogénicas y el mismo número de variantes clínicas de amiloidosis. Además del conocido β-amiloide, hay un amiloide AA asociado con artritis reumatoide, enfermedad cardíaca, enfermedad renal e inflamación intestinal, amiloide AIAPP involucrado en la patogénesis de la diabetes mellitus tipo 2 y otros [2].
 β-amiloide.
β-amiloide.Los autores de SENS ven una manera de resolver el problema de la acumulación de agregados de proteínas en el uso de anticuerpos catalíticamente activos especializados, las llamadas abzimas (abzima inglesa, enzima de anticuerpos), que se seleccionan específicamente para los amiloides y se eliminan del tejido. Recientemente, se ha desarrollado un método prometedor como parte de este enfoque. Se ha descubierto un subconjunto de anticuerpos humanos que tiene actividad catalítica contra un antígeno específico, rompiéndolo en fragmentos más pequeños y menos dañinos, en lugar de capturarlo para su eliminación o destrucción por otras células inmunes. El uso de estos nuevos anticuerpos catalíticos como terapias dirigidas a los amiloides ofrece ventajas potenciales sobre el secuestro de anticuerpos utilizados en otras vacunas amiloides. El primero es que se requiere una reducción de la dosis para eliminar eficazmente los agregados extracelulares de los tejidos. Esto se debe a que los anticuerpos secuestrantes pueden capturar y luego transportar solo una molécula amiloide a la vez. Mientras las abzimas se unen a la molécula amiloide, tritúrela y luego pase a la siguiente una tras otra, permitiendo que cada molécula de anticuerpo destruya rápidamente varias moléculas amiloides. Otra es que los anticuerpos catalíticos pertenecen a una clase que se transporta de manera más eficiente a través de la barrera hematoencefálica que protege nuestro cerebro, mientras que el secuestro de anticuerpos es más difícil de superar esta barrera [3].
El amiloide más famoso y mejor estudiado hoy es el β-amiloide, que muchos investigadores atribuyen a la enfermedad de Alzheimer. Esta enfermedad fue descrita hace más de un siglo por A. Alzheimer, quien fue el primero en indicar el síntoma patomorfológico principal de esta enfermedad: placas seniles insolubles encontradas en el cerebro de los muertos que padecían esta enfermedad. Hoy en el mundo hay más de 40 millones de personas con un diagnóstico de enfermedad de Alzheimer: la probabilidad de desarrollar esta patología se duplica cada cinco años después de 65 años. Y las estimaciones a largo plazo de la OMS sobre el aumento masivo de tales pacientes en las próximas décadas son extremadamente pesimistas.
Se sabe que las placas insolubles en el cerebro de los pacientes están formadas principalmente por el péptido β-amiloide (Aβ), que tiene un peso molecular de 4 kDa y una longitud de aproximadamente 40 residuos de aminoácidos. Aβ es un fragmento de la proteína transmembrana de la proteína precursora amiloide (proteína precursora amiloide, APP), que se encuentra en muchos tejidos del cuerpo, incluso en las sinapsis de las neuronas. La APP está involucrada en algunos procesos fisiológicos asociados con la neuroplasticidad, la formación de sinapsis y la neuroprotección (supervivencia de las células nerviosas) [4].
A diferencia de su predecesor, el Aβ es tóxico para las células nerviosas, contribuyendo a su degeneración y muerte. Se forma separando el dominio N-terminal extracelular (sAPP) de la proteína precursora. Este proceso puede llevarse a cabo mediante dos secretasas diferentes: α-secretasa y β-secretasa, que tienen una diferencia fundamental en su acción. En el primer caso, la fragmentación se produce entre residuos de aminoácidos dentro de la secuencia Aβ, lo que impide la formación posterior de un péptido amiloide. En segundo lugar, patológico, bajo la influencia de la β-secretasa, el proceso de fragmentación debido a sus características termina en la formación de Aβ. Esta segunda vía asociada con el desarrollo de neuropatologías es más rara, y la razón por la cual la fragmentación de la proteína precursora sigue no está completamente clara [5].
 β-secretasa.
β-secretasa.La neurotoxicidad de Aβ se asocia con una violación de la homeostasis del calcio, excitotoxicidad, procesos inflamatorios, estimulación del estrés oxidativo y apoptosis. La opinión predominante era que la acumulación de Aβ en el cerebro es un proceso puramente patológico debido a la imposibilidad de eliminar Aβ del tejido cerebral. Hoy se sabe que, sin embargo, el Aβ puede eliminarse del cerebro de al menos 2 formas: perivascular (a través de la linfa) y proteolítico (escisión por varias enzimas) [6, 7]. Por lo tanto, la formación en la vejez de la enfermedad de Alzheimer con la acumulación de fibrillas amiloides insolubles puede estar asociada con varios factores estimulantes. Que puede ser de naturaleza genética y puede estar asociado con estrés, hipoxia, isquemia y accidentes cerebrovasculares anteriores [8].
El β-amiloide oxida el colesterol y los ácidos grasos poliinsaturados, formando las formas más tóxicas de especies reactivas de oxígeno: radicales hidroxilo y peróxido de hidrógeno. La racemización del ácido L-aspártico en proteínas de larga vida promueve la formación de β-amiloide y α-sinucleína. Se observan acumulaciones patológicas de este último en la enfermedad de Parkinson, la enfermedad de Alzheimer, la enfermedad de Levy y otras enfermedades neurodegenerativas.
Otro signo patomorfológico de neurodegeneración en la enfermedad de Alzheimer son los agregados de proteína tau hiperfosforilada (proteína τ): filamentos helicoidales emparejados (PHF) y ovillos neurofibrilares (NFT). Fisiológicamente, la proteína τ está involucrada en la estabilización de los microtúbulos de las neuronas, lo que garantiza la transferencia a través del citoplasma de las neuronas de los orgánulos celulares, las glucoproteínas y otras sustancias. En la enfermedad de Alzheimer, la proteína τ se hiperfosforila, pierde su capacidad normal de estabilizar los microtúbulos y se acumula en la célula con estructuras neurotóxicas insolubles. Lo que sucede antes durante la formación de la patología, la formación de agregados amiloides o de proteína τ, no es una pregunta clara. Pero, obviamente, estos dos procesos están interconectados y se estimulan entre sí. Entonces, ambas proteínas patológicas exhiben propiedades de priones similares a la proteína priónica PrPsc: las formas de proteínas plegadas incorrectamente por el tipo de reacción en cadena estimulan la transformación de proteínas normales en proteínas irregulares en las neuronas sanas que las rodean. Entre ellos, Aβ y la proteína τ también interactúan por el tipo de priones: se describe cómo Aβ activa la proteína quinasa GSK3 al fosforilar la proteína τ y hacer que se forme de manera incorrecta [5].
 proteína τ.
proteína τ.Más recientemente, se creía que aunque las enfermedades por priones y la enfermedad de Alzheimer tienen ciertas similitudes bioquímicas, la segunda patología, a diferencia de la primera, no es infecciosa y no se transmite de un organismo a otro. Pero en 2015, aparecieron las primeras noticias inquietantes. En la revista Nature, un neurólogo británico publicó un artículo en el que hablaban sobre la posible ruta de transmisión de Aβ de una persona a otra. Los autores realizaron un estudio de autopsia de los cerebros de ocho personas que murieron de la enfermedad de Creutzfeldt-Jakob. En los seis muertos, además de las lesiones asociadas con la enfermedad subyacente, se encontraron grandes acumulaciones de amiloides en el cerebro. Lo que no es característico ni para la corta edad de los muertos, ni para esta patología. Tampoco se encontraron defectos asociados con amiloidogénesis y neuropatologías en sus genomas. Los investigadores sugirieron que se introdujo Aβ en el cuerpo del fallecido durante la inyección de la hormona del crecimiento infectada con amiloide. De la misma manera que varios cientos de personas se infectaron previamente y murieron por inyecciones de priones que contienen hormona del crecimiento [9].
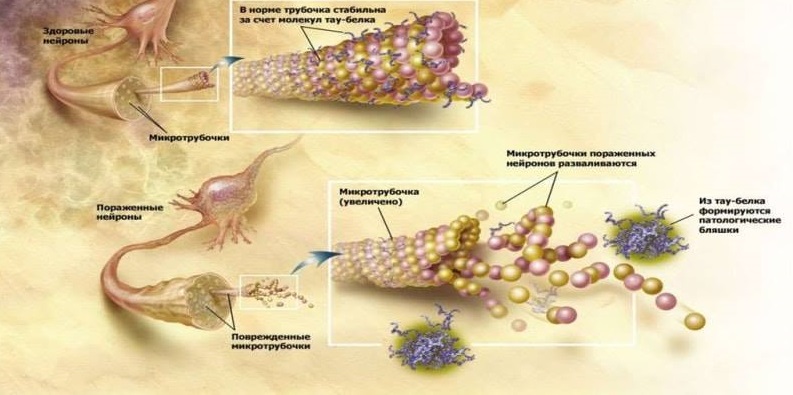 Las funciones de la proteína τ son normales y patológicas.
Las funciones de la proteína τ son normales y patológicas.La confirmación de la infecciosidad de la enfermedad de Alzheimer puede ser otro estudio en el que ratones de laboratorio con aumento de amiloidogénesis y ratones normales se combinaron quirúrgicamente con flujo sanguíneo. Como resultado, los ratones sanos comenzaron a acumular Aβ en el cerebro, lo cual no es típico de estos roedores. Este estudio por primera vez mostró el potencial para la penetración de Aβ con sangre en el cerebro y la posterior participación en el desarrollo de la neurodegeneración [10].
La relación entre la acumulación de β-amiloide y proteína τ en tejidos con neuropatologías relacionadas con la edad determina la necesidad de buscar métodos efectivos para identificar estos agregados de proteínas como biomarcadores de la neuropatología futura y el envejecimiento acelerado. Hoy, varios de estos métodos ya son conocidos.
Los depósitos de amiloide en el tejido cerebral se pueden detectar mediante tomografía por emisión de positrones, cuando el β-amiloide se determina por el isótopo radiactivo introducido en el cuerpo y conectado al amiloide.
Uno de los biomarcadores más sensibles en el diagnóstico temprano de la enfermedad de Alzheimer y los trastornos congestivos moderados (UKI) en la transición a la fase de patología hoy en día se considera los niveles de amiloide Aβ-42, proteína τ total y proteína τ fosforilada en el líquido cefalorraquídeo (LCR). Además, los amiloides con patología muestran una disminución en el nivel, y los niveles en el líquido cefalorraquídeo de la proteína τ, total y fosforilada, aumentan. Esto se debe al hecho de que en las personas sanas no hay acumulaciones de amiloide en forma de placas y, por lo tanto, se encuentra una gran cantidad de amiloide libre en el líquido cefalorraquídeo. Los valores bajos de la proteína τ muestran la ausencia de destrucción del citoesqueleto neuronal.
Se encontró una correlación significativa entre la edad y una desaceleración en la excreción de β-amiloide del sistema nervioso, que puede estar asociada con la esclerosis de los vasos linfáticos y una disminución en su capacidad de drenaje. Restaurar el drenaje es uno de los tratamientos prometedores para la enfermedad de Alzheimer, propuesto por Leucadia, cuya entrevista con el fundador fue traducida y publicada en
habr.com/post/371513Por lo tanto, la concentración de Aβ-42 en el líquido cefalorraquídeo al nivel de 716.9 ± 94.2 ng / ml puede considerarse indicadores normales para una persona sana. Y el nivel de Aβ-42, que muestra un mayor riesgo de neuropatología, es <209 ng / ml. Para una proteína τ, los niveles de 73,9 ± 51,7 ng / ml se consideran valores normales en el líquido cefalorraquídeo. Un aumento en los niveles de proteína τ a 231.6 ± 158.5 ng / ml ya puede indicar la presencia de un proceso neurodegenerativo activo. Según las ideas actuales, un estudio combinado de los niveles de proteína Aβ-42 y τ en el líquido cefalorraquídeo muestra una alta sensibilidad en el diagnóstico precoz de neuropatologías: 94% de la probabilidad de diagnosticar la enfermedad de Alzheimer [11].
Pronto, se espera la aparición de métodos inmunológicos y espectrométricos de masas ultrasensibles para el diagnóstico de amiloidosis (proporciones de proteínas Aβ42 / 40 o APP669-711 / Aβ42) y neurodegeneración (proteínas τ y neurofilamentos) en el plasma sanguíneo [12]. También hay métodos "sin marcas" para detectar proteínas plegadas de forma inadecuada en plasma [13].
Autores de la revisión: Denis Odinokov, Alexey Rzheshevsky.
Lista de literatura usada- Rameev V., Kozlovskaya L. Amiloidosis: métodos modernos de diagnóstico y tratamiento. Farmacoterapia efectiva. Urología y Nefrología. 2012. No. 11, p.6-15.
- Butler L.I., Karpova O.Yu., Alexandrova E.N., Petrova S.Yu. Amiloidosis del corazón en ancianos. Archivo de Medicina Interna. 2015. No. 6 (26), pág. 28-36.
- AmyloSENS: Eliminando basura de entre celdas.
- 4Lee, V., Goedert, M., Trojanowski, J. (2001) Tauropatías neurodegenerativas, Annu. Rev. Neurosci., 24, 1121-1159.
- Tatarnikova O.G., Orlov M.A., Babkova N.V. Proteína beta amiloide y Tau: estructura, interacción y propiedades similares a los priones. Avances en química biológica, vol. 55, 2015, p. 351-390.
- Weller, R., Yow, H., Preston, S., Mazanti, I., Nicoll, J. (2002) La enfermedad cerebrovascular es un factor importante en el fracaso de la eliminación de beta amiloide del cerebro humano envejecido, Ann. NY Acad. Sci., 977, 162–168.
- Nalivaeva, N., Fisk, L., Belyaev. N., Turner, A. (2008) Enzimas degradantes de amiloide como dianas terapéuticas en la enfermedad de Alzheimer, Curr. Alzheimer Res., 5, 212–224.
- Fisk, L., Nalivaeva, N., Boyle, J., Peers C., Turner A. (2007) Efectos de la hipoxia y el estrés oxidativo en la expresión de neprilisina en células de neuroblastoma humano y neuronas corticales de rata y astrocitos, Neurochem. Res. 32, 1741-1748.
- Jaunmuktane Z., Mead S., Ellis M., Wadsworth JDF, Nicoll AJ, Kenny J., et al. (2015). Evidencia de transmisión humana de la patología β-amiloide y la angiopatía amiloide cerebral. Nature 525, 247-250.
- XL Bu, Y Xiang, WS Jin, J Wang, LL Shen, ZL Huang, K Zhang, YH Liu, F Zeng, JH Liu, HL Sun, ZQ Zhuang, SH Chen, XQ Yao, B Giunta, YC Shan, J Tan , XW Chen, ZF Dong, HD Zhou, XF Zhou, W Song y YJ Wang. La proteína β-amiloide derivada de la sangre induce patologías de la enfermedad de Alzheimer. Psiquiatría Molecular. 2017
- V.Yu. Lobzin, A.Yu. Emelin, L.A. Alekseeva. Biomarcadores liquorológicos de neurodegeneración en el diagnóstico precoz del deterioro cognitivo. Boletín de la Academia Médica Militar Rusa. 2013, núm. 4, pág. 15-20.
- Blennow, Kaj y Henrik Zetterberg. "Biomarcadores para la enfermedad de Alzheimer: estado actual y perspectivas para el futuro". Revista de medicina interna (2018).
- Nabers, Andreas y col. "El biomarcador de sangre amiloide detecta la enfermedad de Alzheimer". Medicina molecular EMBO (2018).