El desarrollo de la terapia de envejecimiento no es posible sin un diagnóstico confiable del envejecimiento. No parece razonable esperar la muerte de una persona o la aparición de una enfermedad mortal para comprender: ¿hemos retrasado o no el proceso de envejecimiento con esta o aquella terapia? Debemos ver de inmediato la imagen objetiva causada por nuestras intervenciones antienvejecimiento.
En la práctica clínica, todavía no existe un "gran diagnóstico de envejecimiento". Es decir, no es posible que el paciente y el médico tratante detecten cambios relacionados con la edad a nivel molecular que preceden la aparición de enfermedades. Queremos cerrar esta brecha describiendo, en primer lugar, todos los principales marcadores de los cambios relacionados con la edad y el nivel tecnológico disponible para medirlos.
Continuaremos presentando el concepto de diagnóstico SENS del envejecimiento, basado en el hecho de que hoy el programa SENS (lograr un envejecimiento insignificante mediante métodos de ingeniería) describe los enfoques para aumentar la vida humana.
Muchos han escuchado sobre la glucosilación de proteínas, los productos finales de glucosilación (CNG, AGE) y el daño que causan al cuerpo. Pero, debe tenerse en cuenta que la adición de azúcares a otras moléculas está lejos de ser siempre una patología. La glucosilación en sí es un proceso fisiológico muy común e importante en los organismos vivos. Por lo tanto, una parte importante de todas las proteínas sintetizadas en las células se someten a glucosilación enzimática, que es necesaria para su funcionamiento normal.
Básicamente, dos glicanos (la parte de carbohidrato del ligamento es una molécula orgánica) participan en la glicosilación: N-glicanos (unidos al grupo amida de la asparagina) y O-glicanos (unidos al grupo hidroxilo de serina o treonina). Debido al envejecimiento, estamos más interesados en los N-glucanos. Se describe que con el envejecimiento, cambia el espectro de las cadenas de azúcar, que se unen a las proteínas inmunes durante la N-glucosilación. Y dicho cambio juega un papel clave en el aumento relacionado con la edad en la inflamación general en el cuerpo. Por lo tanto, el nivel de anticuerpos IgG glucosilados puede predecir la edad biológica de una persona incluso con mayor precisión que la longitud de los telómeros [1].
Además, dos glucanos más, NGA2F y N2AF, demostraron ser prometedores biomarcadores de envejecimiento. Como parte del programa de investigación europeo MARK - AGE sobre biomarcadores del envejecimiento, que finalizó en 2013, se desarrolló la prueba GlycoAgeTest para determinar la edad biológica de una persona. Se basa en la proporción del número de glucanos NGA2F (que aumenta con la edad) y N2AF (cuyo nivel disminuye con la edad). Otro posible biomarcador de envejecimiento y enfermedades relacionadas con la edad (cardiovascular y diabetes) descrito en el estudio MARK - AGE fue la glicoproteína clusterina, que participa en la estabilización de las estructuras de proteínas [2].
Pasamos ahora a la consideración de la parte patológica de este fenómeno. Además de la glucosilación enzimática regulada por el cuerpo, existe una forma no enzimática de este proceso, la llamada Reacción de Maillard, cuyo resultado es la aparición en el cuerpo de una variedad de productos de glicación. Cabe señalar que el proceso de glicosilación no enzimática prácticamente no está regulado. Aunque existe la posibilidad de "restringir" la glucosilación a través de la transglicación, en la que se consumen glutatión, poliaminas, tioles, aminoácidos libres, por ejemplo, taurina, lisina. Y también a través de la inactivación de metilglioxal por el sistema de glicoxalasa: la glioxalasa I convierte metilglioxal y glutatión reducido en lactoilglutatión, que luego se metaboliza a D-lactato por la glioxalasa II.
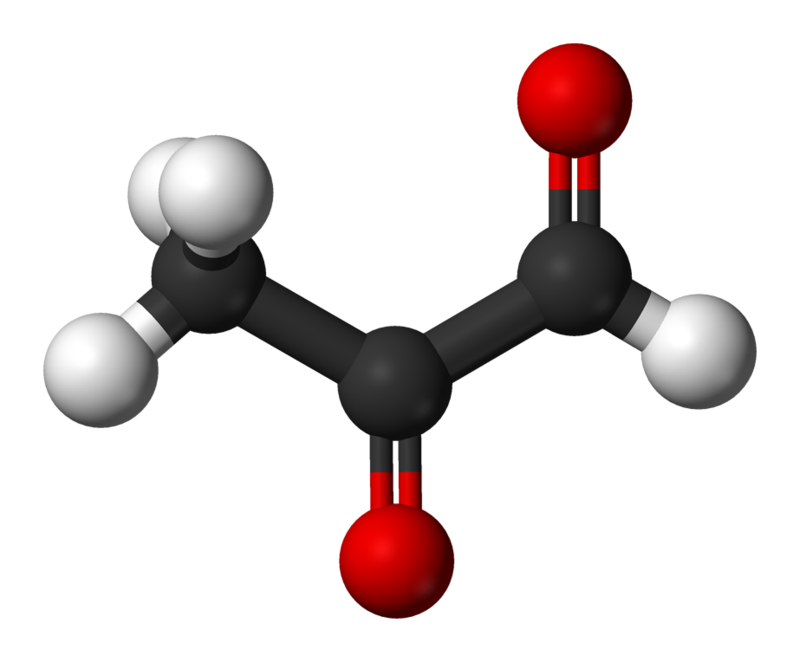 Estructura de metilglioxal
Estructura de metilglioxalEntre los productos de glicación, se distinguen los productos de glicación temprana (productos Amadori) y tardía (o final). La glicosilación no enzimática ocurre en varias etapas. Este proceso comienza con el hecho de que la glucosa y otros azúcares simples se combinan con el grupo amino y desencadenan una cadena de reacciones adicionales. Al principio, durante la reacción entre el grupo aldehído de azúcares y el grupo amino, se forma un grupo aldimina inestable (base de Schiff), que puede convertirse en una serie de otros compuestos más estables, productos de glicosilación temprana, los llamados Productos Amadori. Uno de los primeros productos de la adición de glucosa a la proteína es la Ne - fructosil - lisina, que, a su vez, degrada, forma varios productos finales de glicación (GNC). Las hidroimidazolonas, derivados de residuos de arginina modificados por glioxal, metilglioxal y 3-desoxiglucosona (3-DG), se producen en grandes cantidades como GNC. Otros GNC bien estudiados son Nδ - carboximetil - lisina (CML) y Nδ - carboxietil - lisina (CEL), así como glucosapano y pentosidina, que son característicos de la reticulación de proteínas [3]. Uno de los tipos de GNC más fáciles de definir es la pentosidina, que se acumula, por ejemplo, en los tendones de los músculos grandes de una persona (es decir, donde se reduce la velocidad de renovación del colágeno) desde los 20 años y su concentración aumenta linealmente hasta la vejez.
Hasta hace poco, se creía que la glucosa es la sustancia principal para la formación de GNC. Pero el establecimiento exacto de diferentes tasas de formación intra y extracelular de GNC mostró que esto no es así. Los azúcares como la fructosa, la glucosa-6-fosfato y el gliceraldehído-3-fosfato tienen una mayor tasa de formación intracelular de GNC. Se ha descrito el efecto negativo del gluceraldehído sobre la molécula de la principal proteína contráctil y del citoesqueleto actina, lo que conduce a la formación de enlaces cruzados de pentosidina y bitirosina y a la pérdida de la funcionalidad de la actina [4].
 Reticulación de moléculas de colágeno con glucosapan.
Reticulación de moléculas de colágeno con glucosapan.Ahora se cree que la glicosilación no enzimática y el GNC están estrechamente asociados con una variedad de enfermedades dependientes de la edad, como diabetes, artritis reumatoide, aterosclerosis, enfermedad de Parkinson y Alzheimer, esclerosis lateral amiotrófica, cataratas y cáncer [5]. Las proteínas sometidas a glicación en la reacción de Maillard se reticulan fisiológicamente y pierden sus propiedades. Esto presenta un problema particularmente grande para las proteínas de larga vida (por ejemplo, las moléculas de colágeno de la piel, según varios estudios, tienen una vida media de 15 años y el cartílago de más de 100 años), que constituyen una parte significativa de todas las proteínas en el cuerpo, aproximadamente un tercio. La reticulación adicional resultante entre las moléculas viola las funciones de estas proteínas, lo que conduce a una pérdida de elasticidad del tejido y a menudo se observa con el envejecimiento y las patologías. La glicación también hace que la proteína de colágeno ya renovada lentamente se vuelva aún más duradera: después de la glicación adquiere resistencia a la acción fisiológica de las colagenasas endógenas, que proporcionan la renovación del tejido.
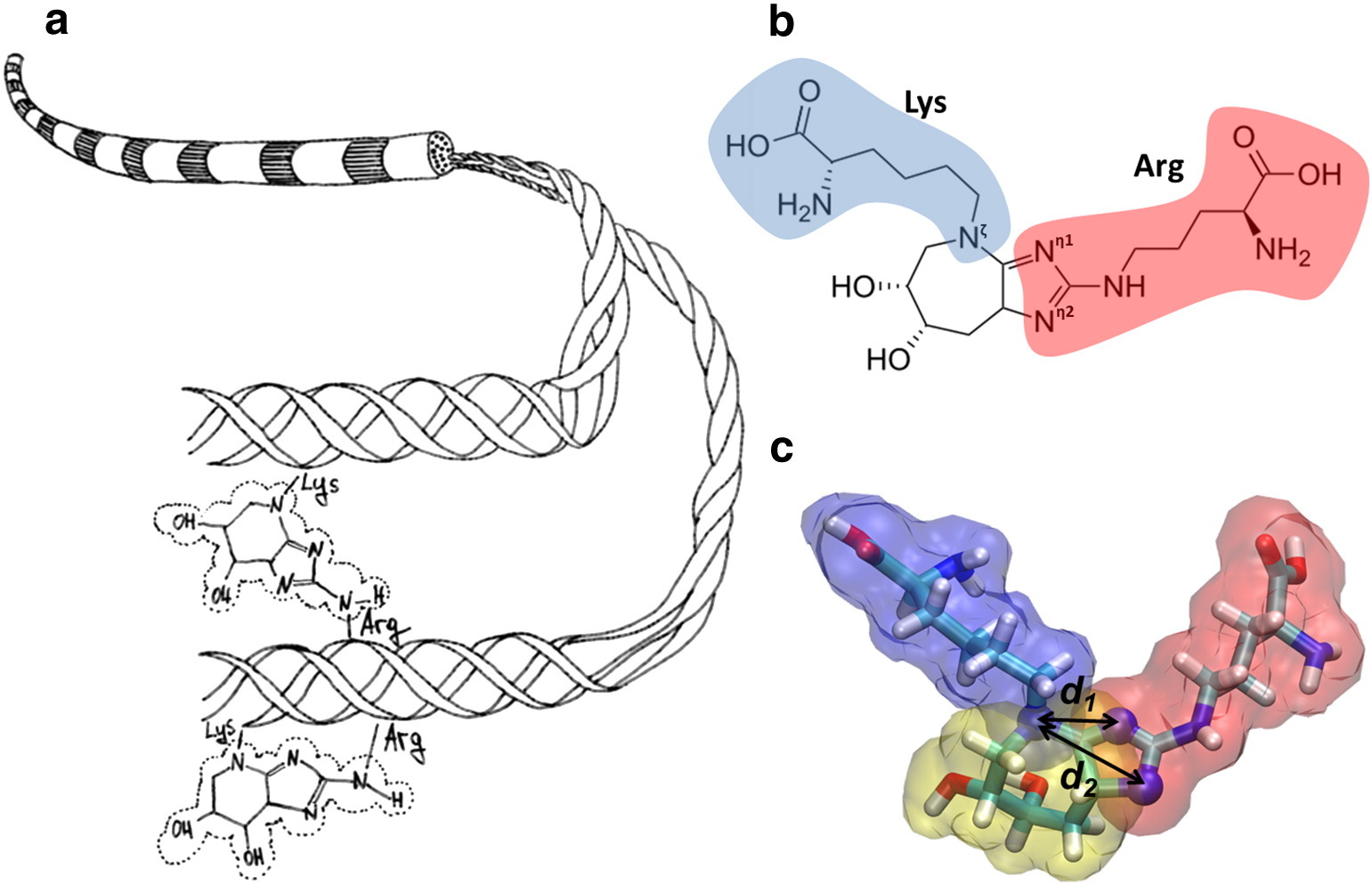 La figura (a) muestra un diagrama de fibrillas de colágeno y la formación de glucosaepan, que se une covalentemente a las cadenas laterales de lisina y arginina. (b) Se muestra la estructura química del glucosopan, que reticula la lisina (azul) con la arginina (rojo). (c) Se muestra un modelo molecular de glucosopano.
La figura (a) muestra un diagrama de fibrillas de colágeno y la formación de glucosaepan, que se une covalentemente a las cadenas laterales de lisina y arginina. (b) Se muestra la estructura química del glucosopan, que reticula la lisina (azul) con la arginina (rojo). (c) Se muestra un modelo molecular de glucosopano.Se describe la participación del factor de crecimiento de fibroblastos glicosilados β-FGF en la formación de fibrosis. La glicación de la secuencia arg-gli-asp de la proteína fibronectina conduce a una violación de la capacidad regenerativa vascular y la progresión de las patologías vasculares. Los GNC se acumulan en el cristalino y la retina con la edad. Las cristalinas, las principales proteínas estructurales de la lente del ojo, son susceptibles de glicación y reticulación. La glicación de las proteínas del cristalino conduce a cataratas. La hemoglobina glucosilada, que se usa para determinar el nivel promedio de glucemia en los últimos 3 meses, pierde la capacidad de transferir oxígeno a los tejidos, lo que afecta negativamente muchos procesos químicos.
También se sabe que la glucosilación de proteínas y la formación de GNC se acompaña de un aumento en la actividad de los radicales libres y la peroxidación lipídica, lo que contribuye al desarrollo de enfermedades relacionadas con la edad. Esto se debe al hecho de que en el proceso de glicación de proteínas, se inician los procesos de autooxidación del azúcar, acompañados de un aumento en la producción de especies reactivas de oxígeno (ROS). Además, la unión de CNG al receptor de CNG (RAGE) también conduce a la formación de ROS reactivos y a la posterior activación del factor de transcripción sensible al estrés oxidativo NF-kB asociado con inflamación y aterogénesis.
A su vez, la activación de NF-κB aumenta la expresión de RAGE, creando un ciclo de retroalimentación positiva que mejora la producción de promotores inflamatorios. Además, la interacción CNG-RAGE activa la NADPH oxidasa (un complejo de enzimas que produce superóxido), lo que aumenta el estrés oxidativo intracelular. Y el aumento del estrés oxidativo por la NADPH oxidasa en respuesta a la interacción de AGE-RAGE activa, a su vez, NF-κB. Y aquí podemos observar una serie de "círculos viciosos": ciclos con comentarios positivos.
La glicación de las proteínas de la cadena respiratoria mitocondrial también contribuye a este proceso: la interrupción de la cadena respiratoria sirve como una fuente constante de radicales superóxido. Además, la formación en mitocondrias y en otras estructuras bajo la influencia de la glicación de GNC no descomponibles puede ser responsable de la implementación de un fenómeno como la "memoria metabólica". Cuando en pacientes con diabetes tipo 2, el control glucémico estricto ya no previene el desarrollo de complicaciones asociadas con la enfermedad cardiovascular. Se supone que los GNC no descomponibles juegan un papel importante en este fenómeno [6].
Además, con la glicación, se produce un aumento en los procesos inflamatorios. Por lo tanto, durante la glucosilación del colágeno, los productos finales de este proceso se acumulan en la matriz extravascular, que el cuerpo percibe como extraña. Debido a esto, surgirá una respuesta inmune durante la cual las células inmunes (macrófagos) aumentarán la secreción de citocinas proinflamatorias (TNF-α, interleucina-6, etc.), que son conocidas por su capacidad de afectar negativamente la resistencia a la insulina y la aterogénesis [7].
Además, las proteínas "reticuladas" cambian la estructura (nanotopografía) y aumentan la rigidez de la matriz extracelular y, a través de los mecanorreceptores de membrana y el citoesqueleto celular, junto con las moléculas de señalización influyen en la expresión de los genes, la función de las células, los tejidos y el cuerpo en general. Además, gracias a la prolina, las moléculas de colágeno conducen ondas electromagnéticas débiles generadas por células y tejidos y, posiblemente, además de las señales mecánicas y químicas, forman un único sistema de señal bioeléctrica del cuerpo. Es interesante observar que al cambiar la topografía del medio o la radiación electromagnética, no solo puede controlar el ciclo celular, sino también convertir las células somáticas adultas en células madre sin la ayuda de virus con el vector de factores de Yamanaka.
Incluso los cambios menores en el módulo de corte y la viscoelasticidad del medio intercelular tienen un fuerte efecto en las células: la matriz extracelular "antigua" puede limitar significativamente la efectividad del uso de senolíticos y la terapia con células madre. Entonces, los fibroblastos "jóvenes" envejecen rápidamente en la matriz antigua y viceversa: las células "viejas" pierden signos de un fenotipo secretor relacionado con el envejecimiento en la matriz "joven".
¿Cuáles son las causas de las proteínas glicadas y el GNC? Se cree que el principal para el hombre moderno hoy es la comida chatarra. La corteza frita marrón-negra en los productos representa la colección de GNC, formada debido al procesamiento térmico de productos (freír carne, papas, etc.) a altas temperaturas. El tocino frito se considera el poseedor del récord de la cantidad de GNC formados. Además, el consumo de alimentos que contienen muchos carbohidratos rápidos (confitería, bebidas azucaradas, etc.) también puede contribuir a la glucosilación de proteínas y la formación de GNC. Existen productos conocidos que, por el contrario, ayudan a resistir la acumulación de GNC: rábano negro, rábano, brócoli, gracias a la sustancia sulforafano que contienen. No es sorprendente, pero junto con los gourmets, los fumadores se suministran regularmente con dosis elevadas de GNC. El humo del tabaco contiene glicotoxinas que reaccionan con los residuos de lisina y arginina para formar GNC. Esta es probablemente la razón por la cual los fumadores tienen inflamación crónica de los órganos respiratorios [8].
Como ya se mencionó, además de la influencia de factores externos, la formación de GNC también ocurre normalmente de manera endógena (es decir, dentro del cuerpo) en condiciones fisiológicas. Aunque este proceso es lento e insignificante, aumenta significativamente con una mayor concentración de radicales libres, con resistencia a la insulina, diabetes mellitus y un aumento de la glucosa en sangre. Acumulando en el cuerpo, el GNC empuja a una persona al “pantano” de los procesos patológicos, de los cuales no es tan fácil salir.
En la expresión figurativa de los autores de SENS, la reticulación de proteínas actúa como "esposas" moleculares que unen moléculas de proteínas, violando así su función. Los autores de SENS ven una solución a este problema en el desarrollo de fármacos que puedan reaccionar con la reticulación y romperlos sin destruir otras características estructurales de las moléculas. En su opinión, una circunstancia favorable en este proceso es que los enlaces cruzados que ocurren como accidentes químicos en las estructuras de nuestras moléculas de proteínas tienen una estructura química muy inusual, que normalmente no ocurre en las sustancias producidas por el cuerpo. Lo que debería facilitar la búsqueda y creación de agentes terapéuticos.
Además, los autores de SENS identifican una serie de enfoques prometedores para resolver este problema. Como encontrar o desarrollar enzimas, en lugar de medicamentos, para romper los enlaces cruzados. Además del desarrollo de proteínas "desechables" que destruirían la reticulación, y luego serían destruidas en el proceso. Se sabe que tales proteínas existen para otros fines, por ejemplo, la proteína de regeneración de ADN MGMT [9]. A favor de un enfoque para la búsqueda de enzimas, dice el hecho de que las enzimas deshidratantes se describen en organismos vivos. Entonces, en hongos y bacterias, se encontraron enzimas resistentes a la glicación, amadoriasis, fructosolisina-6-quinasa frlD y fructosolisina-6-fosfato deglycase frlB, que actúan sobre compuestos de aminoácidos de bajo peso molecular con azúcares [10]. En los vertebrados, se encontraron las enzimas fructosamina-3-quinasa (FN3K) y su proteína relacionada FN3K-RP, que pueden descomponer los productos de glicación intracelularmente en procesos dependientes de ATP [11].
Se cree que el glucosaepano tiene el mayor efecto en el curso de las enfermedades en los ancianos y, por lo tanto, es un objetivo prioritario para la terapia antienvejecimiento.
Desafortunadamente, el glucosapano no se eligió como el objetivo de los fármacos anti-entrecruzamiento previamente desarrollados, como Alagebrium / ALT-711 (Wolffenbuttel et al., 1998), C36 (Cheng et al., 2007), TRC4149 (Pathal et al., 2008 ), y solo tiene que demostrar su papel en los mecanismos del envejecimiento. Estas sustancias estaban destinadas a neutralizar la carboximetilisina, el producto de reacción de Maillard tardío más común que se acumula en el cuerpo con diabetes.
En este momento, un grupo de David Spiegel de la Universidad de Yale está trabajando en la síntesis de anticuerpos contra proteínas que contienen glucosaepan. Aubrey de Gray confirma la importancia de la investigación de glucosaepano y recientemente anunció el registro de Revel, sobre la base de lo cual la investigación iniciada en la universidad probablemente continuará.
Sin embargo, es probable que ni los anticuerpos ni las enzimas, debido a su tamaño, puedan penetrar entre las fibrillas de colágeno. Además, la reticulación desgarrada del colágeno se restablece después de tomar el medicamento, lo que requerirá un segundo curso de terapia.
Por lo tanto, los catalizadores artificiales similares a enzimas, cuyos tamaños pueden ser varias veces más pequeños que los tamaños de las enzimas originales, parecen ser una alternativa más interesante. Un grupo de Christian Schaffmeister de la Universidad de Temple está desarrollando moléculas similares con una actividad catalítica determinada (espiroligómeros).
Como se señaló anteriormente, dado que los productos finales de la glicación se acumulan durante el envejecimiento, su cuantificación puede ser un biomarcador preciso y confiable del envejecimiento. Sin embargo, tanto la detección de GNC en el cuerpo como el diagnóstico temprano de cambios en la composición y estructura de la matriz intercelular son difíciles debido a la naturaleza de los cambios, limitada por órganos y sistemas, y la necesidad de múltiples biopsias. Incluso en un organismo, los resultados son muy diferentes según la ubicación de la biopsia y el tipo de producto final de glicación final que se examina.
Los métodos disponibles para determinar los productos finales de glicación en la piel, como la autofluorescencia, es decir, sin el uso de tintes especiales (el dispositivo AGE-READER fabricado por la empresa holandesa DiagnOptics BV) no proporcionan datos precisos y muchos factores pueden influir en los resultados de la medición, por ejemplo, cambios en el agua. - .
El método principal y más preciso para cuantificar el GNC en el cuerpo hoy en día es el método de cromatografía en combinación con la detección espectrométrica de masas. La espectrometría de masas permite identificar proteínas con un alto grado de certeza y determinar sus cantidades en mezclas de proteínas complejas.También se usa un ensayo inmunosorbente ligado a enzimas para determinar el nivel de GNC. Pero este método tiene una serie de limitaciones cualitativas (especificidad insuficiente de anticuerpos, influencia de productos de glicación libre, etc.). Por lo tanto, se cree que es aconsejable llevarlo a cabo en combinación con la espectrometría de masas. El GNC también se puede identificar por la intensidad total de su fluorescencia. Esto también tiene sus limitaciones (la mayoría de los GNC no cuantifican la fluorescencia, por lo tanto, no se pueden determinar) y permite una determinación más precisa de péptidos de GNC de bajo peso molecular y productos de glicación libre.Uno de los biomarcadores prometedores, que muestra no solo la acumulación de GNC, sino también el mayor riesgo de mortalidad por todas las causas, es la carboximetil-lisina plasmática (KML). KML es uno de los GNC dominantes en el cuerpo, tanto circulante como tisular. Además, KML es el único GNC que actúa como ligando para los receptores de GNC (RAGE). La unión de RAGE a KML conduce a un aumento en la generación de radicales libres, la activación de la vía del factor nuclear Nf-κB y un aumento en el nivel de mediadores inflamatorios (como el factor de necrosis tumoral alfa, interleucina-6 y proteína C reactiva). Se sabe que la CML se acumula en los grandes vasos sanguíneos con la edad. Y las altas concentraciones de este GNC en suero están asociadas con una mayor rigidez arterial, un poderoso factor de riesgo para el desarrollo de patologías cardiovasculares y la mortalidad por ellas,como se muestra en el estudio longitudinal de Baltimore sobre el envejecimiento [12].También se sabe que las personas mayores con enfermedades cerebrovasculares tienen un mayor nivel de CML en las neuronas corticales y los vasos cerebrales, lo que se asocia con la gravedad del deterioro cognitivo. En un estudio de 6 años de Invecchiare in Chianti, que involucró a 1.013 personas mayores de 65 años, se demostró que la concentración plasmática promedio de CML, medida por el ensayo inmunoabsorbente ligado a enzimas, fue significativamente mayor en aquellas personas que murieron por todas las causas que sobrevivientes [13]. En 2018, un grupo de científicos daneses y suecos describió un nuevo anticuerpo monoclonal, D1-B2, dirigido a KML, que tiene un buen potencial mediante un ensayo inmunosorbente ligado a enzimas para detectar este GNC. [14]Anteriormente, utilizando el método de cromatografía líquida acoplada junto con la espectrometría de masas, se identificaron una serie de GNC (glucosaepan, DOGDIC, MODIC y GODIC), que se acumulan en los tejidos durante el envejecimiento y las patologías y pueden usarse como marcadores para procesos fisiopatológicos [15]. El método de cromatografía líquida de alto rendimiento permite detectar dos clases más de GNC asociadas con el envejecimiento y la diabetes: GOLD y MOLD [16].Autores de la revisión: Denis Odinokov, Alexey Rzheshevsky.Referencias- Krištić J, Vučković F, Menni C, Klarić L, Keser T, Beceheli I, Pučić-Baković M. et al. Glycans are a novel biomarker of chronological and biological ages.Gerontol A Biol Sci Med Sci. 2014 Jul;69(7):779-89.
- Bürkle A, Moreno-Villanueva M, Bernhard J, Blasco M, Zondag G, Hoeijmakers JH6, Toussaint O, Grubeck-Loebenstein B, Mocchegiani E, Collino S, Gonos ES, Sikora E. et al. MARK-AGE biomarkers of ageing. Mech Ageing Dev. 2015 Nov;151:2-12.
- Ahmed N., Thornalley PJ . . 2009. №9, . 642-51.
- . ., . ., . ., . . in vitro , . . 2006, №2, . 51-59.
- .., . : . , 2010, : 56(2), 168-178.
- .. «» . . . 2011. № 4.
- Bernheim J, Rashid G, Gavrieli R, Korzets Z, Wolach B. In vitro effect of advanced glycation end-products on human polymorphonuclear superoxide production. Eur J Clin Invest. 2001. Dec;31(12):1064-9.
- Mullick AE, McDonald JM, Melkonian G, Talbot P, Pinkerton KE, Rutledge JC. Reactive carbonyls from tobacco smoke increase arterial endothelial layer injury. Am J Physiol Heart Circ Physiol. 2002 Aug;283(2):H591-7.
- GlycoSENS: Breaking extracellular crosslinks.
- Monnier VM, Sell DR. Prevention and repair of protein damage by the Maillard reactionin vivo. Rejuvenation Res. 2006;9(2):264–273.
- Szwergold BS1, Bunker RD, Loomes KM. The physiological substrates of fructosamine-3-kinase-related-protein (FN3KRP) are intermediates of nonenzymatic reactions between biological amines and ketose sugars (fructation products). Med Hypotheses. 2011 Nov;77(5):739-44.
- Semba RD, Najjar SS, Sun K, et al. Serum carboxymethyl-lysine, an advanced glycation end product, is associated with increased aortic pulse wave velocity in adults. Am J Hypertens. 2009;22:74–79
- Semba, RD, Bandinelli, S., Sun, K., Guralnik, JM, & Ferrucci, L. (2009). Plasma Carboxymethyl-Lysine, an Advanced Glycation End Product, and All-Cause and Cardiovascular Disease Mortality in Older Community-Dwelling Adults. Journal of the American Geriatrics Society, 57(10), 1874–1880.
- Wendel U, Persson N, Risinger C, Bengtsson E, Nodin B, Danielsson L, Welinder C, Nordin Fredrikson G, Jansson B, Blixt O. A novel monoclonal antibody targeting carboxymethyllysine, an advanced glycation end product in atherosclerosis and pancreatic cancer. PLoS One. 2018 Feb 8;13(2):e0191872.
- Biemel KM, Fried DA, Lederer MO. Identification and quantification of major maillard cross-links in human serum albumin and lens protein. Evidence for glucosepane as the dominant compound. J Biol Chem. 2002 Jul 12;277(28):24907-15. Epub 2002 Apr 26.
- Chellan P, Nagaraj RH. Protein crosslinking by the Maillard reaction: dicarbonyl-derived imidazolium crosslinks in aging and diabetes. Arch Biochem Biophys. 1999 Aug 1;368(1):98-104.