Mitocondrias: ¿pequeños trabajadores o grandes jefes?Si cree que la historia más importante para nosotros para vivir juntos comienza durante la boda, entonces este no es el caso en absoluto. La historia más importante de la vida de cada persona comenzó hace más de mil millones de años cuando nuestros ancestros unicelulares distantes se vieron obligados a firmar un "contrato de matrimonio" con aquellos a quienes ahora llamamos mitocondrias (ver la teoría de la simbiogénesis).
Las mitocondrias tienen dos membranas (interna y externa) y su propio material hereditario en forma de ADN (Fig. 1). En la membrana interna de las mitocondrias hay un sistema de fosforilación oxidativa, cuya operación proporciona la oxidación de sustratos de energía con la formación de ATP.
Fig. 1) Estructura esquemática de las mitocondrias.
En el contrato matrimonial de la célula y las mitocondrias no hay una cláusula "sobre enfermedad y salud", y buena. Si la mitocondria envejece, la célula puede matarla durante la mitofagia, y la mitocondria, a su vez, regula el proceso de apoptosis en las células disfuncionales y viejas. Si se interrumpe el proceso de control de calidad mutuo, se lanzan mecanismos de envejecimiento. Los mecanismos de la apoptosis se alteran, aumenta el número de radicales libres no controlados por las mitocondrias. Esto causa inflamación sistémica, daño al ADN de la célula. Por lo tanto, existe una fuerte relación entre la disfunción MX, las enfermedades relacionadas con la edad, el envejecimiento y las disfunciones metabólicas [1]. La disfunción metabólica es un motor constante del apocalipsis del envejecimiento.
"Como una ardilla en una rueda" - la dinámica de las mitocondrias
No toda la culpa de los trastornos metabólicos recae en nuestra sobrealimentación. Los trastornos metabólicos se asocian principalmente con la incapacidad de las mitocondrias para hacer frente a los nutrientes. Las mitocondrias en la célula no son fáciles. "Alimentamos" nuestras células demasiado o muy poco, y les presentamos una "solicitud" para dar energía en forma de ATP, cuya cantidad debe coincidir exactamente con nuestras necesidades. Para “salir” regularmente de esta situación, las mitocondrias realmente usan algunos “movimientos”: fisión y fusión. Estas "mitodomotiones" se unen bajo el nombre de "dinámica mitocondrial". El equilibrio entre la división mitocondrial y la fusión es el mecanismo central de la adaptación bioenergética a las necesidades metabólicas de la célula [2, 3].
La mayoría de las mitocondrias se encuentran en tejidos con altas necesidades de energía: músculos, hígado, tejido adiposo marrón y cerebro. No es sorprendente que la dinámica de las mitocondrias en estos tejidos haya sido mejor estudiada.
Entonces, si una célula de cualquiera de estos tejidos (a excepción de algunas neuronas en el cerebro, más sobre eso más adelante) recibe una gran cantidad de nutrientes (la ingesta excede el costo), entonces las mitocondrias están en un estado dividido (fragmentado). Si la célula está en un estado de hambre (ingresos menores que el costo), entonces las mitocondrias se fusionan y están en un estado conectado. [3,4]. Así es como se mantiene la homeostasis celular (Fig. 2).
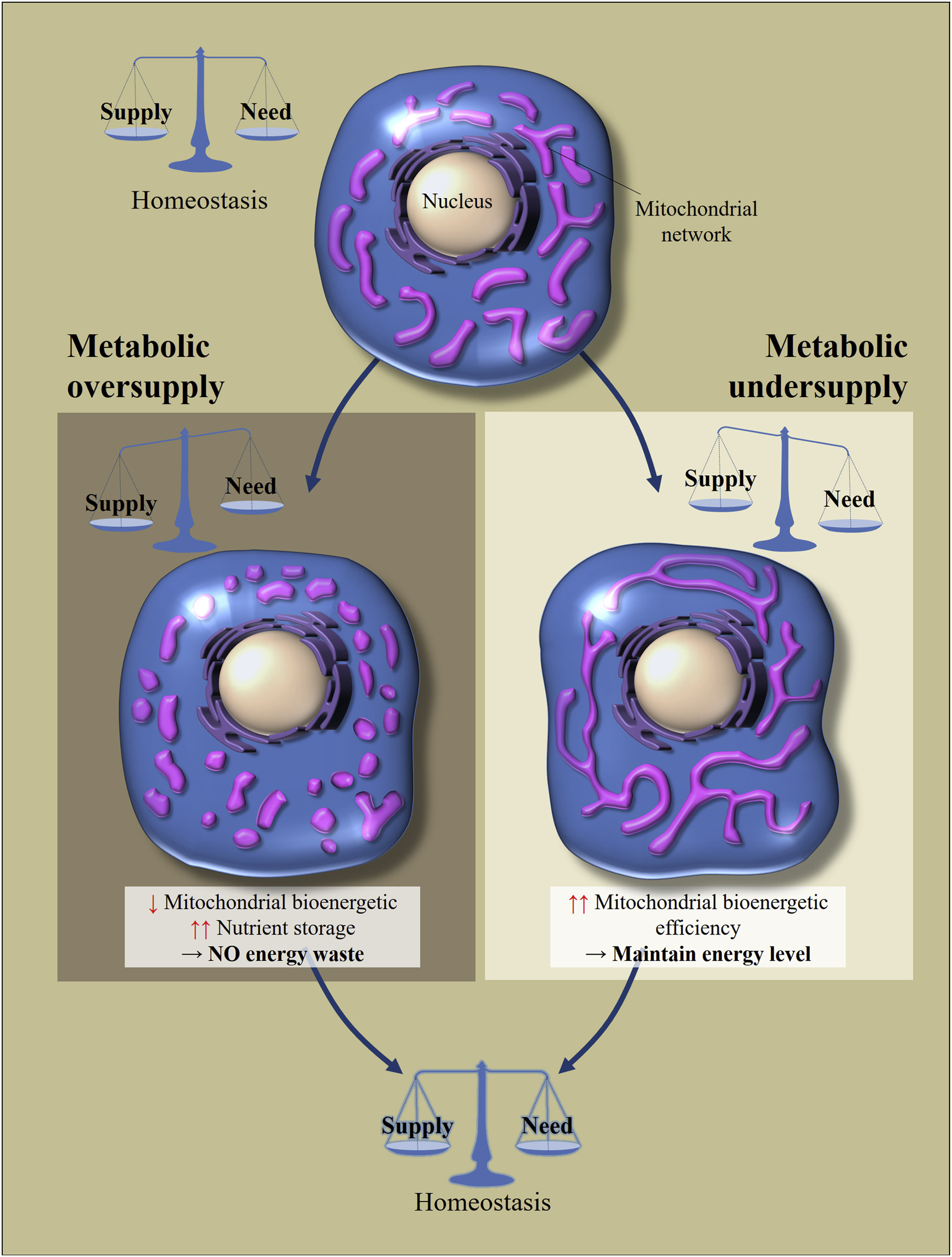 Fig. 2
Fig. 2 Regulación de la morfología y la eficiencia bioenergética de las mitocondrias en respuesta al consumo excesivo o insuficiente de nutrientes [de 2]
La homeostasis metabólica celular depende del equilibrio entre la ingesta de nutrientes y su consumo. Los cambios en el suministro de nutrientes conducen a adaptaciones celulares para restablecer el equilibrio. El exceso de nutrición conduce a la fragmentación de la red mitocondrial, lo que provoca una disminución en la eficiencia bioenergética de las mitocondrias. Esto evitará la pérdida de energía. En contraste, con el hambre metabólica, las mitocondrias se alargan para aumentar su eficiencia bioenergética.¿Cuál es el truco de estos movimientos? Si la célula está en un estado de hambre, la fusión de las mitocondrias puede aumentar su eficiencia bioenergética (la cantidad de ATP que se crea por molécula de nutrientes). Si un exceso de nutrientes ingresa a la célula, pueden ser 1) almacenados o 2) disipados esta energía en forma de calor. La tarea de las mitocondrias en este caso es disipar más energía en forma de calor, almacenar menos en forma de ATP (la acumulación de NADH y ROS provocará estrés oxidativo). La fragmentación de las mitocondrias les permite reducir la eficiencia de la bioenergía, cuyo principal mecanismo de reducción se considera la "fuga" de protones.
Entonces, vamos a trabajar, y la vida de las mitocondrias continúa constantemente en el ciclo de división y fusión (Fig. 3).
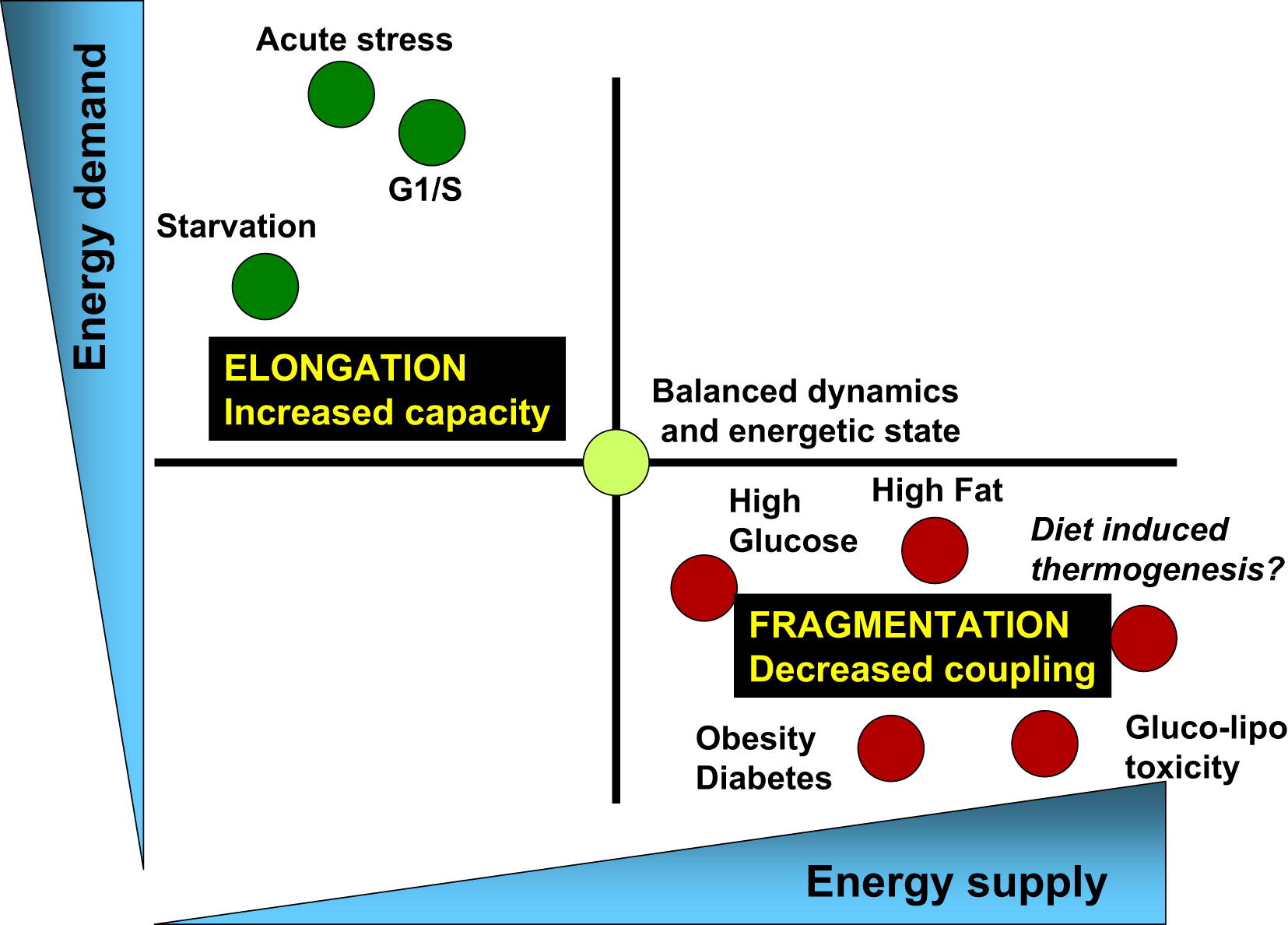 Fig. 3 El equilibrio del consumo de energía y el suministro de energía está asociado con los cambios correspondientes en la arquitectura de las mitocondrias y su eficiencia bioenergética [de 3]
Fig. 3 El equilibrio del consumo de energía y el suministro de energía está asociado con los cambios correspondientes en la arquitectura de las mitocondrias y su eficiencia bioenergética [de 3]
Los procesos fisiológicos asociados con un aumento en la demanda de energía y una disminución en los suministros de energía (por ejemplo, estrés agudo, inanición y la fase G1 / S) se caracterizan por el alargamiento mitocondrial y la respiración asociados con la síntesis de ATP. Por otro lado, los procesos fisiológicos asociados con una disminución en la demanda de energía y un aumento en su suministro (altos niveles de nutrientes, obesidad y diabetes tipo 2) están asociados con la fragmentación de las mitocondrias, la producción de calor o la disminución de la función mitocondrial.Los ciclos saludables de fisión y fusión son clave para la salud metabólica celular.
El ciclo normal de división y fusión mitocondrial es un elemento clave en su control de calidad. Por qué Durante la división mitocondrial, se forman dos hijas, una de las cuales tiene un mayor potencial de membrana y avanza más en el ciclo de división de fusión, y la otra, con una membrana más despolarizada, permanece separada hasta que se restablece el potencial de membrana. Si se restaura el potencial, se reúne con la red mitocondrial. Si permanece despolarizado, se elimina en el proceso de autofagia, que es la clave para la calidad del conjunto mitocondrial (Fig. 4).
La inhibición a largo plazo de la división mitocondrial (con hambre celular prolongada) conduce a la acumulación de mitocondrias dañadas, que no pueden segregarse [3, 4].
Por otro lado, un exceso de nutrientes conduce a la inhibición de la fusión mitocondrial, lo que conduce a la interrupción del ciclo dinámico mitocondrial, aumenta la heterogeneidad mitocondrial intracelular. Sí, con un exceso de alimentos, la fragmentación mitocondrial es protectora, pero la fragmentación prolongada, como la fusión prolongada, es perjudicial para el control de calidad mitocondrial. No hay eliminación selectiva; la masa mitocondrial disminuirá y consistirá en pequeñas mitocondrias despolarizadas.
 Fig. 4 Ciclo de vida de las mitocondrias y su regulación de la disponibilidad de nutrientes [de 3]
Fig. 4 Ciclo de vida de las mitocondrias y su regulación de la disponibilidad de nutrientes [de 3]Las mitofusinas no son solo proteínas
A nivel molecular, la fusión mitocondrial es un proceso de dos etapas que requiere una fusión coordinada de las membranas externa e interna durante eventos secuenciales separados. En los mamíferos, este proceso está regulado por tres proteínas que pertenecen a las GTPasas: Mfn1 y Mfn2 son necesarias para la fusión de la membrana externa y OPA1, para la fusión de la membrana interna. Se necesitan otras proteínas para la división, Fis1 y Drp1.
El papel de las proteínas mitofusina se ha estudiado en estudios de pérdida y ganancia de función. Los ratones mutantes para las proteínas mitofusina mueren ya a mediados de la gestación, porque la fusión mitocondrial se vuelve imposible para ellos. Las mitofusinas son importantes para los procesos de autofagia y mitofagia. La disminución de la expresión de Mfn2 en los cardiomiocitos bloquea el inicio del proceso de autofagia, porque la fusión de autofagosomas con lisosomas está bloqueada. El agotamiento de Mfn2 conduce a una disminución en el potencial de las membranas mitocondriales; para compensar, hay una disminución en la cadena respiratoria, aumenta la captación de glucosa y disminuye la síntesis de glucógeno. La célula cambia a la glucólisis anaeróbica, y este es el camino hacia la degeneración oncológica de la célula. La deficiencia de Mfn2 conduce a cambios neurodegenerativos. Un aumento en la expresión de Mfn2 en los músculos esqueléticos aumenta su sensibilidad a la insulina.
Mfn1 realiza funciones similares, pero probablemente en otros tejidos (la expresión de Mfn2 y Mfn1 varía en diferentes tejidos): Mfn1 se expresa más en el corazón, hígado, páncreas, testículos y Mfn2 en el corazón, el músculo esquelético, el cerebro y el tejido adiposo marrón. .
Por lo tanto, las mitofusinas son reguladores clave de la dinámica mitocondrial. La expresión de las mitofusinas es diferente en los diferentes órganos, proporcionan eficiencia de bioenergía y mecanismos de adaptación a la disponibilidad de nutrientes, y el "destino" de la célula depende de ellos. No es sorprendente que las proteínas de fusión mitocondrial sean objetivos potenciales para las intervenciones farmacológicas [2, 5].
Hipotálamo, mitocondrias, disfunción metabólica y envejecimiento.
La dinámica de las mitocondrias es importante en todas las células. En las células beta del páncreas, las mitocondrias son sensores de nutrientes y generadores de señales de síntesis de insulina, en los músculos, la dinámica mitocondrial es importante para la regulación del metabolismo de la glucosa, etc. Sin embargo, una persona no es solo una colección de diferentes tipos de células, cada una de las cuales toma decisiones independientes. Un organismo es un sistema que tiene un vínculo regulador central para mantener la homeostasis de la energía y la glucosa. Este regulador principal es el hipotálamo.
El hipotálamo se encuentra en el diencéfalo y es el que proporciona la interconexión de los sistemas reguladores nervioso y humoral. Las neuronas hipotalámicas perciben, procesan y responden a las señales del tejido adiposo (leptina), el páncreas (insulina) y otros estímulos hormonales (grelina, colecistoquinina, polipéptido pancreático, etc.). El hipotálamo controla la actividad del sistema endocrino humano debido al hecho de que sus neuronas son capaces de secretar transmisores neuroendocrinos que estimulan o inhiben la producción de hormonas por la glándula pituitaria. En otras palabras, el hipotálamo, cuya masa no supera el 5% del cerebro, es el centro de regulación de las funciones endocrinas y el mantenimiento de la homeostasis de todo el organismo.
Incluso Dilman (Dilman V. M "Gran reloj biológico") señaló el papel principal del hipotálamo en el desarrollo sistemático de la disfunción metabólica, que conduce a la obesidad, diabetes, enfermedades cardiovasculares, oncológicas y envejecimiento. Según la teoría de la hiperadaptosis formada por Dilman, la sensibilidad de los receptores hipotalámicos a las señales provenientes de los tejidos del cuerpo (leptina, insulina, etc.) disminuye gradualmente con la edad. Para provocar su "respuesta", se necesita más y más de una u otra hormona: más insulina, más leptina. Desarrolla resistencia a la insulina y leptina, enfermedades metabólicas que conducen al envejecimiento y la muerte.
Dependiendo de las funciones realizadas, los grupos de neuronas se combinan en los núcleos del hipotálamo. Uno de ellos: el núcleo arqueado (arqueado) es un regulador clave del comportamiento alimentario y el metabolismo. Se pueden formar neuropéptidos orexigénicos (estimulan el apetito) y anorexigénicos (suprimen el apetito), correspondientes a las neuronas AgRP y POMC, respectivamente. Las señales periféricas (insulina, grelina, leptina, etc.) afectan la expresión de péptidos que estimulan o suprimen el apetito, lo que garantiza la coherencia de la regulación central (Fig. 5).
 Fig. 5. Control hipotalámico del metabolismo energético. El cerebro integra señales metabólicas (leptina, insulina, grelina, PYY3-36) de tejidos periféricos como el páncreas, el tejido adiposo y el estómago. En el cerebro, las redes neuronales especializadas coordinan los cambios adaptativos en la absorción y el consumo de alimentos [de cada 5].
Fig. 5. Control hipotalámico del metabolismo energético. El cerebro integra señales metabólicas (leptina, insulina, grelina, PYY3-36) de tejidos periféricos como el páncreas, el tejido adiposo y el estómago. En el cerebro, las redes neuronales especializadas coordinan los cambios adaptativos en la absorción y el consumo de alimentos [de cada 5].Entonces, ¿quién y cómo regula la sensibilidad de las neuronas hipotalámicas?
Un estudio de la dinámica de las mitocondrias en los tejidos cerebrales mostró que la dinámica de las mitocondrias juega un papel importante en la capacidad de las neuronas hipotalámicas para controlar la homeostasis de la glucosa y la energía en el cuerpo [6,7,8].
En las neuronas AgRP (neuronas AgRP que promueven el hambre), que estimulan el apetito y regulan el aumento de peso, el hambre conduce a la división mitocondrial y la alimentación rica en grasas conduce a la fusión. Es decir, la respuesta de las mitocondrias es diferente de la de la mayoría de las otras células.
La fusión de MX en estas neuronas regula la actividad eléctrica en respuesta a una dieta rica en grasas, estimulando la producción de un péptido orexigénico (péptido AgRP), que es necesario para el aumento de peso y la deposición de grasa con un exceso de nutrientes. Las deleciones de Mfn1 y Mfn2 en estas neuronas resultaron en un menor aumento de peso en las ratas debido a los niveles más bajos de leptina circulante.
Las neuronas POMC (suprimen el apetito) tienen la función opuesta, y la dinámica de las mitocondrias en respuesta a la ingesta de nutrientes es diferente. Una disminución en la expresión de mitofusinas en estas neuronas conduce a una interrupción en la conexión de las mitocondrias con EPS y, como resultado, hiperfagia, resistencia a la leptina y obesidad. Al mismo tiempo, el consumo de alimentos aumentó y el consumo de energía disminuyó.
Por lo tanto, la respuesta del cuerpo a una dieta alta en grasas depende de los patrones de dinámica mitocondrial en las neuronas hipotalámicas. La remodelación de las mitocondrias en las neuronas proporciona su respuesta a la ingesta de nutrientes, estimula la producción de neuropéptidos que estimularán o suprimirán el apetito, afectando el metabolismo a nivel corporal (Fig. 6).
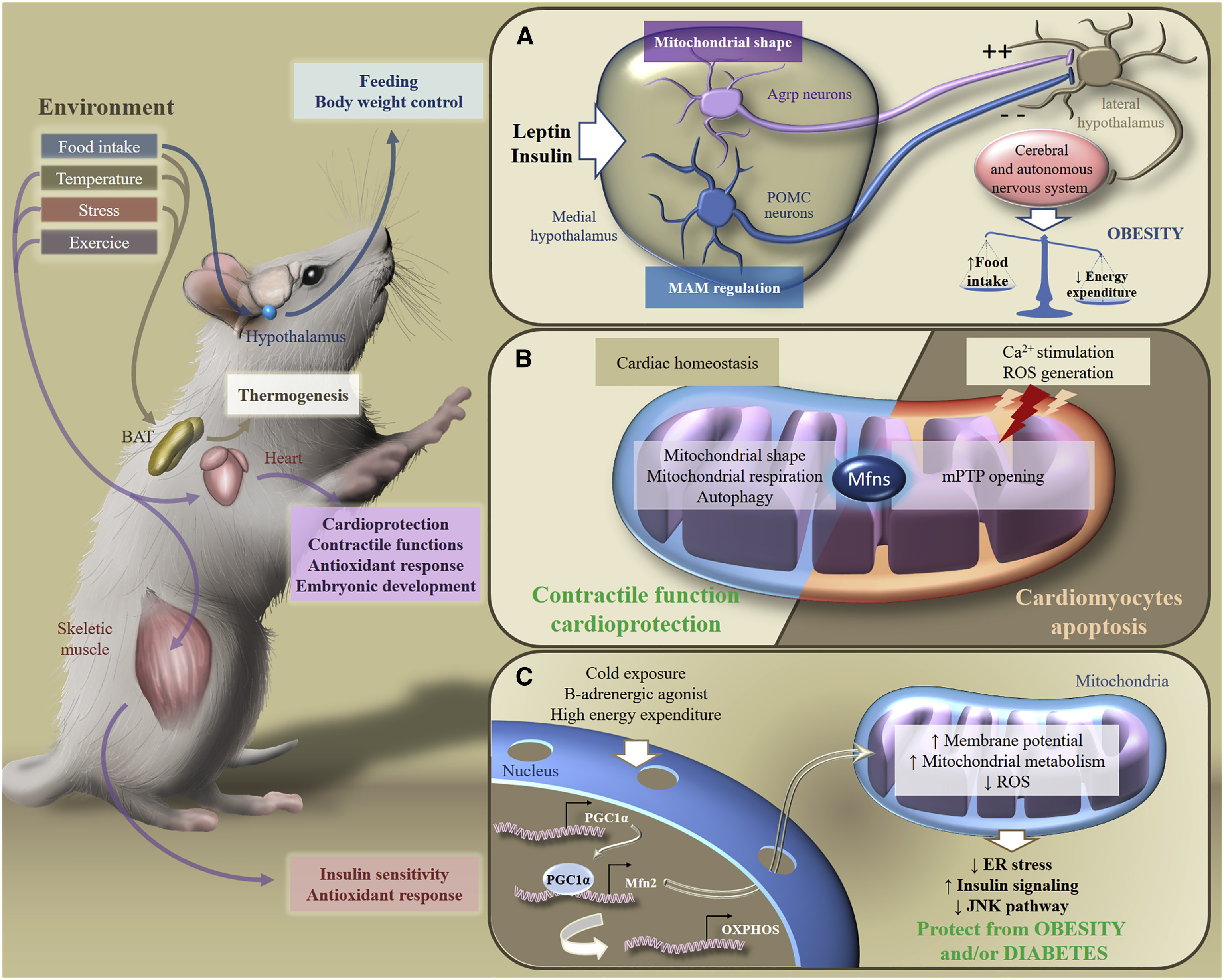 Fig.6. Adaptación metabólica a estímulos ambientales [de 2]
Fig.6. Adaptación metabólica a estímulos ambientales [de 2]En respuesta a los estímulos exógenos, las Mfns participan en la transducción de la señalización metabólica en varios órganos, lo que garantiza el mantenimiento de la homeostasis energética en todo el cuerpo. En particular, en respuesta a la ingesta de alimentos, los cambios de temperatura, el estrés o el ejercicio, el tejido adiposo marrón, el cerebro, el corazón o el músculo esquelético adaptan su metabolismo para controlar la nutrición, el peso corporal, la función contráctil, la respuesta antioxidante o la sensibilidad a la insulina.
¿Cómo influir en la dinámica de las mitocondrias?
1. Nutrición y ejercicioCiclos de nutrición El exceso de alimentos y una dieta alta en grasas (HFD) inhiben la fusión mitocondrial en las células (el mecanismo es diferente en algunas neuronas cerebrales). Un ciclo de fusión de fisión mitocondrial incompleto interrumpe los procesos de autofagia → aumenta la heterogeneidad mitocondrial intracelular → no hay eliminación selectiva de mitocondrias → se acumulan mitocondrias con disfunción.
La restricción calórica (ciclo de alimentación / ayuno) estimula la adaptación bioenergética, proporcionando mecanismos de calidad mitocondrial.
2. Membranas saludables: ácido esteárico, cardiolipina, ácido fosfatídico.Todos los procesos clave dependen de la "salud" de las membranas mitocondriales: autofagia, mitofagia, apoptosis, la relación de las mitocondrias con el retículo endoplásmico y la dinámica de las mitocondrias. Las membranas de los orgánulos celulares están compuestas de lípidos y proteínas. La remodelación de estas membranas se controla mediante interacciones entre lípidos y proteínas específicos.
Los ácidos grasos saturados incluyen palmítico (C16) y esteárico (C18). Se demostró que el uso de ácido esteárico (C18: 0) estimula el proceso de fusión mitocondrial. Su acción está asociada a un efecto sobre las mitofusinas. En ratones, los suplementos dietéticos de ácido esteárico pueden restaurar parcialmente la disfunción mitocondrial causada por mutaciones en los genes Pink1 o parkin. En los neutrófilos de las personas que han estado en una dieta baja en C18: 0 durante 2 días, las mitocondrias están en un estado fragmentado (50% de las células tenían MX fragmentado, 10% conectado con MX). El uso de ácido esteárico les llevó a fusionar las mitocondrias después de 3 horas [8]. Por lo tanto, el ácido estérico es importante para mantener la dinámica mitocondrial. La mayor parte del ácido esteárico se encuentra en los granos de cacao (31-34%).
Los fosfolípidos son los componentes principales de las membranas de orgánulos. También regulan la dinámica de las mitocondrias, y su efecto es diferente [9].
La cardiolipina (CL) estimula la división mitocondrial y la fusión de membranas internas.
La cardiolipina es necesaria para el funcionamiento del complejo IV (citrocromo C oxidasa) de la cadena de transporte de electrones. La cardiolipina se encuentra casi exclusivamente en la membrana interna de las mitocondrias. Con la edad, hay una disminución en la cantidad de cardiolipina. Existe la teoría de que la pérdida de la función de cardiolipina está asociada con el reemplazo de ácidos grasos saturados en su molécula con ácidos grasos poliinsaturados. Para resolver este problema, es necesario introducir grasas saturadas ricas en, en primer lugar, ácido graso esteárico en la dieta.
Para aumentar la eficiencia del suministro de ácidos grasos saturados a la membrana, se pueden utilizar transportadores. Por ejemplo, el uso de fosfatidilcolina saturada (dipalmitofosfatidilcolina y diseroilfosfatidilcolina), que podría suministrar FA saturados directamente a la cardiolipina [10]. La colina, como portadora, pasa fácilmente a través del citosol y entra a las mitocondrias.
El ácido fosfatídico (AR) inhibe la división mitocondrial y estimula la fusión de membranas externas (Fig. 7).
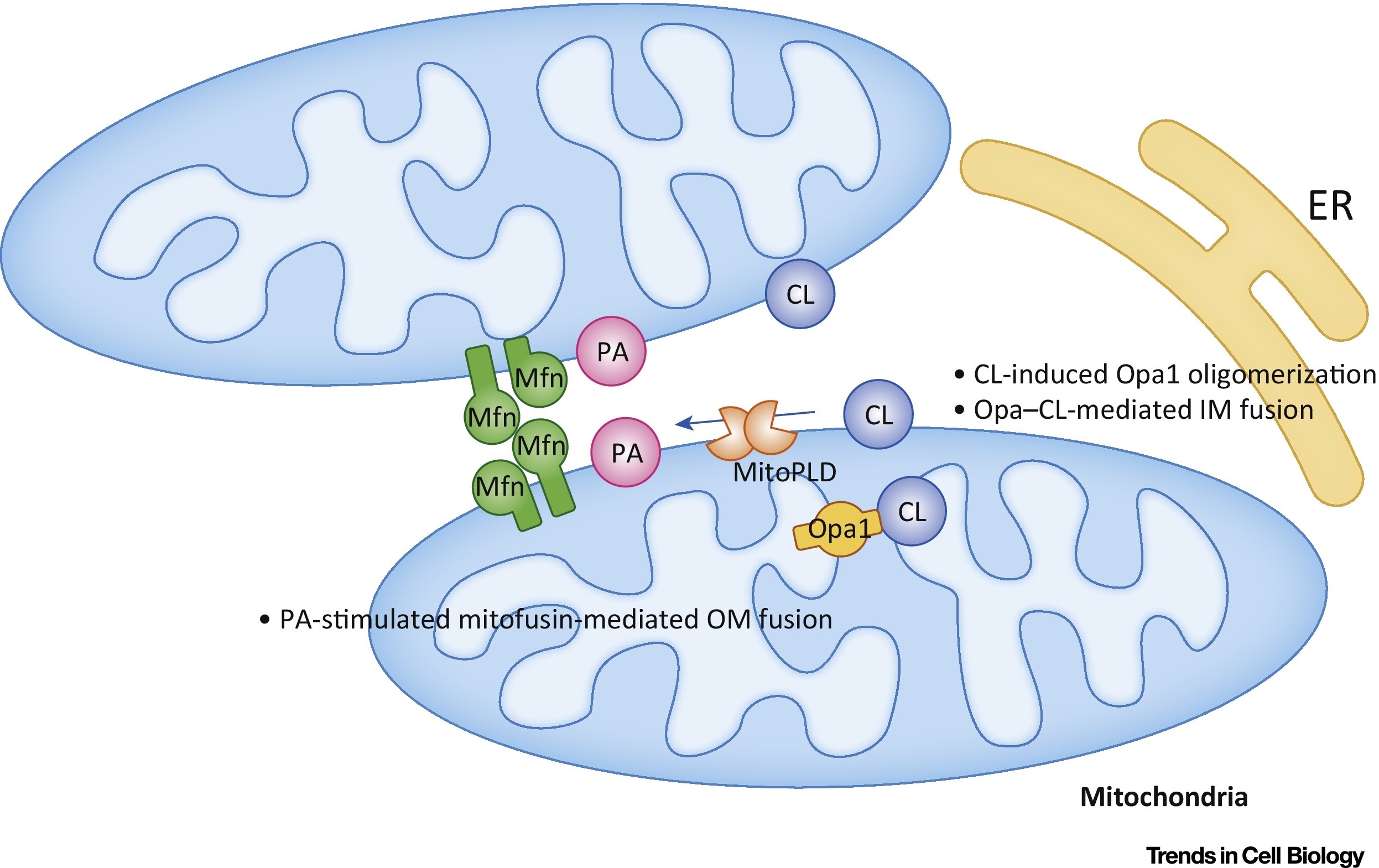 Fig. 7 Regulación de la fusión mitocondrial con ácido fosfatídico (PA) y cardiolipina (CL) [de un total de 9].
Fig. 7 Regulación de la fusión mitocondrial con ácido fosfatídico (PA) y cardiolipina (CL) [de un total de 9].En la membrana externa (OM), la AR estimula la fusión mediada por mitofusina (Mfn). En la membrana interna (IM), CL estimula la fusión mediada por Opa1. Abreviaturas: ER - retículo endoplásmico; MitoPLD, - fosfolipasa D localizada en mitocondrias.
3. Regulación de la expresión de mitofusinas (proteínas responsables de la dinámica de las mitocondrias)Todo lo que mencionamos anteriormente (restricción calórica, ácido esteárico, fosfolípidos) actúa al afectar la expresión de mitofusinas.Además, hay una serie de medicamentos que pueden afectar indirectamente la dinámica de las mitocondrias. Estos incluyen el uso de metformina.Lo más interesante es el uso de sustancias que pueden afectar directamente la expresión de mitofusinas. Una de las drogas potenciales llamada leflunomida (leflunomida), que fue aprobada por la FDA [5,11]. Es un inductor de la expresión de Mfn1 y Mfn2, y se ha registrado como medicamento para el tratamiento de la artritis reumatoide.Terapia génica mitocondrial
La dinámica mitocondrial deteriorada puede estar asociada con la expresión alterada de proteínas responsables de la fusión y división mitocondrial. Además, la disfunción de estas proteínas puede asociarse (y esto ocurre con mayor frecuencia) con sus mutaciones. Hay dos enfoques para considerar las interacciones causa-efecto de la disfunción de las mitocondrias.Anteriormente se creía que el estilo de vida, incluyendo comer en exceso, conduce a la formación de radicales libres, estrés oxidativo, mutaciones del genoma mitocondrial y, en consecuencia, disfunción de las mitocondrias. Sin embargo, recientemente hay evidencia convincente de que las mutaciones del ADN mitocondrial son inevitables, todas tienen mutaciones puntuales de ADN heteroplasmático y están asociadas con errores de replicación y no con daño oxidativo, para lo cual el ADN mitocondrial es bastante estable [12]. Ya en la etapa del óvulo fertilizado, algunas de nuestras mitocondrias portan mutaciones. Con el tiempo, se dividen, hay más mitocondrias mutantes, no pueden realizar su función normalmente.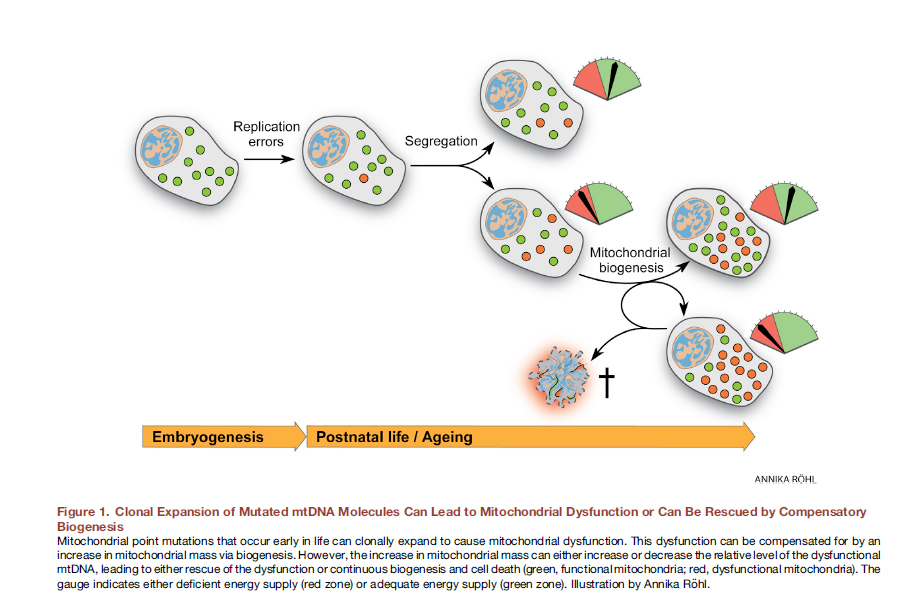 Fig. 8 La expansión clonal de las moléculas de ADNmt mutado puede conducir a la disfunción mitocondrial o puede "salvarse" mediante biogénesis compensatoria [de un total de 12].Aquí, in vivo, la edición del genoma mitocondrial podría ser muy útil. Se ha demostrado que para las mutaciones puntuales de ADN heteroplasmático en ratones, ya se ha logrado un éxito significativo con las nucleasas de dedo de zinc dirigidas (mtZFN) con el suministro mediante un vector adenoviral [13].
Fig. 8 La expansión clonal de las moléculas de ADNmt mutado puede conducir a la disfunción mitocondrial o puede "salvarse" mediante biogénesis compensatoria [de un total de 12].Aquí, in vivo, la edición del genoma mitocondrial podría ser muy útil. Se ha demostrado que para las mutaciones puntuales de ADN heteroplasmático en ratones, ya se ha logrado un éxito significativo con las nucleasas de dedo de zinc dirigidas (mtZFN) con el suministro mediante un vector adenoviral [13].Transferencia mitocondrial
Otro método prometedor para eliminar la disfunción mitocondrial es el trasplante mitocondrial. La esencia de este enfoque es "reemplazar" las mitocondrias dañadas con mitocondrias exógenas sanas. Este enfoque se utilizó por primera vez clínicamente en niños con isquemia miocárdica. Se utilizaron mitocondrias aisladas autólogas para el trasplante, que se aislaron con el músculo recto abdominal (se realizó una biopsia y luego se preparó la preparación), y luego se administraron mediante inyección directa [14]. Se están desarrollando varios enfoques para introducir las mitocondrias: inyección directa de mitocondrias aisladas (inyección local) e inyección sistémica en el torrente sanguíneo, cuando la mitocondria misma "busca" a qué célula ir. Grupos de investigadores están estudiando la posibilidad de un trasplante mitocondrial en la enfermedad de Parkinson, isquemia hepática, accidente cerebrovascular, enfermedades mitocondriales [15].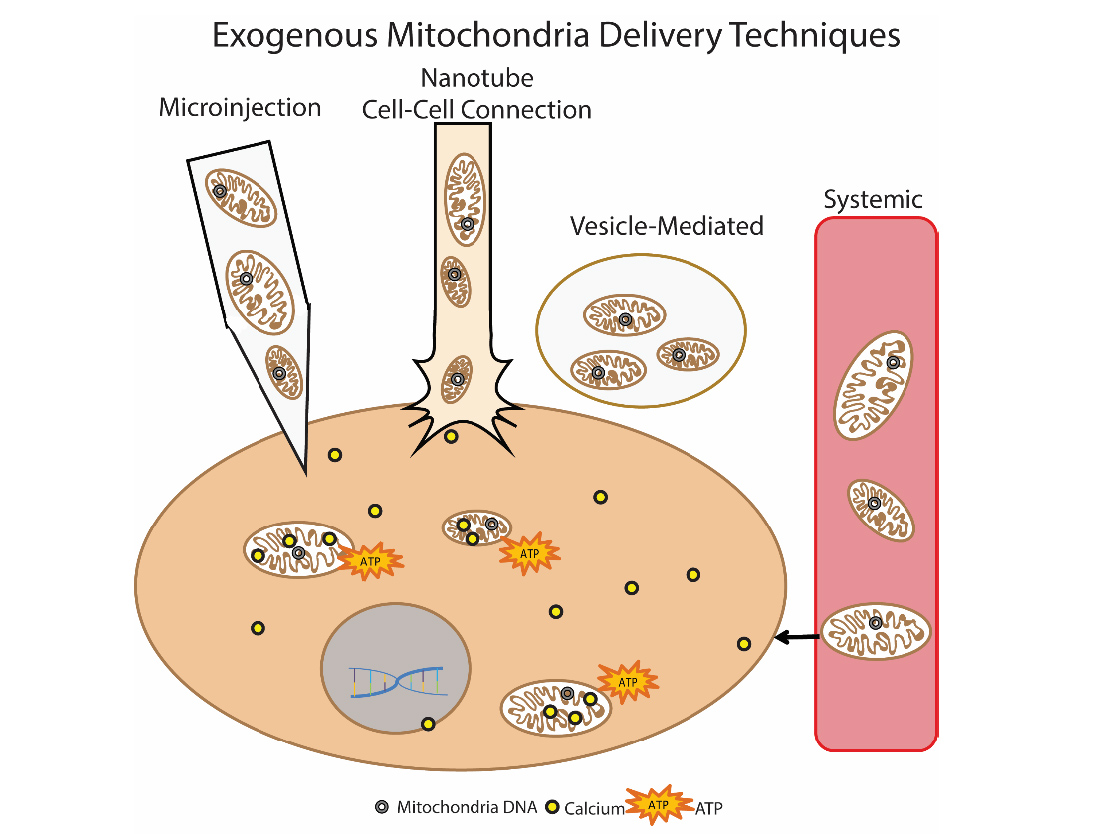 Fig. 9 Métodos para el suministro de mitocondrias exógenas a la célula.Autor Olga Borisova
Fig. 9 Métodos para el suministro de mitocondrias exógenas a la célula.Autor Olga BorisovaLiteratura1. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. «Mammalian mitochondria and aging: an update.» Cell metabolism 25.1 (2017): 57-71.
www.sciencedirect.com/science/article/pii/S15504131163050222. Schrepfer, Emilie, and Luca Scorrano. «Mitofusins, from mitochondria to metabolism.» Molecular cell 61.5 (2016): 683-694.
www.sciencedirect.com/science/article/pii/S1097276516001337#fig13. Marc Liesa, Orian Shirihai “Mitochondrial Dynamics in the Regulation of Nutrient Utilization and Energy Expenditure” Cell methabolism (2013): 491-506
www.sciencedirect.com/science/article/pii/S1550413113001046#fig34. Ramos, Eduardo Silva, Nils-Göran Larsson, and Arnaud Mourier. «Bioenergetic roles of mitochondrial fusion.» Biochimica et Biophysica Acta (BBA)-Bioenergetics 1857.8 (2016): 1277-1283.
www.sciencedirect.com/science/article/pii/S00052728163008585. Cunarro, Juan, et al. «Hypothalamic mitochondrial dysfunction as a target in obesity and metabolic disease.» Frontiers in endocrinology 9 (2018): 283.
www.frontiersin.org/articles/10.3389/fendo.2018.00283/full6. Marcelo O.Dietrich et al. «Mitochondrial Dynamics Controlled by Mitofusins Regulate Agrp Neuronal Activity and Diet-Induced Obesity”.
www.sciencedirect.com/science/article/pii/S0092867413010957#figs27. Steculorum, Sophie M., and Jens C. Brüning. „Sweet mitochondrial dynamics in VMH neurons.“ Cell metabolism 23.4 (2016): 577-579.
www.sciencedirect.com/science/article/pii/S15504131163011768. Senyilmaz-Tiebe, Deniz, et al. „Dietary stearic acid regulates mitochondria in vivo in humans.“ Nature communications 9.1 (2018): 3129.
www.nature.com/articles/s41467-018-05614-69. Kameoka, Shoichiro, et al. „Phosphatidic Acid and Cardiolipin Coordinate Mitochondrial Dynamics.“ Trends in cell biology (2017).
www.sciencedirect.com/science/article/pii/S096289241730158710.
raypeatforum.com/community/threads/mitolipin-liquid-saturated-phosphatidylcholine-pc-mix.1039811. Miret-Casals, Laia, et al. „Identification of new activators of mitochondrial fusion reveals a link between mitochondrial morphology and pyrimidine metabolism.“ Cell chemical biology25.3 (2018): 268-278.
12. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. „Mammalian mitochondria and aging: an update.“ Cell metabolism 25.1 (2017): 57-71.
13. Gammage et al. “Genome editing in mitochondria corrects a pathogenic mtDNA mutation in vivo” Nature medicine, 2017
www.nature.com/articles/s41591-018-0165-914. Emani, Sitaram M., et al. „Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury.“ The Journal of thoracic and cardiovascular surgery 154.1 (2017): 286-289.
www.jtcvs.org/article/S0022-5223 (17)30258-1/fulltext
15. McCully, James D., et al. „Mitochondrial transplantation: From animal models to clinical use in humans.“ Mitochondrion 34 (2017): 127-134.
www.sciencedirect.com/science/article/pii/S1567724917300053