Mecanismos de antienvejecimiento y vida útil más larga asociados con la restricción calórica: datos de estudios de animales genéticamente modificados.
Es bien sabido que la restricción calórica (RC) aumenta la esperanza de vida e inhibe diversos cambios fisiopatológicos. CR inhibe la señalización de la hormona del crecimiento / factor de crecimiento similar a la insulina y mTORC1, activa la sirtuina y mejora la regulación redox mitocondrial. Pero los mecanismos exactos están en discusión. En esta revisión, discutimos los mecanismos de RC utilizando datos de investigación en animales que se han modificado genéticamente de acuerdo con los avances recientes en tecnologías moleculares y genéticas, en términos de la hipótesis de respuesta adaptativa propuesta por Holliday en 1989. También explicaremos los efectos positivos de la RC, clasificados según si funcionan en condiciones nutricionales o en ayunas.
En 1935, CR se describió para aumentar la longevidad en ratas [1]. La CR, también conocida como restricción dietética o restricción energética, se usa ampliamente en la investigación sobre el envejecimiento como una manipulación dietética fuerte y fácilmente reproducible para extender la vida. Se ha observado RC en varias especies, desde levaduras y nematodos hasta mamíferos. En mamíferos, se estudió principalmente con roedores en los que la RC suprime varios cambios fisiopatológicos relacionados con la edad y prolonga la vida útil promedio y máxima. Sin embargo, los efectos beneficiosos de CR desaparecen en ciertas cepas y / o condiciones. Una revisión reciente detalla estas limitaciones [2]. El grado en que la RC ejerce efectos beneficiosos depende de factores como las especies de roedores, las cepas y el momento de aparición de la RC. Sin embargo, en general, la RC a largo plazo iniciada a una edad temprana suprime los cambios fisiopatológicos relacionados con la edad y prolonga la longevidad en diferentes roedores. También es importante que las limitaciones de los nutrientes individuales (por ejemplo, glucosa, lípidos, proteínas) sin restricción de energía no causen tales efectos beneficiosos [3, 4].
Hace más de 20 años, se descubrió que los ratones enanos Ames que tienen una mutación del gen Prop1 viven más que los ratones de tipo salvaje [5]. Este fue el primer informe de que una sola mutación genética o modificación genética puede extender la longevidad en los mamíferos. Hasta donde sabemos, más de 40 ratones y ratas con una sola mutación genética o modificación genética viven más que los animales de tipo salvaje. De estos ratones y ratas, aproximadamente un tercio muestra una señal de hormona de crecimiento (GH) / factor de crecimiento similar a la insulina 1 (IGF1) suprimida. Dado que CR también suprime la señalización de GH / IGF1, los efectos beneficiosos de CR pueden basarse en esto. Otros mecanismos moleculares que se han propuesto para regular los efectos beneficiosos de la RC incluyen la inhibición de la actividad del blanco mecanicista del complejo 1 de rapamicina (mTORC1), la activación de la autofagia, la activación del metabolismo de NAD + y sirtuina, y el aumento de la regulación redox de las mitocondrias [6, 7]. Sin embargo, estos mecanismos no se entienden completamente.
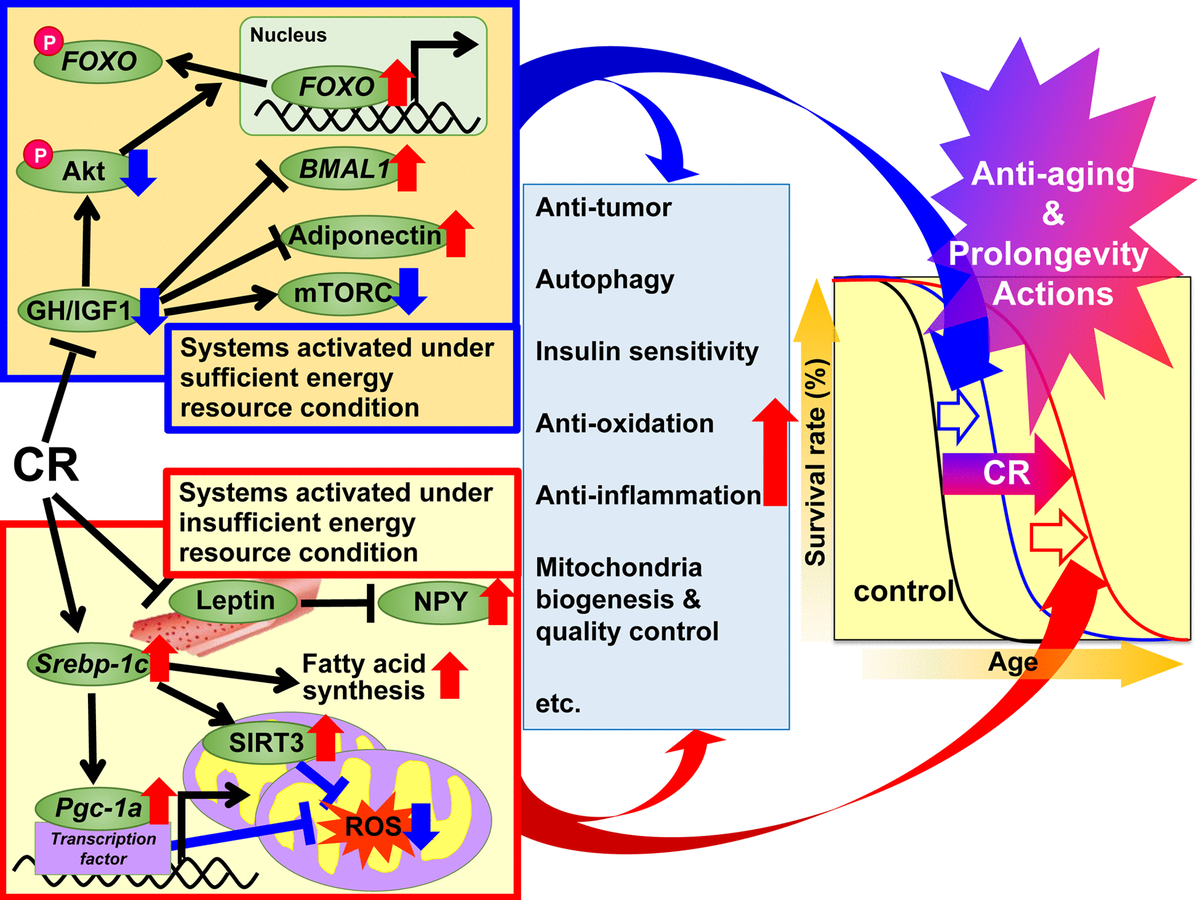 Fig.1. Los mecanismos de acción propuestos de la restricción calórica (RC) contra el envejecimiento y para aumentar la esperanza de vida en función de la hipótesis de respuesta adaptativa. Se propone que los mecanismos reguladores de RC se dividan en dos sistemas. El primer sistema se activa bajo condiciones de energía suficiente, cuando es posible usar energía libremente, y los animales crecen bien, se reproducen más y almacenan el exceso de energía en forma de triglicéridos (TG) en el tejido adiposo blanco (WAT) para su uso posterior. Este sistema incluye la hormona del crecimiento (GH) / factor de crecimiento similar a la insulina 1 (IGF1), Akt, FOXO, mTORC, adiponectina y BMAL1. El segundo sistema se activa en condiciones de energía insuficiente, cuando no hay beneficio del uso excesivo de energía, y los animales suprimen el crecimiento y la reproducción y usan la energía ahorrada para mantener la función biológica. Este sistema incluye tales vías de señalización: proteína SREBP-1c, sirtuina (SIRT), proteína PGC-1α, especies de oxígeno reactivo mitocondrial (ROS), leptina y neuropéptido Y (NPY). En animales con CR, estas señales son efectivas para uso de energía Además, varias señales y / o factores pueden contribuir a los efectos beneficiosos asociados con la RC, incluidas las acciones antioxidantes, antiinflamatorias, antitumorales y otras acciones de RC en diversos grados en cada tejido u órgano, y de ese modo conducir al rejuvenecimiento y la prolongación de la vida.
Fig.1. Los mecanismos de acción propuestos de la restricción calórica (RC) contra el envejecimiento y para aumentar la esperanza de vida en función de la hipótesis de respuesta adaptativa. Se propone que los mecanismos reguladores de RC se dividan en dos sistemas. El primer sistema se activa bajo condiciones de energía suficiente, cuando es posible usar energía libremente, y los animales crecen bien, se reproducen más y almacenan el exceso de energía en forma de triglicéridos (TG) en el tejido adiposo blanco (WAT) para su uso posterior. Este sistema incluye la hormona del crecimiento (GH) / factor de crecimiento similar a la insulina 1 (IGF1), Akt, FOXO, mTORC, adiponectina y BMAL1. El segundo sistema se activa en condiciones de energía insuficiente, cuando no hay beneficio del uso excesivo de energía, y los animales suprimen el crecimiento y la reproducción y usan la energía ahorrada para mantener la función biológica. Este sistema incluye tales vías de señalización: proteína SREBP-1c, sirtuina (SIRT), proteína PGC-1α, especies de oxígeno reactivo mitocondrial (ROS), leptina y neuropéptido Y (NPY). En animales con CR, estas señales son efectivas para uso de energía Además, varias señales y / o factores pueden contribuir a los efectos beneficiosos asociados con la RC, incluidas las acciones antioxidantes, antiinflamatorias, antitumorales y otras acciones de RC en diversos grados en cada tejido u órgano, y de ese modo conducir al rejuvenecimiento y la prolongación de la vida.Objetivos y mecanismos moleculares de la RC.
Señalización de GH, IGF1 y FOXO1
GH aumenta la producción de IGF1 predominantemente en el hígado a través del receptor de GH (GHR). IGF1 actúa sobre el receptor IGF1 y luego fosforila Akt, serina / treonina quinasa en las células diana. La forma fosforilada de Akt fosforila los factores de transcripción de FOXO, lo que facilita la exportación nuclear. Por lo tanto, la supresión de la señalización de GH / IGF1 transcripcionalmente aumenta la expresión de varios genes activados por factores de transcripción FOXO.
Varias especies de ratones modificados, enanos de Ames, enanos de Snell y nocaut de GHR (GHR KO), muestran señalización de GH suprimida y tienen una vida útil prolongada. Estos ratones enanos tienen fenotipos similares a los ratones CR, incluida la señalización suprimida de GH / IGF1, niveles reducidos de hormona tiroidea, insulina y glucosa, temperatura corporal más baja y obesidad reducida. Sin embargo, el perfil de expresión de los genes del hígado difiere significativamente entre los ratones GHR KO y los ratones CR [8]. También informamos que parte del perfil de expresión génica en el tejido adiposo blanco (WAT) de las ratas CR es significativamente diferente del de las ratas enanas de toda la vida que portan el transgén antisentido GH [9].
Bonkowski y col. informó que CR aumenta la sensibilidad a la insulina y aumenta la esperanza de vida en ratones de tipo salvaje, pero no en ratones GHR KO [10]. Por lo tanto, sugirieron que el efecto de aumentar la vida de CR depende de la supresión de la señalización de GH / IGF1. En ratones enanos y ratas enanas que portaban el transgén GH antisentido, CR aumentó aún más la esperanza de vida [11, 12]. Estos datos sugieren que las acciones antienvejecimiento y el aumento de la esperanza de vida de CR pueden regularse tanto independientemente de la señal GH / IGF1 como de forma independiente.
Los factores de transcripción FOXO en mamíferos consisten en cuatro isoformas, es decir, FOXO1, 3, 4 y 6. Los ratones FOXO1 KO (con un gen desactivado de este gen) tienen una vida CR extendida, pero no hubo efecto antitumoral asociado con CR [13]. Por el contrario, en ratones FOXO3 KO, la adición de CR inhibió la tumorigénesis, pero no hubo un aumento inducido por CR en la esperanza de vida [14]. Estas diferencias pueden estar asociadas con un patrón de activación diferencial en los tejidos y / o células de las cuatro isoformas de los factores de transcripción inducidos por CROX FOXO.
La proteína BMAL1 es un factor de transcripción involucrado en la regulación del ritmo circadiano. En los ratones BMAL1 KO (eliminados de este gen), la ingesta de alimentos aumentó, el peso corporal disminuyó y los fenotipos de envejecimiento se aceleraron. En estos mismos ratones, CR no redujo los niveles de insulina e IGF1 y no aumentó la esperanza de vida. Lo que indica la participación de BMAL1 en el efecto beneficioso de CR y que este efecto beneficioso depende de la transmisión de señales de GH / IGF1 [15].
Alarma mTOR
La mTOR quinasa, serina / treonina quinasa, se ha identificado como la molécula objetivo de la rapamicina. Forma dos complejos multiproteínas separados, conocidos como mTORC1 y mTORC2. Se sabe que MTORC1 se activa por aminoácidos y factores de crecimiento (por ejemplo, insulina e IGF1). La activación de mTORC1 promueve la síntesis de proteínas a través de la proteína quinasa ribosómica S6 1, la síntesis de ácidos grasos a través de la proteína de unión reguladora esteroidal (SREBP) 1 y la diferenciación de adipocitos por los receptores activados por el proliferador de peroxisomas (PPARγ). mTORC1 inhibe la autofagia y la biosíntesis lisosómica a través del factor de transcripción EB (TFEB). La función de mTORC2 es poco conocida, pero se cree que incluye un aumento de las acciones anabólicas y la supresión de las acciones catabólicas, como para mTORC1 [16].
Los ratones que recibieron una regulación negativa de mTORC1 rapamicina durante un período prolongado después de la mediana edad tuvieron un aumento en la esperanza de vida [17]. De acuerdo con este descubrimiento, los ratones transgénicos con sobreexpresión de la proteína TSC1, que regula negativamente mTORC1, viven más que los ratones de tipo salvaje [18]. Además, los ratones knock-out con proteína quinasa ribosómica S6 1 y ratones mutantes mTOR también vivieron más tiempo que los ratones de tipo salvaje [19, 20].
Hasta donde sabemos, los efectos beneficiosos de la RC aún no se han estudiado en ratones con función defectuosa de mTORC1. Sin embargo, en levaduras con inhibición genética, mTOR CR no aumentó la esperanza de vida [21]. La autofagia se ve reforzada por la inhibición de mTORC1. En los nematodos deficientes en genes asociados con la autofagia, la RC no aumentó la esperanza de vida [22]. Según estos datos, es probable que una disminución en la actividad de mTOR y la activación del aparato autofágico estén asociadas con un efecto positivo de la RC.
Sirtuins
Sir2 fue descubierto como un nuevo gen involucrado en la supresión de la transcripción en levaduras. Después de eso, se informó que juega un papel clave en la prolongación de la vida en RC [23, 24]. Se han identificado siete genes de ortólogos de sirtuina, sirtuinas Sirt1 - Sirt7, en mamíferos. Las proteínas SIRT1, 6 y 7 se localizan principalmente en el núcleo, SIRT2 en el núcleo y el citoplasma, y SIRT 3, 4 y 5 principalmente en las mitocondrias. Las sirtuinas catalizan las reacciones de desacetilación de diversas proteínas, incluidas las histonas, dependiendo de NAD [25].
Entre siete sirtuinas de mamíferos, se informa que SIRT1, 3 y 6 están involucradas en la fisiopatología relacionada con la edad y la regulación de la vida [26]. Los ratones transgénicos en los que la proteína SIRT1 se sobreexpresó selectivamente en neuronas hipotalámicas tuvieron una vida útil más larga que los ratones de tipo salvaje. [27] Los ratones hembra transgénicos en los que se sobreexpresó la proteína SIRT6 tuvieron una vida útil más larga que los ratones de tipo salvaje [28]. En ratones ancianos, CR aumentó la expresión de SIRT6 y mejoró la insuficiencia renal durante 6 meses. Además, mientras que la sobreexpresión de SIRT6 suprimió el envejecimiento celular al reducir la actividad del factor de transcripción relacionado con la inflamación NF-κB, la eliminación de SIKT6 aceleró el envejecimiento celular [29]. En ratones SIRT3 KO, anteriormente se observaron diversas patologías relacionadas con la edad [30]. Aunque CR previno la pérdida de audición relacionada con la edad en ratones de tipo salvaje, este efecto no se observó en ratones SIRT3 KO [31].
Factor de transcripción NRF2
NRF2 se une a elementos de la respuesta antioxidante para inducir la expresión de genes diana en respuesta al estrés oxidativo y mejora la expresión de genes implicados en las respuestas antioxidantes y de desintoxicación. En condiciones fisiológicas, NRF2 se une a la proteína Keap1 en el citoplasma, donde se degrada. Bajo estrés, incluido el estrés oxidativo, después de que Keap1 es capturado por p62 fosforilado, NRF2 se transloca al núcleo, se une a elementos de respuesta antioxidante y activa la transcripción de genes antioxidantes [32].
Dado que la expresión de NRF2 disminuye con el envejecimiento en roedores, se supone que aumentan los niveles de especies reactivas de oxígeno y diversos riesgos de cáncer. Sin embargo, CR suprime una disminución de la capacidad antioxidante relacionada con la edad al aumentar la expresión de genes implicados en la antioxidación y la desintoxicación. En los nematodos, Skn-1, un homólogo de NRF2, es indispensable para que la acción de CR aumente la vida útil. Los ratones knockout NRF2 muestran una disminución en la expresión de genes involucrados en la respuesta antioxidante y la desintoxicación, lo que resulta en una oncogénesis acelerada. Se ha investigado el papel de NRF2 en los efectos beneficiosos de CR utilizando ratones NRF2 KO. Los resultados mostraron que NRF2 es importante para el efecto antitumoral de la RC, pero no está involucrado en los efectos asociados con la esperanza de vida y el aumento de la sensibilidad a la insulina CR [33].
Neuropéptido Y (NPY)
En los mamíferos, las neuronas en el núcleo arqueado hipotalámico perciben el estado de energía de los niveles de circulación hormonal. El balance energético negativo asociado con CR y la posterior reducción en la masa grasa aumenta la circulación de los niveles de grelina y adiponectina y reduce los niveles de leptina, insulina e IGF1 en la sangre. Estos cambios hormonales activan las neuronas NPY en el núcleo arqueado hipotalámico. La mayoría de estas neuronas sintetizan la proteína Agrp, debilitando la actividad de las neuronas POMC en el núcleo arqueado. Un cambio en la actividad de las neuronas primarias inhibe las neuronas hipotalámicas secundarias que secretan somatotropina, gonadotropina y hormona liberadora de tirotropina, y activa las neuronas que secretan hormona liberadora de corticotropina. Este cambio hipotalámico suprime la señalización de GH / IGF1, la función tiroidea y la reproducción y activa la función de los glucocorticoides suprarrenales. La mayoría de estos perfiles de secreción neuronal alterados se observan en ratones y ratas con CR [34].
En ratones knockout NPY KO, la adición de CR no aumentó la esperanza de vida, indujo tolerancia al estrés oxidativo en el hígado y alteró el perfil de secreción neuronal. Sin embargo, CR disminuyó los niveles de insulina en sangre e IGF1, aumentó los niveles de adiponectina y corticosterona en sangre, y disminuyó la expresión de genes involucrados en la oxidación beta en el hígado. Por lo tanto, NPY debería ser un factor clave asociado con las acciones de RC independientes de GF / IGF1 [35].
Mutación de ADN mitocondrial (ADNmt)
Se cree que la acumulación de mutaciones de ADNmt es uno de los factores clave de patogénesis en enfermedades relacionadas con la edad. Los ratones PolgA D257A / D257A portan una mutación en la ADN polimerasa gamma de mtDNA y muestran un desarrollo anterior de la acumulación relacionada con la edad de mutaciones de mtDNA y fenotipos de edad en varios tejidos [36]. En ratones PolgA, D257A / D257A CR no extendió la vida útil, no afectó la acumulación de deleción de ADNmt en el músculo esquelético y no mejoró la función cardíaca, y esto contribuyó a la sarcopenia. Estos datos indican que la acumulación de mutaciones de ADNmt puede inhibir los efectos beneficiosos de la RC [37].
Nuestros nuevos resultados: remodelación CR del tejido adiposo
La obesidad visceral asociada con diabetes, hiperlipidemia e hipertensión, conocida colectivamente como "síndrome metabólico", es un factor de riesgo conocido para el desarrollo de enfermedades ateroscleróticas potencialmente mortales, que incluyen infarto de miocardio e infarto cerebral. El tejido adiposo, originalmente pensado solo para estar relacionado con la función energética, se ha descrito recientemente como un órgano endocrino que secreta varias moléculas biológicamente activas llamadas adipocinas. Los adipocitos grandes que acumulan triglicéridos (TG) aumentan excesivamente la secreción de adipocinas inflamatorias, incluido el factor de necrosis tumoral α (TNF-α) y la interleucina-6 (IL-6), y disminuyen la secreción de adiponectina en comparación con los adipocitos pequeños, que acumulan menos TG. Estos perfiles de secreción de adipocinas están directamente involucrados en patologías relacionadas con la edad, incluida la resistencia a la insulina, la hipertensión y la aterosclerosis [38]. Además, recientemente se ha informado que el tejido adiposo y las adipocinas son actores clave en la regulación de la vida útil. Por ejemplo, los ratones con inactivación del receptor de insulina en los adipocitos mostraron una disminución en la obesidad, un aumento en la biogénesis mitocondrial y una vida útil más larga que los ratones de tipo salvaje [39]. Los ratones transgénicos con sobreexpresión de adiponectina en el hígado mostraron una mayor supervivencia que el control [40]. Los factores de transcripción PPARγ y CCAAT / proteínas de unión al potenciador α (C / EBPα) y β (C / EBPβ) están implicados en la diferenciación de los adipocitos. Los ratones con descomposición del gen C / EBPβ en el locus C / EBP mostraron una biogénesis mitocondrial mejorada y una vida útil más larga [41]. En contraste, los ratones PPARγ KO noqueados tenían una vida útil más corta que los ratones de control [42].
Se ha informado que CR aumenta la forma activa de adiponectina en ratones de cualquier edad. Esta regulación de la adiponectina asociada a CR depende de la señalización de GH / IGF1 [43, 44]. Analizamos el cambio asociado a RC en orden cronológico y obtuvimos los siguientes resultados. CR aumentó la expresión de genes y / o proteínas involucradas en la biosíntesis de ácidos grasos (FA) y la biogénesis mitocondrial en el tejido adiposo después de una fase CR temprana. El cambio relacionado con la RC ocurrió más predominantemente en el tejido adiposo que en otros tejidos u órganos. Después de esto, se produjeron cambios morfológicos, incluida una disminución en el tamaño de los adipocitos y cambios metabólicos en el hígado [45]. Para aclarar los cambios en el tejido adiposo metabólico relacionados con CR que ocurrieron independientemente de la señal GH / IGF1, luego comparamos el perfil de expresión génica de CR en el tejido adiposo de ratas de tipo salvaje con ratas transgénicas administradas ad libitum (AL). Nuestros resultados mostraron que CR mejora la expresión de genes involucrados en la biosíntesis de ácidos grasos, en particular, en el principal factor de transcripción de la biosíntesis de ácidos grasos, genes reguladores SREBP-1, independientemente de GH / IGF1 [9].
Por lo tanto, luego comparamos el efecto de CR con varios parámetros, incluida la vida útil entre los ratones SREBP-1c KO noqueados y los ratones de tipo salvaje. Los ratones SREBP-1c KO tenían una vida útil ligeramente más corta que los ratones de tipo salvaje. En ratones de tipo salvaje con una vida útil prolongada, CR aumentó la expresión de proteínas involucradas en la biosíntesis de ácidos grasos y la biogénesis mitocondrial y suprimió el estrés oxidativo. La mayoría de estos cambios se observaron principalmente en el tejido adiposo, y no en otros tejidos. En contraste, la extensión de la vida asociada a CR y los cambios en el tejido adiposo no se observaron en ratones SREBP-1c KO. Se ha informado que la proteína PGC-1α es un regulador clave de la biogénesis mitocondrial inducida por CR [46]. Observamos que SREBP-1c se une al promotor del gen Pgc-1α, lo que sugiereque SREBP-1c regula directamente la transcripción de Pgc-1α [47]. Además, los resultados del análisis del proteoma del tejido adiposo mostraron que la CR activa el ciclo piruvato / malato [48]. De hecho, se ha informado que CR activa la biosíntesis de ácidos grasos de novo en el tejido adiposo, pero no en el hígado [45]. Estos datos indican que los ratones SREBP-1c KO no pueden usar grasas de manera eficiente en condiciones de RC. Por lo tanto, el tejido adiposo no solo puede funcionar como tejido para almacenar energía, sino que también puede desempeñar el papel de convertir la glucosa en un ácido graso más intensivo en energía a través de SREBP-1c en condiciones de RC.pero no en el hígado [45]. Estos datos indican que los ratones SREBP-1c KO no pueden usar grasas de manera eficiente en condiciones de RC. Por lo tanto, el tejido adiposo no solo puede funcionar como tejido para almacenar energía, sino que también puede desempeñar el papel de convertir la glucosa en un ácido graso más intensivo en energía a través de SREBP-1c en condiciones de RC.pero no en el hígado [45]. Estos datos indican que los ratones SREBP-1c KO no pueden usar grasas de manera eficiente en condiciones de RC. Por lo tanto, el tejido adiposo no solo puede funcionar como tejido para almacenar energía, sino que también puede desempeñar el papel de convertir la glucosa en un ácido graso más intensivo en energía a través de SREBP-1c en condiciones de RC.CR
En 1989, Holliday explicó los efectos del antienvejecimiento y la esperanza de vida desde la RC desde el punto de vista evolutivo de los organismos que desarrollaron sistemas de respuesta adaptativa para maximizar la supervivencia durante los períodos de escasez de alimentos [49, 50]. Con base en este punto de vista evolutivo, dividimos las acciones beneficiosas de CR en dos sistemas; "Sistemas activados en condiciones suficientes de recursos energéticos" y "Sistemas que funcionan en condiciones insuficientes de recursos energéticos". El primero se activa in vivo, lo que proporciona a los animales el uso gratuito de energía al proporcionarles una nutrición abundante. En otras palabras, cuando hay mucha comida para el uso libre de energía, los animales crecen bien, se reproducen más y almacenan el exceso de energía como TG en el tejido adiposo para su uso posterior.pero no tanto que sean obesos. El segundo sistema se activa en el entorno natural, lo que no permite el uso gratuito de energía debido a la escasez de alimentos. En otras palabras, cuando no hay beneficio del uso gratuito de energía, los animales suprimen el crecimiento y la reproducción y usan la energía ahorrada del crecimiento y la reproducción para mantener la función biológica. La adaptación a los cambios ambientales naturales es una prioridad para la supervivencia animal.los animales inhiben el crecimiento y la reproducción y usan la energía ahorrada del crecimiento y la reproducción para mantener la función biológica. La adaptación a los cambios ambientales naturales es una prioridad para la supervivencia animal.los animales inhiben el crecimiento y la reproducción y usan la energía ahorrada del crecimiento y la reproducción para mantener la función biológica. La adaptación a los cambios ambientales naturales es una prioridad para la supervivencia animal.Con base en la hipótesis de respuesta adaptativa y los hallazgos recientes mencionados anteriormente, proponemos un conjunto de mecanismos para los efectos beneficiosos de la RC.Dado que las condiciones experimentales de CR pueden simular condiciones de energía insuficientes, planteamos la hipótesis de que CR suprime "sistemas activados en condiciones de energía suficiente" y activa "sistemas activados en condiciones de energía insuficientes" e induce aditivamente acciones antienvejecimiento y para aumentar la vida útil. El primer conjunto de sistemas incluye señales de GH / IGF1, FOXO, mTORC, adiponectina y BMAL1, y CR parece suprimir estas reacciones anabólicas. El segundo conjunto de sistemas incluye la señalización de SREBP-1c / mitocondrias, SIRT y NPY, y probablemente CR activa estas reacciones para el uso óptimo de recursos energéticos insuficientes. Además, diversas señales y / o factores pueden contribuir a los efectos antienvejecimiento y prolongación de la vida de la RC en diversos grados con antioxidantes, antiinflamatorios,antitumoral y otras acciones en diversos tejidos.Con respecto a los paradigmas de intervención dietética, no solo se aplicó RC, sino también restricción de energía intermitente (IER) y restricción de tiempo nutricional (TRF) [2]. IER generalmente incluye ayuno cada dos días o 2-3 días a la semana. El TRF, que es más popular en la investigación de la obesidad que la investigación en bioheronología, generalmente implica limitar el acceso a los alimentos (con alto contenido de grasa) durante varias horas al día. Los efectos beneficiosos causados por IER o TRF son parcialmente similares a los causados por CR. Sin embargo, hasta donde sabemos, ningún estudio ha utilizado planes de investigación rigurosos, incluidos los programas de nutrición, para comparar las tres intervenciones dietéticas. Por lo tanto, se pueden requerir estudios comparativos de RC, IER y TRF en el futuro.Perspectivas
Los estudios con monos muestran que los efectos beneficiosos de la RC también pueden ocurrir en humanos y otros mamíferos [51]. Los estudios actuales de RC se centran en dos temas, es decir, en la identificación de los mecanismos moleculares de CR, así como en el desarrollo de preparaciones miméticas de CR. Creemos que el desarrollo de nuevos fármacos que actúan como RC puede ser difícil sin comprender los mecanismos moleculares de la RC. Para desarrollar dichos medicamentos que sean aplicables a los humanos, se necesitan más estudios sobre los mecanismos moleculares de la RC, especialmente en los primates. En este informe, proponemos clasificar y discutir los mecanismos moleculares de los efectos beneficiosos de Cheka dependiendo de si funcionan en condiciones de recursos energéticos ricos o insuficientes. Otros estudios sobre los mecanismos moleculares de los beneficios de RC también deben tener en cuentala medida en que las señales / factores involucrados contribuyen a las acciones de CR antioxidantes, antiinflamatorios, antitumorales y de otro tipo en cada tejido u órgano, y de ese modo conducen al rejuvenecimiento y a una mayor esperanza de vida. Los estudios de animales genéticamente modificados que se centran en uno de los dos sistemas mencionados anteriormente muestran diferencias en el grado de efectos inducidos por CR en ratones de diferente origen y aquellos que comparan los efectos beneficiosos de CR con factores IER o TRF ayudarán a aclarar no solo los mecanismos moleculares adicionales de CR, pero también los relacionados con la esperanza de vida.y de ese modo conducir al rejuvenecimiento y aumentar la esperanza de vida. Los estudios de animales genéticamente modificados que se centran en uno de los dos sistemas mencionados anteriormente muestran diferencias en el grado de efectos inducidos por CR en ratones de diferente origen y aquellos que comparan los efectos beneficiosos de CR con factores IER o TRF ayudarán a aclarar no solo los mecanismos moleculares adicionales de CR, pero también los relacionados con la esperanza de vida.y de ese modo conducir al rejuvenecimiento y aumentar la esperanza de vida. Los estudios de animales genéticamente modificados que se centran en uno de los dos sistemas mencionados anteriormente muestran diferencias en el grado de efectos inducidos por CR en ratones de diferente origen y aquellos que comparan los efectos beneficiosos de CR con factores IER o TRF ayudarán a aclarar no solo los mecanismos moleculares adicionales de CR, pero también los relacionados con la esperanza de vida.que están relacionados con la esperanza de vida.que están relacionados con la esperanza de vida.: .
:
Hoshino S, Kobayashi M, Higami Y. Mechanisms of the anti-aging and prolongevity effects of caloric restriction: evidence from studies of genetically modified animals. Aging (Albany NY). 2018 Sep 16.