Las células senescentes (antiguas) hoy se llaman células en las que el ciclo celular se detiene bajo la influencia de varios factores (estrés o agotamiento del recurso de división). Como resultado, tales celdas no se dividen y no se actualizan.
La conferencia Cell Senescence in Cancer and Aging en la Universidad de Cambridge ofreció la siguiente definición de envejecimiento celular: “
El envejecimiento celular se refiere a la detención sostenida de la proliferación causada por varios factores desencadenantes moleculares, incluida la activación de oncogenes, así como las divisiones celulares excesivas. Además, las células senescentes se caracterizan por la secreción de una serie de reguladores del estroma y reguladores inflamatorios (los denominados "asociados con el envejecimiento del fenotipo del seróforo"), que afectan el funcionamiento de las células vecinas, incluidas las inmunocompetentes. Varios hechos convincentes indican que el envejecimiento celular es un mecanismo eficaz para suprimir el crecimiento tumoral. Al mismo tiempo, el envejecimiento celular puede contribuir al envejecimiento de los tejidos y de todo el organismo ".
Debido a varios mecanismos causales, se distinguen tres tipos de envejecimiento celular.
El primero a principios de los años 60 del siglo pasado se descubrió el envejecimiento celular replicativo. En el trabajo ya famoso, los gerontólogos estadounidenses L. Hayflick y P. Moorhead, en experimentos con fibroblastos humanos cultivados, establecieron que las células no se dividen indefinidamente y que existe un límite para la división celular (más tarde llamado límite o límite de Hayflick) [1]. Después de 10 años, el biólogo soviético Aleksey Olovnikov dio una explicación lógica de este fenómeno, vinculando el límite de las divisiones celulares con el acortamiento gradual de las secciones terminales de los telómeros de ADN. Esto se debe al hecho de que la enzima telomerasa, capaz de aumentar los telómeros después de su acortamiento, no es activa en la mayoría de las células somáticas. Después de que los telómeros se acortan a un nivel crítico, se produce una respuesta de daño en el ADN (DDR), como resultado de lo cual el ciclo celular se detiene y la célula se vuelve senescente. Se sabe que los factores externos que afectan negativamente la salud y la longevidad (obesidad, falta de ejercicio, estrés) también tienen un efecto negativo en el acortamiento de los telómeros [2]. Además, la aceleración de la reducción de la longitud de los telómeros se observa en pacientes con enfermedades neurodegenerativas, como la enfermedad de Alzheimer [3].
Para la mayoría de las células, se cree que el límite de Hayflick es de aproximadamente 50 divisiones, después de lo cual la célula deja de dividirse. Para distinguir el envejecimiento del cuerpo en su conjunto del envejecimiento celular, Hayflick y Moorhead introdujeron un término especial para la revolución científica, que se refiere al envejecimiento celular - senescencia (en contraste con el envejecimiento - envejecimiento).
Además del envejecimiento replicativo, el envejecimiento celular también puede ser causado por otros factores que inducen prematuramente el envejecimiento celular independientemente de la longitud de los telómeros. Estos factores constituyen el segundo y tercer tipo de envejecimiento celular.
Por lo tanto, la activación de oncogenes como RAS y RAF provoca el envejecimiento celular llamado senescencia celular inducida por oncogén (OIS). Esta forma de envejecimiento celular está asociada con la supresión tumoral. Los estudios genómicos comparativos de células con envejecimiento replicativo y OIS muestran que, aunque hay algunos cambios generales en la expresión génica entre estas dos especies en comparación con las células en proliferación, también hay diferencias significativas [4]. Se sabe que el daño en el ADN asociado con especies reactivas de oxígeno (ROS) juega un papel importante en los mecanismos del envejecimiento de OIS. ERK quinasa también participa activamente en la aparición de OIS, estimulando la degradación de proteínas necesarias para la progresión del ciclo celular. El papel de la respuesta al daño del ADN (DDR) en este tipo de envejecimiento celular no se ha aclarado. Se sabe que los oncogenes mutantes, como H-Ras G12V, tienen el potencial de activar las vías moleculares del envejecimiento celular asociadas con la p38 MAPK quinasa y el factor de transcripción NF-kB, independientemente del daño en el ADN. El gen Ras oncogénico también puede contribuir a la regulación positiva de p53 a través de p19ARF y al envejecimiento celular, independientemente del daño en el ADN. [5] Por lo tanto, la estimulación del envejecimiento celular OIS no se excluye incluso en ausencia de daño en el ADN.
Un tercer tipo de envejecimiento celular, también independiente de la longitud de los telómeros, es la senescencia prematura inducida por estrés (SIPS). Surge en respuesta a factores de estrés de diversa naturaleza: radiación ionizante y ultravioleta, un aumento en el nivel de ROS, fármacos quimioterapéuticos. A diferencia del envejecimiento de OIS, la aparición de SIPS depende completamente de la respuesta al daño del ADN (DDR). Fenotípicamente, SIPS y la senescencia celular replicativa son muy similares, pero pueden diferir en el nivel de expresión de proteínas. El papel de SIPS en el envejecimiento general del cuerpo no queda completamente claro: el aumento de la expresión de antioxidantes y la supresión de ROS, los principales factores en la aparición de SIPS, no condujeron a un aumento en la vida útil [6].
Los mecanismos moleculares para detener el ciclo celular en células senescentes se están estudiando activamente en la actualidad. Se sabe que el grado de daño en el ADN afecta el ciclo celular de diferentes maneras. Por lo tanto, el daño moderado al ADN puede inducir una detención temporal del crecimiento, el daño extenso al ADN causa la muerte celular programada, el daño persistente al ADN causa el envejecimiento celular. Los determinantes moleculares (los factores principales) que gobiernan la transición de la suspensión temporal del crecimiento a la detención irreversible del ciclo son complejos y aún no están completamente descritos. Se sabe que el daño en el ADN activa inicialmente la vía p53-p21, que detiene el ciclo celular. Luego, si el daño en el ADN no se repara, la célula entra en apoptosis o se vuelve senescente. En el segundo caso, la proteína p16 INK4a juega un papel clave, que regula la preservación a largo plazo de la detención del ciclo celular mediante la vía de señalización pRb-E2F (proteína de retinoblastoma, factor de transcripción pRb E2F) y cambios en la estructura de la cromatina [7].
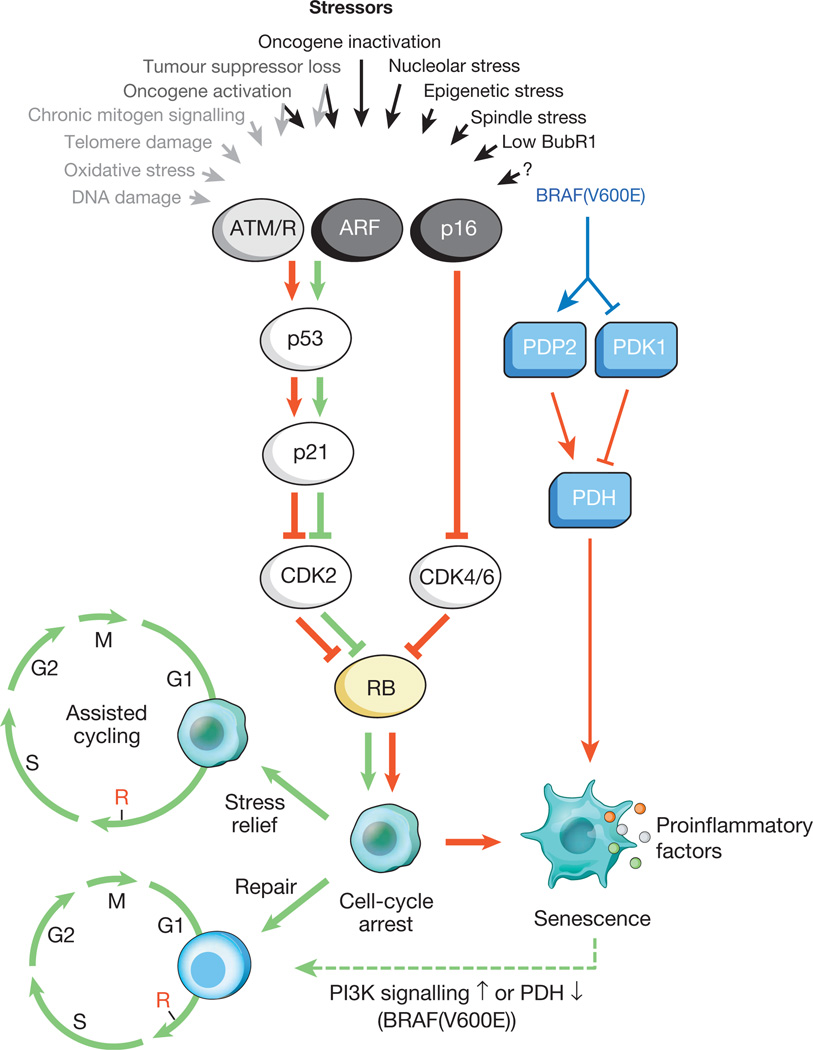
Fig.1.
Estímulos que causan el envejecimiento celular y las principales vías efectorasUna variedad de tensiones intracelulares y externas pueden activar el programa de envejecimiento celular. Estos factores estresantes capturan varias cascadas de señalización celular y, en última instancia, activan p53 y p16 INK4a. Los tipos de estrés que activan la señalización de p53 a través de DDR se indican mediante texto gris y flechas (ROS (ROS) causan una respuesta de daño de ADN (DDR), interrumpiendo la transcripción de genes y la replicación de ADN, así como acortando los telómeros). La p53 activada induce la p21, que causa la detención temporal del ciclo celular al inhibir la ciclina E-Cdk2. p16 INK4a también inhibe la progresión del ciclo celular, pero lo hace dirigiéndose a los complejos ciclina D-Cdk4 y ciclina D-Cdk6. Tanto p21 como p16 INK4a actúan para prevenir la inactivación de Rb, lo que conduce a la represión continua de los genes diana E2F necesarios para el inicio de la fase S. Con estrés severo (flechas rojas), las células bloqueadas temporalmente entran en la etapa de detención del ciclo celular. Las células susceptibles a daños menores pueden restaurarse con éxito y reanudar el ciclo normal. Por lo tanto, la vía p53-p21 puede antagonizar o sinergizar con p16 INK4a en la vejez dependiendo del tipo y nivel de estrés. BRAF (V600E) está asociado con el envejecimiento a través de la vía del efector metabólico. BRAF (V600E) activa la PDH induciendo PDP2 e inhibiendo la expresión de PDK1, promoviendo un cambio de la glucólisis a la fosforilación oxidativa, lo que causa el estrés redox de envejecimiento. Las células en proceso de envejecimiento inducen una transcripción inflamatoria independientemente del estrés inductor relacionado con el envejecimiento (los puntos coloreados representan varios factores SASP). Las flechas roja y verde, respectivamente, indican actividad que promueve el envejecimiento y el "antienvejecimiento". La flecha verde punteada indica el mecanismo de "cambio de envejecimiento".Se sabe que las células senescentes influyen activamente en su microambiente (los tejidos que las rodean), secretando una serie de moléculas activas: citocinas proinflamatorias, quimiocinas, factores de crecimiento, proteasas (un total de aproximadamente 40 tipos diferentes de moléculas). Estas sustancias se combinaron en un solo grupo: el fenotipo secretor asociado a la senescencia (SASP) asociado con el envejecimiento celular. Se sabe que los factores SASP participan activamente en la remodelación de tejidos en el desarrollo embrionario. Además, bajo su influencia, se reconstruyen tanto el cuerpo de la madre como el embrión. Se cree que la naturaleza evolutiva de SASP está asociada con una serie de mecanismos de defensa: supresión tumoral, recuperación del trauma y regeneración de tejidos.
El efecto fisiológico simplificado de SASP puede describirse como sigue. Las moléculas proinflamatorias secretadas forman un foco de inflamación alrededor de las células senescentes que se eliminarán. Lo que atrae a las células del sistema inmune a este lugar para eliminar las células envejecidas. Las metaloproteasas de matriz de matriz SASP (MMP-1, MMP-10, MMP-3) y las serina proteasas remodelan la matriz extracelular para facilitar la penetración de las células del sistema inmune en las células que envejecen. Y finalmente, los factores de crecimiento secretados estimulan la proliferación de células vecinas para reemplazar las células senescentes remotas.
Se describe cómo el mecanismo SASP debería funcionar normalmente, en un cuerpo joven y saludable. Pero con la edad y con las desviaciones, su efectividad puede disminuir significativamente, lo que provoca la acumulación de células senescentes en los tejidos y, como consecuencia, la secreción prolongada de factores proinflamatorios SASP. Que se acompaña de la aparición de focos de inflamación crónica. Además, se sabe que la actividad prolongada de SASP actúa como una infección en las células normales. Las moléculas activas secretadas por las células senescentes ingresan al espacio extracelular y, actuando sobre las células normales vecinas, inician la detención del ciclo celular y la detención de la proliferación. Lo que acelera en gran medida el desarrollo del envejecimiento celular en los tejidos.
Además, la secreción prolongada de factores SASP por el envejecimiento de las células se asocia con el desarrollo de patologías relacionadas con la edad. Por lo tanto, el aumento de la secreción de metaloproteasas de la matriz por las células senescentes estimula el desarrollo de enfermedades coronarias, osteoporosis y osteoartritis. Las células senescentes del músculo liso están involucradas en el desarrollo de la aterosclerosis, a través de la secreción de una gran cantidad de citocinas proinflamatorias. La secreción prolongada del factor proinflamatorio TNF-α por las células T senescentes está implicada en procesos asociados con la disfunción ósea. Además, se sabe que un aumento en el nivel de IL-6 proinflamatorio se asocia con resistencia a la insulina, diabetes, aterosclerosis y enfermedad hepática. Para referirnos a todos estos procesos asociados con la inflamación crónica sistémica y el envejecimiento, en los que los factores SASP juegan un papel clave, se introdujo un término especial: inflamatorio. Además, se ha descrito el doble papel de SASP en la carcinogénesis: su actividad supresora y promotora de tumores [8].
En relación con el doble papel del envejecimiento celular descrito anteriormente en jóvenes y viejos, algunos científicos consideran el envejecimiento celular como un ejemplo de pleiotropía antagonista evolutiva, que todavía se formula con humor con la frase "usar ahora - pagar después". Según esta teoría, los procesos que se han atrincherado en la evolución para aumentar la supervivencia de los organismos jóvenes pueden tener efectos nocivos acumulativos en las personas mayores. Por lo tanto, los mecanismos asociados con las células senescentes a una edad temprana están involucrados en el embarazo, la recuperación de lesiones y la protección contra los tumores. En una edad posterior, los mismos mecanismos causan inflamación sistémica, degeneración tisular y el desarrollo de patologías [9].
Entre el grupo de células corporales envejecidas, los autores del concepto SENS destacan dos tipos asociados con el tejido adiposo: preadipocitos y células de tejido adiposo visceral. Y esto no es una coincidencia, ya que hoy se sabe que la grasa visceral es metabólicamente activa y libera una serie de moléculas activas: las adipocinas. Los cuales, a su vez, están asociados con el desarrollo de una serie de patologías relacionadas con la edad (resistencia a la insulina, diabetes, enfermedades cardiovasculares). Los autores de SENS también se centran en el deterioro del sistema inmune relacionado con la edad. En su opinión, esto se debe a la sobrecarga del cuerpo por el envejecimiento de las células y, como respuesta, a la sobreproducción de T-killers que destruyen las células senescentes en detrimento de otros tipos de células inmunes. Lo que hace que un cuerpo envejecido sea vulnerable a diversas infecciones.
Los autores de SENS ven una solución al problema de la acumulación de células senescentes en dos direcciones. El primero es el desarrollo de medicamentos que son tóxicos para las células viejas, o que causan su apoptosis, pero que son inofensivos para las células sanas y normales. Y la segunda dirección es la búsqueda de estimulantes del sistema inmunitario para buscar selectivamente y matar las células objetivo que envejecen. Según los desarrolladores de SENS, la forma más probable de atacar selectivamente estas células anormales sería utilizar las moléculas distintivas que se encuentran en sus superficies. De hecho, los diferentes tipos de células tienen diferencias en sus superficies. Por lo tanto, el primer paso es la identificación y orientación de los marcadores de la superficie celular que son específicos de las células senescentes que se eliminarán. Esta estrategia no es abstracta, pero ya forma la base de algunos tratamientos contra el cáncer que bloquean el crecimiento celular y atraen a las células inmunes para destruirlas [10].
Los estudios han demostrado que las células senescentes en realidad se acumulan con la edad en varios tejidos [11]. También se describió que la eliminación de las células senescentes que se acumulan en un modelo de ratones que envejecen rápidamente evita la aparición de tres fenotipos principales de envejecimiento (cataratas, sarcopenia, pérdida de grasa subcutánea) [12]. En este sentido, es bastante obvio que existe la necesidad de identificar biomarcadores confiables y efectivos del envejecimiento celular. Los cuales son necesarios en primer lugar para rastrear los efectos de posibles fármacos senolíticos.
Muy a menudo, la beta-galactosidasa asociada a la senescencia, SA-β-Gal, se usa como un biomarcador de células senescentes. La enzima β-galactosidasa es una hidrolasa lisosómica que descompone la beta-galactosa terminal de los compuestos que la contienen (lactosa, sulfatos de queratina, esfingolípidos, etc.). En 1995, se describió que la expresión de SA-β-Gal aumentaba significativamente en las células senescentes. Se utiliza un método inmunohistoquímico para determinar su contenido en tejidos envejecidos. Como un método alternativo para determinar la actividad de SA-β-gal en las células, se usa citometría de flujo usando 5-dodecanoilaminofluoresceína di-β-D-galactopiranosido como sustrato.
Sin embargo, el uso de SA-β-Gal como biomarcador del envejecimiento celular tiene sus propias limitaciones, ya que esta enzima puede dar falsos positivos, aumentando la expresión no solo en las células envejecidas, sino también en las células "jóvenes", por lo que, por diversas razones, la proliferación es limitada. Por lo tanto, hoy se considera aconsejable utilizar SA-β-Gal junto con otros marcadores de envejecimiento celular.
En 2017, la citología israelí desarrolló una nueva tecnología más eficiente basada en la citometría de flujo utilizando el citómetro ImageStreamX. Este método permitió la detección de SA-β-Gal en tejidos con una eficiencia de más del 80%. Para aumentar la eficiencia del análisis, los científicos, junto con SA-β-Gal, determinaron varios biomarcadores más del envejecimiento celular: las proteínas HMGB1 y γH2AX. HMGB1 es una proteína del grupo de las proteínas nucleares no histonas HMG, en las células senescentes abandona el núcleo y se mueve hacia el espacio extracelular. γH2AX, la forma fosforilada de la histona H2AX, es un marcador reconocido para el daño temprano del ADN y el envejecimiento celular. Además, un nuevo método realizado por científicos israelíes hizo posible determinar el envejecimiento de las células por su mayor tamaño. Según los investigadores, su tecnología se puede utilizar para determinar rápidamente la efectividad de nuevos compuestos farmacéuticos que se diseñarán específicamente para eliminar las células envejecidas de los tejidos. [13]
Los focos de heterocromatina (SAHF) asociados con el envejecimiento celular también pueden ser otro biomarcador del envejecimiento. Las SAHF son estructuras especiales de heterocromatina que se forman en los núcleos de las células que envejecen. Su formación está asociada con la heterocromatinización irreversible asociada con la inactivación de los genes involucrados en el ciclo celular ubicado en este sitio (MCM3, PCNA, Ciclina A). Se puede ver SAHF bajo el microscopio después de la tinción con un tinte especial DAPI. Además, se ha descrito una mayor expresión de la proteína de leucemia promielocítica (PML) en las células senescentes, que también puede ser un marcador adicional del envejecimiento celular [14].
p16 INK4a - . p16 INK4a , . p16 INK4a , , . , p16 INK4a IL-6, . , p16 INK4a [15].
1..1. β- (senescence-associated beta-galactosidase, SA-β-Gal).
2. HMGB1 (high-mobility group protein B1).
3. γH2AX.
4. (SAHF).
5. (PML).
6. p16 INK4a.
: .
1. L.HayflickP.S.Moorhead. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961 Dec;25:585-621.
2. Epel ES, Blackburn EH, Lin J, Dhabhar FS, Adler NE, Morrow JD, Cawthon RM. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci US A. 2004 Dec 7;101(49):17312-5.
3. Panossian LA, Porter VR, Valenzuela HF, Zhu X, Reback E, Masterman D, Cummings JL, Effros RB. Telomere shortening in T cells correlates with Alzheimer's disease status. Envejecimiento de neurobiol. 2003 Jan-Feb;24(1):77-84.
4. Nelson DM1, McBryan T, Jeyapalan JC, Sedivy JM, Adams PD. A comparison of oncogene-induced senescence and replicative senescence: implications for tumor suppression and aging. Age (Dordr). 2014 Jun;36(3):9637.
5. Palmero I, Pantoja C, Serrano M. p19ARF links the tumour suppressor p53 to Ras. Nature. 1998 Sep 10; 395(6698):125-6.
6. Pérez VI1, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 2009 Feb;8(1):73-5.
7. Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003 Jun 13; 113(6):703-16.
8. .., .., .., .. « » : SASP ? Acta Naturae, 2018, 10(1). .4-15.
9. Shankar J. Chinta, Georgia Woods, Anand Rane, Marco Demaria, Judith Campisi, and Julie K Andersen. Cellular senescence and the aging brain. Exp Gerontol. 2015 Aug; 68: 3–7.
10. ApoptoSENS: Removing dysfunctional cells.
11. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev. 2007 Jan;128(1):36-44.
12. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232-6.
13. Anat Biran, Lior Zada, Paula Abou Karam, Ezra Vadai, Lior Roitman, Yossi Ovadya, Ziv Porat, and Valery Krizhanovsky. Quantitative identification of senescent cells in aging and disease. Aging Cell. 2017 Aug; 16(4): 661–671.
14. Bruno Bernardes de Jesus and Maria A. Blasco. Assessing Cell and Organ Senescence Biomarkers. Circ Res. 2012 Jun 22; 111(1): 97–109.
15. Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, Joseph G Ibrahim, Nancy E. Thomas, and Norman E. Sharpless. Expression of p16INK4a in peripheral blood T-cells is a biomarker of human aging. Aging Cell. 2009 Aug; 8(4): 439–448.