La historia de los biomarcadores epigenéticos comenzó en 2013. Luego, un pionero en esta dirección, un especialista en el campo de la genética y la bioestadística, un empleado de la Universidad de California en Los Ángeles, Steve Horvath, presentó su nuevo método revolucionario para determinar la edad biológica, llamado "reloj epigenético". Como su nombre lo indica, este método se basó en cambios en el epigenoma, es decir, la metilación del ADN.
La metilación del ADN es uno de los mecanismos epigenéticos de regulación de la expresión génica. Durante la metilación, el grupo metilo de las enzimas especiales CH3 se une a una de las bases de ADN, la citosina. Como resultado, se forma 5-metilcitosina y la expresión génica se desactiva, el proceso de transcripción se bloquea. Como saben hoy, la metilación del ADN es un proceso dinámico. Puede cambiar bajo la influencia de factores externos, está asociado con el desarrollo de una serie de patologías y puede ser heredado por varias generaciones futuras. La metilación juega un papel clave en la desactivación del ADN extraño, así como en los procesos de desarrollo y envejecimiento. Se describen los cambios relacionados con la edad en la metilación descritos como "deriva epigenética". Entonces, con la edad, se observan hipometilación (desmetilación) y la inestabilidad cromosómica asociada. Además, con el envejecimiento, también ocurre el proceso inverso: la hipermetilación de ciertas regiones promotoras, incluidos ciertos genes supresores de tumores, que se asocia con el desarrollo de patologías [1]. En general, hoy se cree que los cambios de metilación juegan un papel clave en el envejecimiento.
Basado en el hecho de que la edad cronológica se asocia con cambios predecibles en el epigenoma, hipo e hipermetilación en muchas regiones del genoma, se ha desarrollado la primera generación de biomarcadores de envejecimiento epigenético basados en la metilación del ADN. En 2011, el primer artículo de científicos de la Universidad de California, Los Ángeles, titulado "Predictor epigenético de la edad", mostró que la metilación del ADN tiene una relación clara con la edad. En 2013, Steve Horvat, utilizando una técnica de aprendizaje automático asistida por computadora, identificó 353 sitios de metilación que estaban altamente correlacionados con la edad cronológica de la persona, que formaron la base del primer "reloj epigenético" o "reloj croata" [2].
La importancia de este descubrimiento es difícil de sobreestimar. Hay que decir que la historia de éxito de S. Horvat está llena de drama no inventado. Según las memorias del propio Horvat, al principio no querían aceptar su artículo sobre un nuevo método epigenético para medir la edad en más de una de las revistas. Constantemente tenía que escuchar de los revisores la misma frase que "es demasiado bueno para ser verdad". Pero Horvath no se rindió y dedicó todo su tiempo a finalizar el nuevo método: "Escribí en cada tiempo libre, como si fuera la última vez que completara mi artículo". Justo antes de completar el trabajo en la familia croata, ocurrió un desastre: su hija recién nacida murió. Pero esto no perturbó al obstinado científico. La última edición de su artículo fue nuevamente rechazada por Genome Biology. Y después de recibir otro comentario crítico de los revisores, Horvath, en sus recuerdos, hizo tres cosas que no deberían hacerse: “Después de leer los comentarios de los revisores, pasé los siguientes 10 minutos haciendo tres cosas que nunca deberían hacerse. Primero, fui al refrigerador y bebí tres botellas de cerveza tan rápido como pude. En segundo lugar, volví a la computadora y le escribí una carta al editor. En tercer lugar, lo envié ". Y esta vez, la fortuna le sonrió, su artículo fue aceptado.

¿Cómo puede ser útil un "reloj epigenético"? Según el autor del descubrimiento, este método puede desempeñar un papel importante en la evaluación de la efectividad de las intervenciones contra el envejecimiento, ya que puede reducir significativamente el período de espera para obtener resultados. Además, se supone que los sitios de metilación identificados por Croacia no son solo marcadores, sino también participantes activos en el envejecimiento (al menos algunos). Lo que les da a los investigadores un objetivo terapéutico potencial en la lucha contra el envejecimiento y las patologías relacionadas con la edad. Además, este nuevo método puede ser útil en procedimientos penales, cuando se requieren muestras de edad de muestras de tejido. Pero, por supuesto, el "reloj epigenético" adquirió la mayor importancia posterior en la predicción de enfermedades y el aumento del riesgo de mortalidad.
Al final resultó que, el "reloj epigenético" mostró un valor de "cero" en el tallo embrionario e indujo células pluripotentes, espermatozoides, óvulos y células de placenta. Y durante los primeros 5 años de vida, un curso acelerado asociado con el desarrollo del cuerpo. A la edad de 21 años, el "reloj epigenético" se desaceleró gradualmente y luego pasó a una velocidad más o menos uniforme, cambiando su rendimiento bajo la influencia de factores externos. Además, resultó que diferentes tejidos envejecen a diferentes velocidades. El más susceptible a los procesos de envejecimiento fue el tejido mamario en las mujeres. Desde el punto de vista de la epigenética, el cerebro envejece más lentamente, mientras que las células sanguíneas y óseas muestran un envejecimiento ligeramente acelerado [3].
En el mismo 2013, científicos chinos y estadounidenses publicaron un artículo que presentaba otra versión del "reloj epigenético": "reloj Hannum". Gregory Hannum, un bioingeniero de la Universidad de California en la Universidad de California en San Diego, y sus colegas estudiaron perfiles de metilación de ADN de 450,000 dinucleótidos CpG de células sanguíneas de personas de 19 a 101 años, identificando 71 sitios de metilación más correlacionados con la edad [4]. La principal diferencia entre el "reloj Hannum" y el "reloj Horvat" es su especificidad: las muestras de ADN se toman de las células sanguíneas y no de ningún tejido, como el método croata.
Muy rápidamente, el valor principal del "reloj epigenético" se hizo evidente. La comparación de su progreso con la edad cronológica es de gran valor pronóstico para evaluar el riesgo de mortalidad por todas las causas y el desarrollo de muchas patologías. Si el "reloj epigenético" tiene prisa, hay enfermedades, envejecimiento acelerado y acortamiento de la vida. Si van más lento que la edad cronológica, hay buenas posibilidades de longevidad. Los estudios han demostrado que el "reloj epigenético" tiene una alta correlación con la mortalidad por todas las causas y enfermedades relacionadas con la edad.En 2015, Horvat y sus colegas realizaron estudios para determinar la relación entre el cáncer de pulmón y la edad epigenética. Después de analizar los datos de 2.029 personas, se descubrió que la aceleración de la edad epigenética estaba asociada con un mayor riesgo de cáncer de pulmón, y esta relación era más fuerte en los fumadores y las personas mayores de 70 años: "Los resultados mostraron que los indicadores estandarizados de la aceleración de la edad epigenética (IEAA) fueron asociado significativamente con la incidencia de cáncer de pulmón (HR: 1.50, P = 3.4 × 10 -3). Además, hemos demostrado que la asociación puede ser aún más fuerte entre las personas mayores (70 años o más) o aquellos que actualmente son fumadores. En general, nuestros resultados muestran que IEAA puede ser un biomarcador útil para evaluar la susceptibilidad al cáncer de pulmón desde el punto de vista del envejecimiento biológico ”[5].
En el mismo año, otro grupo de investigadores estableció la relación de la "edad epigenética" con el riesgo de muerte por todas las causas en personas mayores de 60 años. Para el análisis, tomamos datos de cuatro estudios (un total de 4658 personas), cuya edad promedio de los participantes fue de 79.1, 69.5, 66.3 y 72.9 años, respectivamente. La edad epigenética se determinó mediante dos métodos: el "reloj croata" (basado en 353 sitios de metilación CpG) y el "reloj Hannum" (basado en 71 sitios de metilación CpG). Ambos métodos mostraron una fuerte correlación entre sí, aunque los conjuntos básicos tenían coincidencias solo en sitios de 6 CpGs. Los resultados del estudio mostraron que la aceleración de la "edad epigenética" en comparación con la cronológica en 5 años aumentó el riesgo de mortalidad en las personas en un 16%. Los autores concluyeron: “Las tasas de envejecimiento acelerado derivadas de la metilación del ADN son factores heredados que predicen la mortalidad independientemente de la salud, el estilo de vida o los factores genéticos conocidos. Por lo tanto, se puede suponer que la edad prevista de la metilación del ADN es un "reloj epigenético" que mide la edad biológica que se une, pero no siempre en paralelo con la edad cronológica, y puede dar predicciones de la esperanza de vida "[6].
En 2016, los oncólogos alemanes realizaron un estudio que describe la relación entre el envejecimiento epigenético acelerado y la mortalidad por cáncer y enfermedades cardiovasculares y todas las demás causas. Para su trabajo, utilizaron el "reloj epigenético" de Horvath y Hannum. La edad de metilación del ADN se evaluó en una cohorte de 1863 personas mayores que participaron en el estudio ESTHER con una edad promedio de 62.5 años. Los resultados mostraron que una edad epigenética mayor que la cronológica se asoció con una mayor mortalidad. Una aceleración de 5 años de la "edad epigenética" determinada por el método croata resultó en un aumento de la mortalidad en un 22% y en un 16% utilizando el método Hannum [7].
En 2016, un gran equipo internacional de investigadores dirigido por Steve Horvath realizó un metanálisis a gran escala en el que se examinaron datos de 13.089 personas de tres grupos raciales / étnicos: blancos, hispanos y afroamericanos. La edad epigenética aquí también fue determinada por dos métodos: el "reloj croata" y el "reloj Hannum". Este trabajo mostró que una aceleración del "reloj epigenético" en 1 año (en comparación con la edad cronológica) aumentó el riesgo de mortalidad por todas las causas al 4%. Además, también se observó el efecto contrario: la desaceleración de las "horas epigenéticas" condujo a un menor riesgo de mortalidad. Además, los investigadores registraron un fenómeno interesante: “Descubrimos que el 5 por ciento de las personas tienen un curso más rápido de edad biológica, lo que conduce a una vida útil más corta. El envejecimiento acelerado aumenta el riesgo de muerte de estas personas en un 50 por ciento a cualquier edad adulta ”[8, 9].
También se conocen varios factores externos que afectan el curso del "reloj epigenético". En 2017, Horvath y sus colegas describieron la relación de la dieta, el alcohol, la educación y el ejercicio con el transcurso del tiempo epigenético. Según los propios autores, su trabajo confirmó la verdad bien conocida: una dieta con verduras, pescado y carne magra, consumo moderado de alcohol, actividad física y educación ralentizan el curso del tiempo epigenético y contribuyen a prolongar la vida. Los niveles elevados de insulina y glucosa, proteínas C-reactivas y triglicéridos, así como el exceso de peso corporal y la presión arterial alta aceleraron el envejecimiento del epigenoma. En el mismo estudio, los científicos no encontraron un efecto positivo del fármaco antidebásico metformina en el transcurso del tiempo epigenético [10]. En el mismo año, los investigadores finlandeses demostraron una vez más la relación de la obesidad con el envejecimiento epigenético acelerado [11]
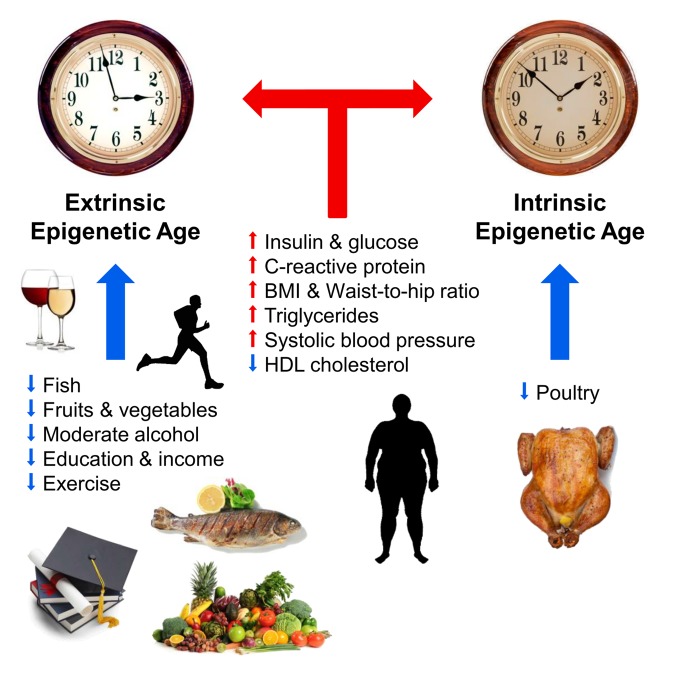
Fig. 1
Factores que afectan la edad epigenética (de [10]).
Las flechas azules y rojas indican factores que ralentizan y aceleran el envejecimiento, respectivamente. El reloj simboliza el reloj epigenético externo (reloj epigenético extrínseco, una versión extendida del método Hannum) y el reloj epigenético interno (reloj epigenético intrínseco, reloj croata). Efectos positivos en el curso del tiempo epigenético (ralentización): pescado, aves, verduras y frutas, lipoproteínas de alta densidad, alcohol moderado, formación y actividad física. Afecta negativamente el curso del tiempo epigenético (acelerar): niveles elevados de insulina, glucosa, proteína C reactiva, triglicéridos, presión arterial alta, aumento de peso corporal y una proporción incorrecta de cintura y caderas.Varios equipos de investigación han llevado a cabo trabajos que describen la relación entre el curso del tiempo epigenético y las funciones físicas y cognitivas, los síndromes de Down y Werner, la infección por VIH, la enfermedad de Alzheimer y la menopausia [12-17]. Una clara relación entre la longevidad y la desaceleración del "reloj epigenético" también se demostró utilizando el ejemplo de centenarios italianos de 100 años [18]. Durante mucho tiempo, Steve Horvath no pudo usar su método para predecir el curso acelerado de la edad biológica durante la progeria Hutchinson-Guildford. Pero este año este problema se resolvió: él y sus colegas crearon "relojes epigenéticos" especiales basados en fibroblastos, que consisten en 391 sitios CpG, llamados "relojes de piel-sangre" [19].
El siguiente paso en el trabajo de S. Horvat fue el desarrollo de un biomarcador más eficaz del envejecimiento, con capacidades de diagnóstico mejoradas que predicen el riesgo de mortalidad por diversas causas y el desarrollo de enfermedades relacionadas con la edad. El inconveniente de los "relojes epigenéticos" anteriores, según Horvath, era que el uso de la edad cronológica como estándar para determinar las desviaciones de edad puede excluir los sitios CpG cuyos perfiles de metilación no muestran cambios fuertes y dependientes del tiempo. En cambio, muestran solo la discrepancia entre la edad biológica y la cronológica. Por lo tanto, es importante no solo capturar CpG que muestran la diferencia con el tiempo cronológico, sino también aquellos que muestran diferencias en el riesgo y el estado fisiológico entre personas de la misma edad cronológica. En 2018, un nuevo biomarcador llamado DNAm PhenoAge, fue creado
En la primera etapa, el equipo de S. Horvath analizó en una gran muestra de personas, 9926 personas, participantes en el estudio NHANES III, la relación de 42 biomarcadores clínicos y la edad cronológica con el riesgo de mortalidad. Como resultado, se determinaron 9 biomarcadores para predecir la edad fenotípica:
1. Albúmina
2. Creatinina
3. Glucosa
4. Proteína C reactiva
5. Porcentaje de linfocitos
6. El volumen promedio de glóbulos rojos
7. El ancho de la distribución de los glóbulos rojos.
8. Conteo de glóbulos blancos
9. Fosfatasa alcalina.Luego validaron los biomarcadores seleccionados, verificaron su modelo de edad fenotípica en otra muestra de personas (6209 personas). La verificación mostró una correlación entre el aumento de la edad fenotípica y el mayor riesgo de mortalidad por todas las causas: un aumento de un año en la edad fenotípica se asoció con un aumento del 9% en el riesgo de mortalidad por todas las causas, un aumento del 9% en el riesgo de mortalidad por enfermedades relacionadas con el envejecimiento, un aumento del 10% en el riesgo de mortalidad por enfermedades cardíacas enfermedad vascular, un aumento del 7% en el riesgo de muerte por cáncer, un aumento del 20% en el riesgo de muerte por diabetes y un aumento del 9% en el riesgo de muerte por enfermedades respiratorias.
En la segunda etapa del estudio, los autores asociaron la metilación del ADN con la edad fenotípica. Los científicos han identificado qué sitios de GpC metilados están asociados con estos 9 biomarcadores clínicos que predicen la edad fenotípica. Identificaron 513 CpG de dichos sitios que predijeron la edad fenotípica. Un nuevo marcador epigenético se denominó DNAm PhenoAge. La prueba mostró una precisión bastante alta del nuevo biomarcador: entre 1998 y 2007, el cambio promedio en DNAm PhenoAge fue de 8,51 años, mientras que el cambio promedio en la edad fenotípica clínica fue de 8,88 años.
Después de eso, los investigadores probaron su nuevo marcador biomarcador utilizando datos de 4 grandes estudios, Women's Health Initiative (n = 4207), Framingham Heart Study (n = 2553), Normative Aging Study (n = 657) y Jackson Heart Study (n = 1747). Los resultados mostraron que DNAm PhenoAge se asoció significativamente con un riesgo de mortalidad posterior en todos los estudios (independientemente de la edad cronológica): un aumento de un año en DNAm PhenoAge se asoció con un aumento del riesgo de mortalidad por todas las causas en un 4,5%.
El análisis genético de DNAm PhenoAge mostró que los 513 sitios CpG utilizados en él tienen 41 CpG idénticos al reloj croata y 6 CpG idénticos al reloj Hannum. Se encontraron cinco CpG idénticos en los tres métodos epigenéticos. 149 CpG de DNAm PhenoAge se encuentran en grupos de dinucleótidos CpG (islas CpG).
Todos los datos obtenidos durante el estudio de Steve Horvath y su equipo mostraron que el nuevo biomarcador tiene un gran valor predictivo para determinar los riesgos de enfermedades relacionadas con la edad y el riesgo de mortalidad.
" , , DNAm PhenoAge, , , , , . , . , , / , . , "[20].Autor: Alexey Rzheshevsky.Referencias- Vayserman A.M., Voitenko V.P., Mekhova L.V. Epidemiología epigenética de enfermedades relacionadas con la edad. Ontogenesis 2011.42, 1–21;
- Horvath S. Edad de metilación del ADN de tejidos humanos y tipos de células. Genome Biol. 2013.14, R115.
- Josh Mitteldorf. Reloj de envejecimiento de metilación: una actualización. 14 de febrero de 2018.
- Hannum, G; Guinney, J; Zhao, L; Zhang, L; Hughes, G; Sadda, S; Klotzle, B; Bibikova, M; Fan, JB; Gao, Y; Deconde, R; Chen, M; Rajapakse, I; Friend, S; Ideker, T; Zhang, K (2013). Genome-wide methylation profiles reveal quantitative views of human aging rates. Mol Cell. 49: 359–367.
- Morgan E. Levine, H. Dean Hosgood, Brian Chen, Devin Absher, Themistocles Assimes and Steve Horvath. DNA methylation age of blood predicts future onset of lung cancer in the women's health initiative. Aging (Albany NY). 2015 Sep; 7(9): 690–700.
- Riccardo E Marioni, Sonia Shah, et al. DNA methylation age of blood predicts all-cause mortality in later life. Genome Biol. 2015; 16(1): 25.
- Laura Perna, Yan Zhang, Ute Mons, Bernd Holleczek, Kai-Uwe Saum, and Hermann Brenner. Epigenetic age acceleration predicts cancer, cardiovascular, and all-cause mortality in a German case cohort. Clin Epigenetics. 2016; 8: 64.
- Brian H. Chen, Riccardo E. Marioni et al. DNA methylation-based measures of biological age: meta-analysis predicting time to death Aging (Albany NY). 2016 Sep; 8(9): 1844–1859.
- Epigenetic clock predicts life expectancy. ScienceDaily. 28 September 2016.
- Quach A1, Levine ME1 et al. Epigenetic clock analysis of diet, exercise, education, and lifestyle factors. Aging (Albany NY). 2017 Feb 14;9(2):419-446.
- Nevalainen T, Kananen L, Marttila S, Jylhävä J, Mononen N, Kähönen M, Raitakari OT, Hervonen A, Jylhä M, Lehtimäki T, Hurme M. Obesity accelerates epigenetic aging in middle-aged but not in elderly individuals. Clin Epigenetics. 2017 Feb 14;9:20.
- Marioni RE, Shah S, McRae AF, Ritchie SJ, Muniz-Terrera G, Harris SE, Gibson J, Redmond P, Cox SR, Pattie A, Corley J, Taylor A, Murphy L, et al.. The epigenetic clock is correlated with physical and cognitive fitness in the Lothian Birth Cohort 1936. Int J Epidemiol. 2015; 44:1388–96.
- Horvath S, Garagnani P, Bacalini MG, Pirazzini C, Salvioli S, Gentilini D, Di Blasio AM, Giuliani C, Tung S, Vinters HV, Franceschi C. Accelerated epigenetic aging in Down syndrome. Aging Cell. 2015; 14:491–95.
- Horvath S, Levine AJ. HIV-1 Infection Accelerates Age According to the Epigenetic Clock. J Infect Dis. 2015; 212:1563–73.
- Maierhofer A, Flunkert J, Oshima J, Martin GM, Haaf T, Horvath S. Accelerated epigenetic aging in Werner syndrome. Aging (Albany NY). 2017; 9:1143–52.
- Levine ME, Lu AT, Bennett DA, Horvath S. Epigenetic age of the pre-frontal cortex is associated with neuritic plaques, amyloid load, and Alzheimer's disease related cognitive functioning. Aging (Albany NY). 2015; 7:1198–211
- Levine ME, Lu AT, Chen BH, Hernandez DG, Singleton AB, Ferrucci L, Bandinelli S, Salfati E, Manson JE, Quach A, Kusters CD, Kuh D, Wong A, et al.. Menopause accelerates biological aging. Proc Natl Acad Sci USA. 2016; 113:9327–32.
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, Mari D, Arosio B, Monti D, Passarino G, De Rango F, D'Aquila P, Giuliani C, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (Albany NY). 2015; 7:1159–70.
- Steve Horvath, Junko Oshima et al. Epigenetic clock for skin and blood cells applied to Hutchinson Gilford Progeria Syndrome and ex vivo studies. Aging. Volume 10, Issue 7, pp 1758—75.
- 20. Morgan E. Levine, Ake T. Lu, et al. An epigenetic biomarker of aging for lifespan and healthspan. Aging (Albany NY). 2018 Apr; 10(4): 573–591.