A mediados de 2018, se
publicó el
trabajo sobre la electrofisiología del cerebro de las ratas, junto con el cual se puso a disposición del público un
conjunto de datos único . El conjunto de datos es único en el sentido de que contiene grabaciones simultáneas del potencial de campo local utilizando un nuevo electrodo (sonda o sonda)
Neuropixels de alta densidad y un electrodo de parche de una celda ubicada cerca de la muestra. El interés en tales grabaciones no solo es fundamental, sino que también se aplica, porque le permite validar modelos para el análisis de la actividad neuronal registrada por las muestras modernas. Y esto, a su vez, se relaciona directamente con el desarrollo de nuevas neuroprótesis. ¿Cuál es la novedad fundamental y por qué este conjunto de datos es tan importante? Te lo diré debajo del corte.
 KDPV: el resultado de modelar el potencial extracelular cerca de una neurona durante la generación del potencial de acción ( fuente ). El color indica la amplitud del potencial. Esta ilustración será importante para una mayor comprensión.Los métodos electrofisiológicos para estudiar el
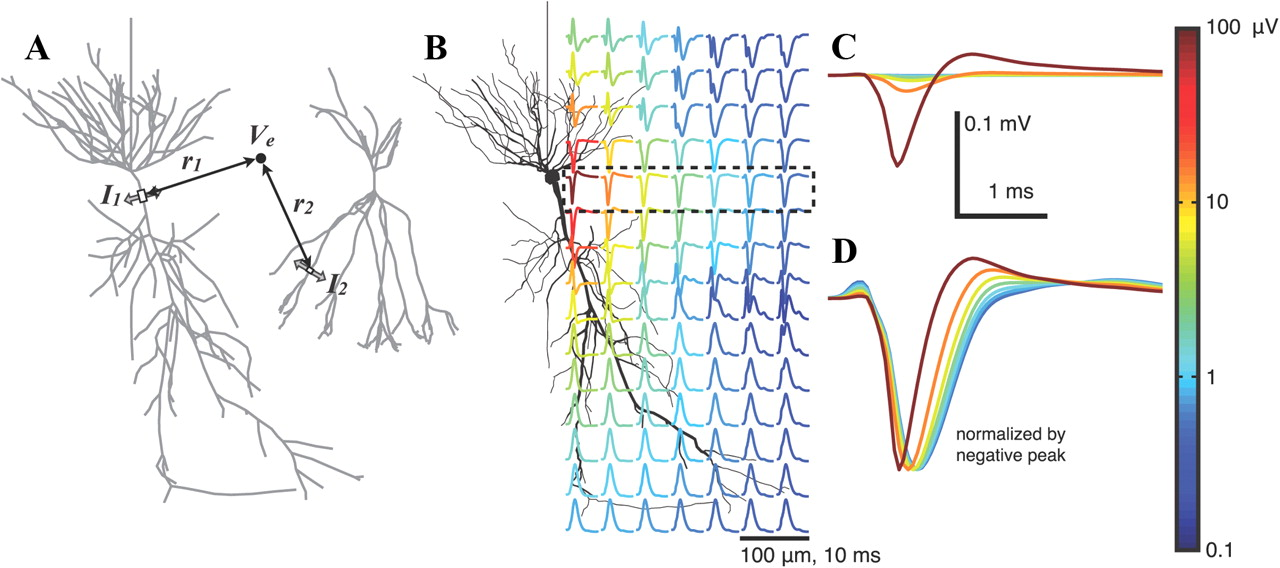
KDPV: el resultado de modelar el potencial extracelular cerca de una neurona durante la generación del potencial de acción ( fuente ). El color indica la amplitud del potencial. Esta ilustración será importante para una mayor comprensión.Los métodos electrofisiológicos para estudiar el cerebro se basan en registrar el potencial eléctrico del cerebro. Se pueden dividir en no invasivos, principalmente electroencefalografía (EEG), e invasivos, por ejemplo, electrocorticografía (ECoG), patch-clamp (patch-clamp) o registro de potencial de campo local (LPP = potenciales de campo locales, LFP) . Para este último, se inyecta un pequeño electrodo de 10-100 micras de tamaño directamente en el cerebro y se registra su potencial. Para estudiar la actividad del cerebro de los mamíferos a nivel celular, es decir, para medir la actividad de las células individuales, no se pueden aplicar los métodos no invasivos disponibles, porque el potencial de una célula decae en el espacio muy rápidamente, literalmente por 100 μm (ver KDPV). Por lo tanto, en cualquier modelo animal, así como en humanos, los métodos no invasivos brindan información solo sobre la actividad colectiva de las neuronas y el trabajo, muy probablemente, a nivel de tejido, pero no las neuronas individuales.
Pero con métodos invasivos no es tan simple. Para registrar la actividad de una neurona, es necesario acercar el electrodo muy cerca de la neurona, idealmente colocarlo dentro de la célula, como se hace en la pinza de parche, o usar
electrodos afilados , lo cual es difícil en la práctica, muy difícil. Por otro lado, cualquier electrodo extracelular de ~ 10 μm de tamaño registrará potenciales de acción de 5-10 células alrededor debido a la alta densidad de neuronas y la alta conductividad iónica de la solución extracelular. Por lo tanto, la tarea de registrar células individuales se resuelve técnicamente aumentando la densidad de los electrodos ubicados cerca de la célula. En este sentido, la electrofisiología moderna se está moviendo hacia un aumento en la densidad de los electrodos, un aumento en su número y una disminución en el tamaño. Entre los requisitos existe la necesidad de amplificar la señal más cerca del sitio de registro para reducir el ruido y colocar un multiplexor para reducir el tamaño. Entonces, en 2016, se anunció en una preimpresión, y en 2017 se publicó en Nature, y en 2018 ya apareció
en el mercado , una nueva muestra de Neuropixels de alta densidad hecha por tecnología CMOS, en 960 electrodos, de los cuales 384 están disponibles para grabación simultánea. El tamaño de un sitio de registro es de 12 micras. El espesor de la muestra es de 24 micras. Además, con los electrodos de alta densidad, así como con la amplificación activa, las personas comenzaron a trabajar durante mucho tiempo, pero Neuropixels fue el primero en lograr la producción y las ventas, por lo que en un futuro próximo esta prueba particular en artículos será cada vez más frecuente.
 Fig. Esquema de neuropixels. En un sustrato de silicio monolítico hay 960 sitios, así como un multiplexor completo y una interfaz AD para 384 canales.
Fig. Esquema de neuropixels. En un sustrato de silicio monolítico hay 960 sitios, así como un multiplexor completo y una interfaz AD para 384 canales.Estructura de datos
Además de los
ritmos de actividad clásicos (alfa, beta, gamma, etc.) que son responsables de la sincronización grupal, los datos obtenidos usando tales muestras también contienen los potenciales de acción de las células individuales (AP = potenciales de acción, AP, picos, adherencias) , que en el registro parecen picos cortos con una duración de ~ 1 ms.
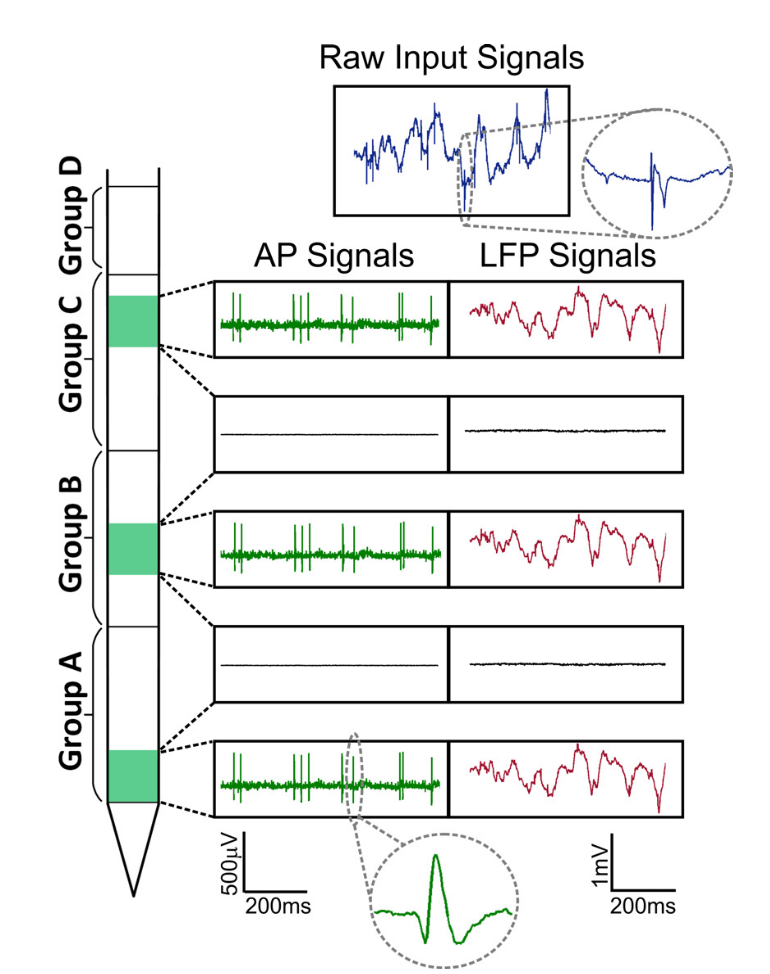 Fig. Señales Neuropixels. Se distinguen dos partes de la señal: potencial de campo local (LFP, hasta ~ 300 Hz) y actividad celular (AP, desde 300 Hz).
Fig. Señales Neuropixels. Se distinguen dos partes de la señal: potencial de campo local (LFP, hasta ~ 300 Hz) y actividad celular (AP, desde 300 Hz).Al mismo tiempo, si el potencial de campo local de baja frecuencia generalmente se analiza dentro del marco de las oscilaciones y el análisis espectral o de ondículas se usa como en el EEG, entonces la actividad celular contiene los potenciales de acción de las células individuales, que consiste en eventos discretos contra un fondo de ruido. La tarea de aislar la actividad de las células individuales se reduce formalmente a la tarea de un problema de cóctel, cuando un orador separado debe distinguirse del conjunto de oradores. Los datos grandes aparecen cuando evaluamos el flujo de datos de una de esas muestras. Para el análisis de picos, el muestreo se realiza a 30–40 kHz con digitalización de 16 bits por punto (uint16), por lo tanto, registrar ya 100 electrodos en 1 segundo tendrá un peso de 8 MB. Al mismo tiempo, los experimentos suelen durar horas, lo que equivale a cientos de gigabytes de solo un día hábil, y para un estudio completo, digamos, de 10 de esos registros. Por lo tanto, el potencial de esta muestra también depende en gran medida de los algoritmos de aprendizaje automático, que se utilizan para el análisis de datos.
Aprendizaje automático y actividad celular
Típicamente, una tubería para el análisis de la actividad celular consiste en preprocesamiento, segmentación de espigas y agrupamiento. Esta parte de la investigación se conoce comúnmente como análisis de conglomerados o clasificación de picos. Como preprocesamiento, generalmente se usa filtrado de paso bajo (> 300 Hz), porque se cree que no hay otros ritmos fisiológicos por encima de 300 Hz, y solo queda información sobre la actividad celular individual. Además, durante el preprocesamiento en muestras densas, es posible reducir el ruido correlacionado, por ejemplo, pastillas a 50 Hz. La segmentación generalmente se toma como un umbral simple, por ejemplo, cualquier cosa por encima de 5 desviaciones de ruido estándar puede considerarse un evento. Sucede que la segmentación de dos umbrales se usa, con un umbral blando y duro, para distinguir eventos relacionados en el espacio y el tiempo, como en el algoritmo de
segmentación de cuencas hidrográficas, solo en la agrupación de conglomerados, la propagación de marcadores tiene en cuenta la topología de la muestra. Después de la segmentación, se toma una ventana que dura de 1 a 2 ms cerca del centro de cada evento, y la señal en esta ventana, recolectada de todos los canales, se convierte en una muestra para su posterior agrupación. Esta muestra se llama forma de onda de pico. Las diferentes celdas y su diferente distancia del sitio de registro conducen al hecho de que sus formas de onda variarán (ver KDPV). El algoritmo de agrupación de forma de onda en sí utiliza EM, búsqueda de coincidencia de plantilla, aprendizaje profundo y muchas variaciones (
tema en github ). El único requisito es entrenar sin un maestro. Pero hay un problema. Nadie sabe con certeza qué parámetros debe tomar para su canalización para que el análisis sea el más efectivo. Por lo general, después de la agrupación, el analista revisa manualmente los resultados y realiza cambios a discreción. Por lo tanto, los resultados del análisis pueden incluir errores de algoritmos y errores humanos. Y pueden no serlo, por lo tanto, el tema de la validación objetiva permanece abierto.
Hay varias formas de validar una tubería. En primer lugar, cambiar las condiciones externas para el objeto de estudio. Por ejemplo, durante un experimento, si estudia las partes visuales de la corteza, puede cambiar la textura, el color y el brillo de la imagen. Si en el análisis hay una célula que cambia su actividad dependiendo del estímulo, entonces estás de suerte. En segundo lugar, puede mejorar o disminuir farmacológicamente la actividad de un tipo particular de célula, por ejemplo, usando ciertos bloqueadores de canales. Luego, la actividad de su célula aumentará / disminuirá, y verá la diferencia en la agrupación. Sin embargo, dicha modulación de la actividad también conducirá a cambios en las formas de onda, porque el perfil del potencial de acción en el tiempo está completamente determinado por la cinética de los canales iónicos. En tercer lugar, puede medir o inducir la actividad de ciertas células de forma optogenética o usando una pipeta de parche, como en este conjunto de datos. Debido a la gran relación señal / ruido y la estabilidad del electrodo de parche, tendrá plena confianza en la actividad de una sola celda. Conceptualmente, la publicación se dedicó al ensamblaje de un conjunto de datos de validación utilizando una abrazadera de parche.
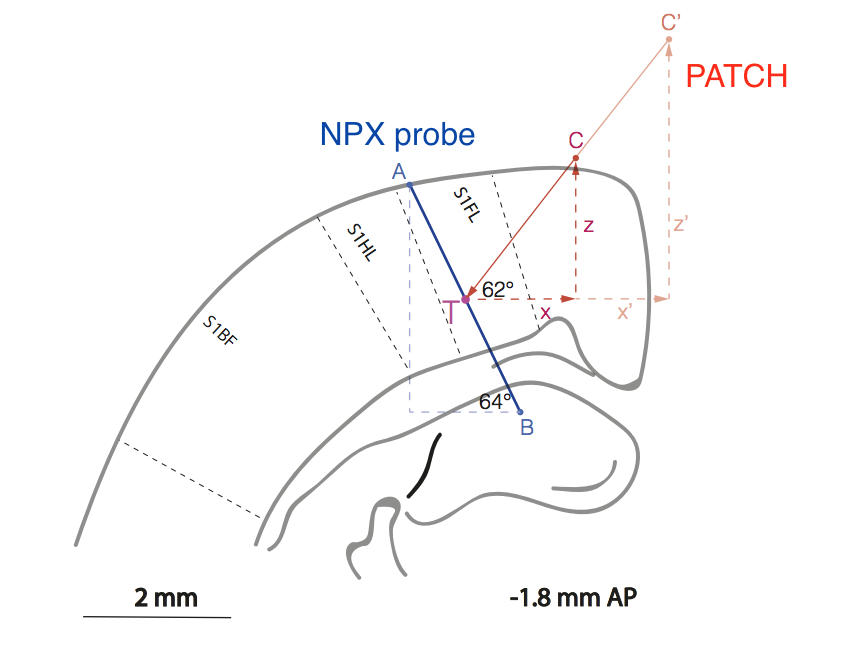 Fig. Representación esquemática de la posición relativa de la muestra (línea AB) y la pipeta de parche (línea C'CT) en la región de la corteza de la rata, que es responsable de procesar la información sensorial de la pata delantera (S1FL = córtex sensorial 1 extremidad anterior.
Fig. Representación esquemática de la posición relativa de la muestra (línea AB) y la pipeta de parche (línea C'CT) en la región de la corteza de la rata, que es responsable de procesar la información sensorial de la pata delantera (S1FL = córtex sensorial 1 extremidad anterior.No es necesario decir que el trabajo metodológico es extremadamente difícil, porque los experimentadores tuvieron que desarrollar un método para la disposición mutua de dos electrodos en la corteza cerebral sin control visual con una precisión de ~ 10 μm.
El efecto de la densidad del electrodo en la agrupación de espigas
¿Por qué es tan importante aumentar la densidad de los sitios de registro? Para una analogía, tomamos el hecho conocido entre los investigadores de EEG de que, desde cierto umbral, un aumento en el número de electrodos en la tapa no conduce a un aumento notable en la información recibida, es decir, la señal del electrodo difiere ligeramente de la interpolación lineal de señales de electrodos vecinos. Alguien dice que este umbral ya se alcanza a los 30, alguien a los 50, alguien a los 100 electrodos. Aquellos que trabajan con EEG en detalle pueden ser corregidos. Pero en el caso de la actividad celular, el umbral para la densidad de los sitios de registro en una muestra aún no se conoce, por lo que la raza de muestras de alta densidad continúa. Para esto, el equipo de Kampff Lab continúa trabajando con una muestra con un sitio de 5x5 μm
2 , y
se han publicado
datos preliminares para esto. Los especialistas que trabajan con electrodos densos comparten su experiencia de que, inesperadamente, el número específico de células individuales que pueden aislarse de muestras de la misma área es mayor donde la densidad de los sitios de registro es mayor. Este efecto está bien ilustrado en
otro estudio realizado por los mismos coautores, quienes seleccionaron artificialmente solo una parte de los sitios de una muestra densa y evaluaron visualmente la calidad de los grupos resultantes después de la conversión de tSNE a los valores de PCA de los picos de forma de onda. Este no es un canon para la agrupación, pero es bueno para ilustrar las dependencias. Como prueba, Neuroseeker actuó en 128 canales con un tamaño total de 700x70 μm
2 con un sitio de 20x20 μm
2 .
 Fig. TSNE sobre diagramas de PCA en formas de onda sin procesar mientras reduce artificialmente la densidad de sitios en la muestra. Los sitios de trabajo se muestran esquemáticamente en la parte superior de cada diagrama. Se muestra claramente cómo crece exactamente el número de grupos segregados con el aumento de la densidad del sitio, A es el mejor, F es el peor.
Fig. TSNE sobre diagramas de PCA en formas de onda sin procesar mientras reduce artificialmente la densidad de sitios en la muestra. Los sitios de trabajo se muestran esquemáticamente en la parte superior de cada diagrama. Se muestra claramente cómo crece exactamente el número de grupos segregados con el aumento de la densidad del sitio, A es el mejor, F es el peor.¿Cuál es la esencia del trabajo?
En los datos de Marques-Smith et al. Hay grabación simultánea de la abrazadera de parche y muestras. Utilizando datos de patchclamp, los científicos encontraron momentos de potenciales de acción y los usaron para segmentar y promediar formas de onda que ya están en la muestra. Como resultado, pudieron construir distribuciones de muy alta calidad del potencial de acción en tiempo y espacio en toda el área de la muestra.
 Fig. A la izquierda, los rastros de actividad celular se muestran simultáneamente en el clip de parche (negro) y en el canal Neuropixels más cercano (azul). En el medio: 500 muestras individuales y su promedio. A la derecha está la distribución del potencial de acción en el espacio sobre el área de muestra y en el tiempo.
Fig. A la izquierda, los rastros de actividad celular se muestran simultáneamente en el clip de parche (negro) y en el canal Neuropixels más cercano (azul). En el medio: 500 muestras individuales y su promedio. A la derecha está la distribución del potencial de acción en el espacio sobre el área de muestra y en el tiempo.A continuación, se plantea la cuestión sobre la variación de la forma de onda extracelular de punta a punta: sí, es palpable y debe tenerse en cuenta. Luego muestran que es fundamentalmente posible rastrear la distribución del potencial de acción a lo largo de la membrana celular utilizando sus electrodos densos, pero esto ya se ha demostrado anteriormente en el trabajo de otros grupos. En conclusión, ofrecen a los posibles colaboradores algunas preguntas fundamentales de la neurofisiología, que puede intentar responder con la ayuda de su conjunto de datos, y también ofrecen usar el conjunto de datos para validar las tuberías para agrupar la actividad celular. Esto último parece un desafío audaz, porque ahora hay muchos algoritmos de agrupamiento y la competencia entre los métodos es muy grande. No todos los métodos, en primer lugar, funcionan con una cantidad tan grande de canales y, en segundo lugar, no todos pueden ofrecer agrupaciones objetivamente de alta calidad.
Que sigue
En primer lugar, se acerca una nueva versión de
Neuroseeker en 1300 canales que también utiliza tecnologías CMOS,
ya hay datos preliminares
disponibles .
En segundo lugar, estamos esperando otro conjunto de datos, ya del Instituto Allen para la Ciencia del Cerebro, que se anunció en la conferencia FENS en 2018. Utilizará simultáneamente 4 (!) Muestras de neuropixels para estudiar las secciones visuales de la corteza del ratón con varios estímulos visuales. Prometieron publicar a finales de 2018
aquí , junto a los datos biphoton (también un conjunto de datos muy poderoso), pero hasta ahora nada.
En tercer lugar, la tarea de agrupar células para registrar el potencial extracelular me parece estéticamente hermosa. Converge los métodos de microelectrónica, neurofisiología y aprendizaje automático. Además, tiene un gran valor fundamental y aplicado. Supongo que la audiencia del habr estará interesada en aprender sobre la cocina técnica de la electrofisiología, es decir, sobre algoritmos de agrupamiento, porque en esta área ha desarrollado su propio zoológico. Yo, a su vez, he acumulado varias preguntas para estos algoritmos, y ese conjunto de datos no se puede omitir. Por lo tanto, en la siguiente parte, pasaremos al análisis de algunos algoritmos, comenzando con el Klustakwik canónico, continuando con los métodos de plantilla Kilosort o Spyking Circus, y luego YASS, que
declara muy firmemente
sobre sí mismo que funciona más rápido y mejor que todos los demás, porque DL y porque puede. Tema en github con una lista de algunos clústeres
aquí . Anticipando algunas preguntas, no veo el punto de desarrollar mi propio algoritmo, porque la competencia ya es muy grande, y muchas ideas ya han sido implementadas y probadas por otros. Pero si hay temerarios, contribuiré con placer.
Se aceptan sugerencias y deseos. Gracias por su atencion!