Demandez à Ethan n ° 36: un incroyable électrons rotatifs
Le lecteur demande:Quand j'ai lu votre réponse sur les lasers, je me suis souvenu de ma vieille question sur le principe de Pauli. Si je comprends bien, pour deux électrons dans une molécule d'hydrogène, les spins doivent être opposés. Est-ce à dire que lors de la formation d'une molécule, les électrons modifient leur spin, ou seuls des électrons aux spins opposés peuvent-ils former une molécule?
Il y a beaucoup à dire à ce sujet, alors commençons par le principe de l'interdiction de Pauli.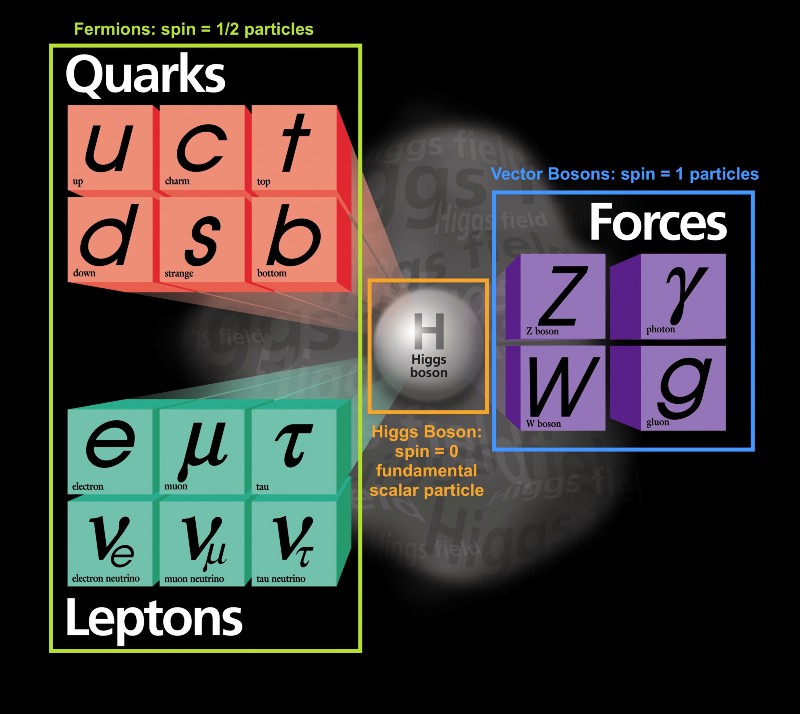 Malgré la grande variété de différents types de particules élémentaires qui existent dans l'Univers, ils peuvent tous être divisés en deux types:
Malgré la grande variété de différents types de particules élémentaires qui existent dans l'Univers, ils peuvent tous être divisés en deux types:- les fermions sont des particules avec un spin demi-entier: ± 1/2, ± 3/2, ± 5/2, ..
- les bosons sont des particules avec un spin entier: 0, ± 1, ± 2, ..
Fait intéressant, les particules composites se comportent également soit comme des fermions, soit comme des bosons. Les protons et les neutrons se comportent comme des fermions avec des spins ± 1/2, comme des électrons. Chaque particule possède un ensemble d'états quantiques qu'elle peut occuper, avec des niveaux d'énergie discrets, des moments angulaires, des directions de spin, etc.La principale différence entre les fermions et les bosons est que si vous avez deux particules identiques, vous pouvez y envoyer autant de bosons dans le même état quantique, mais les fermions identiques ne peuvent pas occuper le même état.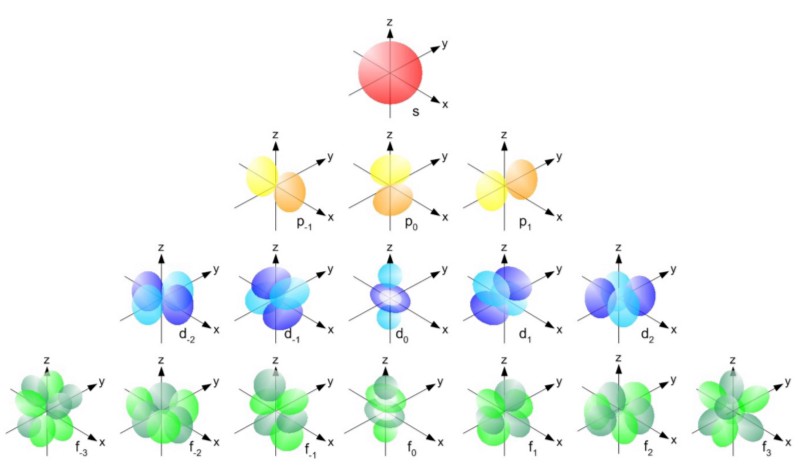 Si l'électron n'était pas un fermion, mais un boson, alors n'importe quel atome pourrait être entassé dans n'importe quel atome à n'importe quel niveau d'énergie inférieur (rouge ci-dessus). Mais un électron est un fermion, il obéit donc au principe d'interdiction. Deux électrons peuvent prendre le niveau d'énergie minimum, car ils peuvent avoir des spins +1/2 et -1/2, mais pour ajouter un troisième électron, vous devez passer à un autre état quantique.Les états quantiques dans les atomes sont arrangés de sorte que vous puissiez aller à un niveau d'énergie plus élevé (n dans l'image ci-dessous), puis à des états avec un moment angulaire plus élevé (l).
Si l'électron n'était pas un fermion, mais un boson, alors n'importe quel atome pourrait être entassé dans n'importe quel atome à n'importe quel niveau d'énergie inférieur (rouge ci-dessus). Mais un électron est un fermion, il obéit donc au principe d'interdiction. Deux électrons peuvent prendre le niveau d'énergie minimum, car ils peuvent avoir des spins +1/2 et -1/2, mais pour ajouter un troisième électron, vous devez passer à un autre état quantique.Les états quantiques dans les atomes sont arrangés de sorte que vous puissiez aller à un niveau d'énergie plus élevé (n dans l'image ci-dessous), puis à des états avec un moment angulaire plus élevé (l).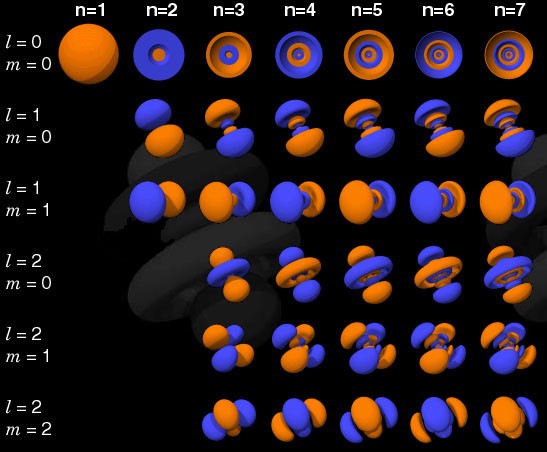 Par conséquent, les états l = 0 sont des orbitales s, l = 1 sont des orbitales p, l = 2 sont des orbitales d, et ainsi de suite. Par conséquent, le tableau périodique a juste une telle structure: avec deux éléments dans la rangée supérieure (n = 1, l = 0, m = 0 et spin = ± 1/2), 8 éléments dans la deuxième rangée (n = 2, l = 0, m = 0, et spin = ± 1/2, et n = 2, l = 1, m = 1,0, ou -1 et spin = ± 1/2), 18 éléments dans la troisième rangée, etc.
Par conséquent, les états l = 0 sont des orbitales s, l = 1 sont des orbitales p, l = 2 sont des orbitales d, et ainsi de suite. Par conséquent, le tableau périodique a juste une telle structure: avec deux éléments dans la rangée supérieure (n = 1, l = 0, m = 0 et spin = ± 1/2), 8 éléments dans la deuxième rangée (n = 2, l = 0, m = 0, et spin = ± 1/2, et n = 2, l = 1, m = 1,0, ou -1 et spin = ± 1/2), 18 éléments dans la troisième rangée, etc.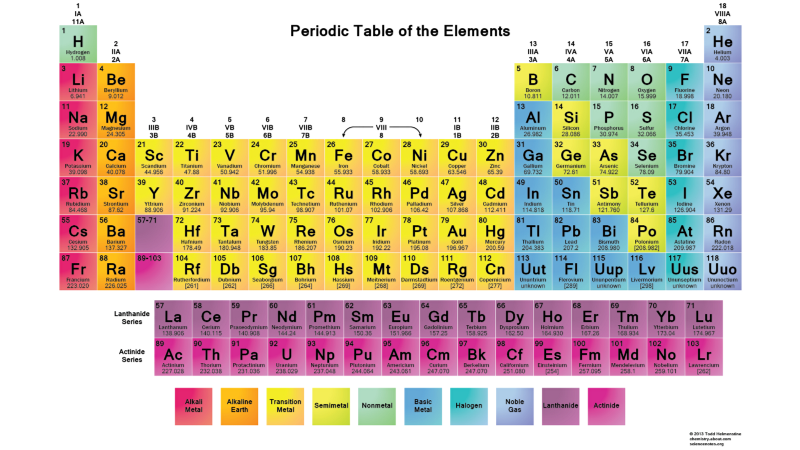 Par conséquent, en ajoutant 6, 10, 14, etc. les occurrences à chaque nouvelle ligne du tableau sont dues au principe de Pauli.Et bien que nous ne puissions pas distinguer un électron d'un autre, car ils sont identiques, chaque système atomique est unique. En d'autres termes, si vous avez quatre atomes d'hydrogène différents à l'état fondamental, ils n'auront pas besoin d'occuper différents niveaux d'énergie.
Par conséquent, en ajoutant 6, 10, 14, etc. les occurrences à chaque nouvelle ligne du tableau sont dues au principe de Pauli.Et bien que nous ne puissions pas distinguer un électron d'un autre, car ils sont identiques, chaque système atomique est unique. En d'autres termes, si vous avez quatre atomes d'hydrogène différents à l'état fondamental, ils n'auront pas besoin d'occuper différents niveaux d'énergie. En général, puisque les noyaux atomiques (protons) sont différents les uns des autres (ne sont pas dans le même noyau ou sont dans des états quantiques qui se chevauchent dans un sens quelconque), et les électrons sont attachés à leur proton (c'est-à-dire qu'ils ne sont pas dans des états quantiques se chevauchant les uns avec les autres), un système d'atomes d'hydrogène libres est très probablement organisé de manière à ce qu'ils soient tous dans un état de base, quelque chose comme ceci:
En général, puisque les noyaux atomiques (protons) sont différents les uns des autres (ne sont pas dans le même noyau ou sont dans des états quantiques qui se chevauchent dans un sens quelconque), et les électrons sont attachés à leur proton (c'est-à-dire qu'ils ne sont pas dans des états quantiques se chevauchant les uns avec les autres), un système d'atomes d'hydrogène libres est très probablement organisé de manière à ce qu'ils soient tous dans un état de base, quelque chose comme ceci: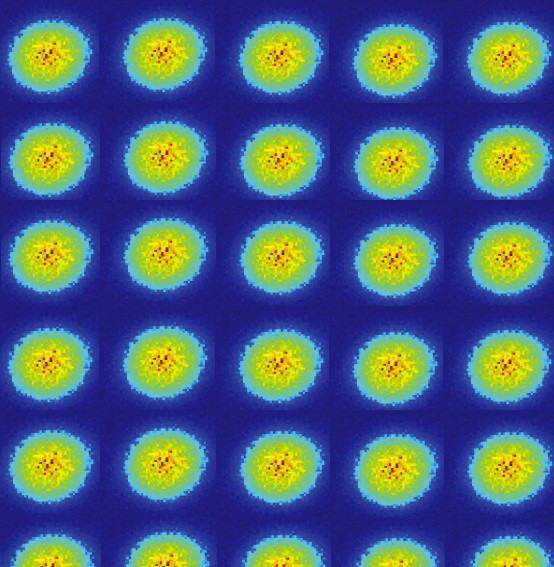 au moins, il est sage de configurer votre système de cette façon au départ. Mais si une paire de ces atomes interagissent entre eux, ils s'uniront et formeront une molécule d'hydrogène. Tout comme un atome d'hydrogène dans son état fondamental est légèrement plus léger (13,6 eV) qu'un proton libre et un électron libre en raison de l'énergie de liaison, une molécule d'hydrogène est donc légèrement plus légère (4,52 eV) que deux atomes d'hydrogène libres .Mais la question a été posée correctement. Puisque si deux atomes différents tentent de se reconnecter, les fonctions d'onde des électrons tenteront de se chevaucher.
au moins, il est sage de configurer votre système de cette façon au départ. Mais si une paire de ces atomes interagissent entre eux, ils s'uniront et formeront une molécule d'hydrogène. Tout comme un atome d'hydrogène dans son état fondamental est légèrement plus léger (13,6 eV) qu'un proton libre et un électron libre en raison de l'énergie de liaison, une molécule d'hydrogène est donc légèrement plus légère (4,52 eV) que deux atomes d'hydrogène libres .Mais la question a été posée correctement. Puisque si deux atomes différents tentent de se reconnecter, les fonctions d'onde des électrons tenteront de se chevaucher.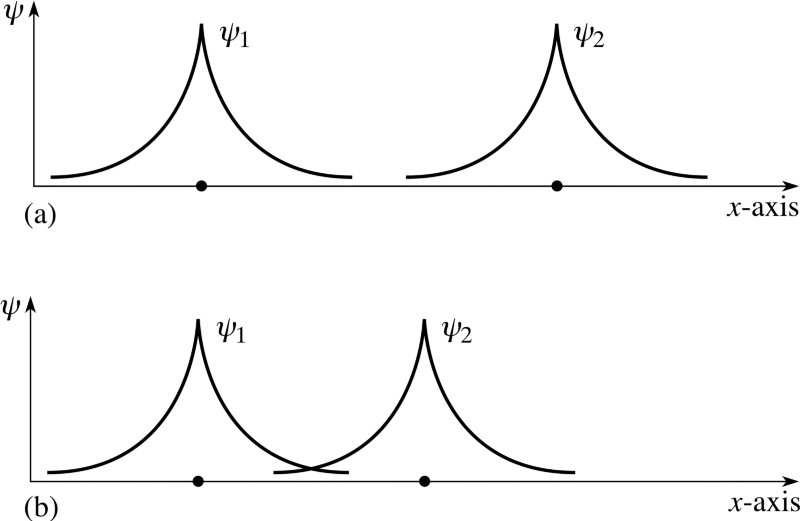 Mais les électrons ont non seulement des fonctions de spin, mais aussi des ondes spatiales. Cela signifie qu'ils occupent l'espace d'une manière spéciale. Si je rapproche deux atomes d'hydrogène, leurs fonctions d'ondes spatiales peuvent être symétriques, comme dans le diagramme ci-dessus, ou antisymétriques, comme dans le diagramme ci-dessous.
Mais les électrons ont non seulement des fonctions de spin, mais aussi des ondes spatiales. Cela signifie qu'ils occupent l'espace d'une manière spéciale. Si je rapproche deux atomes d'hydrogène, leurs fonctions d'ondes spatiales peuvent être symétriques, comme dans le diagramme ci-dessus, ou antisymétriques, comme dans le diagramme ci-dessous.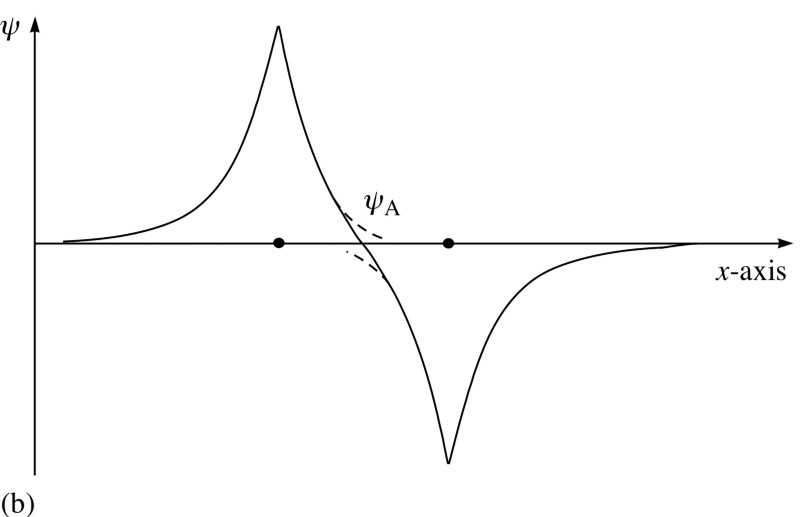 Et ici le principe de Pauli entre en vigueur.Si les atomes d'hydrogène se rapprochent des fonctions d'ondes symétriques, alors les spins des électrons doivent être anti-directionnels - si l'un a un spin de +1/2, le second a un spin de -1/2, et vice versa.Et si deux atomes s'associent avec des fonctions d'onde antisymétriques, alors les spins des électrons doivent être alignés: si le premier est +1/2, alors le second devrait également avoir +1/2, et vice versa.Par conséquent, les atomes d'hydrogène peuvent être connectés de deux manières - soit avec des fonctions d'ondes symétriques et des spins anti-directionnels, ou vice versa.
Et ici le principe de Pauli entre en vigueur.Si les atomes d'hydrogène se rapprochent des fonctions d'ondes symétriques, alors les spins des électrons doivent être anti-directionnels - si l'un a un spin de +1/2, le second a un spin de -1/2, et vice versa.Et si deux atomes s'associent avec des fonctions d'onde antisymétriques, alors les spins des électrons doivent être alignés: si le premier est +1/2, alors le second devrait également avoir +1/2, et vice versa.Par conséquent, les atomes d'hydrogène peuvent être connectés de deux manières - soit avec des fonctions d'ondes symétriques et des spins anti-directionnels, ou vice versa.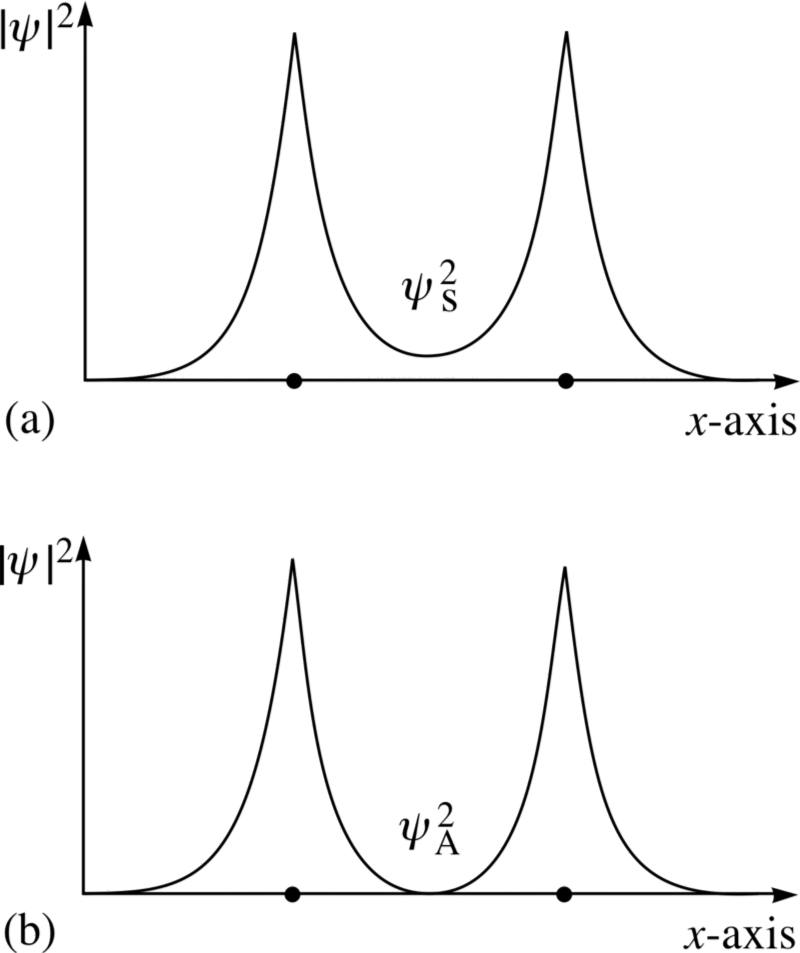 Jetez un œil à ces deux combinaisons - en haut, les fonctions d'onde se chevauchent, désignant la connexion, et en bas, elles ne se chevauchent pas, ce qui indique que cet état n'est pas connecté.Nous pouvons calculer quelle sera l'énergie de liaison pour ces deux états.
Jetez un œil à ces deux combinaisons - en haut, les fonctions d'onde se chevauchent, désignant la connexion, et en bas, elles ne se chevauchent pas, ce qui indique que cet état n'est pas connecté.Nous pouvons calculer quelle sera l'énergie de liaison pour ces deux états.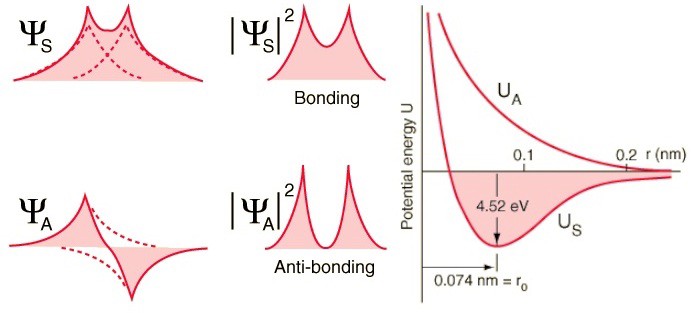 Dans un état antisymétrique, où les spins des électrons sont alignés, les atomes ne se formeront pas. Ce n'est que dans un état symétrique, où les fonctions des ondes spatiales sont symétriques et les spins sont dirigés de façon opposée, qu'une molécule d'hydrogène peut se former.Par conséquent, pour former une molécule, vous avez besoin de deux atomes d'hydrogène avec des fonctions d'ondes spatiales symétriques et des spins multidirectionnels (+1/2 et -1/2). Et d'ailleurs, vous pouvez voir comment la mécanique quantique vous interdit d'y pousser un troisième atome d'hydrogène - vous pouvez donc faire un atome H, une molécule H2, mais jamais H3.
Dans un état antisymétrique, où les spins des électrons sont alignés, les atomes ne se formeront pas. Ce n'est que dans un état symétrique, où les fonctions des ondes spatiales sont symétriques et les spins sont dirigés de façon opposée, qu'une molécule d'hydrogène peut se former.Par conséquent, pour former une molécule, vous avez besoin de deux atomes d'hydrogène avec des fonctions d'ondes spatiales symétriques et des spins multidirectionnels (+1/2 et -1/2). Et d'ailleurs, vous pouvez voir comment la mécanique quantique vous interdit d'y pousser un troisième atome d'hydrogène - vous pouvez donc faire un atome H, une molécule H2, mais jamais H3.
Source: https://habr.com/ru/post/fr386011/
All Articles