Quelles sont les causes des différences entre les batteries et les supercondensateurs
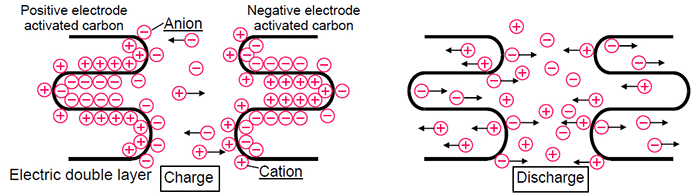
Les sources d'énergie électrochimique sont utilisées partout aujourd'hui et ont des caractéristiques distinctives: la capacité, ou la quantité d'énergie stockée, ainsi que la puissance, ou la capacité de transférer ou d'accumuler rapidement cette énergie (décharge / charge à des courants élevés). De plus, la sécurité et la longévité sont très importantes pour les batteries. Dans cet article, je vais vous expliquer en quoi les batteries et les supercondensateurs diffèrent au niveau chimique et comment cela affecte leurs caractéristiques techniques.Je vais commencer par les piles. Aujourd'hui, les batteries lithium-ion et nickel-hydrure métallique (NiMH) sont les plus couramment utilisées, mais les batteries lithium-ion remplacent progressivement le NiMH pour plusieurs raisons. Premièrement, les batteries lithium-ion sont plus gourmandes en énergie. En effet, par rapport aux électrolytes alcalins NiMH, qui limitent la tension de la cellule à 1,2 V, les électrolytes des batteries au lithium-ion à base de carbonate fournissent une tension de 3V. Et cela signifie moins de cellules nécessaires pour atteindre une certaine tension, ainsi que des tailles plus compactes, ce qui est simplement nécessaire pour les appareils électroniques portables modernes. Et, plus important encore, par rapport au NiMH, qui utilise des alliages avec des métaux des terres rares, les batteries lithium-ion contiennent des matériaux moins chers.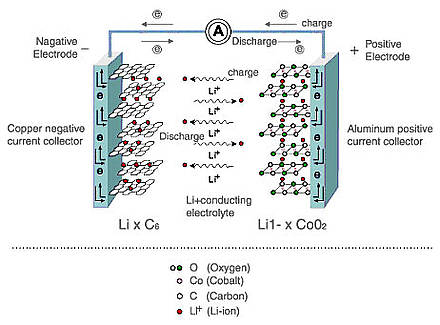
Linden's Handbook of Batteries, Fourth Edition
IEEE TRANSACTIONS ON POWER ELECTRONICS, Vol. 24, N ° 2, 2009
J. Electrochem Soc., Vol. 145, N ° 10, 1998
BE Conway, Supercondensateurs électrochimiques: fondements scientifiques et applications technologiques, 1999
Source: https://habr.com/ru/post/fr397915/
All Articles