Est-il possible de fabriquer une source d'alimentation comestible ou le principe de fonctionnement d'une pile à combustible abiotique. Partie 1: Théorie
Sur Internet, il existe de nombreuses instructions sur la façon de fabriquer des piles «comestibles» à partir de citrons, etc. Mais la comestibilité de tels appareils est en cause, car les électrodes sont généralement des plaques métalliques (généralement du zinc et du cuivre), et seul l'électrolyte, dont le rôle est le citron, est comestible. Récemment, je me suis demandé, est-il possible de créer une batterie entièrement comestible?Je vais expliquer tout de suite que la batterie ne doit pas provenir de batteries biocompatibles, mais de composants comestibles. Bien sûr, il serait facile de fabriquer un supercondensateur comestible à partir de charbon actif, mais, comme vous le savez, la consommation d'énergie des supercondensateurs est très faible par rapport aux batteries.La principale difficulté d'une telle idée est de trouver des électrodes / collecteurs de courant adaptés. D'une part, il est nécessaire que le matériau comestible possède une bonne conductivité, et d'autre part, il puisse participer aux réactions électrochimiques. Et la première chose qui vous vient à l'esprit lorsque vous pensez aux conducteurs comestibles est les colorants alimentaires E174 et E175, ils sont également de l'or et de l'argent. Mais dans quelles réactions électrochimiques ces matériaux peuvent-ils être utilisés s'ils sont proches les uns des autres dans une série électrochimique de tensions? Mais ici, nous devons nous rappeler que l'or et l'argent ont une activité électrocatalytique. Où les catalyseurs sont-ils utilisés dans les alimentations électrochimiques? Dans les piles à combustible!Comment fonctionne une pile à combustible? Comme les autres sources d'énergie électrochimique, les piles à combustible ont deux électrodes immergées dans un électrolyte. Mais contrairement aux batteries et aux supercondensateurs, ces électrodes ne sont pas des matières actives, mais des catalyseurs sur lesquels se produisent l'oxydation du "carburant", qui est fourni de l'extérieur, et la réduction de l'oxydant. Par exemple, dans l'exemple classique d'une pile à combustible à hydrogène, le carburant est l'hydrogène et l'agent oxydant est l'oxygène. Soit dit en passant, en comparaison avec d'autres sources d'énergie électrochimiques, par exemple, les batteries et les supercondensateurs, les piles à combustible sont les plus énergivores, car elles fonctionnent tandis que les réactifs sont fournis aux électrodes. Mais leur inconvénient est leur faible puissance, limitée par la vitesse des réactions électrochimiques et la vitesse d'alimentation en carburant et oxydant des électrodes.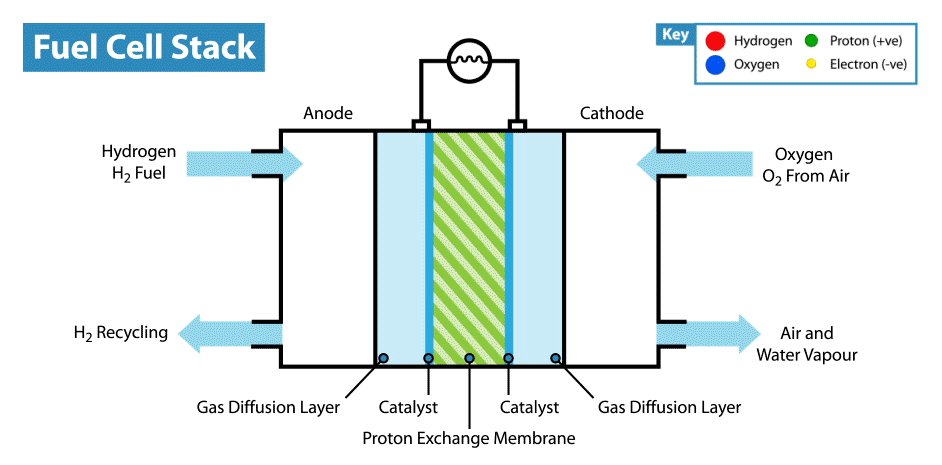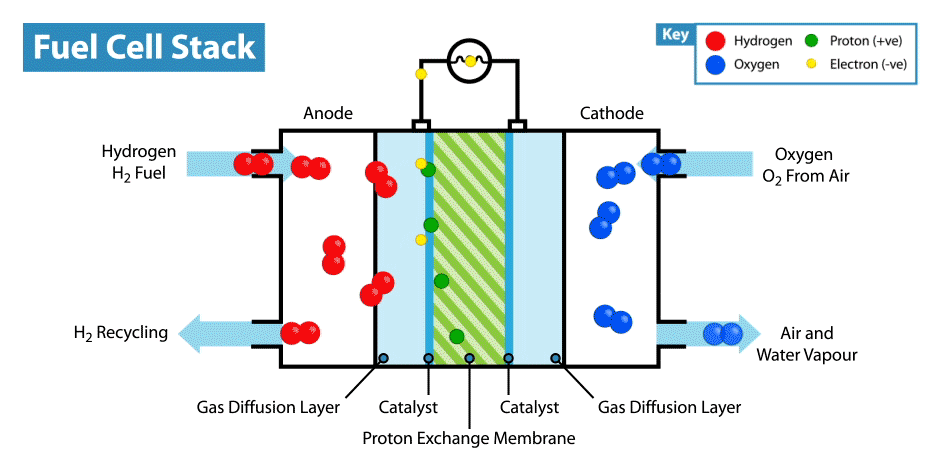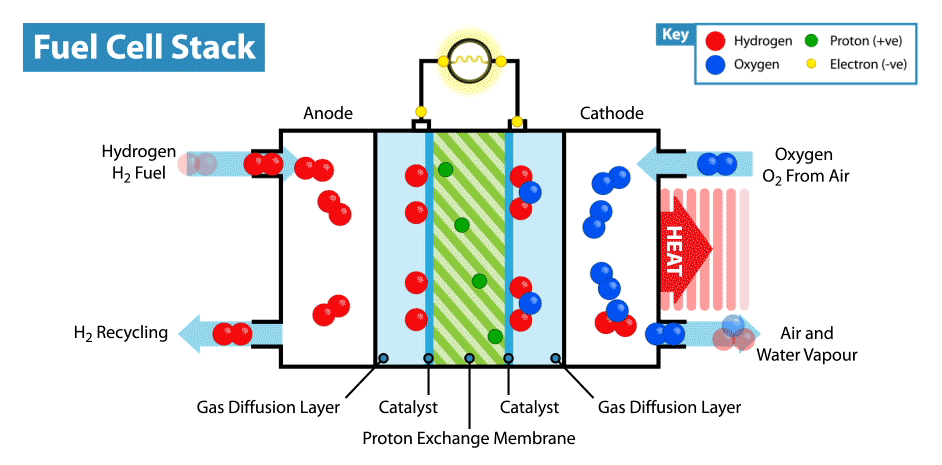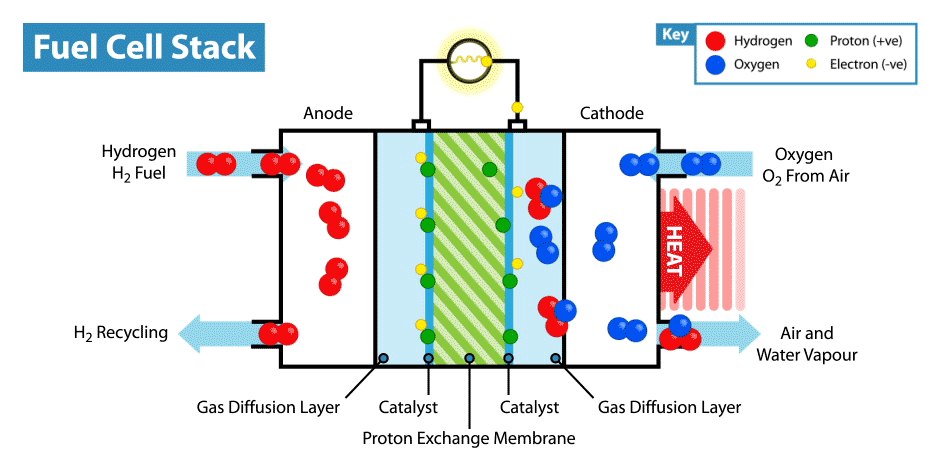

Source: https://habr.com/ru/post/fr398091/
All Articles