(suite. Partie précédente: «Automatisation à partir de l'ADN et des protéines: qu'est-ce que cela a de commun avec l'électronique?» )Nous avons retenu le fait que l'opéron lactose est similaire à l'élément logique ET. Mais d'où viennent ses propriétés numériques? Après tout, les deux signaux d'entrée (AMPc et concentrations de lactose) sont en fait analogiques. Essayons de dessiner les fonctions d'entrée de l'opéron lactose.Chaque entrée du répresseur du lactose comprend deux étapes de reconnaissance moléculaire. Le lactose se lie au répresseur du lactose et le répresseur se lie à l'ADN. Il y a plusieurs dizaines de molécules répressives dans la cellule, dont chacune, tant qu'il n'y a pas de lactose, peut se lier au début de l'opéron lactose. Lorsqu'elle y est liée, l'ARN polymérase ne peut pas commencer à fonctionner. En raison du mouvement thermique de la molécule répressrice, elle continue de tomber de l'ADN et de s'y fixer. S'il n'y a pas de répresseur du tout, l'opéron fonctionne à pleine puissance (maintenant, pour plus de simplicité, nous considérons qu'il y a un excès d'activateur catabolique). À de faibles concentrations du répresseur, il réduit l'activité de l'opéron presque linéairement. Mais alors l'effet de chaque nouvelle portion du répresseur est de moins en moins, et en général, le graphe de dépendance est proche de l'hyperbole y = 1 / (x + 1)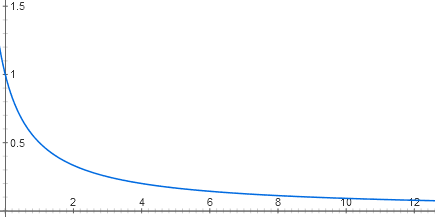
matan. . ?
, , . , :
A + B <-> C
, , - . , - ( , [A], [B] [C] ). : , , .
[C] / ([A] * [B]) = K
. (. . ) . , , .
, , , , ( ) . [C] ([A] * [B]) .
, : RepA + OpA <-> Op ( ). {R-O} = [Op] / ([OpA] * [RepA]). [] ( ) [RepA] ( ). , , : [Op] + [OpA] = 1
[Op] [OpA] :
{R-O} = (1 — [OpA]) / ([OpA] * [RepA])
:
[OpA] = 1 / (K{R-O} * [RepA] + 1)
y = 1 / (x + 1)
Les molécules répressives flottent dans la cellule et ne se lient à l'ADN qu'en paquets de quatre. Pour que la forme active du répresseur devienne inactive, elle doit se lier à quatre molécules de lactose - une ou deux ne suffisent pas, vous avez besoin d'une molécule de lactose pour chaque sous-unité protéique du quadruple répresseur. Bien qu'il y ait peu de lactose dans la cellule, ses molécules se lient au répresseur un ou deux et il reste actif. Mais après un certain seuil de concentration de lactose, la majorité des molécules répressives se lient à quatre molécules de lactose et passent sous une forme inactive. Le graphique de l'activité répressive en fonction de la quantité de lactose a donc une forme en S et est décrit par une fonction de la forme y = 1 / (1 + x ^ 4).Matan[RepA] [Lac]. , : .
RepA + 4 Lac <-> Rep
:
{R-L} = [Rep] / ([RepA] * [Lac]^4)
, :
[Rep] + [RepA] = n, n ≈ 50
, [RepA] = n / ({R-L} * [Lac]^4 + 1)
Maintenant, afin d'obtenir la caractéristique d'entrée de l'opéron pour le lactose, il est nécessaire de substituer la deuxième fonction à la première. Il aura la forme, jusqu'aux coefficients,y = 1 / (1 + (1 / (1 + x ^ 4)))Son emploi du temps est également en forme de S. Il s'avère que l'opéron lactose ne répond pas aux faibles concentrations de lactose. Lorsque la concentration seuil est atteinte, des molécules répressives inactives apparaissent qui se lient chacune à quatre lactoses, et l'opéron se met en marche assez brusquement.La deuxième entrée régulatrice de l'opéron lactose consiste également en deux étapes de reconnaissance moléculaire: l'AMPc se lie à l'activateur et l'activateur à l'ADN. La différence avec l'entrée de lactose est qu'ici la liaison des molécules (activateur ou AMPc) augmente l'activité de ce qu'elles ont contacté (opéron ou activateur). Autrement dit, les graphiques partiront de zéro et s'approcheront de la ligne horizontale quelque part au-dessus de l'axe X.Matan, , :
2 + Akt <-> AktA
K{-} = [AktA] / ([Akt] * []^2)
, [AktA] [Akt] , 100 , . [Akt] [AktA], :
K{-} = [AktA] / ((100 — [AktA]) * []^2)
[AktA] = K{-} * []^2 / (1 + K{-} * []^2)
[AktA] [] y = x^2 / (1 + x^2)
En raison de la liaison de deux molécules d'AMPc, le graphique ne ressemble pas à une hyperbole, mais à une courbe en forme de S. Bien que l'effet de seuil sur celui-ci soit moins perceptible que sur le graphique pour le lactose, car le degré n'est pas le quatrième, mais seulement le second.La dépendance de l'activité de l'opéron sur la quantité d'activateur a une nuance différente. Si la liaison du répresseur supprime l'opéron presque complètement (quelque part jusqu'à 0,1%, ce qui est inférieur à l'erreur de mesure biochimique), alors l'absence d'activateur ne supprime l'activité que jusqu'à 5%. Par conséquent, le graphique sortira non pas de zéro, mais du point (0; 0,05):y = 0,05 + (0,95 * x / (1 + x))Matan« , » ,
= [OpA] + 0,05 * [Op]
[OpA] [AktA] . , , [AktA] . , , [AktA] , :
[OpA] = K{-O} * [AktA] / (K{-O} * [AktA] + 1)
y = x / (1 + x)
, ! , (1 — ) * 0,05. , , :
y = 0,05 + (0,95 * x / (1 + x))
Il reste à obtenir la dépendance de l'activité de l'opéron sur la concentration d'AMPc. Pour ce faire, remplacez la première formule (pour la concentration de CAP active en fonction de la concentration d'AMPc) dans la deuxième formule (pour l'activité de l'opéron à partir de la concentration d'ATS actifs) ...... Et obtenez une fraction de quatre étages:Nous avons obtenu la fonction la plus complexe de toutes dans cet article. Cependant, son graphique ressemble à un graphique d'une dépendance plus simple du CAP actif sur la concentration en AMPc, y = x ^ 2 / (1 + x ^ 2):Il s'agit également d'une courbe en S avec un certain effet de seuil, qui s'approche lentement de l'horizontale y = 1. Elle ne commence pas non plus à partir de zéro, mais à partir du point (0; 0,05).Reste à comprendre comment les deux entrées interagissent. Dans le cas de l'opéron lactose, la réponse est simple - rien du tout. Le répresseur de lactose et l'activateur catabolique n'affectent pas la liaison l'un à l'autre à l'ADN. Par conséquent, la liaison de ces deux protéines peut être considérée comme un événement indépendant. La pleine activité de l'opéron est atteinte lorsque l'activateur est connecté et que le répresseur n'est pas connecté. La probabilité d'une telle coïncidence est égale au produit des probabilités de chacun d'eux séparément. Donc, pour obtenir la fonction d'activité de l'opéron lactose à partir de deux variables ([Lac]) et ([cAMP]), il suffit de multiplier les fonctions de chacune de cette variable:Activité = (1 / (1 + (1 / (1 + [Lac] ^ 4))) * (0,05 + 0,095 * ([cAMP] ^ 2 / (1 + [cAMP] ^ 2)) / ( 1 + ([cAMP] ^ 2 / (1 + [cAMP] ^ 2))))Graphique tridimensionnel de cette fonctionIl ressemble à un plateau se terminant par des gorges sur deux côtés. La gorge droite (faibles concentrations de lactose) est plus profonde et plus plate que la gauche (faibles concentrations d'AMPc).Dans la vraie vie, E. coli autour d'elle ne contient pas de lactose (le plus souvent), ou sa concentration est supérieure au seuil et le répresseur de lactose n'interfère pratiquement pas avec le fonctionnement de l'opéron (lorsque le propriétaire mange quelque chose de laitier). La concentration d'AMPc est un signal interne produit par la cellule elle-même. Il est également soit trop petit pour inclure l'opéron lactose (lorsqu'il y a du glucose ou de l'amidon), soit suffisant pour activer 95% ou plus (s'il n'y a rien de plus savoureux que le lactose). Autrement dit, l'opéron lactose est presque toujours dans les conditions d'un plateau sur ce graphique ou dans l'une des gorges.Les fonctions d'entrée de l'opéron lactose sont mesurées expérimentalement. La méthode de mesure ressemble à la technique de débogage des microcontrôleurs «accrochez la LED sur la jambe de sortie». La région régulatrice de l'opéron est prise et liée au gène de la protéine fluorescente verte. Cette construction génique est insérée dans les cellules d'Escherichia coli, desquelles l'opéron régulier de lactose est retiré (de sorte que la concentration en lactose est fixée de manière rigide par l'expérimentateur) et le système standard codant la faim avec des niveaux d'AMPc. Après cela, l'activité de l'opéron lactose peut être mesurée avec précision par un spectrophotomètre en fonction du niveau de fluorescence verte. Il s'avère que, dans les limites de la précision de mesure (1%), la théorie converge complètement avec l' expérience ).Le bas de la gorge gauche sur le graphique de la fonction d'entrée (à de faibles concentrations d'AMPc) est supérieur à zéro. Ce n'est pas un bug, mais une particularité: grâce à lui, en présence de plusieurs sucres à la fois, E. coli est prêt à passer rapidement au lactose lorsque le glucose est fini. Les mutants d'Escherichia coli, dans lesquels la fonction régulatrice de l'opéron lactose est plus proche de ET pur (c'est-à-dire que l'opéron ne fonctionne pas sans AMPc), passent du glucose au lactose pendant une heure ou plus: au moment de l'épuisement du glucose, ils n'ont pas d'enzymes d'absorption de lactose, ce qui signifie qu'il n'y a pas d'enzymes d'absorption de lactose l'énergie pour les faire rapidement. Escherichia coli normal ("type sauvage") répond à ce point, ayant déjà quelques enzymes pour l'absorption du lactose et il faut 15-20 minutes pour passer complètement à un nouveau sucre.Écartons maintenant de l'opéron lactose et examinons plus largement de quoi les éléments logiques sur une telle base chimique sont capables. Presque partout dans les systèmes de signalisation biochimiques, nous trouvons la reconnaissance moléculaire, qui est décrite par des fonctions de la forme y = x ^ n / (1 + x ^ n) pour les activateurs et y = 1 / (1 + x ^ n) pour les répresseurs. Le degré n dans ces fonctions indique le nombre de molécules du même type à se lier pour obtenir un effet, et il est généralement égal à 1, 2 ou 4 (le plus souvent 2). Des clés logiques plus complexes peuvent être obtenues en ajoutant plus de sites de liaison de protéines régulatrices au début de l'opéron. Il peut y avoir plus de deux types de ces protéines. Les effets de différentes protéines sur l'atterrissage de l'ARN polymérase peuvent s'additionner (OR) ou se multiplier (AND).Mais en général, nous traiterons d'une combinaison (addition ou multiplication) des fonctions de base y = x ^ n / (1 + x ^ n) et y = 1 / (1 + x ^ n) avec différents degrés et coefficients.Certaines fonctionnalités intéressantes sont très simples. Par exemple, la même protéine régulatrice peut se lier (sous forme appariée) à deux régions du promoteur. Dans une section, il agit comme un répresseur, et dans une autre - comme un activateur. Pour que l'opéron fonctionne, il est nécessaire que le site répresseur soit vide et que le site activateur soit occupé. Il s'avère une fonction avec un maximum clair:y = (1 / (1 + x ^ 2)) * (x ^ 2 / (1 + x ^ 2))Sans cette protéine, l'opéron est inactif parce que le site d'activateur est vide, et à des concentrations élevées, il est inactif parce que le site est occupé répresseur. L'activité maximale sera lorsque le site de l'activateur et le site du répresseur sont occupés avec une probabilité de 50%.Vous pouvez toujours créer deux sites de liaison d'activateur, dans l'un l'activateur se liera fortement à l'ADN, mais activera faiblement le gène, dans l'autre - s'attachera faiblement à l'ADN, mais activera fortement le gène. Dans ce cas, nous obtenons une fonction comme y = x ^ 4 / (1 + x ^ 4) + 0,3 * (10x) ^ 4 / (1 + (10x) ^ 4), avec un graphique pas à pas:Maths, oui! Pouvez-vous dire dans les commentaires ce qui est possible et ce qui ne peut pas être obtenu en ajoutant et en multipliant ces fonctions de base y = x ^ n / (1 + x ^ n) et y = 1 / (1 + x ^ n)?Dans la partie suivante, nous traiterons des circuits de tels éléments logiques.