Assemblage de circuits à partir de commutateurs biologiques
← Article précédent du cycleLa logique d'inclusion d'opérons de différentes voies métaboliques dans E. coli est proche des éléments ET et OU. Par conséquent, basé sur eux, vous pouvez créer une construction génique qui implémente un schéma logique arbitraire (pas trop compliqué). Il existe des programmes, par exemple Cello, qui, à partir de la description de la logique dans Verilog, font une séquence d'une construction génique qui implémente cette logique.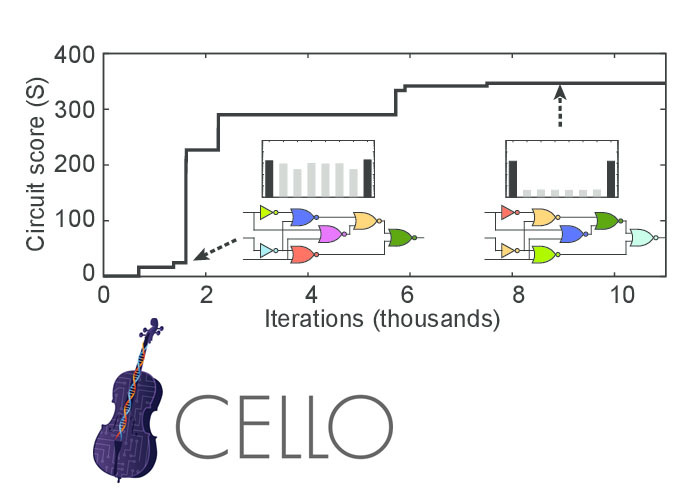
Dynamique de commutation des gènes
Dans le dernier article, nous avons modélisé le fonctionnement de l'opéron lactose avec un modèle simple à quatre paramètres. Le temps ne faisait pas partie de ce modèle. Par conséquent, il ne décrit en fait que l'état d'équilibre, lorsque les niveaux du signal d'entrée restent constants pendant longtemps. Pour modéliser des processus rapides lors de l'activation et de la désactivation des gènes, des facteurs supplémentaires doivent être pris en compte.Tout d'abord, il y a un retard de transcription: du début des travaux de l'ARN polymérase à la fin de la synthèse de l'ARNm, puis des protéines, un temps notable passe, environ 10 minutes chez Escherichia coli et depuis une heure ou plus chez l'homme. Par conséquent, le taux d'apparition de nouvelles molécules protéiques ne dépend pas actuellement de l'état du promoteur de son gène, mais de l'état du promoteur il y a quelques minutes.Deuxièmement, chaque protéine est non seulement synthétisée, mais également décomposée. Dans le cas le plus simple, la décomposition de la protéine n'est pas contrôlée et chaque minute une fraction fixe des molécules de cette protéine se décompose dans la cellule. Plus ils sont, plus ils se séparent. Autrement dit, la protéine a une demi-vie, au cours de laquelle sa concentration diminue de moitié.Plus de détails pour les plus curieux— - . , — .
Pour décrire la dynamique d'activation et de désactivation du gène, nous devons écrire un diffur:
où A est l'activité du gène (la même fonction d'entrée de l'article précédent), tau est le temps de retard de transcription et k est le taux de dégradation des protéines. Si A est d'abord égal à zéro, puis augmente brusquement et se maintient à un niveau constant, alors les changements dans la quantité de protéines au fil du temps ressembleront à ceci:Motifs des réseaux de gènes et leurs fonctions
Le motif le plus simple caractéristique d'Escherichia coli - la boucle de rétroaction - consiste en un gène qui se régule. Le plus souvent, le gène est un répresseur pour lui-même, c'est-à-dire que la rétroaction dans la boucle est négative. S'il s'agit de la principale entrée réglementaire, cette rétroaction sert généralement à stabiliser le niveau de la protéine codée par le gène. Une telle boucle de rétroaction, par exemple, maintient un niveau constant de répresseur de lactose dans la cellule. Si, en plus de la rétroaction négative, il existe d'autres entrées de régulation, la rétroaction accélère la réponse du gène à un signal externe.(les lignes pointillées sont des courbes théoriques, les lignes pleines sont le résultat de l'expérience. Lignes vertes avec rétroaction négative, lignes bleues sans)Une rétroaction positive (une protéine active son propre gène) conduit généralement à déclencher un comportement. Un tel gène a deux états stables: il ne fonctionne pas du tout ou fonctionne à pleine capacité. Un signal externe fort mais court peut transférer un gène d'un état stable à un autre dans lequel il reste jusqu'au signal suivant. Un tel motif peut servir d'élément de mémoire. Si un gène «attrape» du bruit sur une entrée régulatrice, une rétroaction positive entraînera une forte propagation de l'activité des gènes entre les cellules voisines se développant dans les mêmes conditions. Ceci est utilisé pour maintenir l'hétérogénéité des bactéries qui se développent ensemble afin qu'un stress soudain ne tue pas tout le monde à la fois.Par exemple, de nombreux antibiotiques interfèrent avec la synthèse des protéines. Si la cellule ne se développe pas et ne synthétise pas de protéines, elle peut facilement survivre à l'addition d'antibiotiques au milieu et revenir à la croissance plus tard. Chez E. coli, même dans des conditions idéales, jusqu'à 0,01% des cellules sont en hibernation en cas d'empoisonnement soudain de l'environnement. Ces cellules dormantes (elles sont appelées «persistantes») ne diffèrent pas des autres dans l'ADN, elles entrent et sortent de l'hibernation sous le contrôle d'un gène avec rétroaction positive et entrée de bruit.Un autre motif courant des réseaux de gènes est un peu plus compliqué. Elle est appelée «boucle de rétroaction» et se compose de trois gènes: le gène X régule les gènes Y et Z, le gène Y régule Z. Chacun des trois liens dans la boucle peut être une activation ou une répression, donc, en principe, 8 types sont possibles ces boucles. En réalité, on trouve généralement deux types de huit: soit les gènes X et Y sont des activateurs (boucle cohérente de type 1), soit X est l'activateur Y et Z, Y est le répresseur Z (boucle incohérente de type 1).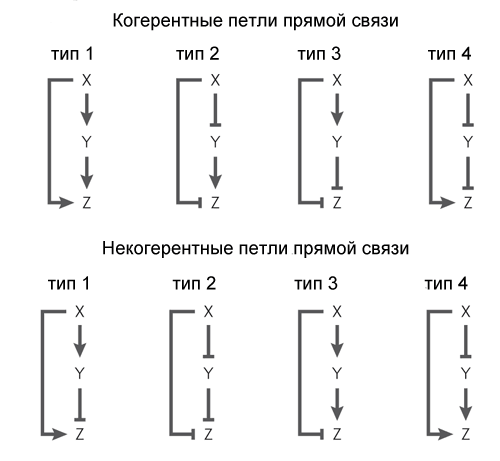
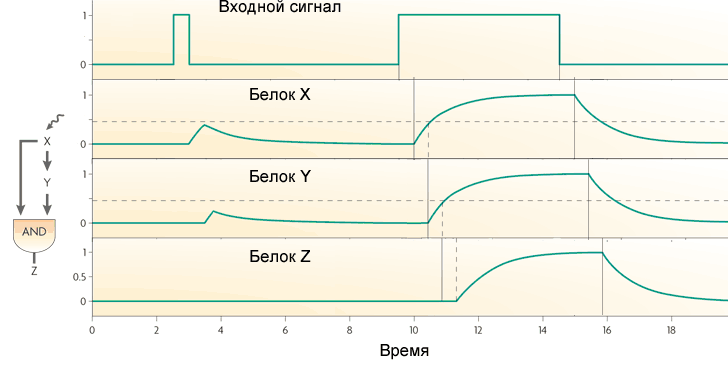 Si le gène Z fonctionne comme OR, alors la fonction de boucle devient le contraire: il transmet toutes les impulsions à la sortie, et se transforme court en longues. Mais elle ne manque pas de courtes pauses entre les impulsions.La boucle directe avec l'activateur X et le répresseur Y agit comme un filtre passe-haut. Il produit des impulsions de petite longueur fixe (égal au retard de transcription du gène Y) à la sortie en réponse aux fronts avant des signaux d'entrée.Le troisième motif fréquent dans les réseaux de gènes d'Escherichia coli est un module à entrée unique. Il s'agit simplement d'un groupe de gènes entraînés par le même gène régulateur. En règle générale, les gènes de ce groupe ont des seuils d'activation différents, de sorte qu'une augmentation régulière de la concentration du facteur de transcription inclut les gènes dans un certain ordre. Un tel schéma est utilisé, par exemple, pour gérer les réponses au stress.
Si le gène Z fonctionne comme OR, alors la fonction de boucle devient le contraire: il transmet toutes les impulsions à la sortie, et se transforme court en longues. Mais elle ne manque pas de courtes pauses entre les impulsions.La boucle directe avec l'activateur X et le répresseur Y agit comme un filtre passe-haut. Il produit des impulsions de petite longueur fixe (égal au retard de transcription du gène Y) à la sortie en réponse aux fronts avant des signaux d'entrée.Le troisième motif fréquent dans les réseaux de gènes d'Escherichia coli est un module à entrée unique. Il s'agit simplement d'un groupe de gènes entraînés par le même gène régulateur. En règle générale, les gènes de ce groupe ont des seuils d'activation différents, de sorte qu'une augmentation régulière de la concentration du facteur de transcription inclut les gènes dans un certain ordre. Un tel schéma est utilisé, par exemple, pour gérer les réponses au stress.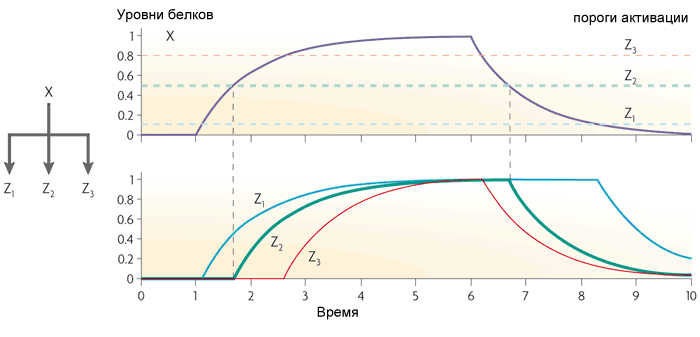 Le quatrième motif, le plus complexe, est le module à entrées multiples, ou régulon à chevauchement dense. Il se compose de plusieurs gènes régulateurs qui contrôlent plusieurs gènes «de sortie».Selon la logique de régulation de chaque gène de sortie, ce motif peut fonctionner très différemment. Il peut être comparé à un assemblage d'éléments logiques qui, selon les connexions, peuvent être un décodeur, un compteur ou autre chose. Il n'existe pas encore de description complète de la logique du travail de tels motifs.Avec ces quatre motifs, la structure des réseaux de gènes d'Escherichia coli ou de levure est pratiquement épuisée. Sur cette base, divers projets artificiels sont déjà en cours. Par exemple, les bactéries avec un générateur d'oscillation, qui se synchronise également dans les cellules voisines, et la sortie des protéines luminescentes- Un analogue complet de «blink a light bulb» pour les microcontrôleurs et «Hello World» pour les autres programmeurs. En ajoutant un «sentiment de quorum» à ce système (lorsque les bactéries perçoivent le nombre de cousins qui les entourent) et en changeant la sortie de la luminescence en toxines, les scientifiques ont collecté des bactéries qui rampent dans les tumeurs cancéreuses et s'accumulent en grande quantité, elles meurent ensemble, libérant des toxines et tuant tumeur ( plus de détails ici ).Mais ce sont des bactéries et des levures. Les réseaux de gènes animaux sont beaucoup plus complexes. Dans la prochaine partie, nous analyserons l'un des réseaux de gènes animaux bien étudiés et les problèmes qui se posent avec leur étude et leur modélisation.
Le quatrième motif, le plus complexe, est le module à entrées multiples, ou régulon à chevauchement dense. Il se compose de plusieurs gènes régulateurs qui contrôlent plusieurs gènes «de sortie».Selon la logique de régulation de chaque gène de sortie, ce motif peut fonctionner très différemment. Il peut être comparé à un assemblage d'éléments logiques qui, selon les connexions, peuvent être un décodeur, un compteur ou autre chose. Il n'existe pas encore de description complète de la logique du travail de tels motifs.Avec ces quatre motifs, la structure des réseaux de gènes d'Escherichia coli ou de levure est pratiquement épuisée. Sur cette base, divers projets artificiels sont déjà en cours. Par exemple, les bactéries avec un générateur d'oscillation, qui se synchronise également dans les cellules voisines, et la sortie des protéines luminescentes- Un analogue complet de «blink a light bulb» pour les microcontrôleurs et «Hello World» pour les autres programmeurs. En ajoutant un «sentiment de quorum» à ce système (lorsque les bactéries perçoivent le nombre de cousins qui les entourent) et en changeant la sortie de la luminescence en toxines, les scientifiques ont collecté des bactéries qui rampent dans les tumeurs cancéreuses et s'accumulent en grande quantité, elles meurent ensemble, libérant des toxines et tuant tumeur ( plus de détails ici ).Mais ce sont des bactéries et des levures. Les réseaux de gènes animaux sont beaucoup plus complexes. Dans la prochaine partie, nous analyserons l'un des réseaux de gènes animaux bien étudiés et les problèmes qui se posent avec leur étude et leur modélisation. Source: https://habr.com/ru/post/fr400899/
All Articles