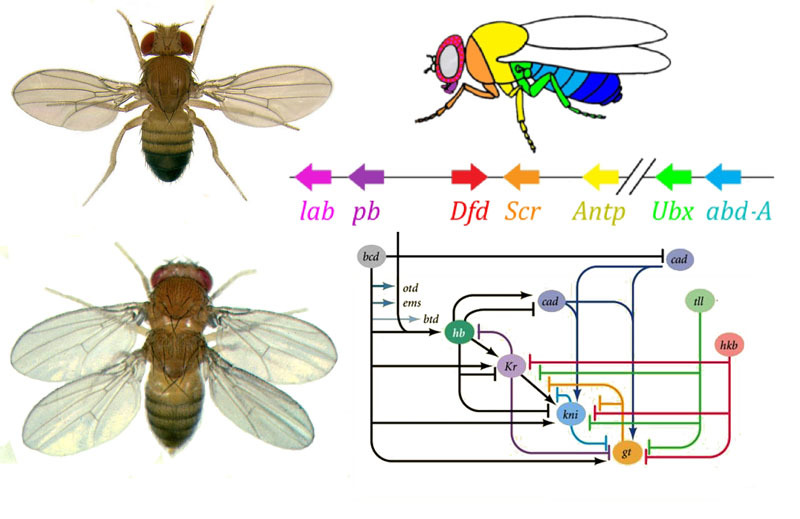
 Comment utiliser un œuf pour transformer un œuf en larve puis en mouche adulte? Une mouche, comme d'autres insectes, se compose de segments. Les segments sont combinés en trois groupes - tête, poitrine et abdomen. Un segment peut avoir une paire de membres. Il y a trois segments dans la poitrine, chacun avec une paire de jambes. Le deuxième segment thoracique a également des ailes, et le troisième - le scarabée au sol (petites ailes de la queue, presque invisibles sans loupe). L'abdomen se compose de huit segments, sans membres. Initialement, il y avait six segments dans la tête, mais au cours de l'évolution des insectes, les frontières entre eux se sont complètement effacées. Leurs membres sont des antennes avec lesquelles la mouche renifle et se sent, et trois paires de membres de la bouche. Pour un insecte ou un cafard, ce serait les mandibules, les maxillaires et la lèvre inférieure, tandis que pour une mouche, ils fusionnent tous dans la trompe.Pour que tous les organes soient en place, chaque cellule doit savoir où elle se trouve dans l'embryon. Par conséquent, aux premiers stades du développement embryonnaire, quand il n'y a pas encore d'organes et que toutes les cellules se ressemblent, une «grille de coordonnées» biochimique y apparaît avec les axes antéropostérieur, dorso-abdominal et gauche-droit. Les mutations des gènes qui forment la grille de coordonnées peuvent facilement et rapidement changer l'apparence de l'animal - déplacer les organes vers un autre endroit, changer leur nombre, etc. Par conséquent, ces gènes sont importants pour l'évolution des animaux et sont étudiés très activement. Le réseau de gènes pour marquer l'embryon d'une mouche de la drosophile, le jouet préféré des généticiens, est peut-être le plus étudié parmi les réseaux de gènes animaux.L'algorithme pour marquer un œuf le long de l'axe antéropostérieur est fondamentalement simple:1) déterminer quelle extrémité de l'œuf sera la tête, quelle queue2) diviser l'embryon le long de l'axe antéropostérieur en 17 segments3) diviser chaque segment en avant, milieu et arrière4) marquer la tête (6 segments), la poitrine (3 segments) et l'abdomen (8 segments)5) marquer les différences individuelles des segments Leréseau de gènes qui traite cela a un dispositif modulaire. Chaque module effectue sa propre étape de l'algorithme général. La mouche de la drosophile s'est avérée être un objet très pratique pour étudier les réseaux de développement de gènes, car elle présente des déformations héréditaires très lumineuses et révélatrices. Par exemple, antennapedia mutation dans laquelle les antennes sont transformées en jambes ou
Comment utiliser un œuf pour transformer un œuf en larve puis en mouche adulte? Une mouche, comme d'autres insectes, se compose de segments. Les segments sont combinés en trois groupes - tête, poitrine et abdomen. Un segment peut avoir une paire de membres. Il y a trois segments dans la poitrine, chacun avec une paire de jambes. Le deuxième segment thoracique a également des ailes, et le troisième - le scarabée au sol (petites ailes de la queue, presque invisibles sans loupe). L'abdomen se compose de huit segments, sans membres. Initialement, il y avait six segments dans la tête, mais au cours de l'évolution des insectes, les frontières entre eux se sont complètement effacées. Leurs membres sont des antennes avec lesquelles la mouche renifle et se sent, et trois paires de membres de la bouche. Pour un insecte ou un cafard, ce serait les mandibules, les maxillaires et la lèvre inférieure, tandis que pour une mouche, ils fusionnent tous dans la trompe.Pour que tous les organes soient en place, chaque cellule doit savoir où elle se trouve dans l'embryon. Par conséquent, aux premiers stades du développement embryonnaire, quand il n'y a pas encore d'organes et que toutes les cellules se ressemblent, une «grille de coordonnées» biochimique y apparaît avec les axes antéropostérieur, dorso-abdominal et gauche-droit. Les mutations des gènes qui forment la grille de coordonnées peuvent facilement et rapidement changer l'apparence de l'animal - déplacer les organes vers un autre endroit, changer leur nombre, etc. Par conséquent, ces gènes sont importants pour l'évolution des animaux et sont étudiés très activement. Le réseau de gènes pour marquer l'embryon d'une mouche de la drosophile, le jouet préféré des généticiens, est peut-être le plus étudié parmi les réseaux de gènes animaux.L'algorithme pour marquer un œuf le long de l'axe antéropostérieur est fondamentalement simple:1) déterminer quelle extrémité de l'œuf sera la tête, quelle queue2) diviser l'embryon le long de l'axe antéropostérieur en 17 segments3) diviser chaque segment en avant, milieu et arrière4) marquer la tête (6 segments), la poitrine (3 segments) et l'abdomen (8 segments)5) marquer les différences individuelles des segments Leréseau de gènes qui traite cela a un dispositif modulaire. Chaque module effectue sa propre étape de l'algorithme général. La mouche de la drosophile s'est avérée être un objet très pratique pour étudier les réseaux de développement de gènes, car elle présente des déformations héréditaires très lumineuses et révélatrices. Par exemple, antennapedia mutation dans laquelle les antennes sont transformées en jambes ou VROTMNENOGIproboscipedia, lorsqu'une partie de la trompe se transforme en jambes. La mutation bithorax donne une mouche à quatre ailes qui, en plus des ailes habituelles sur le deuxième segment thoracique, a une deuxième paire d'ailes sur le troisième segment thoracique.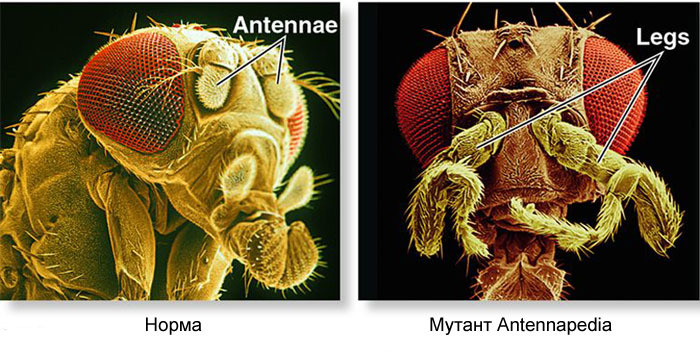
 De telles mutations, dans lesquelles une partie du corps devient très similaire à une autre, sont appelées "homéose". À partir de ces mutants, la génétique a finalement déchiffré l'ensemble du réseau de gènes qui contrôlent le développement de la mouche. Cette œuvre a remporté le prix Nobel en 1995.Tout commence avec les gènes de polarité des œufs - bicoid et nanos. Ils travaillent même avant la fécondation de l'ovule, alors qu'il mûrit dans l'ovaire de la mouche de la mère. Les cellules auxiliaires, pompant les nutriments dans l'œuf, sont situées sur un côté de l'œuf, de sorte que l'œuf a deux extrémités différentes dès le début. L'ARN bicoïde matriciel s'accumule à l'extrémité antérieure de l'œuf, où il est attaché et ne peut pas nager. nanos ARNm est également fixé à l'extrémité postérieure. Après la fécondation, les protéines commencent à être synthétisées à l'aide de ces ARNm. Leurs molécules se sont répandues dans l'œuf. Étant donné que la synthèse des protéines bicoïdes et nanos se produit à une extrémité de l'œuf et se décompose partout, un gradient de protéines bicoïdes diminue, diminuant de l'extrémité antérieure de l'embryon à la partie postérieure, et le gradient nanos de la partie postérieure à l'extrémité antérieure.
De telles mutations, dans lesquelles une partie du corps devient très similaire à une autre, sont appelées "homéose". À partir de ces mutants, la génétique a finalement déchiffré l'ensemble du réseau de gènes qui contrôlent le développement de la mouche. Cette œuvre a remporté le prix Nobel en 1995.Tout commence avec les gènes de polarité des œufs - bicoid et nanos. Ils travaillent même avant la fécondation de l'ovule, alors qu'il mûrit dans l'ovaire de la mouche de la mère. Les cellules auxiliaires, pompant les nutriments dans l'œuf, sont situées sur un côté de l'œuf, de sorte que l'œuf a deux extrémités différentes dès le début. L'ARN bicoïde matriciel s'accumule à l'extrémité antérieure de l'œuf, où il est attaché et ne peut pas nager. nanos ARNm est également fixé à l'extrémité postérieure. Après la fécondation, les protéines commencent à être synthétisées à l'aide de ces ARNm. Leurs molécules se sont répandues dans l'œuf. Étant donné que la synthèse des protéines bicoïdes et nanos se produit à une extrémité de l'œuf et se décompose partout, un gradient de protéines bicoïdes diminue, diminuant de l'extrémité antérieure de l'embryon à la partie postérieure, et le gradient nanos de la partie postérieure à l'extrémité antérieure.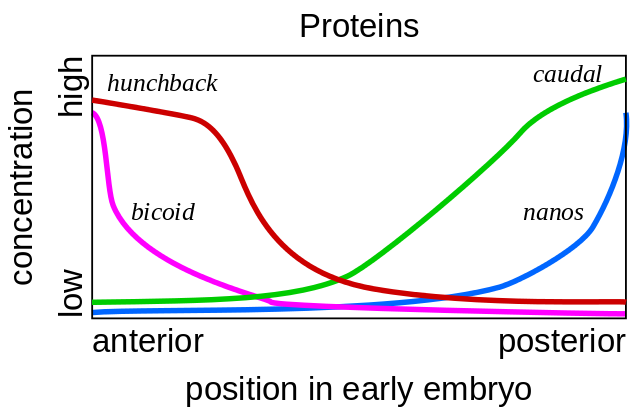 Si un ARNm bicoïde est introduit à un endroit différent dans l'œuf avec une micropipette, une deuxième tête y poussera. Si l'ARNm bicoïde est désactivé artificiellement, un embryon est obtenu sans tête et avec deux ânes.De plus, les protéines bicoïdes et nanos incluent les gènes de l'embryon lui-même, c'est-à-dire qu'un nouvel ARNm commence à être lu à partir d'eux). Les gènes de l'écart sont les premiers à commencer à fonctionner, à partir de l'écart anglais, l'écart. Les deux premiers gènes de ce groupe - bossu et caudal - forment des gradients de la tête à la queue (bossu) et de la queue à la tête (caudal). Mais leurs gradients sont plus lisses que ceux des bicoïdes et des nanos.
Si un ARNm bicoïde est introduit à un endroit différent dans l'œuf avec une micropipette, une deuxième tête y poussera. Si l'ARNm bicoïde est désactivé artificiellement, un embryon est obtenu sans tête et avec deux ânes.De plus, les protéines bicoïdes et nanos incluent les gènes de l'embryon lui-même, c'est-à-dire qu'un nouvel ARNm commence à être lu à partir d'eux). Les gènes de l'écart sont les premiers à commencer à fonctionner, à partir de l'écart anglais, l'écart. Les deux premiers gènes de ce groupe - bossu et caudal - forment des gradients de la tête à la queue (bossu) et de la queue à la tête (caudal). Mais leurs gradients sont plus lisses que ceux des bicoïdes et des nanos.Pourquoi les gènes sont-ils si étrangement appelés?. . , hunchback — «», tailless — «», kruppel - — «», bithorax – « ». Sonic hedgehog , .
Les quatre gènes restants du groupe lacunaire forment chacun une ou deux bandes larges (plus d'un segment) avec des limites assez claires. Ils sont incorporés par des produits protéiques de gènes supérieurs (bicoid, nanos, bossu et caudal). Un arrêt complet de l'un des gènes de ce groupe donne un embryon raccourci, qui manque de plusieurs segments, ceux dans lesquels ce gène fonctionnait normalement.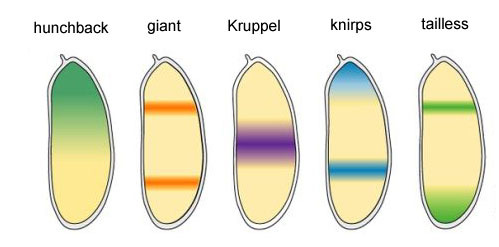 Domaines d'activité des gènes à blocs videsPourquoi se révèle-t-il que quatre gènes à blocs vides (kruppel, géant, knirps et sans queue) divisent l'embryon en bandes, dans chacun desquelles l'un des quatre gènes fonctionne?Premièrement, ils suppriment tous l'activité de l'autre. Dans une seule cellule, une condition serait stable dans laquelle un gène d'un tel groupe fonctionne activement et supprime tous les autres (déclencheur). Mais l'œuf de mouche en développement est plus complexe. À ce moment-là, des milliers de noyaux cellulaires individuels flottent dans le liquide intracellulaire total (cytoplasme). La taille de l'œuf est suffisamment grande pour que le taux de décomposition des protéines régulatrices soit comparable à leur taux de diffusion à l'autre extrémité de l'œuf. Avec une combinaison de diffusion et de suppression mutuelle, un autre état stable apparaît lorsque l'œuf est divisé en plusieurs bandes, dans chacune desquelles un gène du groupe fonctionne. Plus la diffusion des protéines est lente ou plus la décomposition est rapide, plus ces rayures ou taches seront petites.La participation de tels systèmes (appelés réaction-diffusion) au marquage du corps des animaux a été prédite par Alan Turing (oui, qui a inventé la "machine de Turing") en 1952. A cette époque, on savait peu de choses sur les gènes et les protéines, mais les équations décrivant les structures rayées et tachetées ont été correctement déduites par Turing.Ici ou ici, vous pouvez jouer avec un modèle de réaction-diffusion simple de deux substances et sentir comment il peut se comporter.
Domaines d'activité des gènes à blocs videsPourquoi se révèle-t-il que quatre gènes à blocs vides (kruppel, géant, knirps et sans queue) divisent l'embryon en bandes, dans chacun desquelles l'un des quatre gènes fonctionne?Premièrement, ils suppriment tous l'activité de l'autre. Dans une seule cellule, une condition serait stable dans laquelle un gène d'un tel groupe fonctionne activement et supprime tous les autres (déclencheur). Mais l'œuf de mouche en développement est plus complexe. À ce moment-là, des milliers de noyaux cellulaires individuels flottent dans le liquide intracellulaire total (cytoplasme). La taille de l'œuf est suffisamment grande pour que le taux de décomposition des protéines régulatrices soit comparable à leur taux de diffusion à l'autre extrémité de l'œuf. Avec une combinaison de diffusion et de suppression mutuelle, un autre état stable apparaît lorsque l'œuf est divisé en plusieurs bandes, dans chacune desquelles un gène du groupe fonctionne. Plus la diffusion des protéines est lente ou plus la décomposition est rapide, plus ces rayures ou taches seront petites.La participation de tels systèmes (appelés réaction-diffusion) au marquage du corps des animaux a été prédite par Alan Turing (oui, qui a inventé la "machine de Turing") en 1952. A cette époque, on savait peu de choses sur les gènes et les protéines, mais les équations décrivant les structures rayées et tachetées ont été correctement déduites par Turing.Ici ou ici, vous pouvez jouer avec un modèle de réaction-diffusion simple de deux substances et sentir comment il peut se comporter.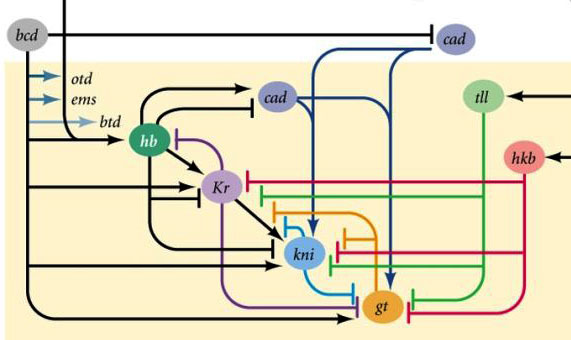 Liens entre les gènes d'écart et les gènes de polarité des œufs. Bcd - bicoid, hb - bossu, cad - caudal, Kr - Kruppel, kni - knirps, gt - géant, tll - sans queue.La suppression des gènes des uns et des autres marquera l'embryon en quelques bandes, mais l'emplacement des bandes d'activité des quatre gènes les uns par rapport aux autres et aux extrémités de l'embryon sera très variable. Pour que les bandes soient toujours en place (par exemple, pour les crochets - une bande dans la tête, l'autre dans la moitié arrière entre le kruppel et les bandes géantes), vous avez besoin d'un deuxième signal de contrôle - des gradients de bicoïde et d'autres protéines de polarité des œufs. Les fonctions d'entrée des gènes d'intervalle pour ces régulateurs ont des maxima à différents niveaux du signal d'entrée (nous avons dérivé une telle fonction d'entrée à la fin du deuxième article ). Par conséquent, les gènes lacunaires sont activés chacun par leur niveau de protéines bicoïdes, bossues et caudales, et leurs zones d'activité sont naturellement situées de la tête à la queue de l'embryon.Après que les gènes d'espacement ont effectué un marquage grossier de l'embryon en 7 bandes (elles ne coïncident pas avec les segments ou la tête-poitrine-abdomen), le module suivant est activé - paire-règle («règles de règle de paire»). Il divise déjà l'embryon en segments, qui devraient être de 17. Le module de règle de paire se compose de cinq gènes, et tous, comme vous l'avez deviné, se suppriment mutuellement. Chacun de ces gènes fonctionne dans tous les segments pairs ou dans tous les segments impairs - les protéines codées par eux se décomposent plus rapidement que les protéines du groupe lacunaire et les bandes, respectivement, sont plus étroites. La désactivation d'une partie des gènes de ce groupe donne un embryon raccourci, dans lequel tous les segments pairs ou impairs disparaissent.
Liens entre les gènes d'écart et les gènes de polarité des œufs. Bcd - bicoid, hb - bossu, cad - caudal, Kr - Kruppel, kni - knirps, gt - géant, tll - sans queue.La suppression des gènes des uns et des autres marquera l'embryon en quelques bandes, mais l'emplacement des bandes d'activité des quatre gènes les uns par rapport aux autres et aux extrémités de l'embryon sera très variable. Pour que les bandes soient toujours en place (par exemple, pour les crochets - une bande dans la tête, l'autre dans la moitié arrière entre le kruppel et les bandes géantes), vous avez besoin d'un deuxième signal de contrôle - des gradients de bicoïde et d'autres protéines de polarité des œufs. Les fonctions d'entrée des gènes d'intervalle pour ces régulateurs ont des maxima à différents niveaux du signal d'entrée (nous avons dérivé une telle fonction d'entrée à la fin du deuxième article ). Par conséquent, les gènes lacunaires sont activés chacun par leur niveau de protéines bicoïdes, bossues et caudales, et leurs zones d'activité sont naturellement situées de la tête à la queue de l'embryon.Après que les gènes d'espacement ont effectué un marquage grossier de l'embryon en 7 bandes (elles ne coïncident pas avec les segments ou la tête-poitrine-abdomen), le module suivant est activé - paire-règle («règles de règle de paire»). Il divise déjà l'embryon en segments, qui devraient être de 17. Le module de règle de paire se compose de cinq gènes, et tous, comme vous l'avez deviné, se suppriment mutuellement. Chacun de ces gènes fonctionne dans tous les segments pairs ou dans tous les segments impairs - les protéines codées par eux se décomposent plus rapidement que les protéines du groupe lacunaire et les bandes, respectivement, sont plus étroites. La désactivation d'une partie des gènes de ce groupe donne un embryon raccourci, dans lequel tous les segments pairs ou impairs disparaissent.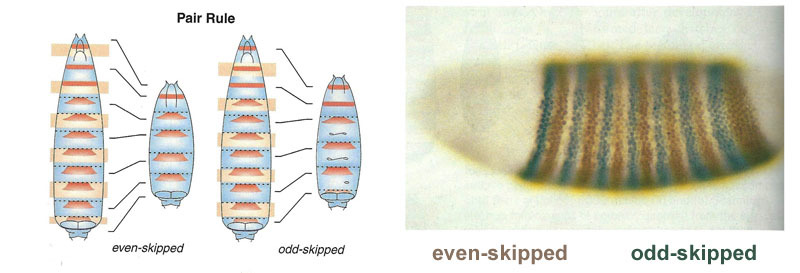 Zones d'activité des gènes du groupe de règles de paire. La photo de droite comporte 14 bandes, pas 17, car les trois autres systèmes de marquage fonctionnent dans les trois premiers segments de la tête.Le module de règles de paire lui-même, sans la participation de l'espace et du bicoïde, peut marquer l'embryon en bandes étroites, mais le nombre de ces bandes serait instable: les segments peuvent être de 12, 18 et même 20. Normalement, les gènes de règles de paire sont difficiles à contrôler l'écart des gènes, et le premier balisage grossier (pour 7 zones) aide à faire avec précision et fiabilité le balisage final (pour 14 + 3 segments).Le point suivant de l'algorithme est de marquer l'avant, le milieu et l'arrière de chaque segment. Cela se fait par des gènes de polarité de segment. Ils se suppriment également et sont activés par des modules supérieurs du réseau de gènes (paire-règle et écart). Seuls les paramètres de diffusion et de désintégration de leurs produits sont sélectionnés pour que les bandes soient très fines - un demi-segment. Les supprimer les uns avec les autres est plus faible et plus organisé qu'avec les gènes à règles de paire. Par conséquent, leurs bandes d'activité se chevauchent partiellement et dans chaque segment, une «ligne» fréquente de bandes se chevauchant différemment est obtenue.La désactivation des gènes de polarité des segments ne conduit généralement pas à un raccourcissement de l'embryon et à la perte de ses parties (comme c'est généralement le cas pour les écarts et les règles de paire), mais à des effets plus subtils. Habituellement, dans ce cas, la moitié de chaque segment dans lequel ce gène était censé fonctionner se transforme en une image miroir de l'autre moitié. Ceci est clairement visible, car la larve de mouche a des rangées de petites épines dirigées vers l'arrière - pour la commodité de ramper. Les mutants dans les gènes de polarité des segments ont des rangées d'épines dirigées vers l'avant.Enfin, c'est au tour des gènes les plus connus et les plus découverts de ce réseau - le module hox. Leur travail donne aux segments une individualité telle que les antennes et les trompes se développent sur les segments de la tête, et les jambes et les ailes se développent sur les segments de la poitrine. Contrairement aux modules précédents, les gènes hox ne s'inhibent pas mutuellement et peuvent travailler ensemble dans le même segment embryonnaire. Une étrange propriété des gènes hox qui n'a pas encore été expliquée: ils sont situés sur le chromosome dans un groupe serré, et dans le même ordre dans lequel ils travaillent dans le corps de l'embryon.
Zones d'activité des gènes du groupe de règles de paire. La photo de droite comporte 14 bandes, pas 17, car les trois autres systèmes de marquage fonctionnent dans les trois premiers segments de la tête.Le module de règles de paire lui-même, sans la participation de l'espace et du bicoïde, peut marquer l'embryon en bandes étroites, mais le nombre de ces bandes serait instable: les segments peuvent être de 12, 18 et même 20. Normalement, les gènes de règles de paire sont difficiles à contrôler l'écart des gènes, et le premier balisage grossier (pour 7 zones) aide à faire avec précision et fiabilité le balisage final (pour 14 + 3 segments).Le point suivant de l'algorithme est de marquer l'avant, le milieu et l'arrière de chaque segment. Cela se fait par des gènes de polarité de segment. Ils se suppriment également et sont activés par des modules supérieurs du réseau de gènes (paire-règle et écart). Seuls les paramètres de diffusion et de désintégration de leurs produits sont sélectionnés pour que les bandes soient très fines - un demi-segment. Les supprimer les uns avec les autres est plus faible et plus organisé qu'avec les gènes à règles de paire. Par conséquent, leurs bandes d'activité se chevauchent partiellement et dans chaque segment, une «ligne» fréquente de bandes se chevauchant différemment est obtenue.La désactivation des gènes de polarité des segments ne conduit généralement pas à un raccourcissement de l'embryon et à la perte de ses parties (comme c'est généralement le cas pour les écarts et les règles de paire), mais à des effets plus subtils. Habituellement, dans ce cas, la moitié de chaque segment dans lequel ce gène était censé fonctionner se transforme en une image miroir de l'autre moitié. Ceci est clairement visible, car la larve de mouche a des rangées de petites épines dirigées vers l'arrière - pour la commodité de ramper. Les mutants dans les gènes de polarité des segments ont des rangées d'épines dirigées vers l'avant.Enfin, c'est au tour des gènes les plus connus et les plus découverts de ce réseau - le module hox. Leur travail donne aux segments une individualité telle que les antennes et les trompes se développent sur les segments de la tête, et les jambes et les ailes se développent sur les segments de la poitrine. Contrairement aux modules précédents, les gènes hox ne s'inhibent pas mutuellement et peuvent travailler ensemble dans le même segment embryonnaire. Une étrange propriété des gènes hox qui n'a pas encore été expliquée: ils sont situés sur le chromosome dans un groupe serré, et dans le même ordre dans lequel ils travaillent dans le corps de l'embryon.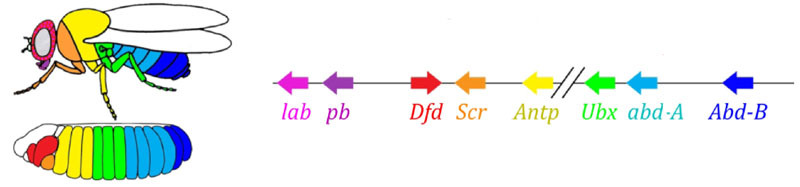 Le marquage de l'embryon est basé sur le principe «plus la poitrine est éloignée, plus il y a de gènes hox et plus il est actif»: l'activité du gène abdominal-A commence par 2 segments abdominaux, augmente à satiété en 4 et se poursuit au niveau maximum dans tous les segments suivants; Le gène abdominal-B fonctionne du 5e au 8e segment de l'abdomen, augmentant l'activité dans chaque segment suivant. Le gène ultrabithorax est inclus dans la demi-force dans le troisième segment thoracique et à pleine capacité dans tout l'abdomen. Lorsqu'elle est désactivée chez les mutants bithorax, les cellules du 3 segment thoracique ne savent pas qu'elles sont le 3 segment thoracique, elles ont le même ensemble de gènes hox que dans le 2 thoracique (c'est-à-dire antennapedia uniquement) et le développement du 3 segment thoracique se poursuit programme 2 poitrine - avec des ailes au lieu des scarabées et des muscles volants puissants.Si vous désactivez tous les gènes hox dans un segment séparé, cela se révélera laid, mais il ressemblera surtout à 1 poitrine, avec les jambes et sans ailes. En effet, les lointains ancêtres des insectes étaient comme des trilobites ou des mille-pattes. Ils avaient de nombreux segments identiques avec des jambes. Par la suite, leur corps s'est raccourci, la partie arrière a perdu des jambes, devenant l'abdomen, et plusieurs segments avant ont rejoint la tête et leurs jambes sont devenues des parties de l'appareil buccal (mandibules, maxillaires et lèvre inférieure).
Le marquage de l'embryon est basé sur le principe «plus la poitrine est éloignée, plus il y a de gènes hox et plus il est actif»: l'activité du gène abdominal-A commence par 2 segments abdominaux, augmente à satiété en 4 et se poursuit au niveau maximum dans tous les segments suivants; Le gène abdominal-B fonctionne du 5e au 8e segment de l'abdomen, augmentant l'activité dans chaque segment suivant. Le gène ultrabithorax est inclus dans la demi-force dans le troisième segment thoracique et à pleine capacité dans tout l'abdomen. Lorsqu'elle est désactivée chez les mutants bithorax, les cellules du 3 segment thoracique ne savent pas qu'elles sont le 3 segment thoracique, elles ont le même ensemble de gènes hox que dans le 2 thoracique (c'est-à-dire antennapedia uniquement) et le développement du 3 segment thoracique se poursuit programme 2 poitrine - avec des ailes au lieu des scarabées et des muscles volants puissants.Si vous désactivez tous les gènes hox dans un segment séparé, cela se révélera laid, mais il ressemblera surtout à 1 poitrine, avec les jambes et sans ailes. En effet, les lointains ancêtres des insectes étaient comme des trilobites ou des mille-pattes. Ils avaient de nombreux segments identiques avec des jambes. Par la suite, leur corps s'est raccourci, la partie arrière a perdu des jambes, devenant l'abdomen, et plusieurs segments avant ont rejoint la tête et leurs jambes sont devenues des parties de l'appareil buccal (mandibules, maxillaires et lèvre inférieure).Modèles mathématiques du réseau génétique pour le marquage d'embryons
Dans le cas de l'opéron lactose et des boucles de liaison directe dans E. coli, il est possible de construire des modèles mathématiques assez simples avec un nombre modéré de paramètres qui prédisent le comportement des gènes pour tous les signaux d'entrée. Pour un opéron lactose, il suffit:- quatre constantes de liaison (répresseur et activateur avec ADN, lactose avec répresseur, AMPc avec activateur)- quatre paramètres de stoechiométrie (4 lactose pour 1 répresseur, 2 activateur cAMP 1, 1 répresseur et activateur par opéron)- deux paramètres de régulation (l'effet du répresseur et de l'activateur sur la probabilité d'atterrissage de l'ARN polymérase)- le niveau de base de l'activité des opérons (lorsqu'il n'y a pas de répresseur ou d'activateur)- délai de transcriptionTotal 12 paramètres.Voyons maintenant les régions régulatrices, disons, des gènes Hox. Dans le diagramme ci-dessous, l'un des blocs régulateurs du gène abdominal-B. Les barres colorées indiquent les sites régulateurs de liaison aux protéines. Ce bloc entier a une taille d'environ 1700 nucléotides - 10 fois plus longue que la région régulatrice de l'opéron lactose. Il possède 39 sites de plantation pour 7 protéines régulatrices différentes de tous les blocs supérieurs de ce réseau de gènes. Et l'abdomen-B a quatre de ces blocs régulateurs. Ils s'allument séquentiellement du 5e au 8e segment de l'abdomen et créent une augmentation progressive du niveau de protéine abdominale B dans ces segments. Autrement dit, pour le modèle mat de ce gène seul, dans le bon sens, vous avez besoin de plus de 100 constantes de liaison, du même nombre de paramètres de régulation et d'un nombre inconnu de paramètres pour décrire l'interaction entre les différents intrants - dans le pire des cas, jusqu'à 1500 interactions par paires entre tous les sites d'atterrissage de protéines en un unité de régulation.Autrement dit, le modèle complet de ce réseau de gènes aura certainement plus d'un millier de paramètres. Et c'est le principal problème: il n'y a pas tellement de signaux de sortie que nous pouvons mesurer dans l'expérience - en fait, seulement les niveaux de chacune des 25 protéines et leur distribution sur la longueur de l'embryon. Par conséquent, personne n'a même essayé de simuler ce réseau avec la même granularité que l'opéron lactose.Vous pouvez essayer de simplifier la tâche et décrire l'effet de chaque protéine régulatrice sur le gène avec seulement trois paramètres (liaison, stoechiométrie et paramètre de régulation). Vous pouvez sélectionner ces paramètres (par exemple, en utilisant des chaînes de Markov) afin que le modèle reproduise avec précision les bandes réelles d'activité génique. Pour les deux premiers blocs du réseau (gènes de polarité des œufs et gènes de gap), de tels modèles sont même réalisés ( par exemple ).Le problème est que les différents départs de l'algorithme de sélection donnent des paramètres de modèle différents - mais ils fonctionnent tous correctement et reproduisent l'activité des gènes dans un véritable bourgeon de mouche! Ces modèles ont des caractéristiques communes (par exemple, tous les gènes lacunaires se suppriment et sont activés par les protéines mères), mais il n'y a pas moins de différences que de similitudes.Et puisque différentes tentatives de modélisation donnent des résultats différents, il est peu probable qu'au moins l'une d'entre elles coïncide avec la réalité. Pire encore, de tels modèles reproduisent un fonctionnement normal, mais manquent beaucoup pour prédire les résultats des mutations.Dans la partie suivante, nous expliquerons pourquoi ces problèmes avec l'étude des réseaux de gènes sont inévitables en biologie (et le réseau de marquage d'embryons de drosophile est l'un des plus simples à étudier!), Ce qui peut être fait à ce sujet et ce que les ingénieurs devraient apprendre des biologistes.
Les barres colorées indiquent les sites régulateurs de liaison aux protéines. Ce bloc entier a une taille d'environ 1700 nucléotides - 10 fois plus longue que la région régulatrice de l'opéron lactose. Il possède 39 sites de plantation pour 7 protéines régulatrices différentes de tous les blocs supérieurs de ce réseau de gènes. Et l'abdomen-B a quatre de ces blocs régulateurs. Ils s'allument séquentiellement du 5e au 8e segment de l'abdomen et créent une augmentation progressive du niveau de protéine abdominale B dans ces segments. Autrement dit, pour le modèle mat de ce gène seul, dans le bon sens, vous avez besoin de plus de 100 constantes de liaison, du même nombre de paramètres de régulation et d'un nombre inconnu de paramètres pour décrire l'interaction entre les différents intrants - dans le pire des cas, jusqu'à 1500 interactions par paires entre tous les sites d'atterrissage de protéines en un unité de régulation.Autrement dit, le modèle complet de ce réseau de gènes aura certainement plus d'un millier de paramètres. Et c'est le principal problème: il n'y a pas tellement de signaux de sortie que nous pouvons mesurer dans l'expérience - en fait, seulement les niveaux de chacune des 25 protéines et leur distribution sur la longueur de l'embryon. Par conséquent, personne n'a même essayé de simuler ce réseau avec la même granularité que l'opéron lactose.Vous pouvez essayer de simplifier la tâche et décrire l'effet de chaque protéine régulatrice sur le gène avec seulement trois paramètres (liaison, stoechiométrie et paramètre de régulation). Vous pouvez sélectionner ces paramètres (par exemple, en utilisant des chaînes de Markov) afin que le modèle reproduise avec précision les bandes réelles d'activité génique. Pour les deux premiers blocs du réseau (gènes de polarité des œufs et gènes de gap), de tels modèles sont même réalisés ( par exemple ).Le problème est que les différents départs de l'algorithme de sélection donnent des paramètres de modèle différents - mais ils fonctionnent tous correctement et reproduisent l'activité des gènes dans un véritable bourgeon de mouche! Ces modèles ont des caractéristiques communes (par exemple, tous les gènes lacunaires se suppriment et sont activés par les protéines mères), mais il n'y a pas moins de différences que de similitudes.Et puisque différentes tentatives de modélisation donnent des résultats différents, il est peu probable qu'au moins l'une d'entre elles coïncide avec la réalité. Pire encore, de tels modèles reproduisent un fonctionnement normal, mais manquent beaucoup pour prédire les résultats des mutations.Dans la partie suivante, nous expliquerons pourquoi ces problèmes avec l'étude des réseaux de gènes sont inévitables en biologie (et le réseau de marquage d'embryons de drosophile est l'un des plus simples à étudier!), Ce qui peut être fait à ce sujet et ce que les ingénieurs devraient apprendre des biologistes.