 Cristaux liquides en phase nématique
Cristaux liquides en phase nématiqueVous avez probablement étudié à l'école qu'une substance peut être en trois
phases thermodynamiques : solide, liquide et gazeuse. (Le terme «phase» est utilisé conjointement avec le terme «état», et aucun d'entre eux n'a une définition claire et universellement acceptée). Pour les jeunes étudiants, c'est une simplification utile, mais en réalité il y a beaucoup plus de phases. Au cours des cent dernières années, nous avons découvert l'existence de centaines de phases solides différentes - certaines d'entre elles sont utilisées pour créer des puces de silicium dans votre ordinateur. De plus, il existe des dizaines de phases de cristaux liquides - certaines d'entre elles créent des images sur votre écran. Et nous n'avons même pas abordé de choses vraiment exotiques: phases quantiques, liquides superfluides, plasma de quarks-gluons, condensats de Bose-Einstein, etc. "Phases topologiques."
Mais d'abord, revenons au début et discutons de ce qu'est la «phase». Comme de nombreux concepts fondamentaux, il est préférable de l'expliquer avec un exemple. Prenons un verre d'eau dans lequel flottent quelques glaçons. Il n'y a qu'une seule substance dans un verre: l'eau. Beaucoup de molécules H
2 O.
Et bien que les molécules de glace soient identiques aux molécules de l'eau environnante, il y a évidemment une grande différence entre elles. Le plus évident est que l'un d'eux est solide, conservant sa forme, tandis que l'autre coule librement et prend la forme d'un vaisseau. Il existe également une différence de densité, de conductivité électrique et de nombreuses autres propriétés. Par conséquent, nous disons que l'eau liquide et la glace sont des phases différentes d'une même substance. (L'eau est la seule substance qu'une personne rencontre constamment en trois phases différentes. C'est l'une des raisons pour lesquelles l'eau est une substance spéciale).
Comment se fait-il que la glace et l'eau présentent un comportement complètement différent? Vous pourriez être tenté de dire que tout dépend de la température: l'eau est chaude, la glace est froide, et à cause de cela, les molécules d'eau se comportent différemment. Mais à 0 ° C et à la pression atmosphérique normale, la glace et l'eau liquide sont stables - c'est-à-dire qu'elles peuvent exister indéfiniment et ne pas changer.
Mais si la principale différence n'est pas la température, alors quoi?
Grande et petite échelle
Les scientifiques discutent depuis longtemps de la relation entre les propriétés macroscopiques de divers matériaux et l'arrangement microscopique des particules à partir desquelles ils sont fabriqués. L'une des premières tentatives a été faite en 1611 par Johannes Kepler dans l'œuvre avec le beau titre: "Flocon de neige hexagonal: cadeau du Nouvel An". Kepler a soutenu que la symétrie sextuple des flocons de neige peut être expliquée en supposant que la glace est créée à partir de minuscules sphères emballées en ensembles hexagonaux.
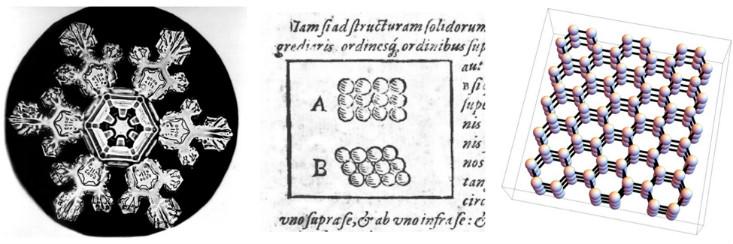
Nous savons maintenant que l'hypothèse de Kepler sur l'arrangement spécial des atomes était légèrement incorrecte - son schéma ne reflète pas la forme tridimensionnelle et l'interaction complexe des molécules d'eau. (En sa faveur, disons que la chimie n’a pas encore été inventée, et l’existence des atomes a finalement été prouvée près de 300 ans plus tard). Cependant, il était sur la bonne voie. La symétrie sextuple des flocons de neige vient du fait que les molécules d'eau s'alignent dans une structure tridimensionnelle avec une symétrie sextuple (et il y a aussi
des cristaux de neige triangulaires , et personne ne sait exactement pourquoi).
Dans le langage de la physique moderne, Kepler a suggéré que la neige est un solide cristallin, une phase de la matière qui obtient ses propriétés du fait que ses atomes ou molécules s'alignent en rangées périodiques ou réseaux cristallins. Les physiciens utilisent le mot «cristal» pour décrire la structure microscopique, peu importe si le matériau ressemble à un diamant, un grain de sable ou un flocon de neige. Par conséquent, pour le physicien, de nombreux métaux et céramiques sont des cristaux, car leurs atomes ou molécules sont disposés en réseau périodique - dans une certaine version en trois dimensions des dessins de Kepler de 1611.
Cela explique la glace dans un verre d'eau. Et l'eau liquide? Dans n'importe quelle substance, à des températures supérieures au zéro absolu (-273 ° C), les molécules se déplacent et rebondissent constamment sur le mot boules de billard après une forte dégradation. La température d'une substance est une mesure de la vitesse de déplacement des molécules.
Dans un liquide, ce mouvement thermique aléatoire est suffisamment fort pour vaincre les forces qui retiennent les molécules dans le réseau. Et sans ce réseau, les molécules peuvent se déplacer beaucoup plus librement. Cela explique pourquoi le liquide succombe lorsque vous le poussez avec votre doigt, et la glace non. Il est intéressant de noter qu'il existe des substances, en particulier du verre à vitre, avec une microstructure complètement aléatoire, mais au niveau macroscopique, elles se comportent néanmoins comme des solides. Comprendre leur comportement est la plus importante des questions ouvertes de la physique des matériaux.
Phases fantastiques
Dans les matériaux en trois dimensions - comme la vraie glace, et non pas comme dans les croquis de Kepler - tout devient plus compliqué, car en trois dimensions, il existe de nombreuses façons d'organiser les molécules dans des structures périodiques. Par exemple, il y a environ 17 phases de glace (environ parce que ce nombre dépend de la façon de les classer), dont la plus récente a été créée et étudiée par des scientifiques italiens l'année dernière. Différentes phases se produisent à différentes températures et pressions, et bien qu'elles soient toutes solides, chacune a sa propre densité, force, réaction aux champs électriques et magnétiques, conductivité thermique, etc. En raison de l'existence de ces différences de comportement macroscopique, nous les appelons différentes phases. Dans des conditions «normales» - température et pression à la surface de la Terre - la glace se présente généralement sous la forme de «glace I
h ». Cette forme cristalline hexagonale stable est précisément responsable de la symétrie sextuple des flocons de neige.
Selon les étiquettes des différentes phases de la glace, la glace IX existe réellement. Heureusement, à la température et à la pression à la surface de la Terre, il est beaucoup plus fragile que l'autre «glace neuf» - la phase stable, à cause de laquelle> les océans ont été durcis de façon catastrophique dans le roman de Kurt Vonnegut «Cradle for the Cat».
Et ce n'est pas tout, même avec une substance aussi familière. D'autres phases de glace non encore découvertes peuvent exister à des pressions ultra élevées dans les centres des géantes gazeuses comme Uranus et Neptune. Dans ces conditions extrêmes, à une pression de 10 millions d'atm. de plus, l'eau doit former des phases solides cristallines très étranges. Parmi eux, il y a une phase conductrice métallique, qui devrait être brillante si vous découvrez comment la polir.
Options intermédiaires
La connexion entre microstructure et macropropriétés est l'idée principale de la science et de l'ingénierie, elle est utilisée dans le développement de nombreux matériaux. Par exemple, les cristaux liquides sont un élément clé des ordinateurs portables, des téléviseurs et des écrans de smartphones. Les molécules de cristaux liquides ont une structure inhabituellement longue qui ressemble à un bâton. De ce fait, ils peuvent être en plusieurs phases différentes, avec des propriétés que l'on ne retrouve pas dans les matériaux conventionnels.
Par exemple, à des températures élevées, les molécules sont en désordre. Chaque «bâton» est dans un endroit aléatoire, comme les molécules dans l'eau liquide, et est orienté dans une direction arbitraire. Il s'agit d'une phase isotrope. À des températures plus basses, les molécules peuvent entrer dans la phase nématique, dans laquelle elles sont situées au hasard, comme dans l'eau liquide, mais dirigées dans la même direction. Puisqu'aucun réseau n'est formé, la phase nématique s'écoule comme un liquide, mais puisque les tiges sont dirigées dans une direction, elle a un ordre microscopique. Par conséquent, ils sont appelés "cristaux liquides".
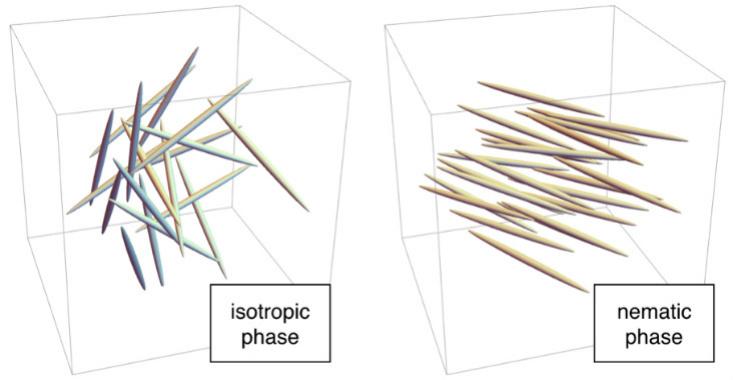
Heureusement pour les humains modernes, la phase nématique a des propriétés inhabituelles associées à la direction. Lorsqu'elles sont touchées dans un champ électrique, les molécules s'alignent le long de celui-ci. Sur les écrans LCD, les molécules en phase nématique se comportent comme un filtre polarisant: un appareil qui transmet la lumière lorsque les molécules sont orientées de manière particulière (par exemple de haut en bas) et la retarde lorsqu'elles sont orientées perpendiculairement. Puisqu'un filtre polarisant est nécessaire pour un tel travail, le filtre est placé entre la source de lumière et l'écran dans les téléphones et les écrans. Dans l'écran LCD, de minuscules électrodes à côté de chaque pixel créent un champ électrique qui contrôle la position des molécules à l'intérieur, et donc l'émission de lumière. Ce schéma de travail est utilisé dans les écrans IPS («commutation dans le plan»). Il existe d'autres options, par exemple, les écrans TN qui utilisent une phase nématique torsadée encore plus exotique.
Modélisation d'une miniature
Il est clair que la microstructure permet d'expliquer les propriétés des matériaux que nous rencontrons et créons. Mais peut-on voir l'ordre microscopique dans la vraie vie? Pour les substances ordinaires, comme la glace, le sel ou le métal, cela est difficile car les atomes et les molécules sont très petits. Une molécule d'eau mesure moins d'un milliardième de mètre - elle ne peut pas être vue dans un microscope optique conventionnel, et il est très difficile de la voir même en utilisant des techniques microscopiques modernes.
Heureusement, non seulement les atomes et les molécules sont capables de s'organiser indépendamment en phases. Au laboratoire de Chaikin au Soft Materials Research Center de l'Université de New York, nous utilisons de petites sphères dures pour étudier les phases de la matière. Ils sont appelés colloïdes et peuvent être fabriqués à partir de divers matériaux, tels que le verre, le plastique ou le métal. Les colloïdes en laboratoire sont 3000 fois plus gros que les molécules d'eau - ils sont comparables en taille aux bactéries ou aux noyaux de cellules animales. Pour les experts en matériaux, les colloïdes sont quelque chose comme des «particules idéales» - assez grandes pour être visibles au microscope et assez petites pour former des phases, un peu comme les matériaux ordinaires.
 Cette photo montre des colloïdes en plastique recouverts d'une composition chimique, grâce auxquels ils se repoussent, étant à la surface de l'eau
Cette photo montre des colloïdes en plastique recouverts d'une composition chimique, grâce auxquels ils se repoussent, étant à la surface de l'eauDans notre laboratoire, nous fabriquons des colloïdes avec un revêtement spécial qui leur permet d'adhérer à la surface de l'eau. Lorsqu'elles collent aux gouttelettes, nous pouvons prendre de belles microphotographies - comme celle-ci. Vous pouvez voir la structure microscopique des différentes phases sur elles et comment leur orientation conduit à l'apparition de propriétés macroscopiques telles que la dureté. Par exemple, nous étudions actuellement comment le comportement de nos particules change en fonction de l'utilisation de gouttelettes sphériques ou de surfaces planes d'eau. La présence de particules sur une sphère aide-t-elle ou empêche-t-elle la formation de cristaux et l'apparition de systèmes comme un solide? Cela peut nous aider à comprendre les propriétés des structures importantes qui ont une forme sphérique ou plus complexe. Si, par exemple, nous en savions plus sur les enrobages protéiques protégeant les gènes du VIH, nous pourrions apprendre à les décomposer et à vaincre le virus.
Quand les cristaux vont mal
L'une des étapes les plus importantes de l'étude de l'ordre microscopique est l'étude des conditions dans lesquelles l'ordre est perturbé. Par exemple, si vous regardez l'image des colloïdes dans le réseau cristallin, vous remarquerez que leur ordre est hétérogène. Vous pouvez voir des imperfections et des irrégularités, des défauts.
 L'image a été prise avec un microscope confocal - une peinture fluorescente est ajoutée à l'échantillon, qui est ensuite éclairée par un laser
L'image a été prise avec un microscope confocal - une peinture fluorescente est ajoutée à l'échantillon, qui est ensuite éclairée par un laserDes défauts similaires se produisent dans les cristaux d'atomes ou de molécules, et ils jouent un rôle important. Par exemple, ils déterminent la fragilité d'un matériau - quel type de charge il peut supporter avant qu'il ne casse. De plus, comme les défauts peuvent affecter la conductivité électrique d'un matériau, les fabricants de semi-conducteurs dépensent des milliards de dollars pour produire des monocristaux de silicium - des blocs de silicium géants sans presque aucun défaut. D'un autre côté, ces défauts microscopiques sont parfois très utiles. Des recherches récentes se sont concentrées sur la gestion et le contrôle des défauts du graphène pour l'optimiser comme filtre de dessalement.
Nous utilisons des cristaux colloïdaux pour observer comment les défauts apparaissent, se déplacent et interagissent les uns avec les autres. Comme les études de phase, l'étude des cristaux colloïdaux peut nous aider à comprendre les défauts d'autres matériaux. Comme dans de nombreux domaines de la vie, les imperfections sont parfois la partie la plus intéressante.