
Lorsqu'une certaine température est dépassée, la cellule devient inutilisable et meurt. L'une des explications les plus simples d'une telle intolérance à la chaleur est que les protéines nécessaires à la vie sont celles qui extraient l'énergie des aliments ou du soleil, se défendent des intrusions, détruisent les déchets, etc. - ont souvent une forme étonnamment précise. Commençant comme de longs brins, ils sont ensuite tordus sous la forme de spirales, d '"épingles à cheveux" et d'autres formes dictées par la séquence de leurs composants. Et ces formes jouent un rôle énorme dans leurs activités. Mais lorsque la température commence à augmenter, les liaisons qui maintiennent les structures protéiques sont rompues: d'abord les plus faibles, puis les plus fortes. Il est logique que la perte de propagation de la structure protéique soit mortelle, mais jusqu'à récemment, les détails de la façon exacte dont cela tue les cellules surchauffées n'étaient pas clairs.
Aujourd'hui, des biophysiciens de l'École technique supérieure suisse de Zurich ont étudié le comportement de chaque protéine dans les cellules de quatre organismes différents avec l'augmentation de la température. Cette étude et la riche collection de données recueillies
dans la revue Science ont montré qu'à une température suffisante pour la mort d'une cellule - humaine ou Escherichia coli E. coli - seules quelques protéines clés sont détruites. De plus, l'abondance des protéines dans les cellules a été associée de manière inattendue à leur stabilité. Des études ont permis aux scientifiques de se familiariser rapidement avec les règles fondamentales par lesquelles le travail des protéines et leur ordre sont construits, et dont les conséquences, comme il est devenu clair, vont bien au-delà de la simple mort par la chaleur.
Paola Piccotti , la biophysicienne qui a dirigé les travaux, a expliqué que les expériences étaient motivées par des questions anciennes et non résolues: pourquoi certaines cellules survivent-elles à des températures élevées, tandis que d'autres meurent? La bactérie Thermus thermophilus vit heureux dans les sources chaudes et les appareils de chauffage domestiques [à une température optimale de 65 ° C - env. trans.], tandis que les cellules d'E. coli languissent à des températures supérieures à 40 ° C. Des preuves convaincantes suggèrent que le point ici est la stabilité différente des protéines de ces organismes. Mais garder une trace de la protéine dans une cellule vivante, ce qui serait une méthode d'étude idéale, est très gênant. L'isolement de la protéine dans un tube à essai ne donne pas toutes les réponses, car à l'intérieur du corps, les protéines se collent et affectent la chimie de l'autre, ou elles se soutiennent mutuellement sous la forme nécessaire. Pour comprendre quoi exactement et pourquoi il se désagrège, il est nécessaire d'observer les protéines à un moment où elles s'affectent encore.
Comment la chaleur détruit les protéines
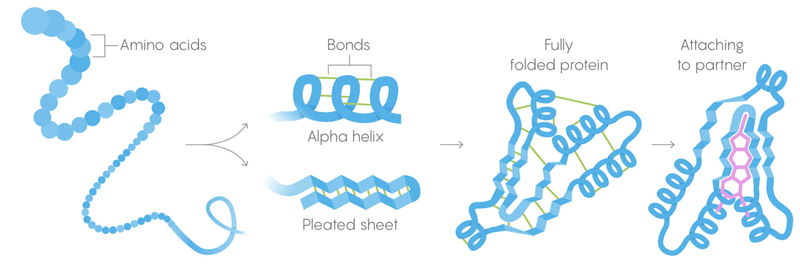 1) La structure primaire des protéines est constituée de longues chaînes d'acides aminés, combinées en séquences données par les gènes.
1) La structure primaire des protéines est constituée de longues chaînes d'acides aminés, combinées en séquences données par les gènes.
2) La structure secondaire est un acide aminé qui se replie également dans des configurations tenues par de faibles liaisons intermoléculaires.
3) Structure tertiaire - liaisons faibles stabilisant l'emplacement des sections droites et torsadées de la structure tridimensionnelle de la protéine. Leur emplacement permet à la protéine de se lier aux molécules désirées.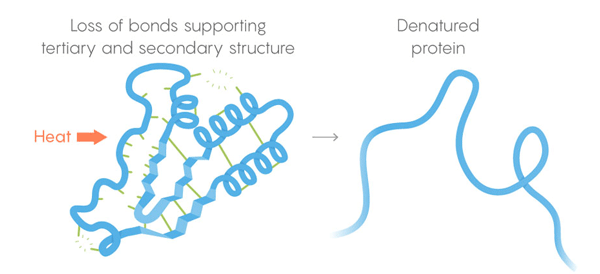 Mort thermique. Les liaisons faibles perdent leur capacité à conserver les structures tertiaires et secondaires, et les dénatures protéiques, c'est-à-dire, se déplient. Mais toutes les protéines ne se déroulent pas à la même température - l'environnement de la protéine dans la cellule peut lui donner une stabilisation supplémentaire.
Mort thermique. Les liaisons faibles perdent leur capacité à conserver les structures tertiaires et secondaires, et les dénatures protéiques, c'est-à-dire, se déplient. Mais toutes les protéines ne se déroulent pas à la même température - l'environnement de la protéine dans la cellule peut lui donner une stabilisation supplémentaire.Pour résoudre la tâche, l'équipe a développé une procédure de surveillance automatisée. Ils ont coupé les cellules et chauffé leur contenu par étapes, libérant à chaque étape les enzymes qui séparaient les protéines. Ces enzymes sont particulièrement efficaces pour couper les protéines dépliées, de sorte que les chercheurs basés sur les restes des protéines coupées pourraient juger quelles protéines se sont effondrées à une température donnée. Ainsi, ils ont pu construire des courbes de dénaturation pour chacune des milliers de protéines étudiées. Les arcs des courbes passent de la structure intacte de la protéine à une température confortable pour celle-ci à un état pleinement développé à haute température. Pour rechercher des différences entre les courbes de différentes espèces de êtres vivants, des expériences ont été menées sur les cellules humaines, E. coli, T. thermophilus et la levure. "L'étude était magnifique", a déclaré
Alan Drummond , biologiste à l'Université de Chicago, faisant référence à la fois à l'échelle et à la précision du processus.
Au cours des observations, il a été clairement constaté que les protéines de tous les êtres vivants ne se déroulent pas d'un coup avec l'augmentation de la température. "Nous avons vu que seul un petit sous-ensemble de protéines s'est effondré au tout début", a déclaré Piccotti, "et il s'agissait de protéines clés." Dans un diagramme avec entrelacement de liaisons protéine-protéine, les protéines les plus fragiles de ce petit sous-ensemble avaient souvent un grand nombre de liaisons, ce qui signifie qu'elles affectent de nombreux processus qui se produisent dans les cellules. "Sans ces protéines, les cellules ne peuvent pas fonctionner", a déclaré Piccotti. "Quand ils disparaissent, tout le réseau est détruit." Et avec elle, évidemment, la vie de la cellule s'arrête.
Ce paradoxe - les protéines les plus importantes se révèlent être les plus fragiles - peut être le reflet de la façon dont l'évolution les a créées pour effectuer les tâches correspondantes. Si une protéine a de nombreux rôles, son instabilité et sa tendance à se déplier et à recouvrir peuvent être un avantage, car elle peut lui permettre de prendre différentes formes, adaptées à différentes tâches. «Beaucoup de ces protéines clés ont une grande flexibilité, ce qui les rend moins stables», mais leur donne en même temps la capacité de se lier à diverses molécules cibles dans la cellule, a expliqué Piccotti. «C'est très probablement ainsi qu'ils font face à leurs fonctions. C'est un compromis. "
Après avoir soigneusement étudié E. coli, pour lequel les données recueillies étaient de la plus haute qualité, les chercheurs ont trouvé une relation entre l'abondance de protéines - le nombre de copies dans la cellule - et sa stabilité. Plus une protéine fait de copies d'une cellule, plus la température est nécessaire pour la détruire. Il s'avère qu'un grand nombre de copies n'est pas en corrélation avec la criticité de la protéine pour sa survie. Certaines protéines clés sont très rares. Ce lien entre l'abondance et la fiabilité confirme l'idée avancée par Drummond il y a dix ans - le système cellulaire qui fabrique les protéines a tendance à faire des erreurs de temps en temps. Une erreur déstabilise généralement la protéine. S'il s'avère que cette protéine est abondante et qu'une telle protéine apparaît dans la cellule cent ou mille fois par jour, des copies incorrectement pliées produites en grande quantité peuvent obstruer la cellule. Ainsi, il serait bénéfique pour l'organisme d'évoluer pour que les protéines les plus abondantes soient aussi les plus stables, ce qui est confirmé par les données obtenues par l'équipe Piccotti.
Pour comprendre quelles qualités d'une protéine la rendent stable, les chercheurs ont comparé les données d'E. Coli et de T. Thermophilus. Les protéines d'E. Coli ont commencé à se désagréger à 40 ° C et se sont presque complètement dégradées à 70 ° C. Mais à cette température, les protéines de T. thermophilus commençaient tout juste à ressentir de l'inconfort - certaines d'entre elles ont conservé leur forme même à 90 ° C. L'équipe a constaté que T. thermophilus avait généralement des protéines plus courtes, et certains types de formes et de composants protéiques étaient plus courants dans les plus stables.
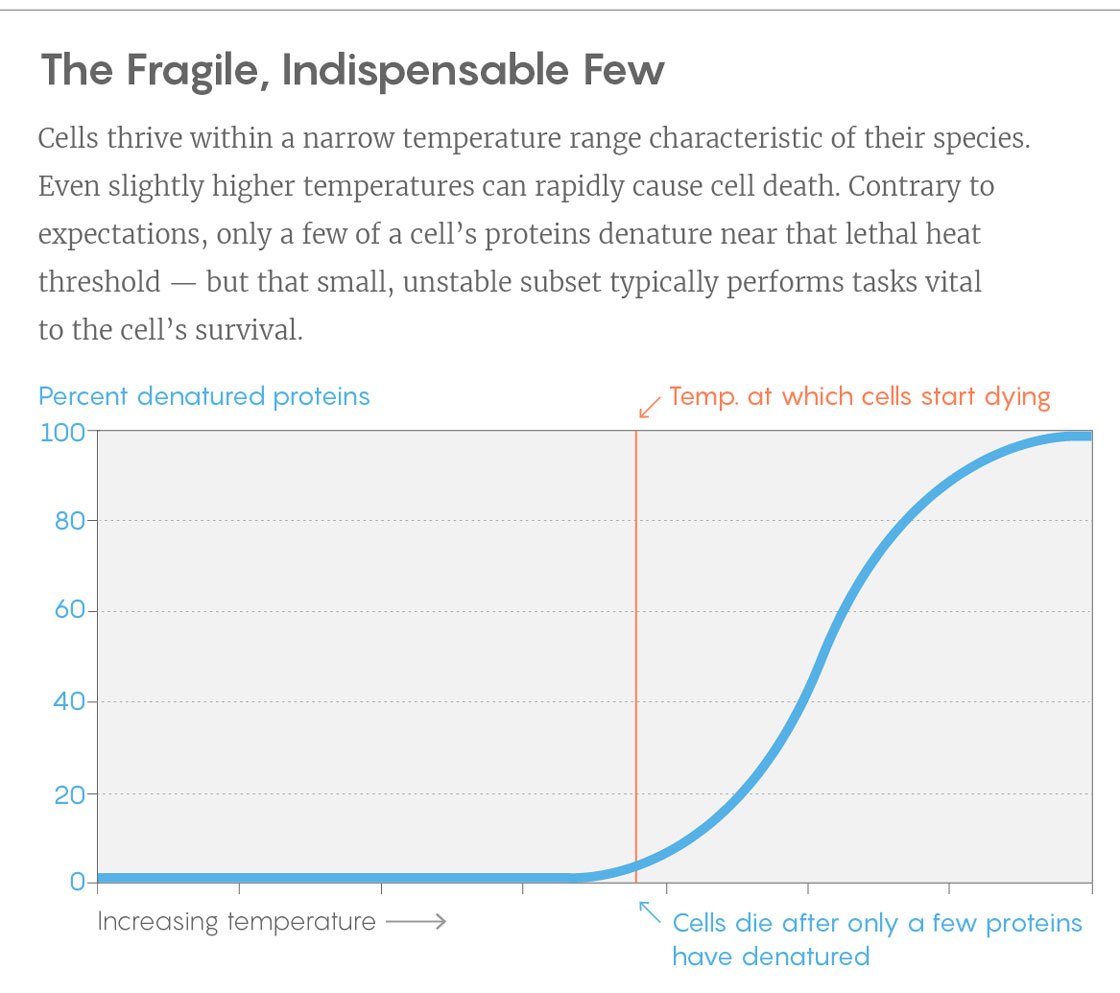 Un exemple de courbe d'une expérience. Vertical - pourcentage de protéines dépliées, horizontal - température. La barre verticale est la température à laquelle les cellules commencent à mourir. Pour ce faire, retournez juste quelques protéines clés.
Un exemple de courbe d'une expérience. Vertical - pourcentage de protéines dépliées, horizontal - température. La barre verticale est la température à laquelle les cellules commencent à mourir. Pour ce faire, retournez juste quelques protéines clés.Les découvertes peuvent aider les chercheurs à développer des protéines dont la stabilité est adaptée à leurs besoins. Dans de nombreux processus industriels où des bactéries sont utilisées, l'augmentation de la température augmente le retour - mais très vite, les bactéries commencent à mourir de la chaleur. Il serait intéressant de savoir si nous pouvons stabiliser les bactéries en rendant les protéines clés plus résistantes à la température, a déclaré Piccotti.
L'abondance d'informations sur la facilité avec laquelle certaines protéines se déplient a beaucoup plu à certains biologistes. La probabilité de son agrégation dépend directement de la stabilité de la protéine: l'apparition de grumeaux de protéines non développées adhérant les uns aux autres. Les agrégats de protéines peuvent se transformer en cauchemar pour les cellules et interférer avec la mise en œuvre des tâches principales. Par exemple, ils sont accusés de causer de graves problèmes neurologiques, comme la maladie d'Alzheimer, dans lesquels des plaques de protéines dépliées obstruent le cerveau.
 Paola Piccotti
Paola PiccottiMais cela ne signifie pas que l'agrégation se produit uniquement dans les organismes souffrant de certaines maladies. Au contraire, les chercheurs ont réalisé qu'il est possible que cela se produise tout le temps et que les cellules saines aient des méthodes pour y faire face. "Je pense que ce phénomène devient de plus en plus courant", a déclaré Michele Vendruscolo, biochimiste à l'Université de Cambridge. «La plupart des protéines ne se plient pas correctement et ne s'agrègent pas dans les cellules. La chose la plus importante que l'équipe Piccotti a établie est la durée pendant laquelle une protéine sélectionnée est à l'état expansé. Cette fois détermine le degré d'agrégation possible des protéines. » Certaines protéines ne se retournent presque jamais et ne s'agrègent pas, d'autres se comportent dans certaines conditions, tandis que d'autres le font tout le temps. Selon le biochimiste, une description détaillée des protéines dans le nouveau travail facilitera grandement l'étude et la compréhension de ces différences entre les protéines. Certaines courbes de dénaturation indiquent que leurs protéines s'agrègent après avoir été dépliées. "Ils ont réussi à suivre les deux étapes - à la fois le déploiement et l'agrégation ultérieure", a déclaré Vendruscolo. "C'est la beauté de cette étude."
Et bien que de nombreux scientifiques s'intéressent aux agrégats en raison des dommages qu'ils causent, certains envisagent ce phénomène d'un point de vue différent. Drummond dit qu'il devient clair que certains agrégats ne sont pas seulement des déchets qui pendent dans une cage. Ils contiennent des protéines actives qui continuent de remplir leurs fonctions.
Imaginez de loin que vous voyez de la fumée s'échapper d'un immeuble, explique Drummond. Autour du bâtiment, vous voyez des personnages, et vous imaginez que ce sont des corps extraits des ruines. Mais si vous vous rapprochez, vous découvrirez peut-être qu'il s'agit de personnes vivantes qui se sont échappées d'un immeuble en feu, attendant la fin de l'incident. C'est le cas de l'étude des agrégats, explique Drummond: les chercheurs constatent que les protéines dans les agrégats ne sont pas des victimes, mais des survivants. "Maintenant, un nouveau domaine scientifique se développe à un rythme explosif", dit-il.
L'agglutination des protéines peut ne pas être un signe de dommage, mais un moyen pour la protéine de maintenir ses fonctions dans une situation difficile. Il peut, par exemple, les protéger de l'environnement. Et lorsque les conditions s'améliorent, les protéines peuvent quitter les agrégats et se replier. "Leur forme change avec la température de telle manière qu'à première vue, il semble que le pliage soit incorrect", explique Drummond. "Mais cela a un autre sens." Dans un
article du magazine Cell de 2015, lui et ses collègues ont identifié 177 protéines de levure qui ont conservé leurs fonctions après leur entrée dans les agrégats. Dans un
article publié en mars, cette équipe a décrit que si l'une des protéines était modifiée de manière à ne pas pouvoir s'agréger, cela entraînerait de graves problèmes de fonctionnement de la cellule.
En général, les travaux affirment que les protéines sont des structures étonnamment dynamiques. Au début, ils peuvent ressembler à des machines rigides travaillant sur des tâches fixes pour lesquelles une forme particulière convient. Mais en fait, les protéines peuvent prendre plusieurs formes différentes au cours de leur fonctionnement normal. Et au bon moment, leur forme peut tellement changer qu'il peut sembler qu'elles se détériorent, bien qu'en fait elles se renforcent au contraire. Au niveau moléculaire, la vie peut être des connexions et des déconnexions permanentes de liaisons.