Classification des troubles dépressifs; le rôle des monoamines (dopamine, norépinéphrine et sérotonine); mécanismes d'action des antidépresseurs; dépression, stress et neuroplasticité.
Dépression (du lat.
Deprimo - supprimer) - une maladie mentale caractérisée par une
"triade dépressive" , qui comprend les troubles suivants:
1.
Dans la sphère émotionnelle. Humeur dépressive et anhédonie - incapacité à profiter des choses naturelles: nourriture, alcool, socialisation, sexe, etc.
2. Dans la sphère cognitive. Une image de soi négative, une expérience du monde négative, une vision négative de l'avenir - c'est la soi-disant
«triade cognitive» . La triade à l'intérieur de la triade + une personne est incapable d'une évaluation adéquate de la situation, ne peut pas appliquer l'expérience positive antérieure de résolution du problème.
3.
Dans la sphère motrice. En règle générale, l'inhibition motrice, mais il peut également y avoir une réaction inverse - une agitation agitée: un patient dans un environnement calme peut constamment sauter, balancer ses bras, changer constamment de posture, ou, par exemple, se lever et partir au milieu d'une conversation.
 Psychiatrie: un guide national. M.: GEOTAR-Media, 2009.1000 s.
Psychiatrie: un guide national. M.: GEOTAR-Media, 2009.1000 s.Il existe des symptômes supplémentaires: perte ou augmentation de l'appétit (perte ou gain de poids), troubles du sommeil (somnolence ou insomnie), sensation de fatigue, fatigue accrue, etc.
Selon l'OMS (Newsletter n ° 369), plus de 300 millions de personnes souffrent de dépression et cet indicateur a tendance à augmenter. La dépression est différente des changements d'humeur ordinaires et des réactions émotionnelles à court terme aux problèmes de la vie quotidienne. Cela peut entraîner de graves problèmes de santé, une mauvaise adaptation sociale, de mauvaises performances et un mauvais apprentissage. Dans le pire des cas, cela peut conduire au suicide.
Chaque année, environ 800 000 personnes meurent des suites du suicide - la deuxième cause de décès parmi les personnes âgées de 15 à 29 ans.
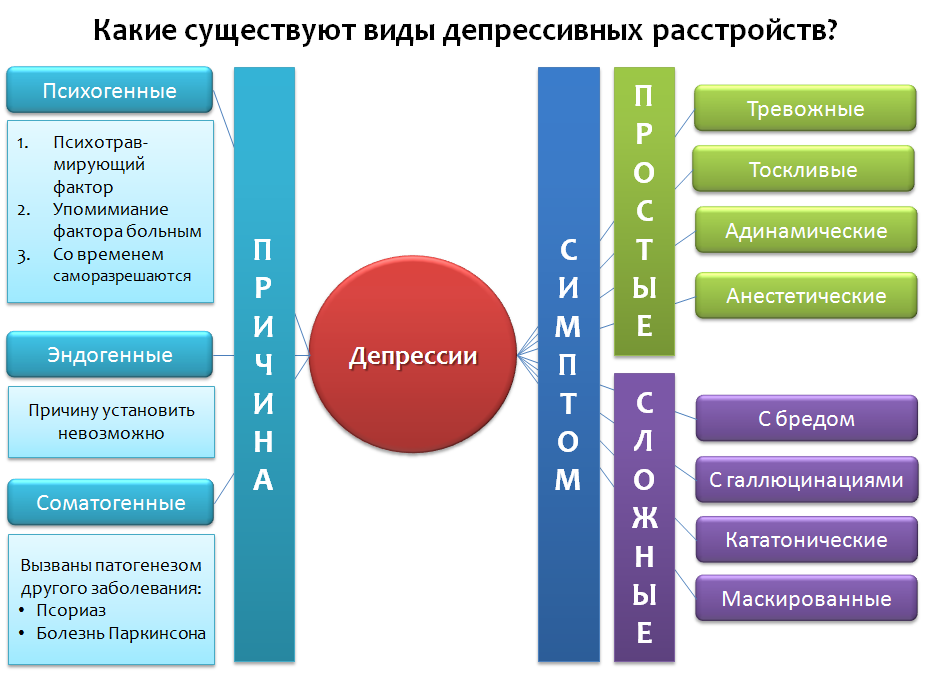 Fig. 1 Dépression: le traitement et la gestion de la dépression chez l'adulte (édition mise à jour). Leicester (Royaume-Uni): British Psychological Society, 2010.
Fig. 1 Dépression: le traitement et la gestion de la dépression chez l'adulte (édition mise à jour). Leicester (Royaume-Uni): British Psychological Society, 2010.Jetons un coup d'œil à la classification simplifiée des troubles dépressifs (Fig.1), qui n'est pas absolue, mais comprend des exemples de base. La dépression peut être classée pour la raison qui les a provoqués (étiologie), et la prédominance de certains symptômes, ainsi que leurs diverses combinaisons.
Dans le premier cas, trois catégories peuvent être distinguées:
1. Dépression
psychogène (réactive) causée par un facteur traumatique. Ce facteur apparaît dans le discours du patient. En règle générale, ces dépressions peuvent résoudre elles-mêmes au fil du temps, la cessation du facteur «le temps guérit».
2.
Endogène - dépressions causées par des facteurs internes qui ne peuvent être établis.
3.
Somatogène - causé par la pathogenèse (mécanisme du développement de la maladie) de diverses maladies. Il est important de ne pas les confondre avec des psychogènes. Par exemple, si une personne souffre de dépression parce qu'elle est
consciente de la présence d' une maladie, il s'agit d'une dépression psychogène (réactive). Somatogènes sont les dépressions causées par le mécanisme d'une autre maladie. Par exemple, dans la maladie de Parkinson, les cellules nerveuses qui produisent la dopamine meurent, qui à leur tour jouent un rôle important dans la réponse émotionnelle. Une carence en dopamine dans les zones du cerveau responsables de la réponse émotionnelle conduit à la dépression. Un deuxième exemple est le psoriasis, qui peut entraîner une diminution de la production de sérotonine (un régulateur important de l'humeur) dans le système nerveux central, et ainsi augmenter le risque de développer des troubles dépressifs.
Selon le symptôme dominant de la dépression, il peut y avoir: anxieux, morne, adynamique, anesthésique (manque d'émotions - «anesthésie émotionnelle») - ce sont des exemples de
«simple dépression» .
Les «dépressions complexes» combinent les symptômes de la dépression et d'autres psychopathologies: dépression avec délires, hallucinations, catatonique, masquée - les symptômes se déguisent en maladies des organes internes ou «somatisent» de manière différente - maux de tête, douleurs abdominales, cœur, etc.
La complexité du traitement des troubles dépressifs est le manque de guérison complète dans le cas de formes sévères ou compliquées de troubles dépressifs. Mais l'auto-résolution de cette maladie est également possible, si le cours n'est pas sévère, il n'y a pas de complications sous forme de symptômes d'autres psychopathologies, etc.
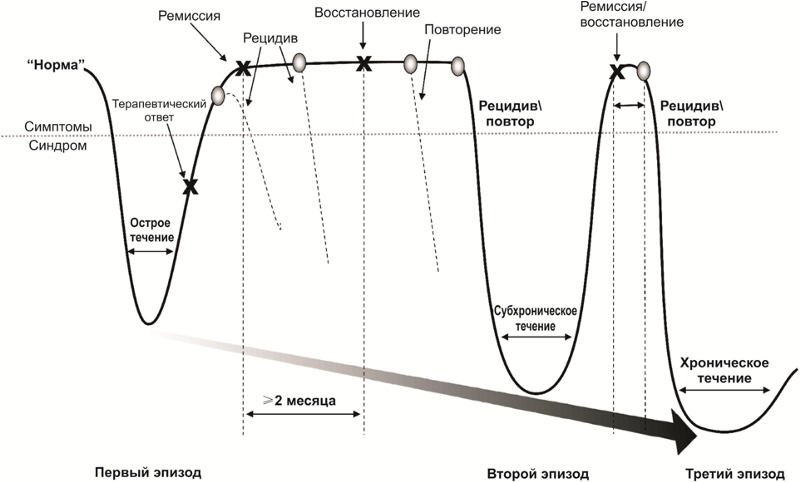 La nature de l'évolution des troubles dépressifs
La nature de l'évolution des troubles dépressifsAprès un traitement médicamenteux et psychothérapeutique réussi, une période de rémission commence, qui s'accompagne soit d'un affaiblissement (rémission partielle) soit d'une disparition complète des symptômes (rémission complète) de la maladie. Pendant la période de traitement actif et de rémission partielle ou complète, le risque de réapparition des symptômes de la maladie - rechute - demeure.
De plus, il existe des risques d'épisodes répétés de dépression après une guérison complète du premier épisode. Les épisodes répétés peuvent être caractérisés par un ensemble d'autres symptômes et une évolution plus sévère. La maladie peut acquérir une évolution chronique. Souvent, le premier épisode d'un trouble dépressif est psychogène (réactif) et répété (si le problème est insoluble, le facteur traumatique était trop fort ou prolongé) - endogène.
Sérotonine, norépinéphrine et dopamine
La figure 2 résume les principaux paramètres de la théorie de la dépression des monoamines.
Des formules de
monoamine sont données pour expliquer le nom de ce groupe de substances - elles ne contiennent qu'un seul groupe amino (-NH2).
Le rôle des monoamines dans le développement de symptômes dépressifs
 Fig. 2 Théorie de la dépression de la monoamine* Un autre groupe NH de sérotonine n'est pas un groupe amino, il fait partie de l'hétérocycle indole.
Fig. 2 Théorie de la dépression de la monoamine* Un autre groupe NH de sérotonine n'est pas un groupe amino, il fait partie de l'hétérocycle indole.On pense que le rôle des monoamines dans la formation de symptômes individuels de dépression est hétérogène. Ainsi,
pour un sentiment de culpabilité et d'inutilité, des idées suicidaires, ainsi qu'une perte d'appétit , une carence en sérotonine peut être responsable.
La dopamine et la noradrénaline sont responsables de l'
apathie, du dysfonctionnement exécutif et de la fatigue .
Une carence de
toutes les monoamines du complexe indique
une humeur dépressive, un dysfonctionnement psychomoteur et des troubles du sommeil.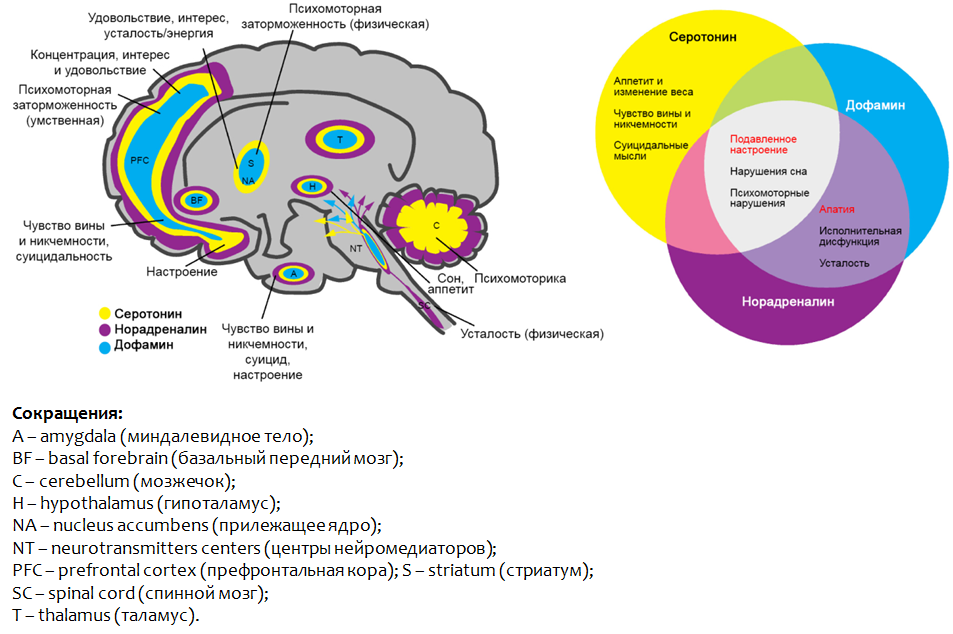 Fig.3. Saltiel PF, Silvershein DI Trouble dépressif majeur: prescription à base de mécanismes pour la médecine personnalisée // Neuropsychiatr Dis Treat. 2015. 11. P. 875–88.
Fig.3. Saltiel PF, Silvershein DI Trouble dépressif majeur: prescription à base de mécanismes pour la médecine personnalisée // Neuropsychiatr Dis Treat. 2015. 11. P. 875–88.La figure 3 montre les parties du cerveau où le dysfonctionnement des monoamines présentées conduit au développement de symptômes dépressifs.
Comme nous l'avons déjà dit, tous les antidépresseurs modernes cliniquement efficaces sont créés dans le cadre de la théorie de la dépression des monoamines.
Antidépresseurs
Conditionnellement, le principe d'action des antidépresseurs peut être divisé en deux groupes:
1. Moyens qui
augmentent la concentration de monoamines (principalement la sérotonine et la noradrénaline) dans le cerveau;
2. Moyens qui
assument la fonction de monoamines (principalement la sérotonine), stimulant des récepteurs spécifiques.
 Fig.4
Fig.4Examinons plus en détail les principaux groupes de mécanismes moléculaires des antidépresseurs. La figure 5 montre le contact synaptique entre deux cellules nerveuses: au-dessus se trouve la terminaison nerveuse d'un neurone (
synapse ), au-dessous se trouve une autre cellule nerveuse qui reçoit un signal.
Les principaux mécanismes moléculaires des antidépresseurs dans le contexte de l'hypothèse de dépression des monoamines
 Fig. 5. Traitement médicamenteux des troubles dépressifs et anxieux. Goodman et Gilman, The Pharmacological Basis of Therapeutics. Douzième édition. 2011. Stahl SM Psychopharmacologie de base des antidépresseurs. Partie 1: Les antidépresseurs ont sept mécanismes d'action distincts // The Journal of Clinical Psychiatry. 1998. 59. Suppl 4. P. 5-14.
Fig. 5. Traitement médicamenteux des troubles dépressifs et anxieux. Goodman et Gilman, The Pharmacological Basis of Therapeutics. Douzième édition. 2011. Stahl SM Psychopharmacologie de base des antidépresseurs. Partie 1: Les antidépresseurs ont sept mécanismes d'action distincts // The Journal of Clinical Psychiatry. 1998. 59. Suppl 4. P. 5-14.La synthèse des neurotransmetteurs (sérotonine et norépinéphrine) a lieu dans les cellules nerveuses, à l'aide desquelles les cellules se transmettent un signal. Les matières de départ pour la synthèse sont les acides aminés essentiels - le L-tryptophane et la L-phénylalanine. Après la synthèse, les neurotransmetteurs sont emballés dans des granules spéciaux -
vésicules , dans lesquels ils se déplacent vers les terminaisons nerveuses (
synapses ) et y sont déposés.
Après que la cellule a
reçu un stimulus spécifique, les
médiateurs sont libérés de la terminaison nerveuse (synapse) dans la
fente synaptique - l'écart entre deux cellules nerveuses. À la surface de la cellule de signal "réceptrice", il y a des formations protéiques spéciales - des
récepteurs (dans ce cas, la sérotonine et les récepteurs adrénergiques) qui se lient au médiateur. Après la liaison, le médiateur active (stimule) le récepteur correspondant, ce qui entraîne une modification des processus métaboliques au sein de la cellule et modifie en conséquence sa fonction (améliore ou supprime).
Après avoir rempli avec succès sa fonction, 80% du médiateur est capturé dans la cellule nerveuse, où une partie du médiateur est détruite par l'enzyme
monoamine oxydase de type A (MAO-A), et une partie est à nouveau emballée dans des vésicules pour être réutilisée. La recapture du médiateur peut réduire considérablement les coûts énergétiques pour la synthèse du médiateur à partir d'acides aminés.
 Fig. 6 Les inconvénients l'emportent et justifient la recherche de nouvelles hypothèses et cibles.
Fig. 6 Les inconvénients l'emportent et justifient la recherche de nouvelles hypothèses et cibles.En bref sur la façon dont les antidépresseurs agissent

1. Violer la recapture du neurotransmetteur dans la terminaison nerveuse, augmentant ainsi sa concentration dans la fente synaptique et améliorant son effet sur les récepteurs. Il est possible à la fois une violation distincte de la recapture de la sérotonine (fluoxétine, fluvoxamine, paroxétine) et de la norépinéphrine (réboxétine, atomoxétine), et une violation simultanée de la capture des deux médiateurs (amitriptyline).
2. Augmenter la libération de médiateurs des terminaisons nerveuses (mirtazapine et tianeptine
actuellement interdite ).
3. Supprimez l'activité de l'enzyme MAO-A et préservez ainsi le médiateur de la destruction (moclobémide).
4. Les récepteurs de la sérotonine du 1er sous-type (Vilazodone) sont stimulés, dont l'activation est associée au soulagement des symptômes dépressifs («bons» récepteurs).
5. Bloquer les récepteurs de la sérotonine de type 2 ("mauvais" récepteurs), qui sont responsables du développement de l'anxiété et des symptômes dépressifs (trazodone).
Dépression et stress
Actuellement, le stress se voit attribuer le rôle de l'un des mécanismes déclencheurs (déclencheurs) des troubles affectifs (troubles de la sphère émotionnelle, affect), y compris les troubles dépressifs. On pense qu'il est dangereux non seulement un événement stressant ponctuel et grave, mais un effet moins intense et constant du stress, en particulier des événements stressants imprévisibles de tous les jours. Il est impossible de s'adapter à de tels effets stressants, et cela conduit à l'activation chronique des mécanismes de défense et d'adaptation avec leur épuisement ultérieur.
L'un des éléments les plus importants de la réponse physiologique du corps au stress est l'axe hypothalamo-hypophyso-surrénalien (Fig. 7).
 Fig. 7. Varghese FP & Brown ES L'axe hypothalamo-hypophyso-surrénalien dans les troubles dépressifs majeurs: une brève introduction pour les médecins de soins primaires // Compagnon de soins primaires au Journal of Clinical Psychiatry. 2001,3 (4). P. 151-155.
Fig. 7. Varghese FP & Brown ES L'axe hypothalamo-hypophyso-surrénalien dans les troubles dépressifs majeurs: une brève introduction pour les médecins de soins primaires // Compagnon de soins primaires au Journal of Clinical Psychiatry. 2001,3 (4). P. 151-155.L'activation successive par le stress des structures centrales (amygdales - hypothalamus - hypophyse) conduit au développement d'hormones du cortex surrénal - glucocorticoïdes (cortisol) - hormones de stress. Ces derniers sont capables d'agir sur la structure du cerveau (responsable de la réponse au stress émotionnel (cortex préfrontal et hippocampe)) et de perturber les processus de neuroplasticité.
Troubles de la neuroplasticité *
Les violations de la neuroplasticité entraînent une violation de la connexion normale entre les structures du cerveau (responsable de la réponse émotionnelle).
* La neuroplasticité est la capacité du cerveau à s'adapter aux changements par la réorganisation, dans le cadre d'un développement normal et dans des conditions de pathologie.
 Fig. 8 Fuchs E., Flügge G. Neuroplasticité adulte: plus de 40 ans de recherche // Plasticité neuronale. 2014. Article ID 541870. Doi: 10.1155 / 2014/541870; Joyce Sh. Neuroplasticité et pratique clinique: renforcer la puissance du cerveau pour la santé // Frontiers in Psychology. 7 (2016): 1118. PMC. Web 7 mai 2017. Zilles K. Plasticité neuronale en tant que propriété adaptative du système nerveux central // Annals of Anatomy. 1992. Vol. 174. Non. 5. P. 383–391.
Fig. 8 Fuchs E., Flügge G. Neuroplasticité adulte: plus de 40 ans de recherche // Plasticité neuronale. 2014. Article ID 541870. Doi: 10.1155 / 2014/541870; Joyce Sh. Neuroplasticité et pratique clinique: renforcer la puissance du cerveau pour la santé // Frontiers in Psychology. 7 (2016): 1118. PMC. Web 7 mai 2017. Zilles K. Plasticité neuronale en tant que propriété adaptative du système nerveux central // Annals of Anatomy. 1992. Vol. 174. Non. 5. P. 383–391.Les plus importants dans le contexte des troubles dépressifs sont le cortex préfrontal, l'amygdale et l'hippocampe.
L'interaction des structures cérébrales est normale
 Fig. 9. Gorman JM, Docherty JP Un rôle hypothétique pour le remodelage dendritique dans l'étiologie des troubles de l'humeur et de l'anxiété // The Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22: 3. P. 256–264
Fig. 9. Gorman JM, Docherty JP Un rôle hypothétique pour le remodelage dendritique dans l'étiologie des troubles de l'humeur et de l'anxiété // The Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22: 3. P. 256–264Normalement, lorsqu'il existe une connexion à part entière entre les neurones de ces structures, le cortex préfrontal traite les informations reçues de l'hippocampe (mémoire, coloration émotionnelle des souvenirs et des événements). L'amygdale est la structure responsable de la sensation de peur. Normalement, le cortex préfrontal supprime l'activité excessive de cette structure.
Fig. 10Il est connu que dans le contexte des troubles dépressifs, les processus de neuroplasticité sont perturbés, en particulier, le nombre de contacts entre les cellules nerveuses diminue, la vitesse de transmission des impulsions change et le nombre de neurones diminue. De plus, dans le contexte de la dépression, une diminution du volume de l'hippocampe et du cortex préfrontal est notée. De tels changements contribuent à la perturbation de la relation fonctionnelle normale entre les structures présentées.
Les symptômes dépressifs, apparemment, peuvent être médiés par ces changements: l'anxiété incontrôlée qui se produit souvent chez les patients souffrant de dépression peut être due au manque d'inhibition de l'amygdale par le cortex préfrontal.
L'interaction des structures cérébrales dans la dépression (théorie)
 Fig.11. Gorman JM, Docherty JP Un rôle hypothétique pour le remodelage dendritique dans l'étiologie des troubles de l'humeur et de l'anxiété. Le Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22 (3). P. 256–64. Kudryashov N.V. Une étude expérimentale de l'activité psychotrope des dérivés de pyrazolo [c] pyridine GIZH-72 et pyrrolodiazépine GMAL-24 dans des conditions de stress modéré chronique imprévisible / Dissertation du candidat des sciences biologiques. 14/03/06. M., 2016. 198 p.
Fig.11. Gorman JM, Docherty JP Un rôle hypothétique pour le remodelage dendritique dans l'étiologie des troubles de l'humeur et de l'anxiété. Le Journal of Neuropsychiatry and Clinical Neurosciences. 2010.22 (3). P. 256–64. Kudryashov N.V. Une étude expérimentale de l'activité psychotrope des dérivés de pyrazolo [c] pyridine GIZH-72 et pyrrolodiazépine GMAL-24 dans des conditions de stress modéré chronique imprévisible / Dissertation du candidat des sciences biologiques. 14/03/06. M., 2016. 198 p.L'incapacité à évaluer correctement la situation et à utiliser l'expérience positive précédente est le résultat d'une violation de la connexion entre le cortex préfrontal et l'hippocampe. Une diminution du volume de l'hippocampe peut expliquer une humeur pathologiquement réduite.
Les mécanismes de régulation de la neuroplasticité dans le cadre des troubles dépressifs
Fig.12Un important régulateur des processus de neuroplasticité est le
facteur neurotrophique cérébral (BDNF -
facteur neurotrophique dérivé du cerveau ), dont les niveaux diminuent en raison du stress et de la dépression.
Les hormones de stress, comme le cortisol, un glucocorticostéroïde produit par le cortex surrénalien, peuvent également agir comme régulateurs négatifs de la neuroplasticité. Il est bien connu que la plupart des antidépresseurs utilisés (en utilisation chronique) sont capables d'augmenter les niveaux de BDNF et, apparemment, cela fait partie de leur effet thérapeutique.
Propriétés du facteur neurotrophique cérébral (BDNF *) et perspective de son utilisation comme antidépresseur
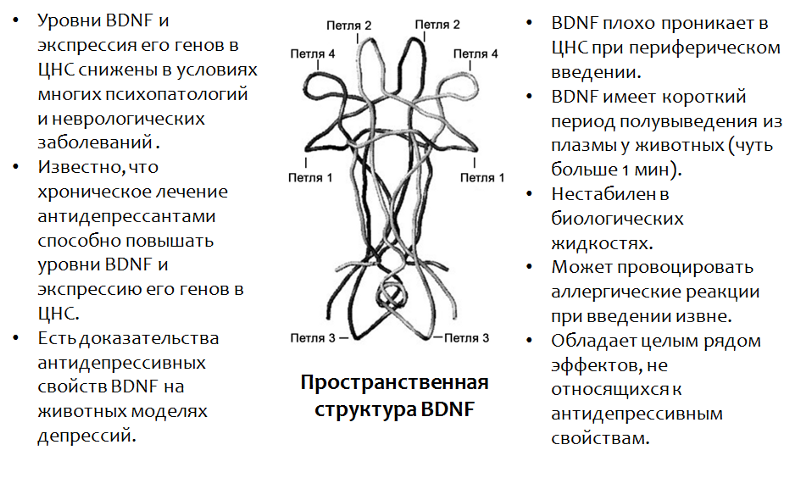 Fig.13. Castrén E., Rantamäki T. Le rôle du BDNF et de ses récepteurs dans la dépression et l'action des antidépresseurs: réactivation de la plasticité du développement // Developmental Neurobiology. 2010,70 (5). P. 289–97.
Fig.13. Castrén E., Rantamäki T. Le rôle du BDNF et de ses récepteurs dans la dépression et l'action des antidépresseurs: réactivation de la plasticité du développement // Developmental Neurobiology. 2010,70 (5). P. 289–97.* Le BDNF joue un rôle important dans de nombreuses psychopathologies, notamment et la dépression. L'utilisation du BDNF lui-même n'est pas possible pour un certain nombre de raisons (énumérées dans la figure).
En plus des antidépresseurs, il existe d'autres facteurs qui contribuent à une augmentation des niveaux de BDNF dans le système nerveux central et qui coïncident avec des stimuli positifs de la neuroplasticité - entraînement, exercice, nouvelle expérience, alimentation, etc. De plus, ces facteurs peuvent souvent compléter le traitement médicamenteux des troubles dépressifs.
La figure 14 présente des données sur une étude des propriétés antidépressives du BDNF lui-même dans des modèles animaux (rats). Étant donné que le BDNF lui-même ne peut pas pénétrer dans le cerveau (à travers la barrière hémato-encéphalique) avec une administration périphérique, dans les expériences, le BDNF a été injecté directement dans le cerveau.
L'étude des propriétés antidépressives du facteur neurotrophique cérébral (BDNF) dans des modèles animaux
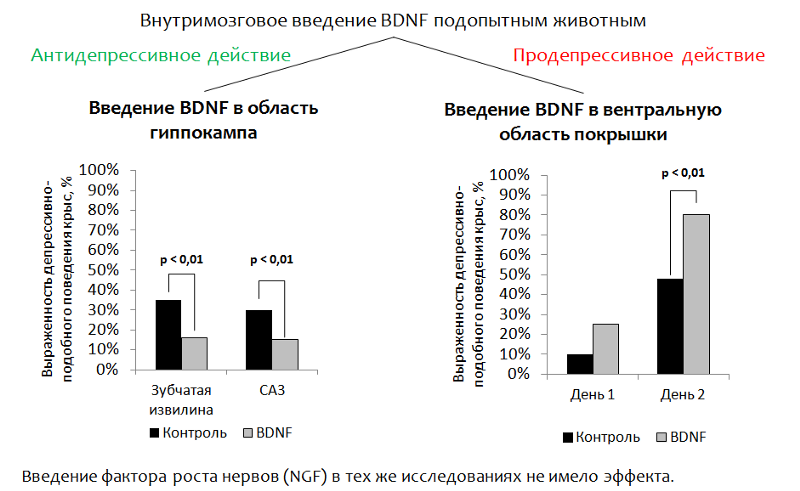 Fig. 14 Eisch AJ, Bolaños CA, de Wit J. et al. Facteur neurotrophique dérivé du cerveau dans la voie vumb midbrain-nucleus accumbens: un rôle dans la dépression // Biological Psychiatry. 2003,54 (10). P. 994-1005; Shirayama Y., Chen AC, Nakagawa S., Russell DS, Duman RS Le facteur neurotrophique dérivé du cerveau produit des effets antidépresseurs dans les modèles comportementaux de la dépression. Journal of Neuroscience. 2002,22 (8). P. 3251–61.
Fig. 14 Eisch AJ, Bolaños CA, de Wit J. et al. Facteur neurotrophique dérivé du cerveau dans la voie vumb midbrain-nucleus accumbens: un rôle dans la dépression // Biological Psychiatry. 2003,54 (10). P. 994-1005; Shirayama Y., Chen AC, Nakagawa S., Russell DS, Duman RS Le facteur neurotrophique dérivé du cerveau produit des effets antidépresseurs dans les modèles comportementaux de la dépression. Journal of Neuroscience. 2002,22 (8). P. 3251–61.1.
Introduction à l'hippocampe . L'idée principale était l'introduction ciblée de BDNF dans la zone du cerveau responsable de la neurogenèse (le gyrus denté de l'hippocampe est l'une des soi-disant
"niches neurogènes" ). Après administration, le comportement dépressif des animaux a été évalué.
(La composante dysphorique de la dépression est évaluée. Les animaux (rats ou souris) sont placés dans un cylindre avec de l'eau d'où il est impossible de sortir d'eux-mêmes. Après un certain temps, les tentatives actives de l'animal pour sortir du cylindre sont remplacées par un «état de désespoir» (l'animal est dans l'eau avec pratiquement aucun mouvement.)La réduction de l'immobilité (immobilisation) de l'animal est considérée comme un corrélat de l'effet antidépresseur. Le BDNF a eu un effet antidépresseur après son introduction dans le gyrus denté (niche neurogène) et la zone CA3 de l'hippocampe (les neurones de cette zone assurent l'interaction du gyrus denté avec d'autres zones de l'hippocampe).
2.
Lorsque le BDNF a été introduit dans la région ventrale du pneu (la zone responsable de la production de dopamine et souffrant de troubles dépressifs), l'effet inverse a été enregistré - une augmentation du comportement de type dépressif.
Mimétique
Puisqu'il n'est pas possible d'utiliser le BDNF lui-même comme médicament, un médicament basé sur ce facteur est en cours de développement.
En particulier, les régions actives de la molécule de BDNF ont été bien étudiées (dont la structure spatiale détermine la boucle de nom. Fig. 15).Actuellement, les mimétiques (substances qui imitent l'activité) du BDNF sont activement étudiées.Développement d'une nouvelle génération de médicaments à base de facteur neurotrophique cérébral (BDNF)
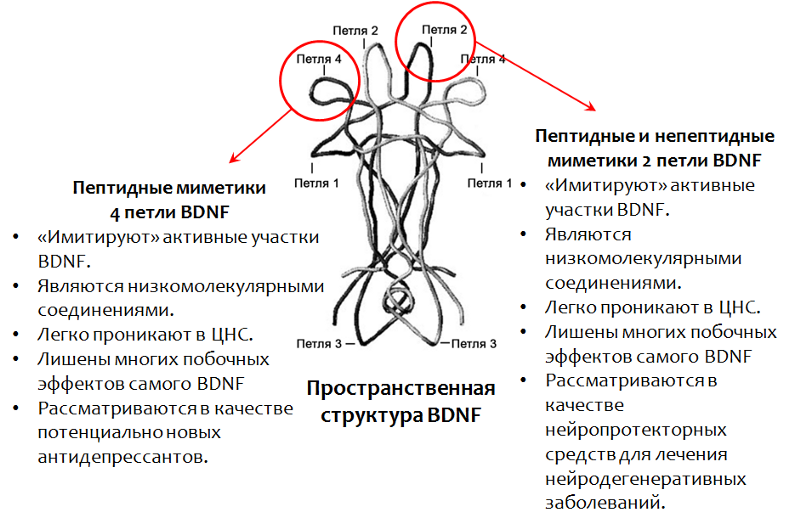 .15. Fletcher JM, Morton CJ, Zwar RA et al. Design of a conformationally defined and proteolytically stable circular mimetic of brain-derived neurotrophic factor // The Journal of Biological Chemistry. 2008. 283(48). P. 33375–83. Massa SM, Yang T., Xie Y. et al. V Small molecule BDNF mimetics activate TrkB signaling and prevent neuronal degeneration in rodents // The Journal of Clinical Investigation. 2010. 120(5). P. 1774–85. .., .., .. . BDNF, -106 // Acta Naturae. 2013. 4(19). P. 116–120.
.15. Fletcher JM, Morton CJ, Zwar RA et al. Design of a conformationally defined and proteolytically stable circular mimetic of brain-derived neurotrophic factor // The Journal of Biological Chemistry. 2008. 283(48). P. 33375–83. Massa SM, Yang T., Xie Y. et al. V Small molecule BDNF mimetics activate TrkB signaling and prevent neuronal degeneration in rodents // The Journal of Clinical Investigation. 2010. 120(5). P. 1774–85. .., .., .. . BDNF, -106 // Acta Naturae. 2013. 4(19). P. 116–120.4 (BDNF) — -106
 Fig. 16. Seredenin S.B., Voronina T.A., Gudasheva T.A. et al. Effet antidépresseur du mimétique original de faible masse moléculaire BDNF, le dipeptide dimérique GSB-106 // Acta Naturae. 2013,4 (19). P. 116-120.GSB-106 - une substance de la structure peptidique, est un BDNF mimétique à 4 boucles (développement domestique). La substance a un effet antidépresseur sur des modèles animaux sous différents modes d'administration. Actuellement, des études approfondies sur les propriétés pharmacologiques de ce composé sont en cours dans le but de créer une nouvelle génération d'antidépresseurs sur sa base.
Fig. 16. Seredenin S.B., Voronina T.A., Gudasheva T.A. et al. Effet antidépresseur du mimétique original de faible masse moléculaire BDNF, le dipeptide dimérique GSB-106 // Acta Naturae. 2013,4 (19). P. 116-120.GSB-106 - une substance de la structure peptidique, est un BDNF mimétique à 4 boucles (développement domestique). La substance a un effet antidépresseur sur des modèles animaux sous différents modes d'administration. Actuellement, des études approfondies sur les propriétés pharmacologiques de ce composé sont en cours dans le but de créer une nouvelle génération d'antidépresseurs sur sa base.Neurogenèse * et dépression
* La neurogenèse est un processus en plusieurs étapes de formation de nouvelles cellules nerveuses dans le système nerveux central mature, qui est une fonction adaptative du système nerveux.
 Fuchs E., Flügge G. Neuroplasticité adulte: plus de 40 ans de recherche // Plasticité neuronale. 2014. Numéro d'article 541870, doi: 10.1155 / 2014/541870Fig. 17Dans la figure 17, nous montrons les zones neurogènes (niches) des mammifères:1) Le gyrus denté de l'hippocampe2) Les bulbes olfactifs3) La zone sousventriculaireOn pense que la principale niche neurogène chez l'homme est l'hippocampe (gyrus denté).Le stress, qui est considéré comme l'un des principaux déclencheurs des troubles dépressifs, conduit à une diminution des taux de BDNF et à une augmentation du cortisol, qui, à son tour, renforce l'effet du glutamate sur le système nerveux central.
Fuchs E., Flügge G. Neuroplasticité adulte: plus de 40 ans de recherche // Plasticité neuronale. 2014. Numéro d'article 541870, doi: 10.1155 / 2014/541870Fig. 17Dans la figure 17, nous montrons les zones neurogènes (niches) des mammifères:1) Le gyrus denté de l'hippocampe2) Les bulbes olfactifs3) La zone sousventriculaireOn pense que la principale niche neurogène chez l'homme est l'hippocampe (gyrus denté).Le stress, qui est considéré comme l'un des principaux déclencheurs des troubles dépressifs, conduit à une diminution des taux de BDNF et à une augmentation du cortisol, qui, à son tour, renforce l'effet du glutamate sur le système nerveux central. Fig. 18Ces changements, dans l'ensemble, suppriment la neurogenèse hippocampique et conduisent à une diminution du volume de l'hippocampe. Sous l'action du glutamate, l'apoptose (mort programmée des cellules nerveuses) est également possible. En violation de la neurogenèse, le cerveau ne peut pas compenser complètement la perte et développer des symptômes dépressifs.Le glutamate est l'un des principaux acides aminés excitateurs du système nerveux central. La violation de la neuroplasticité sous l'influence de l'action excessive du glutamate est apparemment associée à une réaction compensatoire. Les neurones «suppriment» les connexions inutiles et meurent (apoptose) afin de protéger le système nerveux central de la surexcitation et des conséquences dommageables subséquentes de ce processus.Un fait bien connu est la capacité des antidépresseurs à stimuler la neurogenèse, cependant, les mécanismes sous-jacents à ce phénomène n'ont pas encore été entièrement étudiés. Il est connu que tous les groupes d'antidépresseurs agissent sur le système monoamine du cerveau et compensent les déficits fonctionnels ou matériels de la sérotonine et de la norépinéphrine. De plus, les médicaments de ce groupe pharmacologique augmentent les niveaux de facteur neurotrophique cérébral.
Fig. 18Ces changements, dans l'ensemble, suppriment la neurogenèse hippocampique et conduisent à une diminution du volume de l'hippocampe. Sous l'action du glutamate, l'apoptose (mort programmée des cellules nerveuses) est également possible. En violation de la neurogenèse, le cerveau ne peut pas compenser complètement la perte et développer des symptômes dépressifs.Le glutamate est l'un des principaux acides aminés excitateurs du système nerveux central. La violation de la neuroplasticité sous l'influence de l'action excessive du glutamate est apparemment associée à une réaction compensatoire. Les neurones «suppriment» les connexions inutiles et meurent (apoptose) afin de protéger le système nerveux central de la surexcitation et des conséquences dommageables subséquentes de ce processus.Un fait bien connu est la capacité des antidépresseurs à stimuler la neurogenèse, cependant, les mécanismes sous-jacents à ce phénomène n'ont pas encore été entièrement étudiés. Il est connu que tous les groupes d'antidépresseurs agissent sur le système monoamine du cerveau et compensent les déficits fonctionnels ou matériels de la sérotonine et de la norépinéphrine. De plus, les médicaments de ce groupe pharmacologique augmentent les niveaux de facteur neurotrophique cérébral.Les antidépresseurs peuvent stimuler la neurogenèse
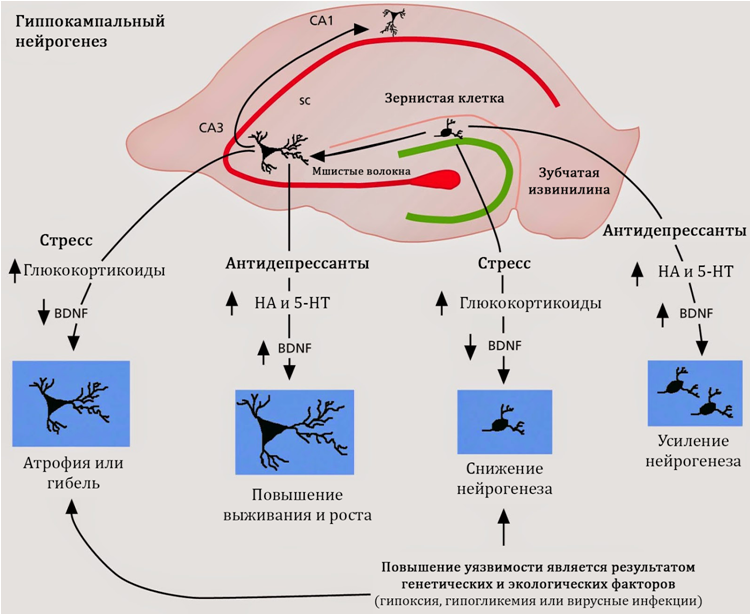 Fig. 19La stimulation de la neurogenèse est caractéristique des antidépresseurs, quels que soient leur mécanisme d'action, leur structure chimique ou leur classe. Par conséquent, la recherche de mécanismes de régulation de la neurogenèse doit être effectuée dans des propriétés communes à tous les antidépresseurs. Ces propriétés communes sont l'activité des antidépresseurs contre la sérotonine et la noradrénaline.Aujourd'hui, une idée se dessine sur le rôle de la sérotonine dans la régulation de la neurogenèse hippocampique.
Fig. 19La stimulation de la neurogenèse est caractéristique des antidépresseurs, quels que soient leur mécanisme d'action, leur structure chimique ou leur classe. Par conséquent, la recherche de mécanismes de régulation de la neurogenèse doit être effectuée dans des propriétés communes à tous les antidépresseurs. Ces propriétés communes sont l'activité des antidépresseurs contre la sérotonine et la noradrénaline.Aujourd'hui, une idée se dessine sur le rôle de la sérotonine dans la régulation de la neurogenèse hippocampique.Mécanismes possibles de l'activité neurogène des antidépresseurs
 Fig. 20. Alenina N., Klempin F. Le rôle de la sérotonine dans la neurogenèse hippocampique adulte. Recherche sur le cerveau comportemental. 2015. 277. p. 49–57.Premièrement, le gyrus denté de l'hippocampe reçoit une régulation de la sérotonine des gros noyaux de la suture (l'accumulation de cellules nerveuses qui produisent de la sérotonine; situées dans le tronc cérébral) à la fois directement et par l'intermédiaire de neurones intercalaires qui portent divers sous-types de récepteurs de la sérotonine à leur surface.Deuxièmement, sur les cellules souches elles-mêmes, des récepteurs de la sérotonine du sous-type 1A ont été détectés , ce qui indique la capacité potentielle de la sérotonine à réguler les cellules souches du cerveau.
Fig. 20. Alenina N., Klempin F. Le rôle de la sérotonine dans la neurogenèse hippocampique adulte. Recherche sur le cerveau comportemental. 2015. 277. p. 49–57.Premièrement, le gyrus denté de l'hippocampe reçoit une régulation de la sérotonine des gros noyaux de la suture (l'accumulation de cellules nerveuses qui produisent de la sérotonine; situées dans le tronc cérébral) à la fois directement et par l'intermédiaire de neurones intercalaires qui portent divers sous-types de récepteurs de la sérotonine à leur surface.Deuxièmement, sur les cellules souches elles-mêmes, des récepteurs de la sérotonine du sous-type 1A ont été détectés , ce qui indique la capacité potentielle de la sérotonine à réguler les cellules souches du cerveau.Les mécanismes de l'activité neurogène des antidépresseurs
 Fig. 21Comme le montrent les études expérimentales (sur les animaux et les cultures cellulaires), les inhibiteurs sélectifs du recaptage de la sérotonine (ISRS, un médicament classique de ce groupe - la fluoxétine) peuvent stimuler le stade de prolifération de la neurogenèse dans l'hippocampe.Le mécanisme proposé est une augmentation de la concentration de sérotonine (5-HT - sérotonine, également connue sous le nom de 5-hydroxytryptamine) dans le système nerveux central et la stimulation (renforcée) ultérieure de la neurogenèse de la sérotonine. Les récepteurs du sous-type 1A de la sérotonine (récepteurs 5HT1A) peuvent également servir decibles potentielles pour les antidépresseurs pendant la neurogenèse. Ces hypothèses sont cohérentes avec les données sur l'effet positif (thérapeutique) de l'activation des récepteurs de la sérotonine 5-HT1A par les antidépresseurs (par exemple, Vilazodone) dans un contexte de troubles dépressifs.Un autre argument qui nous permet de considérer la stimulation de la neurogenèse comme le principal mécanisme d'action des antidépresseurs est la coïncidence dans le temps entre le temps moyen de début de l'effet thérapeutique (de 2 à 7 semaines) et le cycle complet de la neurogenèse (3-7 semaines).En plus de ces mécanismes, les antidépresseurs SSRI démontrent également la capacité d'augmenter les niveaux de BDNF, mais les mécanismes de cet effet restent inconnus.
Fig. 21Comme le montrent les études expérimentales (sur les animaux et les cultures cellulaires), les inhibiteurs sélectifs du recaptage de la sérotonine (ISRS, un médicament classique de ce groupe - la fluoxétine) peuvent stimuler le stade de prolifération de la neurogenèse dans l'hippocampe.Le mécanisme proposé est une augmentation de la concentration de sérotonine (5-HT - sérotonine, également connue sous le nom de 5-hydroxytryptamine) dans le système nerveux central et la stimulation (renforcée) ultérieure de la neurogenèse de la sérotonine. Les récepteurs du sous-type 1A de la sérotonine (récepteurs 5HT1A) peuvent également servir decibles potentielles pour les antidépresseurs pendant la neurogenèse. Ces hypothèses sont cohérentes avec les données sur l'effet positif (thérapeutique) de l'activation des récepteurs de la sérotonine 5-HT1A par les antidépresseurs (par exemple, Vilazodone) dans un contexte de troubles dépressifs.Un autre argument qui nous permet de considérer la stimulation de la neurogenèse comme le principal mécanisme d'action des antidépresseurs est la coïncidence dans le temps entre le temps moyen de début de l'effet thérapeutique (de 2 à 7 semaines) et le cycle complet de la neurogenèse (3-7 semaines).En plus de ces mécanismes, les antidépresseurs SSRI démontrent également la capacité d'augmenter les niveaux de BDNF, mais les mécanismes de cet effet restent inconnus.L'effet de la fluoxétine (Prozac) sur la neurogenèse des primates non humains
 Fig. 22. Perera TD, Dwork AJ, Keegan KA et al. Nécessité de la neurogenèse hippocampique pour l'action thérapeutique des antidépresseurs chez les primates non humains adultes // PLoS ONE. 2011,6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Des études sur les primates (le modèle animal le plus pertinent) ont montré la capacité de la fluoxétine (nom commercial "Prozac") à stimuler la neurogenèse contre le stress (dans ce cas, un modèle de stress d'isolement a été utilisé). La figure 22 montre que la fluoxétine a augmenté de manière significative (statistiquement significative) le taux de prolifération (division) des cellules nerveuses souches dans l'hippocampe des primates.
Fig. 22. Perera TD, Dwork AJ, Keegan KA et al. Nécessité de la neurogenèse hippocampique pour l'action thérapeutique des antidépresseurs chez les primates non humains adultes // PLoS ONE. 2011,6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Des études sur les primates (le modèle animal le plus pertinent) ont montré la capacité de la fluoxétine (nom commercial "Prozac") à stimuler la neurogenèse contre le stress (dans ce cas, un modèle de stress d'isolement a été utilisé). La figure 22 montre que la fluoxétine a augmenté de manière significative (statistiquement significative) le taux de prolifération (division) des cellules nerveuses souches dans l'hippocampe des primates.L'effet de la fluoxétine sur la neurogenèse des primates non humains
 Fig. 23. Perera TD, Dwork AJ, Keegan KA, et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.
Fig. 23. Perera TD, Dwork AJ, Keegan KA, et al. Necessity of Hippocampal Neurogenesis for the Therapeutic Action of Antidepressants in Adult Nonhuman Primates // PLoS ONE. 2011. 6(4):e17600. doi:10.1371/journal.pone.0017600.— . ( ).
(- )
Perera TD, Dwork AJ, Keegan KA et al. Nécessité de la neurogenèse hippocampique pour l'action thérapeutique des antidépresseurs chez les primates non humains adultes. PLOS ONE. 2011,6 (4): e17600. doi: 10.1371 / journal.pone.0017600.Il a été constaté qu'il existe une corrélation entre la stimulation de la neurogenèse par la fluoxétine et la prévention du développement d'un comportement dépressif (anhédonie).
Lors de l'étude de l'effet de la fluoxitine sur la neurogenèse de primates non humains, une corrélation fiable a été établie entre une diminution de la neurogenèse (causée par le stress) et une augmentation du comportement dépressif des primates (anhédonie, qui a été déterminée par une combinaison de troubles sociaux et alimentaires), ainsi qu'une corrélation entre la stimulation de la neurogenèse par la fluoxétine et l'absence de dépression -comportement semblable.
La norépinéphrine est une autre monoamine importante qui, avec la sérotonine, est en mesure de participer à la régulation de la neurogenèse hippocampique.
Mécanismes possibles de l'activité neurogène des antidépresseurs
 Fig.25. Jhaveri DJ, Mackay EW, Hamlin AS, et al. La norépinéphrine active directement les précurseurs de l'hippocampe adulte via les récepteurs adrénergiques β3 // The Journal of Neuroscience. 2010,30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.
Fig.25. Jhaveri DJ, Mackay EW, Hamlin AS, et al. La norépinéphrine active directement les précurseurs de l'hippocampe adulte via les récepteurs adrénergiques β3 // The Journal of Neuroscience. 2010,30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.Dans des études sur des cultures de neurones hippocampiques, il a été montré que la norépinéphrine (contrairement à la sérotonine) augmentait le nombre de cellules souches. La sérotonine, comme démontré précédemment, n'a pas affecté la quantité, mais le taux de prolifération.
En plus des changements quantitatifs, la norépinéphrine a également causé des changements qualitatifs - elle a augmenté la taille des neurosphères, ce qui est clairement montré sur l'image du microscope électronique (voir Fig.26).
Mécanismes possibles de l'activité neurogène des antidépresseurs
 Fig. 26. Jhaveri DJ, Mackay EW, Hamlin AS, et al. La norépinéphrine active directement les précurseurs de l'hippocampe adulte via les récepteurs adrénergiques β3 // The Journal of Neuroscience. 2010,30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.
Fig. 26. Jhaveri DJ, Mackay EW, Hamlin AS, et al. La norépinéphrine active directement les précurseurs de l'hippocampe adulte via les récepteurs adrénergiques β3 // The Journal of Neuroscience. 2010,30 (7). Z. 2795-2806. doi: 10.1523 / JNEUROSCI.3780-09-09.Le rôle des cellules gliales dans la formation des troubles dépressifs
Nous avons précédemment examiné les changements dans les neurones, mais ignoré le rôle des cellules gliales dans la formation des troubles dépressifs. Cependant, des études expérimentales et cliniques indiquent un rôle possible pour la pathologie des cellules gliales dans la pathogenèse de la dépression.
Le rôle de la glie dans la formation de troubles dépressifs
 Fig. 27. Rajkowska G., Miguel-Hidalgo JJ Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007,6 (3). P. 219-233.
Fig. 27. Rajkowska G., Miguel-Hidalgo JJ Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007,6 (3). P. 219-233.Les chercheurs ont présenté un diagramme de la pathogenèse des troubles dépressifs impliquant la glie (Fig.27).
Une prédisposition génétique peut inclure: un facteur héréditaire (la présence d'un trouble dépressif chez l'un des parents augmente le risque de cette maladie chez l'enfant); polymorphisme des gènes: BDNF, un transporteur de sérotonine (qui est impliqué dans la recapture de la sérotonine dans les cellules nerveuses et gliales), les récepteurs de la sérotonine, les enzymes de synthèse de la sérotonine (tryptophane hydroxylase de type 2).
La vulnérabilité génétique, combinée à des facteurs environnementaux et de stress, crée un environnement favorable à la formation de troubles dépressifs.Les scientifiques ont découvert que le rôle des cellules gliales n'est pas le même chez les patients jeunes et âgés (Fig.28). Les cellules gliales peuvent jouer un rôle important dans la pathogenèse des premiers stades des troubles dépressifs, ce qui peut entraîner une diminution prononcée du nombre de neurones pyramidaux à l'âge adulte.
Le rôle des cellules gliales dans la formation des troubles dépressifs n'est pas le même chez les patients jeunes et âgés.
 Fig. 28. Rajkowska G., Miguel-Hidalgo JJ Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007,6 (3). P. 219-233.
Fig. 28. Rajkowska G., Miguel-Hidalgo JJ Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007,6 (3). P. 219-233.En particulier, la perte de la fonction des cellules gliales à un jeune âge augmente le risque de développer des épisodes répétés de dépression dans la vieillesse, mais la carence en neurones pyramidaux plutôt qu'en cellules gliales prévaudra déjà.
 Fig. 29. Rajkowska G., Miguel-Hidalgo JJ Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007,6 (3). P. 219-233.
Fig. 29. Rajkowska G., Miguel-Hidalgo JJ Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007,6 (3). P. 219-233.Une telle dynamique est cohérente avec l'une des fonctions les plus importantes des cellules gliales - l'absorption de l'excès de glutamate de la fente synaptique (contact entre les cellules nerveuses). Le glutamate est l'un des principaux neurotransmetteurs excitateurs du système nerveux central et son action excessive peut entraîner une altération de la neuroplasticité et de l'excitotoxicité (neurotoxicité associée à une excitation excessive; il semble que ce soit une réaction protectrice des cellules nerveuses contre la surexcitation - le nombre de neurones et les connexions entre eux diminuent).
Dans les cellules gliales, il existe une protéine transporteuse impliquée dans le transfert du glutamate de la fente synaptique vers la cellule gliale, où le glutamate est métabolisé.
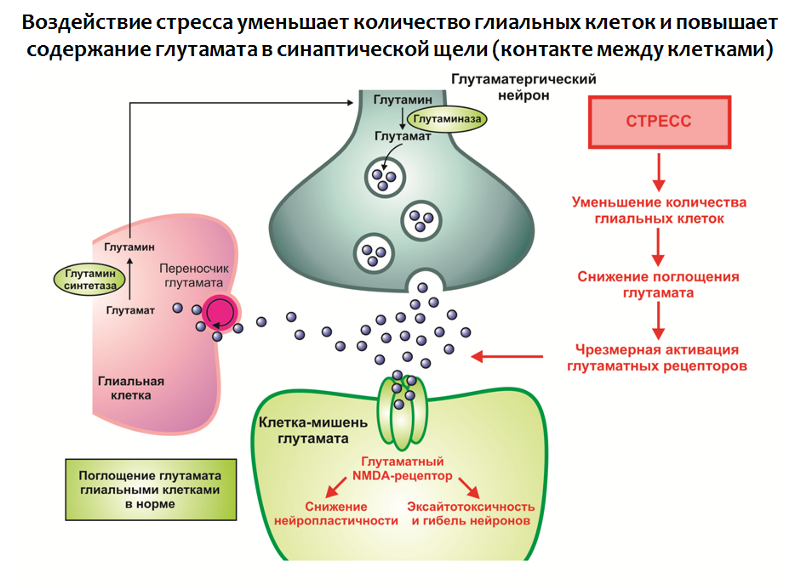 Fig. 30. Rajkowska G., Miguel-Hidalgo JJ Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007,6 (3). P. 219-233.
Fig. 30. Rajkowska G., Miguel-Hidalgo JJ Gliogenesis and Glial Pathology in Depression // CNS & Neurological Disorders Drug Targets. 2007,6 (3). P. 219-233.L'exposition au stress en combinaison avec d'autres facteurs conduit à:
1. Une diminution du nombre de cellules gliales dans les structures du système limbique du cerveau;
2. Hyperproduction de glutamate.
Ainsi, un excès de ce neurotransmetteur excitant est formé, qui est un modulateur négatif de la neuroplasticité (on pense que cela peut faire partie d'une réaction compensatoire qui protège le système nerveux de la surexcitation).
La fonction des cellules gliales n'est pas limitée à l'absorption du glutamate, elles sont également impliquées dans la production de neurotrophines, en particulier du BDNF (Fig. 31).
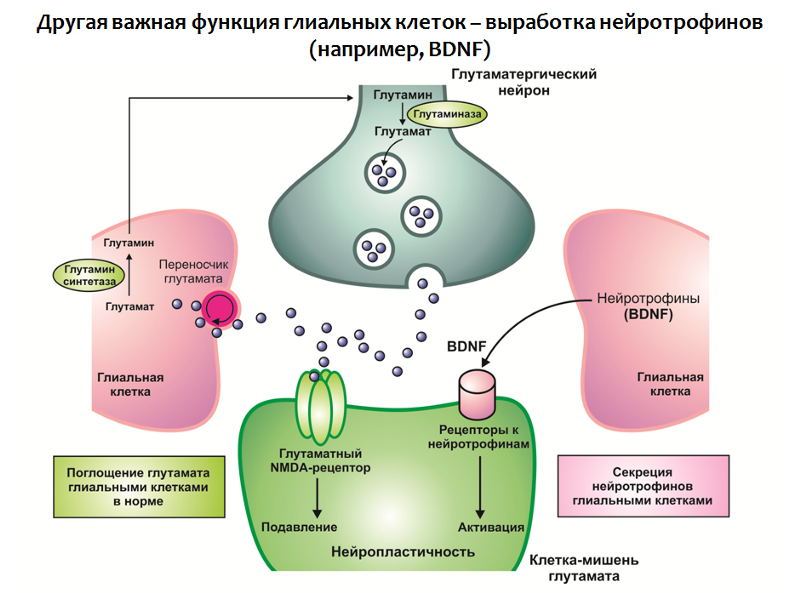 Fig. 31
Fig. 31Dans l'ensemble, un déficit en neurotrophines et un excès de glutamate conduisent à une violation de la neuroplasticité et à des changements de type dépressif (une diminution du volume de l'hippocampe et du cortex préfrontal, une violation du lien fonctionnel normal entre les structures du cercle limbique).
Dans le cadre de ce concept, il est également possible de trouver des explications sur l'efficacité thérapeutique des antidépresseurs (Fig.32):
1. Les antidépresseurs sont capables "d'atténuer" l'effet du stress en normalisant l'activité de l'axe hypothalamo-hypophyso-surrénalien;
2. Augmenter la concentration de BDNF dans le système nerveux central;
3. Stimulez les processus de neuroplasticité.
 Fig. 32
Fig. 32La figure 33 montre un schéma de trouble dépressif généralisé, qui est basé sur le concept de neurodégénérescence médiée par le stress. On voit que les antidépresseurs occupent la niche des «correcteurs des effets du stress». Avec tous les avantages et le potentiel thérapeutique, les antidépresseurs ne sont pas toujours efficaces pour éliminer les symptômes dépressifs.
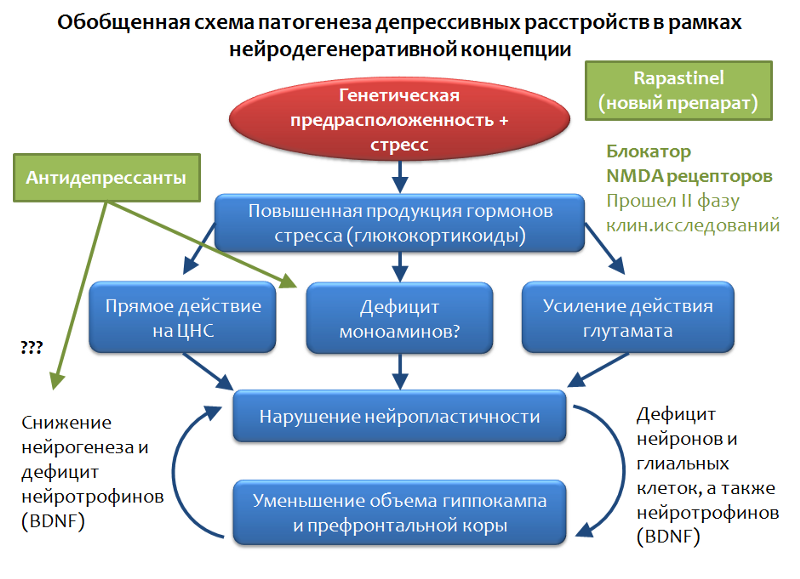 Fig. 33
Fig. 33Il existe des formes dites de troubles dépressifs résistantes à la pharmacothérapie. Ils essaient d'expliquer ce phénomène avec une variété de facteurs de stress, avec une force et une durée d'exposition au stress différentes, et avec des caractéristiques individuelles (mutation des cibles antidépressives). Mais il n'y a qu'une seule conclusion à cette situation: une recherche de cibles fondamentalement nouvelles pour la pharmacothérapie des troubles dépressifs est nécessaire.
Nouvelles tendances dans la création d'antidépresseurs
Une direction prometteuse est l'effet sur le système glutamate, si l'on considère ce neurotransmetteur comme l'un des éléments clés de la pathogenèse des troubles dépressifs. Un succès significatif a été obtenu dans ce domaine - un antidépresseur fondamentalement nouveau a été créé, qui, par son mécanisme, bloque
les récepteurs NMDA du glutamate et empêche l'activité excessive de cet acide aminé. L'antidépresseur Rapasintel a maintenant passé avec succès les phases I et II des essais cliniques, où il s'est avéré très efficace et est considéré comme un traitement pour les formes persistantes de troubles dépressifs.
Dans le cadre de la théorie glutamatergique des troubles dépressifs, on peut considérer le rôle du principal médiateur inhibiteur du système nerveux central - l'acide gamma-aminobutyrique (GABA ou GABA).
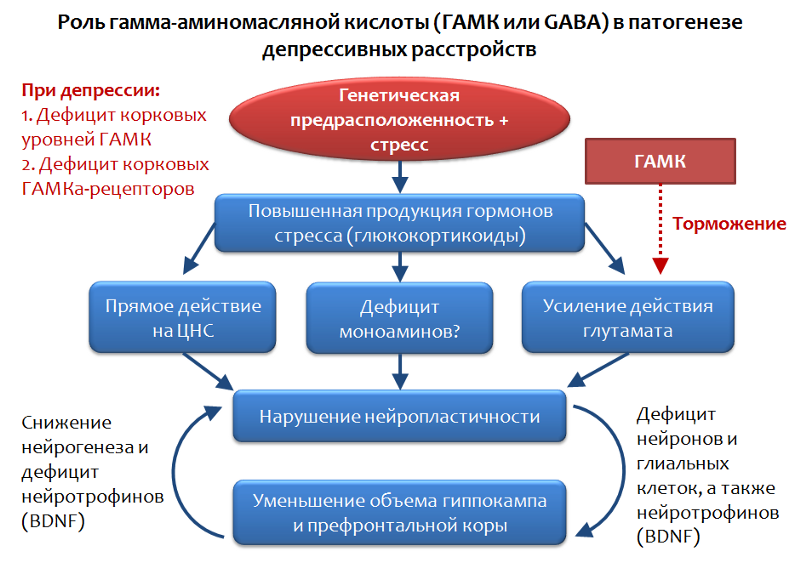 Fig. 34. Möhler H. Le système GABA dans l'anxiété et la dépression et son potentiel thérapeutique // Neuropharmacologie. 2012. Jan. 62 (1). P. 42-53.
Fig. 34. Möhler H. Le système GABA dans l'anxiété et la dépression et son potentiel thérapeutique // Neuropharmacologie. 2012. Jan. 62 (1). P. 42-53.Le GABA est l'opposé fonctionnel du glutamate et est capable de limiter son effet stimulant, par conséquent, l'évaluation du rôle du GABA dans les troubles dépressifs semble tout à fait logique.
Il a été établi que dans le contexte des troubles dépressifs, une déficience des niveaux corticaux de GABA et de ses récepteurs est observée. En particulier, les neurones pyramidaux produisant du glutamate peuvent être inhibés par les interneurones produisant du GABA. Le GABA réalise son effet inhibiteur en activant le récepteur GABA-A.
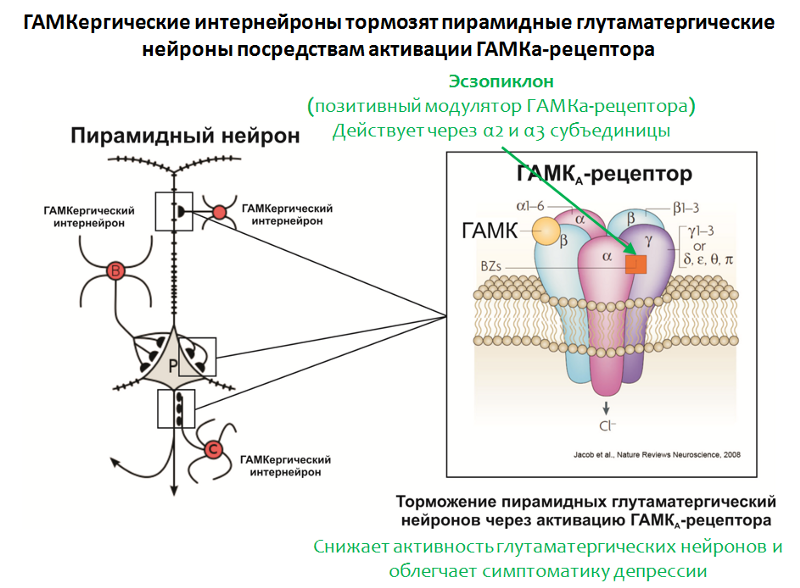 Fig. 35. Möhler H. Le système GABA dans l'anxiété et la dépression et son potentiel thérapeutique // Neuropharmacologie. 2012. Jan. 62 (1). P. 42-53.La structure du récepteur GABA-A
Fig. 35. Möhler H. Le système GABA dans l'anxiété et la dépression et son potentiel thérapeutique // Neuropharmacologie. 2012. Jan. 62 (1). P. 42-53.La structure du récepteur GABA-A est représentée sur la figure 35. Le récepteur se compose de 5 sous-unités (2α, 2β et γ), chaque sous-unité a un sous-type, par exemple, 6 variantes de sous-unités α sont connues. La combinaison de différentes variantes de sous-unités détermine le sous-type du récepteur GABA-A.
À l'appui du rôle du GABA, l'efficacité du modulateur positif du récepteur GABA-A, l'esopiclon, parle également. La cible de ce médicament sont les récepteurs GABA-A qui portent des sous-unités α2 et α3 dans leur composition.
Eszopiklon est parfois utilisé en association avec des antidépresseurs et soulage considérablement les symptômes dépressifs même après le retrait des antidépresseurs. On pense que son effet thérapeutique est associé à une diminution de la fonction glutamate. Il est intéressant de noter que d'autres modulateurs positifs du récepteur GABA-A (qui nécessitent la présence d'autres variantes des sous-unités a, par exemple le
zolpidem ) ne possèdent pas une telle activité.
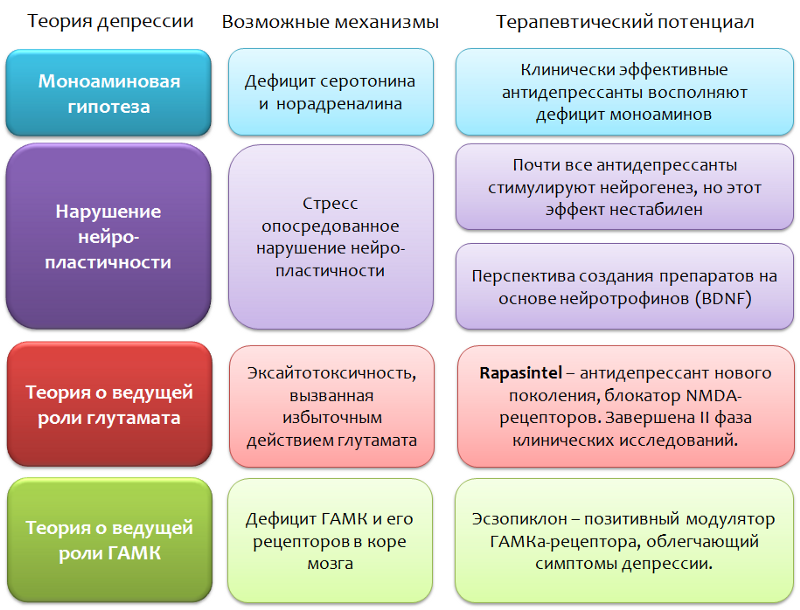 Fig. 36
Fig. 36Et donc, dans le schéma présenté (Fig. 37), nous résumons les données sur la violation des processus de neuroplasticité et le développement de symptômes dépressifs.
1) La suppression des processus de neuroplasticité n'est pas strictement spécifique aux troubles dépressifs, mais est également observée dans d'autres psychopathologies (schizophrénie, trouble affectif bipolaire) et maladies neurologiques (sclérose en plaques, maladie de Parkinson, maladie d'Alzheimer).
2) Dans les modèles animaux, la suppression de la prolifération des cellules souches par des agents chimiques ne bloque pas les effets des antidépresseurs (contrairement aux rayons X, où l'effet inverse est noté).
3) Les ressources de la neurogenèse peuvent être limitées et une stimulation excessive peut conduire à l'épuisement.
4) Les effets à long terme d'une stimulation artificielle prolongée de la neurogenèse sont inconnus. Y a-t-il un risque de développer un processus tumoral?
5) La violation de la neuroplasticité n'est pas un concept exhaustif des troubles dépressifs. Le concept ne peut pas expliquer pleinement la présence de TOUS les symptômes de la maladie (par exemple, somatisation des symptômes dépressifs, lorsque les symptômes de la dépression sont déguisés en maladies des organes internes - maux de tête, douleurs cardiaques, abdominales, etc.), la nature du cours (cycle) et la résistance certaines formes de dépression à la pharmacothérapie (malgré le fait que les antidépresseurs activent la neurogenèse et augmentent le BDNF).
Violation des processus de neuroplasticité et de troubles dépressifs - défauts du concept
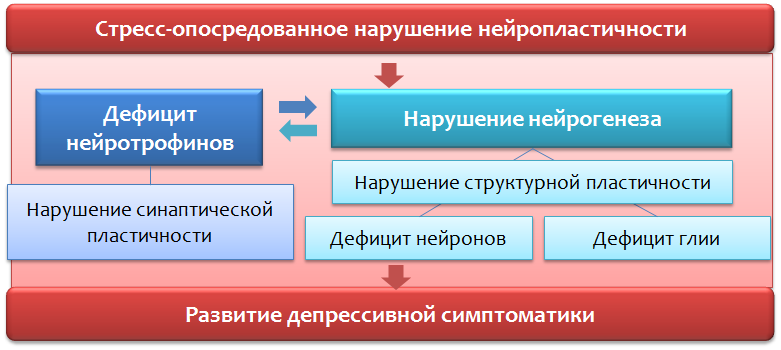 Fig. 37
Fig. 37- La suppression des processus de neuroplasticité n'est pas spécifique aux troubles dépressifs
- Dans les modèles animaux, la suppression de la prolifération des cellules souches ne bloque pas toujours les effets des antidépresseurs
- Les ressources de la neurogenèse peuvent être limitées et une stimulation excessive peut conduire à l'épuisement.
- Les conséquences à long terme d'une stimulation "violente" prolongée de la neurogenèse sont inconnues. Y a-t-il un risque de développer un processus tumoral?
- La violation de la neuroplasticité n'est pas un concept exhaustif des troubles dépressifs.
Les théories sur le rôle des acides aminés des neurotransmetteurs - le glutamate et le GABA, ne sont pas exhaustives. Premièrement, les systèmes présentés (glutamatergique et GABAergique) ne peuvent être considérés isolément des autres facteurs, car en fait, ils sont un maillon intermédiaire dans la pathogenèse des troubles dépressifs ou des symptômes individuels. Deuxièmement, des changements dans les systèmes glutamatergique et GABAergique du cerveau sont observés non seulement dans la dépression, mais aussi dans un certain nombre d'autres troubles et conditions (schizophrénie, troubles anxieux, crises de panique, épilepsie, sensibilité à la douleur, maladie de Parkinson, maladie d'Alzheimer).
 Fig. 38
Fig. 38Si l'on considère l'intervention pharmacologique dans le système glutamatergique, alors elle est sans aucun doute prometteuse et même innovante, car auparavant, tous les antidépresseurs agissaient exclusivement sur le système monoaminegique du cerveau. Cependant, une fonction aussi large du glutamate dans le système nerveux central peut conduire au développement d'effets indésirables et d'un certain nombre de contre-indications. Mais il est trop tôt pour faire des prédictions, le bloqueur des récepteurs du glutamate doit encore passer par les essais cliniques de phase III. Le médicament n'est pas considéré comme un substitut aux antidépresseurs modernes, mais comme un moyen de thérapie d'appoint (par exemple, avec des formes persistantes de dépression).
Les médicaments qui sont des modulateurs positifs des récepteurs GABAA ne sont pas actuellement considérés comme des antidépresseurs indépendants, ils sont utiles pour éliminer les symptômes individuels des troubles dépressifs.
Médicament "idéal"
Une direction prometteuse pour le développement de nouveaux antidépresseurs efficaces et sûrs est l'étude des mécanismes du stress lui-même, car c'est le facteur de stress (événements stressants) qui est considéré comme le principal déclencheur de la formation de troubles dépressifs.
À quoi devrait ressembler un médicament prometteur?
La recherche et la création d'un antidépresseur «idéal» doit reposer sur deux principes simples (selon Franco Borsini):
1. Le médicament ne doit pas changer le psychisme d'une personne en bonne santé
2. Le médicament ne doit agir que dans des conditions de psychopathologie
 Fig. 39. Borsini F. Modèles pour la dépression dans le dépistage des drogues et les études précliniques: orientations futures // World Journal of Pharmacology. 2012.1 (1). P. 21–29.
Fig. 39. Borsini F. Modèles pour la dépression dans le dépistage des drogues et les études précliniques: orientations futures // World Journal of Pharmacology. 2012.1 (1). P. 21–29.L'interruption des mécanismes de stress dans les premiers stades empêcherait tous ces changements qui ont été considérés dans le contexte de notre article. Une telle méthode de correction, en théorie, semble être la plus efficace non seulement pour prévenir le développement de la dépression, mais aussi pour une protection fiable contre les rechutes et les épisodes répétés et plus graves.
La pharmacothérapie, en soi, n'est pas le seul moyen de correction de la psychopathologie considérée. Il ne faut pas accorder moins d'importance à la communication avec les patients, à l'identification de la cause de la maladie. Dans certains cas, l'efficacité de la psychothérapie a également un potentiel élevé, comme Il aide à trouver des solutions au problème et ne combat pas les symptômes de la maladie, laissant le problème non résolu et traduisant la dépression en formes subchroniques et chroniques.