La neurogenèse est un processus en plusieurs étapes de formation de nouvelles cellules nerveuses dans le système nerveux central mature (SNC), qui est sa fonction adaptative.
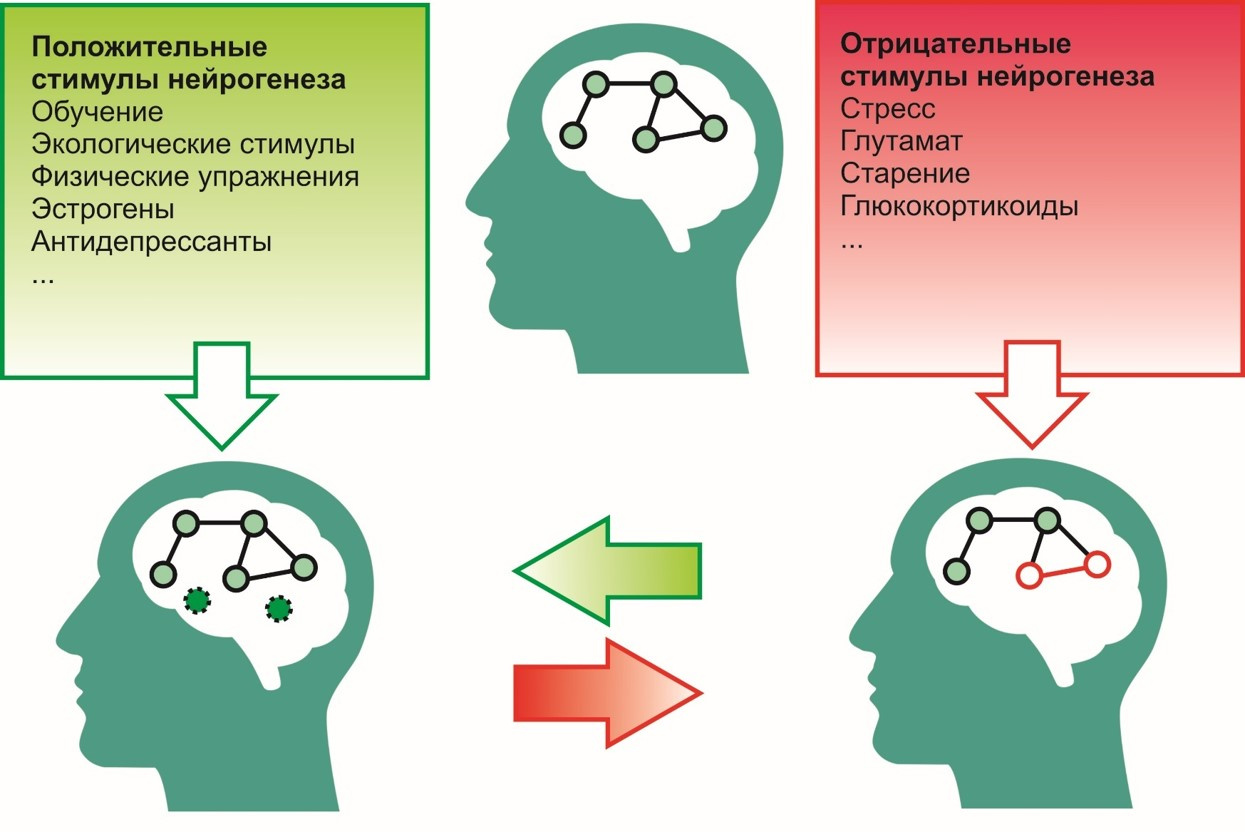
Aux incitations positives, c'est-à-dire Les incitations qui contribuent au processus de neurogenèse comprennent:
- processus d'apprentissage
- environnement écologique (environnement favorable),
- exercices physiques (par exemple, course à pied)
- antidépresseurs
- œstrogènes, etc.
Au négatif -
- le stress
- activité excessive du glutamate dans le système nerveux central,
- exposition aux glucorticoïdes (cortisol - hormone du stress),
- vieillissement et autres.
Pendant de nombreuses années en neurobiologie centrale, il y a eu des dogmes centraux qui ne permettaient pas la possibilité même de neurogenèse.
 La notion d'absence de neurogenèse dans le cerveau des vertébrés matures était basée sur quatre principes:
La notion d'absence de neurogenèse dans le cerveau des vertébrés matures était basée sur quatre principes:- Clinique. Les patients souffrant de pathologies neurologiques avec une lésion prédominante du système nerveux central ne connaissent pas de récupération fonctionnelle. Les troubles cérébrovasculaires, les lésions traumatiques et les maladies neurodégénératives, telles que la maladie de Parkinson et la maladie d'Alzheimer, sont des pathologies du système nerveux central avec une aggravation et une aggravation progressive de l'état clinique du patient. En général, diverses méthodes de traitement ne peuvent qu'éliminer les symptômes, mais pas arrêter le développement de la maladie.
- Fonctionnel. Elle est basée sur le fait que le système nerveux central contrôle de nombreux processus complexes: la régulation des émotions, des mouvements, des réflexes, etc. La gestion de processus aussi complexes nécessite un réglage extrêmement précis et précis. On pensait que la formation de nouvelles cellules nerveuses, leur différenciation et leur migration pouvaient perturber l'organisation structurelle et fonctionnelle des voies neuronales existantes et perturber le système nerveux central.
- Associé à la théorie de la mémoire et de l'apprentissage. Pendant longtemps, on a cru que les «souvenirs» sont l'extraction d'informations à partir de réseaux de neurones formés au cours du processus de formation. Dans ce contexte, la formation de nouvelles cellules nerveuses a été considérée comme un événement incompatible avec la mémoire.
- Technique et expérimental. Manque de capacité technique pour découvrir la neurogenèse et les cellules souches nerveuses dans le système nerveux central mature.
Étapes de formation des idées sur la neurogenèse du cerveau mature- Années 60 - Joseph Altman et al. Les cellules du gyrus denté de l'hippocampe peuvent comprendre de la thymidine radioactive, qui est intégrée dans l'ADN des cellules en division, ce qui permet de les visualiser. En raison du manque de marqueurs moléculaires, il était impossible de prouver que ce sont les neurones qui ont été marqués.
DOI: 10.1126 / science.135.3509.1127
- Années 70 - Michael Kaplan et James Hinds. Ils ont reproduit l'expérience d'Altman et confirmé par microscopie électronique que ce sont les neurones (gyrus dentés et bulbe olfactif) qui sont marqués.
DOI: 10.1126 / science.887941
- Années 80 - Fernando Notteboom. Il a montré que pendant la saison des amours dans les noyaux cérébraux des canaris responsables de la vocalisation et de l'entraînement, le nombre de neurones augmente fortement.
DOI: 10.1038 / scientificamerican0289-74
- Années 90 - Peter Ericsson et al. Pour la première fois, la formation de nouveaux neurones dans l'hippocampe humain a été mise en évidence.
DOI: 10.1038 / 3305
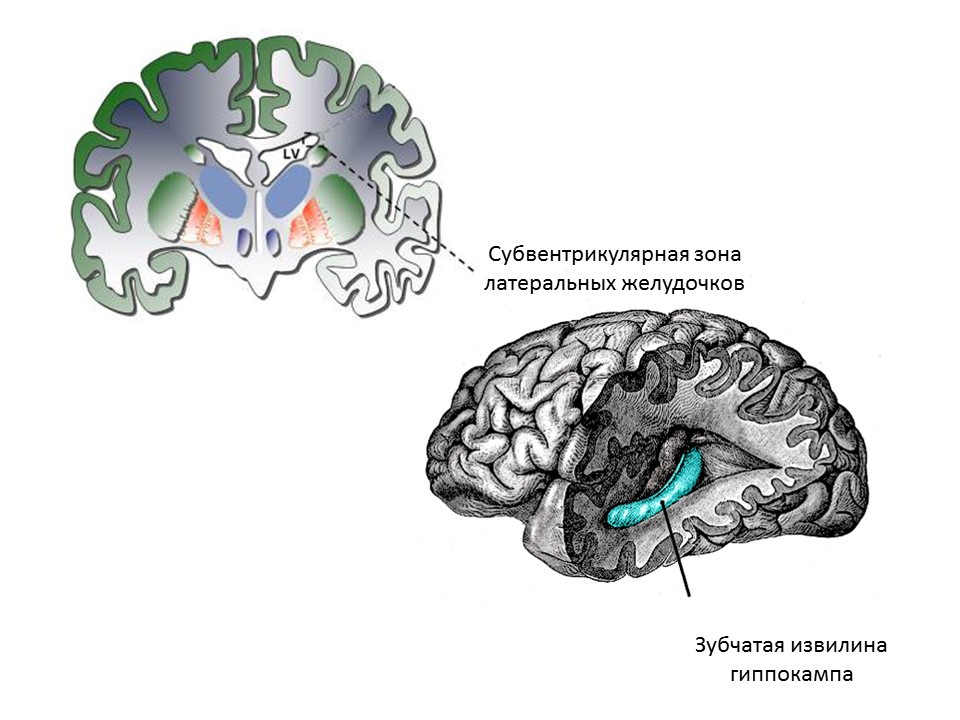
Les principales zones neurogènes du cerveau adulte (ou mature) sont le gyrus denté de l'hippocampe et la zone sous-ventriculaire des ventricules latéraux. Les zones sont représentées sur la figure.
 Étapes de la neurogenèse dans le gyrus denté de l'hippocampe du cerveau mature
Étapes de la neurogenèse dans le gyrus denté de l'hippocampe du cerveau mature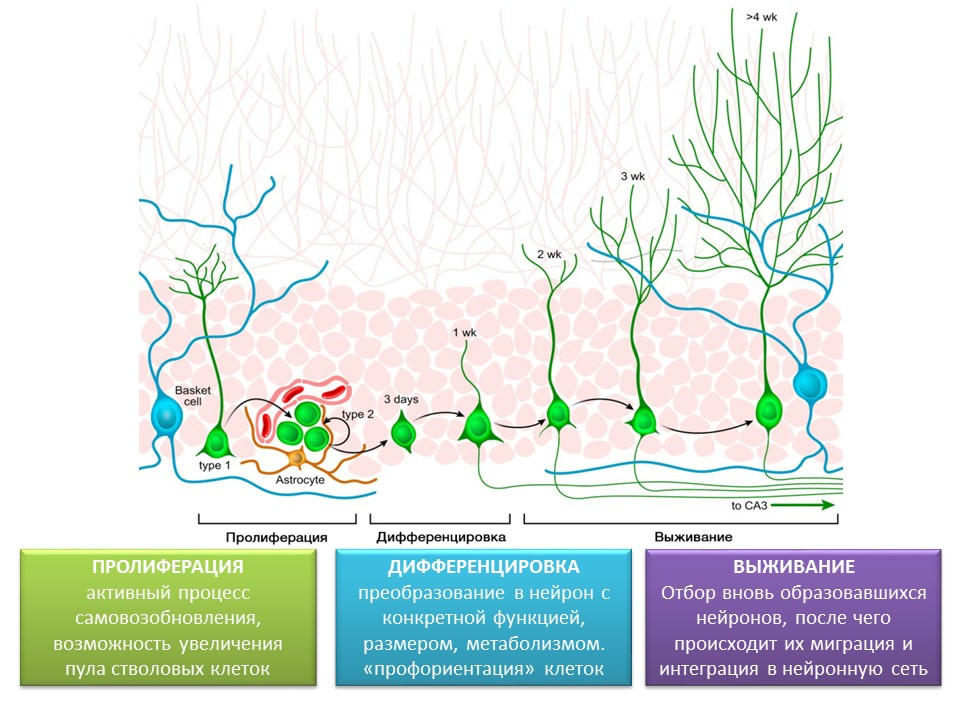
La prolifération est un processus actif d'auto-renouvellement, la possibilité d'augmenter le pool de cellules souches.
Différenciation - conversion en neurone avec une fonction, une taille et un métabolisme spécifiques. En fait, «l'orientation professionnelle» des futures cellules nerveuses.
La survie est la sélection de neurones nouvellement formés, après quoi ils migrent et s'intègrent dans le réseau neuronal. La sélection des cellules nerveuses est l'apoptose (mort programmée) d'une partie des neurones formés. Les cellules restantes migrent vers la région correspondante du cerveau et s'intègrent dans le réseau neuronal.
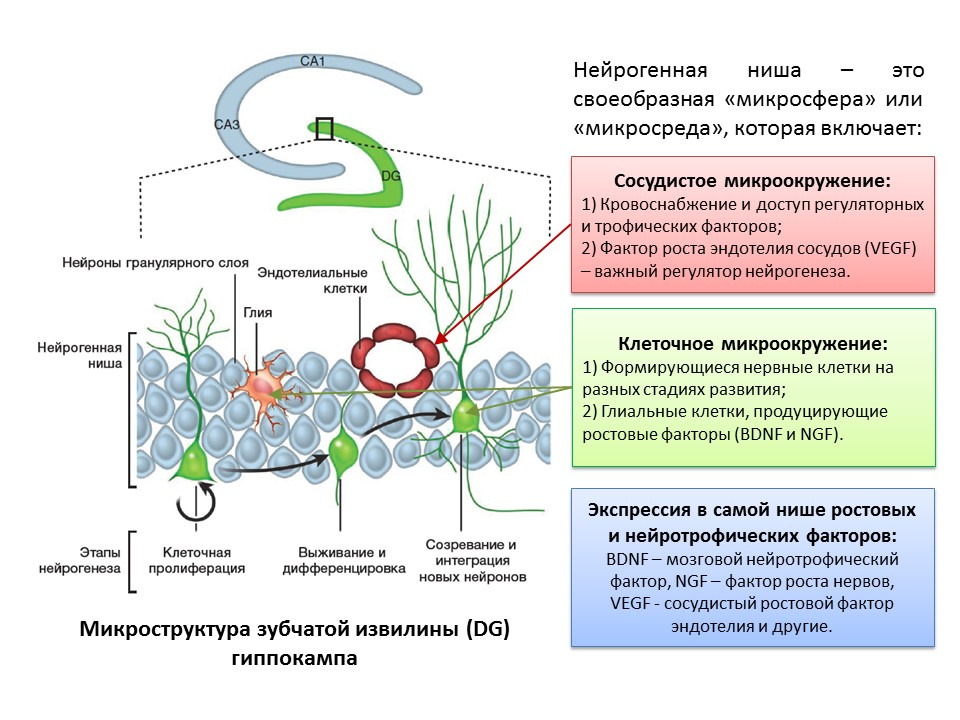
Le terme «neurogenèse» est inextricablement lié au concept de «niche neurogène». La «niche neurogène» elle-même est une «microsphère» dans laquelle se déroule le processus de neurogenèse lui-même. La niche neurogène comprend:
- microenvironnement vasculaire, qui, d'une part, fournit du sang à la niche elle-même et assure l'apport de diverses molécules régulatrices (les cellules souches sont formées et transformées à proximité immédiate des vaisseaux sanguins, et d'autre part, le facteur de croissance endothélial vasculaire (VEGF) est un facteur régulateur important non seulement dans le processus d'angiogenèse (la croissance de nouveaux vaisseaux dans le système vasculaire existant) et de vasculogenèse (la formation du système vasculaire embryonnaire), mais aussi un régulateur direct de la neurogenèse;
- le microenvironnement cellulaire, qui comprend des cellules nerveuses à divers stades de développement et des cellules gliales qui remplissent une fonction trophique (elles produisent des facteurs de croissance, par exemple, le facteur neurotrophique cérébral - BDNF et le facteur de croissance nerveuse - NGF);
- expression dans le créneau de la croissance et des facteurs de régulation. En plus des cellules gliales et d'autres structures matures de la niche, les cellules souches sont capables de produire des facteurs de régulation et de croissance, réalisant ainsi une autorégulation (régulation autocrine).
Évaluation des processus de neurogenèse à l'aide de marqueurs spécifiques
Une question importante et intéressante qui mérite une attention particulière est la question de savoir comment détecter la neurogenèse dans les tissus cérébraux des mammifères matures.
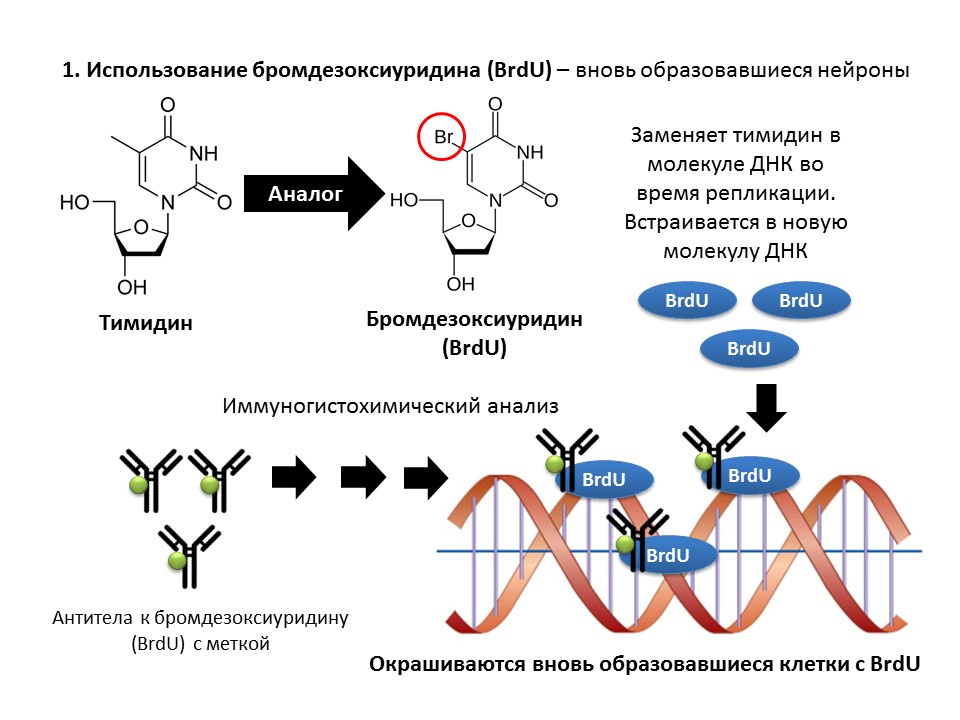
La bromodésoxyuridine (BrdU) est un analogue structurel de la thymidine - un composant de la molécule d'ADN. Lorsqu'il est introduit dans le corps, BrdU est inséré dans l'ADN des cellules en division au lieu de la thymidine, offrant la possibilité de détecter les cellules nouvellement formées et de les séparer des "anciennes". Après avoir obtenu un échantillon de tissu cérébral, ils sont traités avec des anticorps anti-BrdU (les anticorps contiennent un marqueur fluorescent), qui se lient à BrdU via le mécanisme de réaction immunochimique antigène-anticorps et permettent la détermination colorimétrique de BrdU. Ainsi, sur une micropréparation, il est possible de quantifier les cellules marquées avec BrdU, les cellules dites BrdU positives.
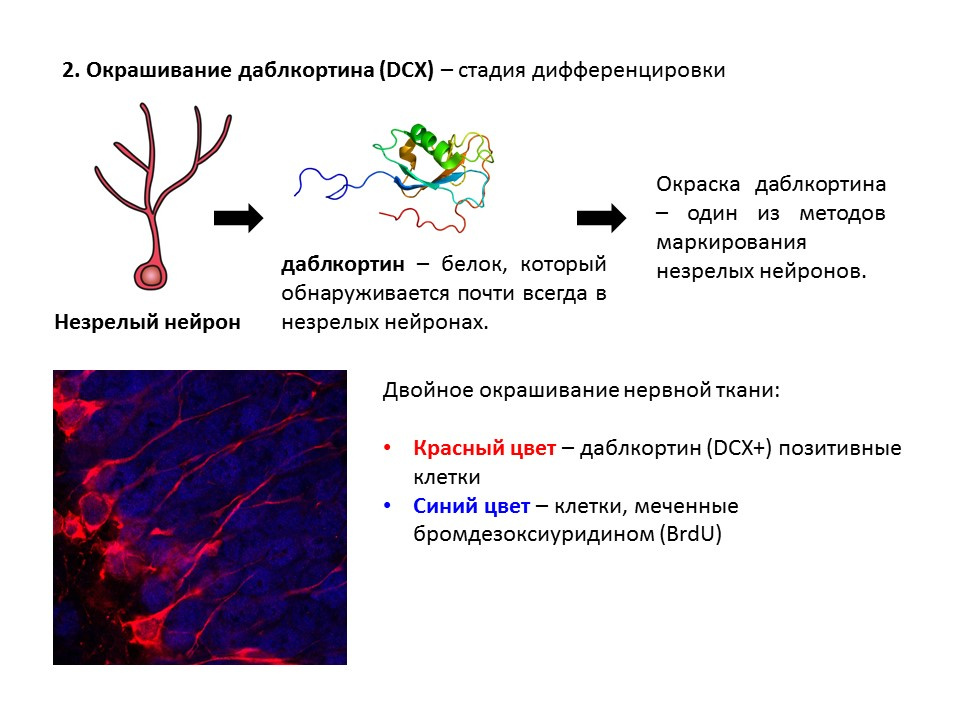
La doublécortine est une protéine que l'on trouve presque toujours dans les neurones immatures et qui permet de les détecter.
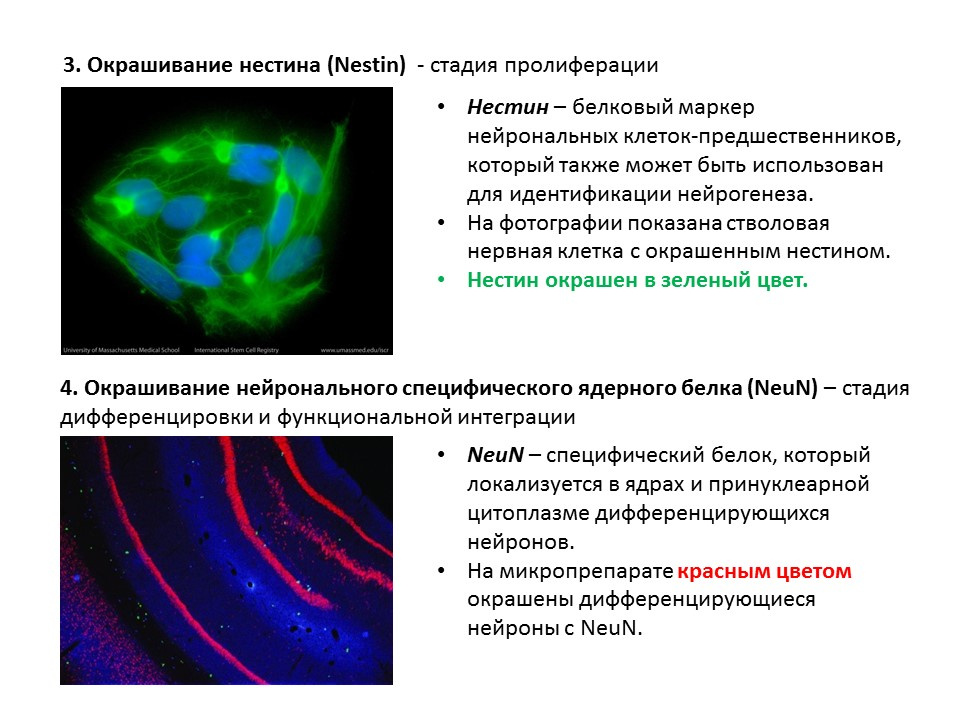
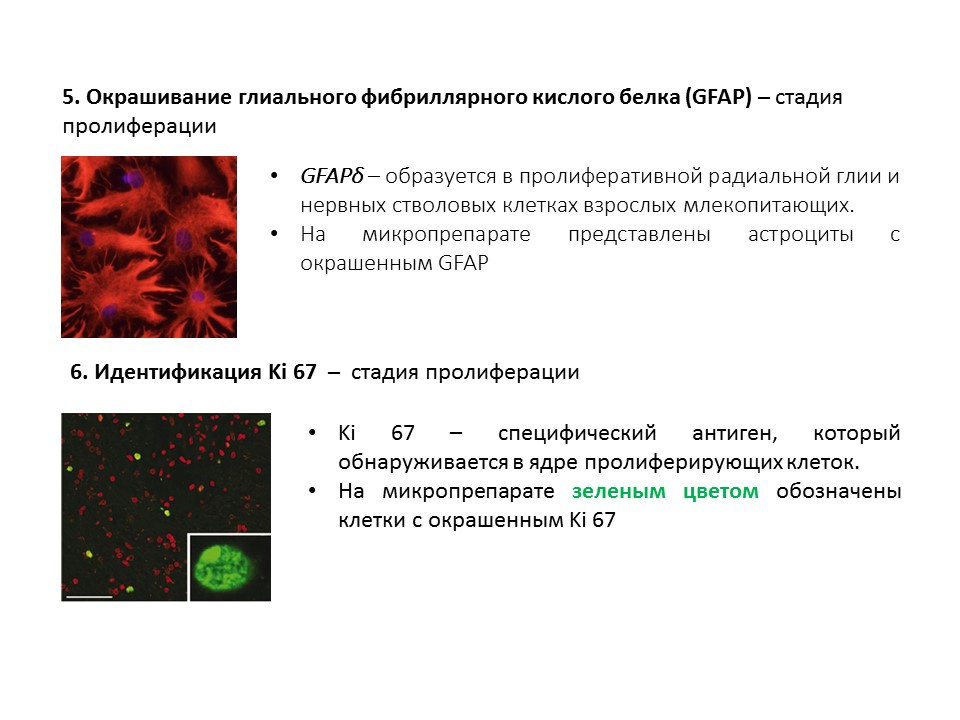 Un schéma récapitulatif des principales méthodes de détection des différentes étapes de la neurogenèse, qui résume les informations précédentes présentées.
Un schéma récapitulatif des principales méthodes de détection des différentes étapes de la neurogenèse, qui résume les informations précédentes présentées.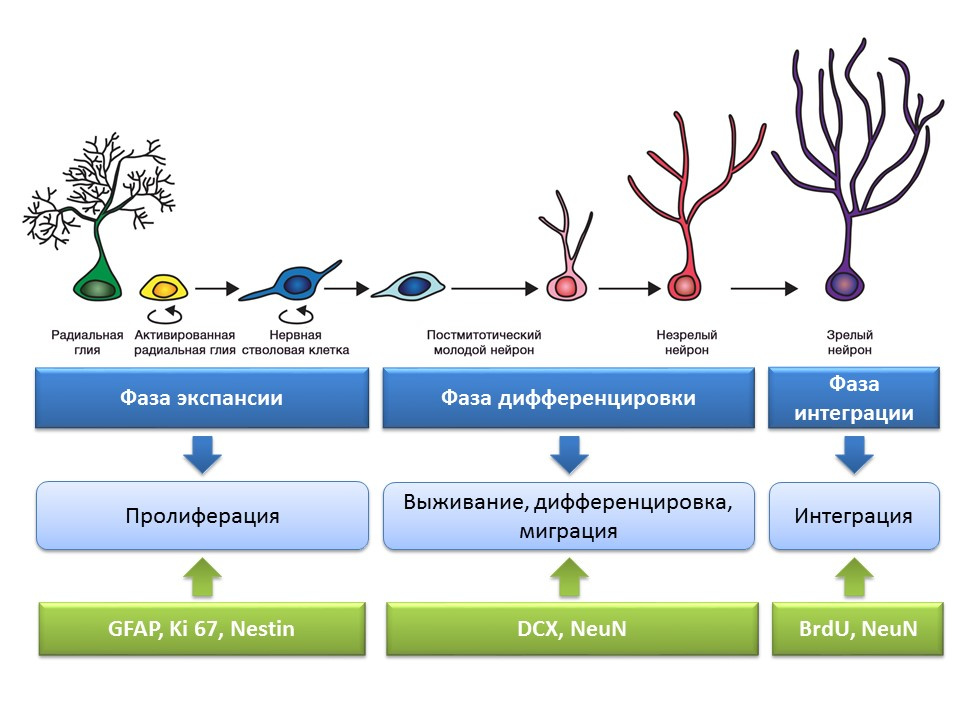
Régulation de la neurogenèse dans le cerveau mature
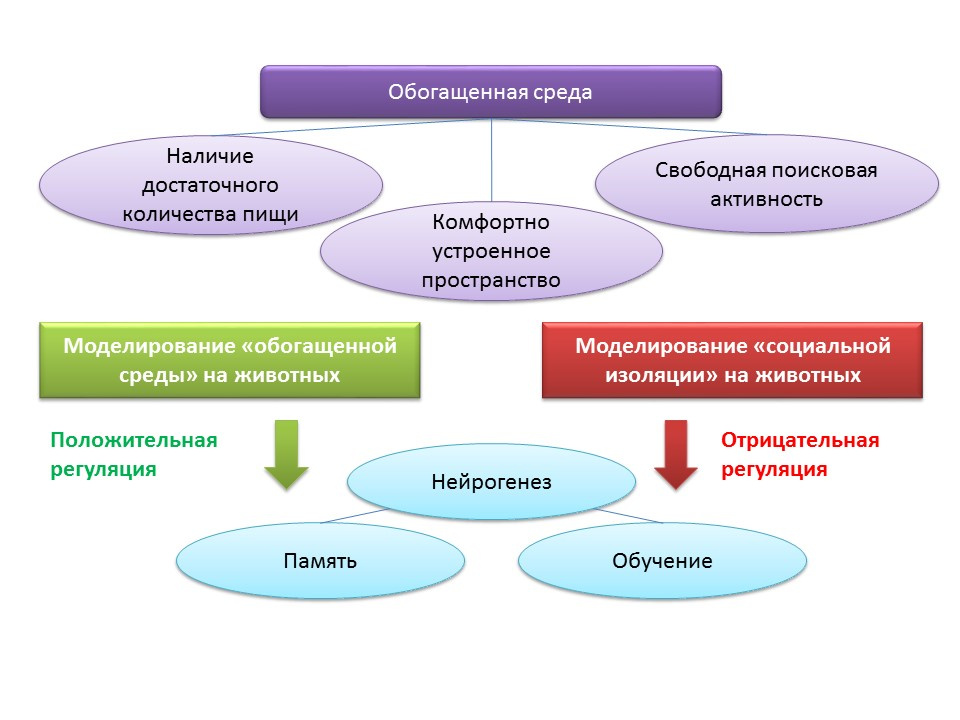
Les facteurs environnementaux de régulation de la neurogenèse sont associés au concept d '«environnement enrichi». Le terme «environnement enrichi» comprend lui-même un cadre de vie favorable, à savoir la présence d'une nourriture suffisante, un espace confortable et la possibilité d'une activité de recherche gratuite.
 DOI: 10.1002 / hipo.22218DOI: 10.1038 / 386493a0DOI: 10.1016 / j.brainres.2011.08.00.007DOI: 10.1016 / j.neuroscience.2011.10.040PMID: 9547229
DOI: 10.1002 / hipo.22218DOI: 10.1038 / 386493a0DOI: 10.1016 / j.brainres.2011.08.00.007DOI: 10.1016 / j.neuroscience.2011.10.040PMID: 9547229Dans les expérimentations animales, il a été constaté que le fait de rester dans un «environnement enrichi» a un effet positif sur la neurogenèse: la production de facteurs de croissance et de neurotrophines, le nombre de cellules proliférantes et leur survie augmentent. Une neurogenèse accrue est corrélée à une amélioration des fonctions cognitives chez les animaux (principalement avec l'apprentissage et la mémoire).
Les souris C57BL / 6J expérimentales ont été maintenues pendant 2 mois dans un espace protégé dans les conditions d'une station biologique (dans une clairière forestière), et le groupe témoin a été maintenu dans des conditions de laboratoire standard. Chez les animaux du groupe expérimental, une augmentation du nombre de synapses excitatrices et inhibitrices a été notée par rapport au groupe témoin. Cette expérience montre que les conditions environnementales peuvent influencer favorablement la morphologie et la fonction du système nerveux central des rongeurs placés dans un environnement enrichi.
Le maintien des animaux dans des conditions d'isolement social en laboratoire, au contraire, a agi comme un régulateur négatif de la neurogenèse.
De plus, le placement des animaux dans un «environnement enrichi» après une ischémie cérébrale a contribué au renforcement des processus régénératifs dans les zones neurogènes du cerveau.
Les résultats de ces études ne sont pas quelque chose d'extraordinaire, car dans la médecine moderne, des cours de réadaptation et des vacances de bien-être sont utilisés.
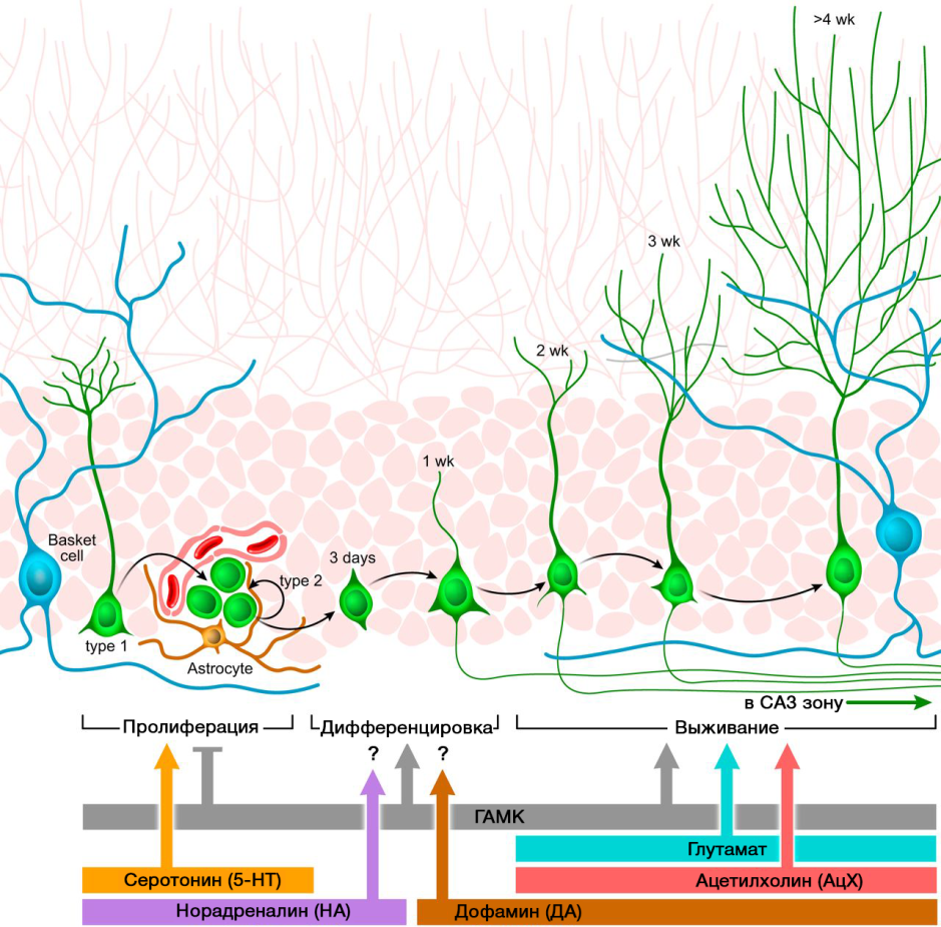
Les neurotransmetteurs du système nerveux central jouent un rôle important dans la régulation de la neurogenèse. La photo montre un schéma récapitulatif d'une telle réglementation.
 DOI: 10.1152 / physrev.00004.2014
DOI: 10.1152 / physrev.00004.2014Le rôle régulateur des neurotransmetteurs CNS présentés dans les processus de neurogenèse est en corrélation avec une carence ou un excès de ces molécules dans diverses maladies du système nerveux central associées à une modification du niveau de neurogenèse.
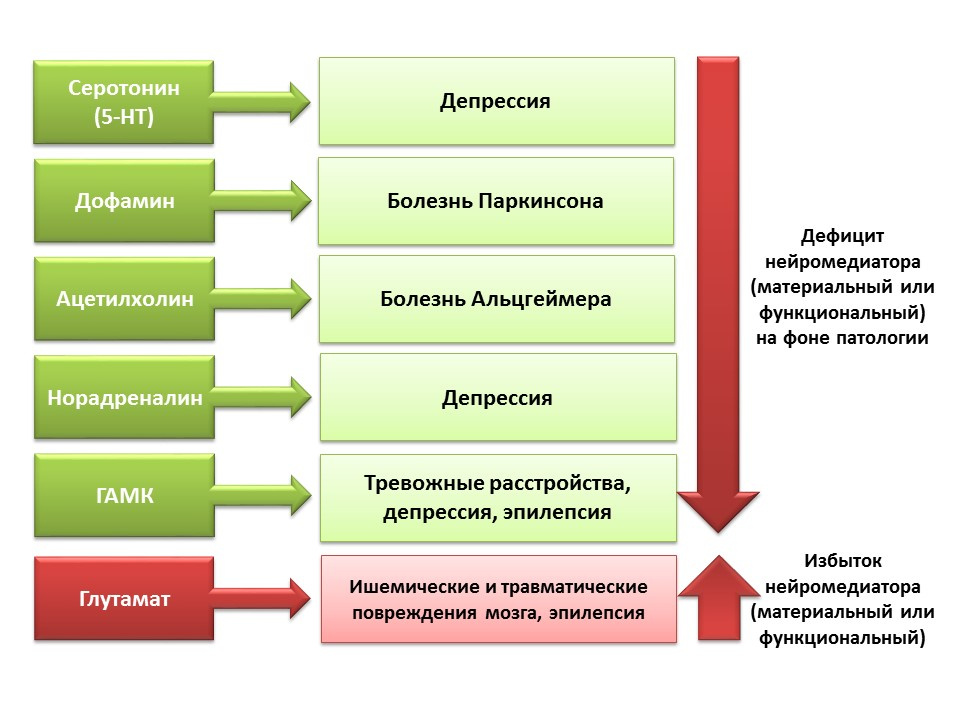
En raison de la possibilité de manipulation pharmacologique des systèmes de neurotransmetteurs du système nerveux central, nous pouvons évaluer la contribution d'un neurotransmetteur aux différents stades de la neurogenèse du cerveau mature.
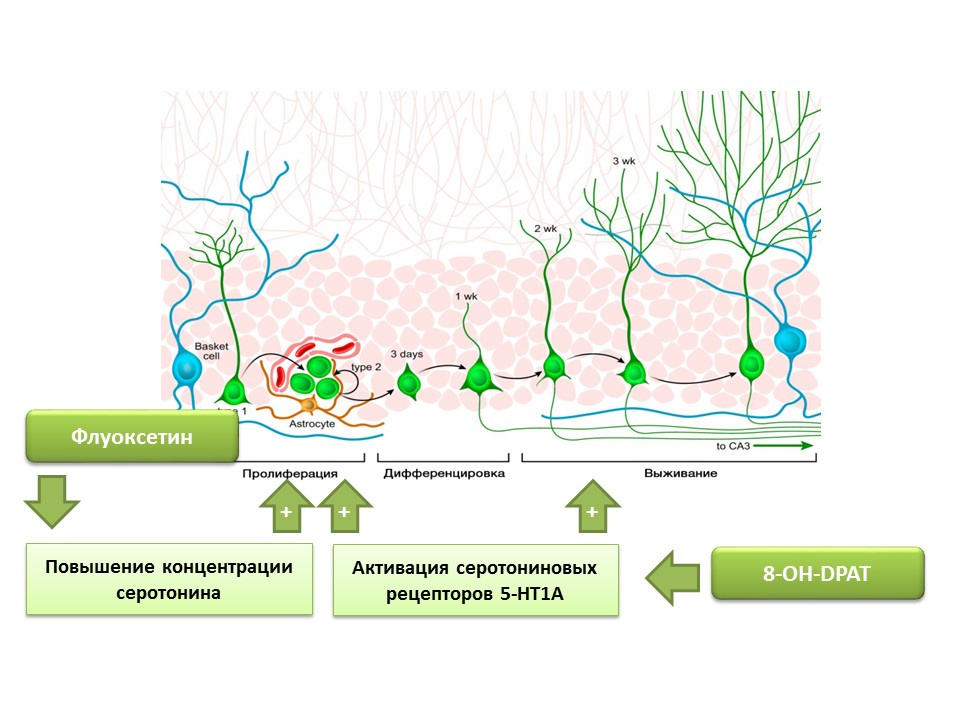
Il a été établi que la fluoxétine (un antidépresseur du groupe des inhibiteurs sélectifs du recaptage de la sérotonine), qui peut augmenter la concentration de sérotonine dans le système nerveux central, améliore la prolifération des cellules souches nerveuses dans le gyrus denté de l'hippocampe des rongeurs et des primates. Plus tard, des récepteurs du sous-type 1A de la sérotonine (récepteurs 5-HT1A) ont été trouvés sur les cellules souches elles-mêmes et cela est cohérent avec la capacité de la substance 8-OH-DPAT (activateur sélectif de ces récepteurs) à stimuler la prolifération et la survie de nouveaux neurones dans le gyrus denté de l'hippocampe d'animaux expérimentaux (souris et rats).
Les primates ont été exposés à un stress chronique (isolement social), après quoi un comportement dépressif et anxieux a été évalué, ainsi qu'à une neurogenèse hippocampique (post-mortelle). Le stress chronique a entraîné une diminution de la neurogenèse en combinaison avec des déficits comportementaux (augmentation du comportement de type dépressif et anxieux). Le traitement à la fluoxétine (un antidépresseur qui augmente la concentration de sérotonine dans le système nerveux central en supprimant sa recapture) a stimulé la neurogenèse et a empêché les comportements dépressifs et anxieux.
DOI: 10.1371 / journal.pone.0017600
Une autre expérience confirme le rôle de la sérotonine dans la régulation de la neurogenèse adulte. La stimulation chronique des récepteurs de la sérotonine 5-HT1A avec le 8-OH-DPAT chez le rat a entraîné une prolifération accrue de cellules souches nerveuses et la survie de neurones différenciés dans le gyrus denté de l'hippocampe et de la zone sous-ventriculaire, ainsi qu'une augmentation de la gliogenèse.
DOI: 10.1016 / j.euroneuro.2009.11.00.00
Les expériences présentées confirment le rôle régulateur important de la sérotonine dans les processus de neurogenèse dans le cerveau adulte.
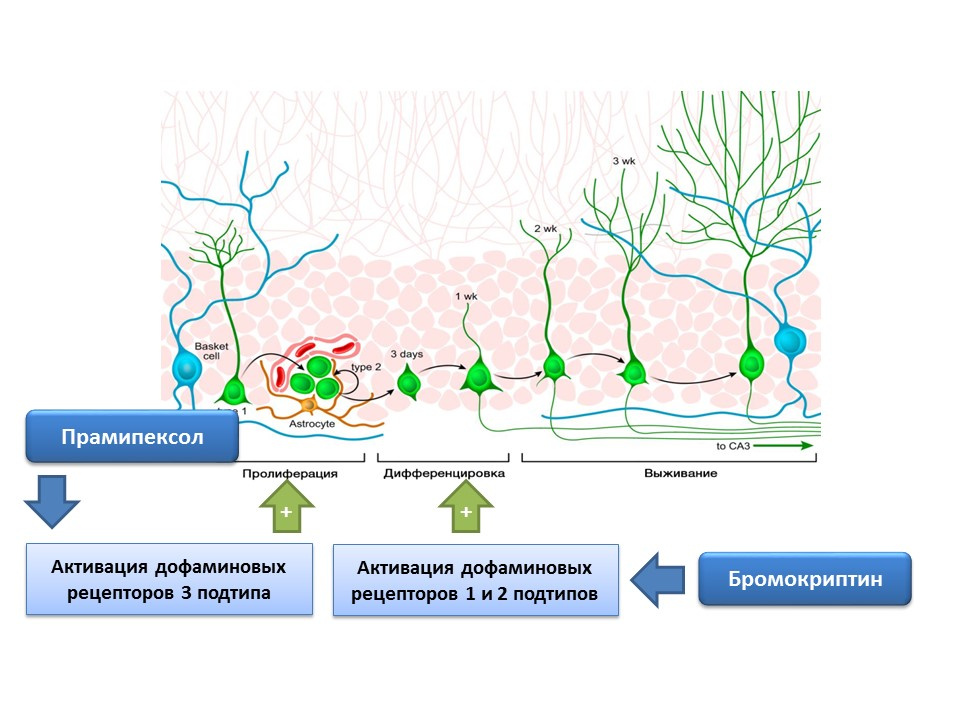 DOI: 10.4161 / cc.8.18.9512DOI: 10.1016 / j.neuropharm.2011.01.026
DOI: 10.4161 / cc.8.18.9512DOI: 10.1016 / j.neuropharm.2011.01.026La dopamine est également activement impliquée dans la régulation de la neurogenèse. Il a été démontré que l'activation des récepteurs de la dopamine de type 1 et 2 (D1 et D2) avec la bromocriptine améliore le processus de différenciation des cellules souches nerveuses, tandis que la stimulation des récepteurs D3 avec le pramipexole entraîne une prolifération accrue.
Le pramipexole, un agoniste des récepteurs de la dopamine ayant une plus grande affinité pour les récepteurs D3 que le D2, est utilisé dans la maladie de Parkinson, éliminant efficacement les symptômes de cette maladie. De plus, le médicament a une activité neuroprotectrice. Dans une expérience, l'effet du pramipexole sur la neurogenèse dans une culture cellulaire de souris a été évalué. Il a été montré que le traitement de la culture cellulaire avec du pramipexole entraînait une augmentation de la taille des neurosphères (grappes de cellules souches nouvellement formées) et des cellules contenant de la doublécortine (neurones immatures). L'effet stimulant du pramipexole sur la neurogenèse a été éliminé par les bloqueurs des récepteurs de la dopamine - U99194A et le sulpiride. De plus, il a été démontré que le pramipexole améliore la libération de BDNF. Les résultats présentés suggèrent que l'efficacité du pramipexole dans la maladie de Parkinson est associée non seulement à la reconstitution d'une carence fonctionnelle en dopamine, mais également à un effet stimulant sur la neurogenèse, et indique également un rôle régulateur important de la dopamine au stade de la prolifération des cellules souches nerveuses.
DOI: 10.1016 / j.neuropharm.2011.01.026
La présence de récepteurs de dopamine des sous-types 1 et 2 sur les cellules souches nerveuses a été confirmée expérimentalement, et le rôle régulateur important de la dopamine dans la prolifération et la différenciation dans la culture de cellules nerveuses a également été démontré. En particulier, le traitement de la culture cellulaire de la zone sous-ventriculaire avec de la bromocriptine (un stimulateur des récepteurs de dopamine des sous-types D1 et D2) dans des conditions de leurs dommages par la neurotoxine MPTP (modélisation de la maladie de Parkinson sur la culture cellulaire) a conduit à une prolifération et une différenciation cellulaire accrues.
DOI: 10.4161 / cc.8.18.9512
La norépinéphrine est capable d'augmenter le nombre de précurseurs de cellules souches neurales grâce à l'activation des récepteurs bêta-3-adrénergiques. Cet effet a été montré en utilisant un agoniste sélectif des bêta-3-adrénorécepteurs (activateur) - substance BRL37344.
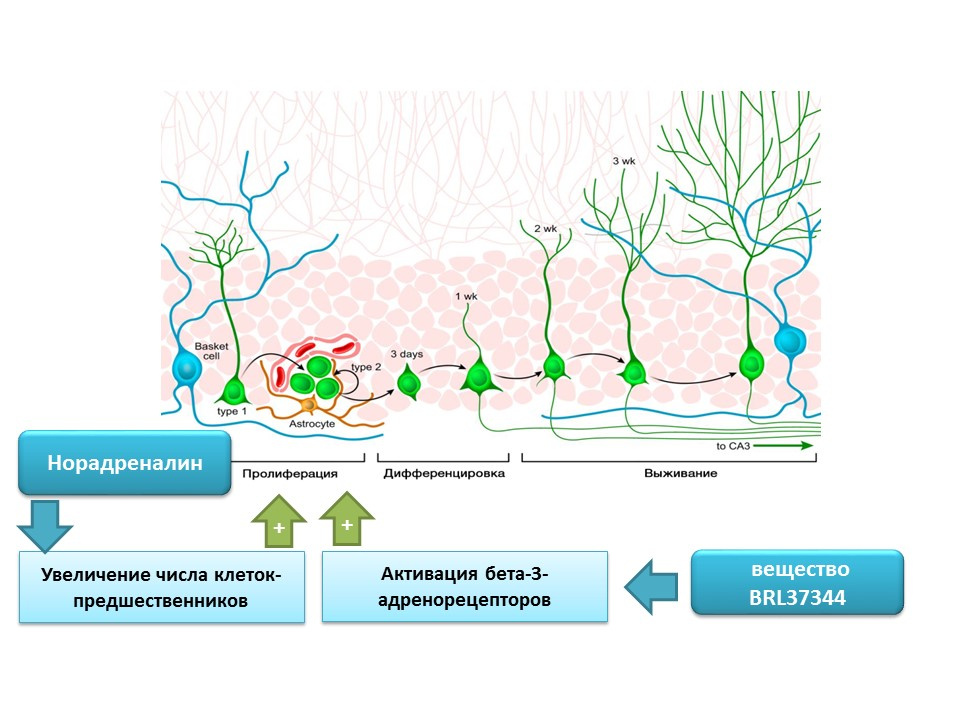
Le rôle régulateur de la norépinéphrine dans les processus de neurogenèse mature a été évalué dans une étude in vitro complète (en culture cellulaire) in vivo (chez la souris). L'ajout de norépinéphrine à la culture cellulaire a entraîné une augmentation de la taille des neurosphères (accumulations de cellules souches nerveuses). L'administration systémique d'un agoniste sélectif des récepteurs bêta-3-adrénergiques a entraîné une prolifération accrue de cellules souches nerveuses dans l'hippocampe de souris. Ces études confirment la présence de récepteurs adrénergiques sur les cellules nerveuses immatures et indiquent également le rôle régulateur de la norépinéphrine, qui est apparemment réalisé grâce aux récepteurs bêta-3-adrénergiques.
DOI: 10.1523 / JNEUROSCI.3780-09-09Les cellules souches nerveuses, comme mentionné précédemment, sont capables de produire elles-mêmes des facteurs de régulation. L'un de ces facteurs est l'acide gamma-aminobutyrique (GABA) - le principal médiateur inhibiteur du système nerveux central. En particulier, il a été montré sur la culture de précurseurs murins de cellules nerveuses que les cellules souches nerveuses améliorent la synthèse du GABA, qui à son tour améliore la prolifération en activant la glie radiale (donne naissance aux cellules souches) et contribue à une augmentation de la taille des neurosphères (accumulation de cellules souches) dans l'expérience.
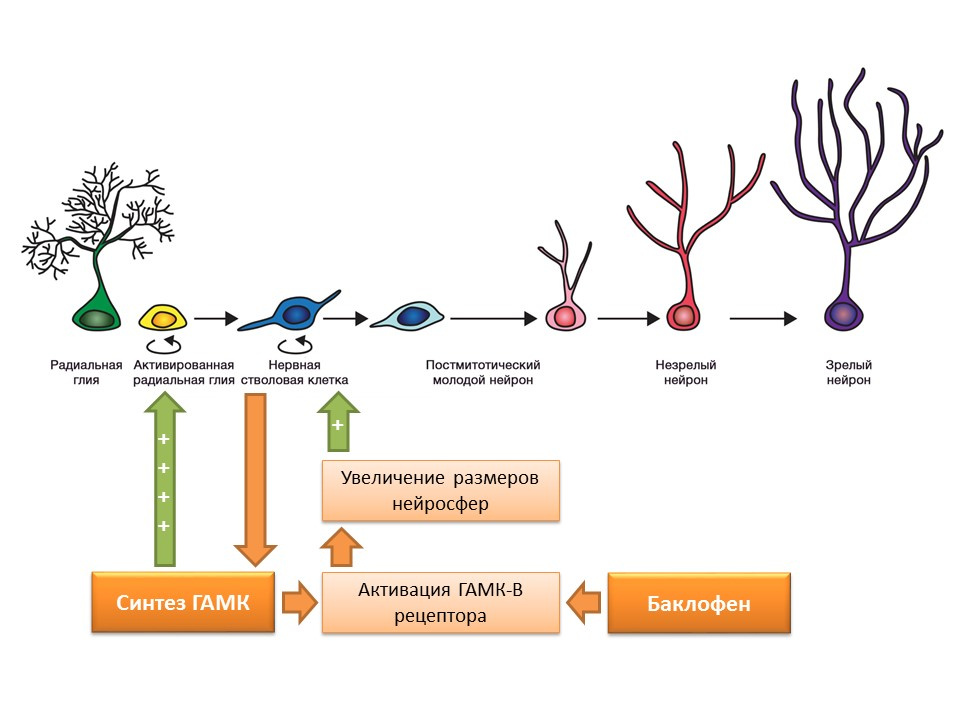
Il a été constaté que cet effet du GABA est réalisé grâce aux récepteurs GABA-B. Les études ont utilisé un agoniste sélectif des récepteurs GABA-B - le baclofène.
DOI: 10.1002 / jcp.21422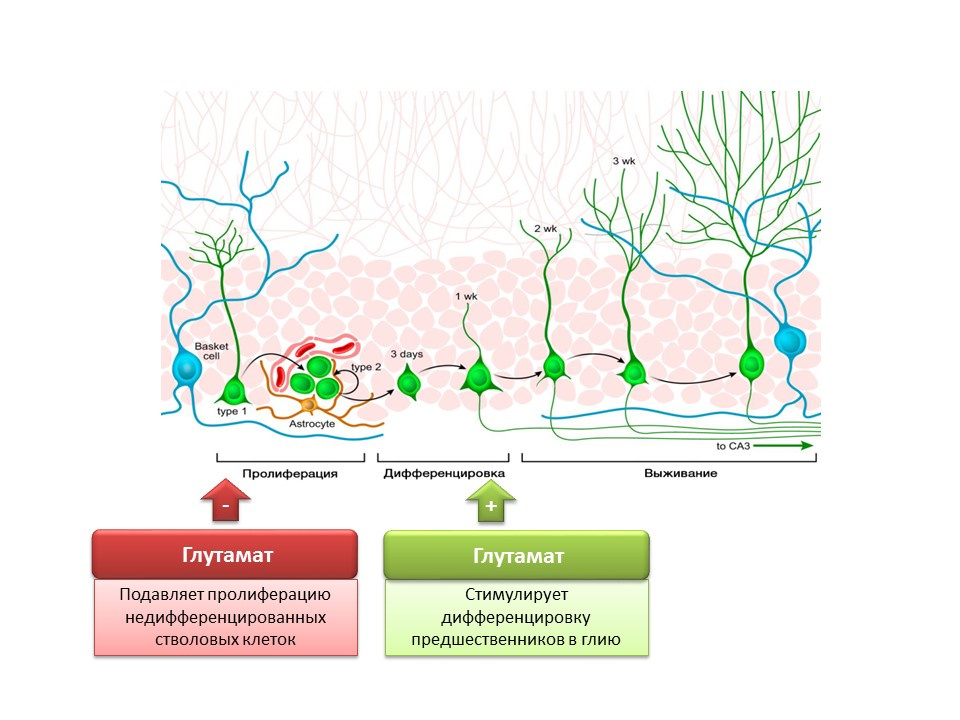 Nakamichi N, Takarada T, Yoneda Y. Neurogenèse médiée par l'acide gamma-aminobutyrique et le glutamatesignaling. J. Pharmacol Sci. 2009; 110 (2): 133-49
Nakamichi N, Takarada T, Yoneda Y. Neurogenèse médiée par l'acide gamma-aminobutyrique et le glutamatesignaling. J. Pharmacol Sci. 2009; 110 (2): 133-49Le rôle du principal médiateur excitant dans le système nerveux central est double. D'une part, le glutamate inhibe la prolifération des cellules souches indifférenciées. En revanche, il stimule la différenciation des précurseurs en ligne gliale. On pense que certains ratios de glutamate et de GABA sont nécessaires pour réguler la différenciation des cellules souches nerveuses en certains types de neurones. Par exemple, le glutamate, comme déjà mentionné, favorise la formation de cellules gliales (astrocytes), et le GABA favorise la formation de neurones qui synthétisent le GABA lui-même (neurones GABAergiques).
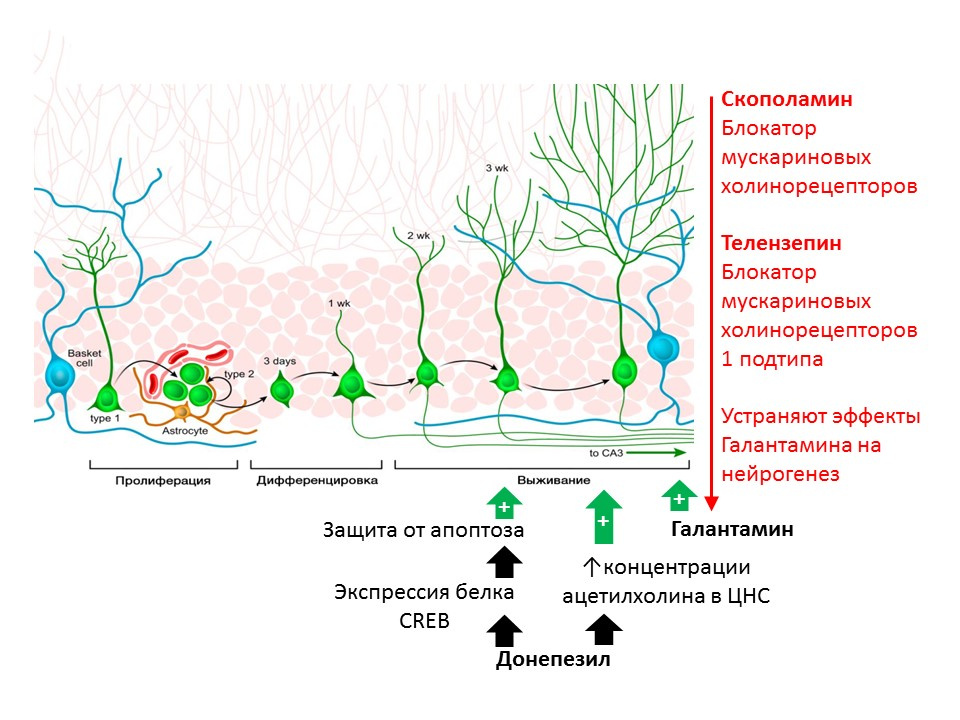 Kotani S et al. H. Donepezil, un inhibiteur de l'acétylcholinestérase, améliore la neurogenèse de l'hippocampe chez l'adulte Chem Biol Interact. 2008; 175 (1-3): 227-30
Kotani S et al. H. Donepezil, un inhibiteur de l'acétylcholinestérase, améliore la neurogenèse de l'hippocampe chez l'adulte Chem Biol Interact. 2008; 175 (1-3): 227-30
Kita Y et coll. La galantamine favorise la neurogenèse hippocampique adulte via les récepteurs muscariniques et α7 nicotiniques chez la souris. Int J Neuropsychopharmacol.2014; 17 (12): 1957-68.Le rôle régulateur de l'acétylcholine (ACX) a été démontré chez des rats utilisant des substances qui empêchent sa destruction (inhibiteurs de l'acétylcholinestérase - une enzyme qui décompose ACX). Le donépézil et la galantamine augmentent la concentration d'ACX dans le système nerveux central (le donépézil augmente également l'expression de la protéine CREB, un facteur de transcription, améliorant ainsi la protection des neurones immatures contre l'apoptose) et augmente la survie des neurones immatures. L'effet positif de la galantamine sur la neurogenèse est éliminé par la scopolamine (bloqueur de tous les sous-types de récepteurs cholinergiques muscariniques) et la télenzépine (bloqueur du sous-type 1 des récepteurs cholinergiques muscariniques), ce qui suggère la réalisation d'effets ACh sur la neurogenèse par l'activation de récepteurs muscariniques de type 1 (
Kotani Sez, al. H. Dras. inhibiteur, améliore la neurogenèse de l'hippocampe adulte. Chem Biol Interact. 2008; 175 (1-3): 227-30; Kita Y et al. Galantamine favorise la neurogenèse de l'hippocampe adulte via les récepteurs muscariniques et α7 nicotiniques chez la souris. Int J Neuropsychopharmacol. 2014; 17 (12): 1957-68. ).
Les sourcesShetty AK. Les cellules progénitrices de la région CA3 de l'hippocampe de rat embryonnaire au jour 19 génèrent in vitro des phénotypes neuronaux spécifiques à la région. Hippocampe. 2004; 14 (5): 595-614
Gómez-Lira G et al. Phénotype programmé et induit des cellules des granules hippocampiques. J Neurosci. 2005; 25 (30): 6939-46
Nakamichi N, Takarada T, Yoneda Y. Neurogenèse médiée par la signalisation de l'acide gamma-aminobutyrique et du glutamate. J. Pharmacol Sci. 2009; 110 (2): 133-49
Arenas E. Ingénierie d'un phénotype dopaminergique dans les cellules souches / précurseurs: rôle de Nurr1, des signaux dérivés de la glie et de Wnts. Ann NY Acad Sci. 2005; 1049: 51-66
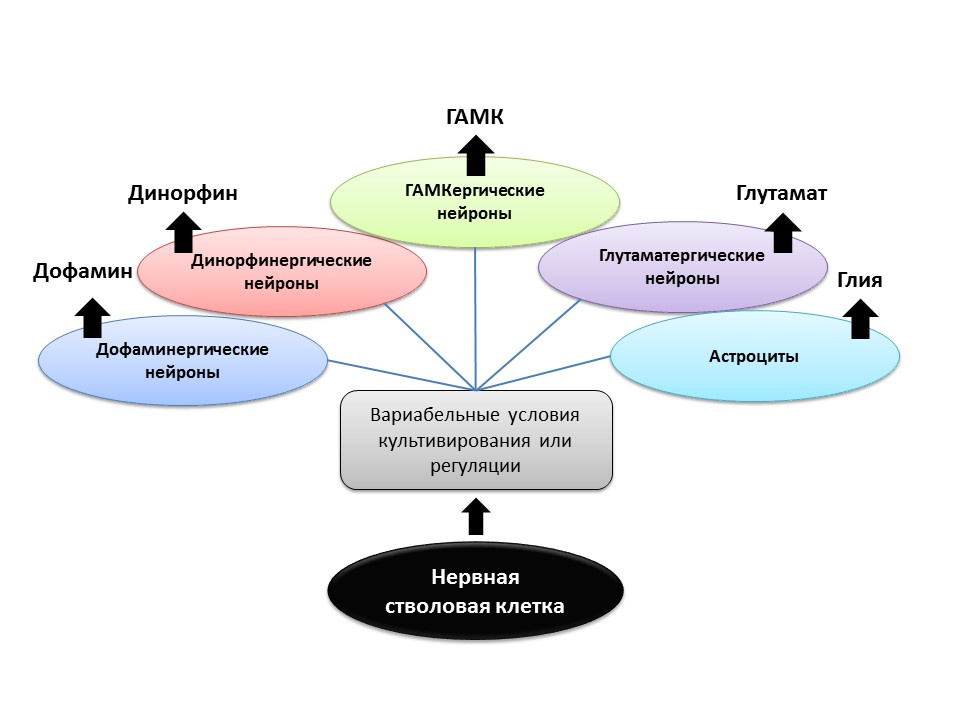
Dans les conditions expérimentales (chez l'animal ou en culture cellulaire), il a été démontré qu'en modifiant le rapport des facteurs régulateurs et en ajoutant les neurotransmetteurs aux cellules souches nerveuses elles-mêmes, le phénotype du neurotransmetteur (c'est-à-dire la fonction de la future cellule) des neurones nouvellement formés peut être «programmé».
Par exemple, la culture de cellules souches avec des astrocytes vous permet d'obtenir une population de neurones glutamatergiques (neurones qui produisent du glutamate) et de dopamine - dopaminergiques.Il est possible qu'une telle action dirigée à l'avenir puisse être utilisée pour la formation sélective de cellules nerveuses d'un certain phénotype. Par exemple, si nous savons quel type est perdu dans une maladie particulière (avec la maladie de Parkinson, les dopaminergiques meurent, avec la maladie d'Alzheimer, cholinergique). Mais à l'heure actuelle, cet aspect de la neurogenèse reste complètement inexploré, et il est trop tôt pour parler de régulation programmée de la neurogenèse (il y a peu d'études).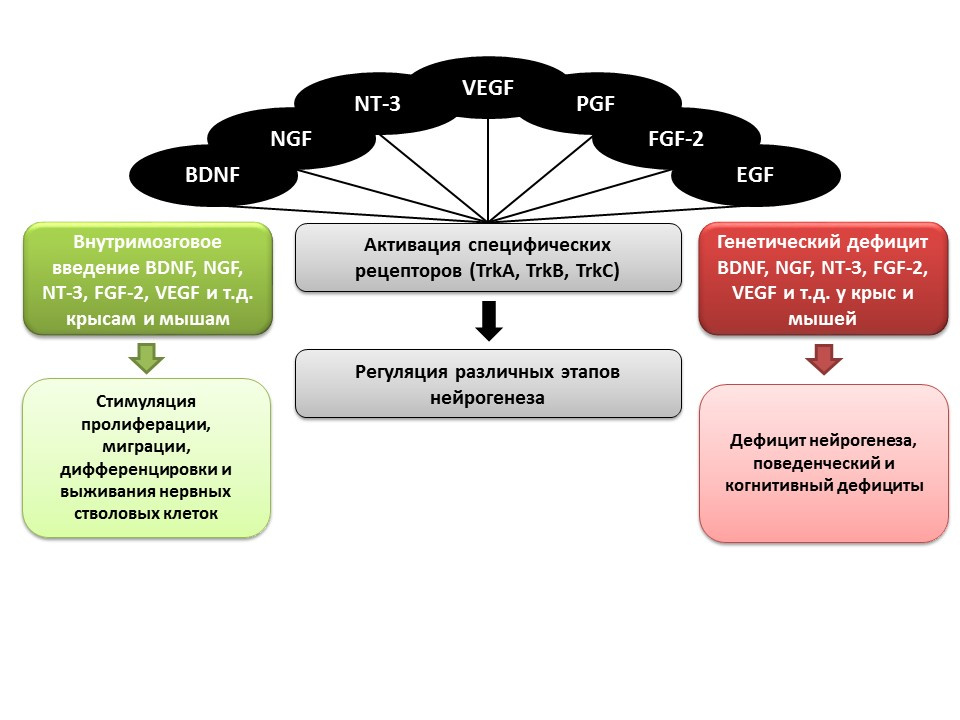
Les sourcesPencea V et al. Infusion of BDNF into the lateral ventricle of the adult rat leads to new neurons in the parenchyma of the striatum, septum, thalamus, and hypothalamus. J.Neurosci. 2001;21:6706–6717
Bath KG et al. Variant brain-derived neurotrophic factor (Val66Met) alters adult olfactory bulb neurogenesis and spontaneous olfactory discrimination. J Neurosci. 2008; 28:2383–2393
Gascon E, Vutskits L, Zhang H, et al. Sequential activation of p75 and TrkB is involved in dendritic development of subventricular zone-derived neuronal progenitors in vitro. Eur J Neurosci. 2005;21:69–80
Kahn MA, Kumar S, Liebl D, et al. Mice lacking NT-3, and its receptor TrkC, exhibit profound deficiencies in CNS glial cells. Glia. 1999;26:153–165
Shimazu K, Zhao M, Sakata K, et al. NT-facilitates hippocampal plasticity and learning and memory by regulating neurogenesis. Learn Mem. 2006; 13(3):307-15)
Zhao M, Li D, Shimazu K, et al. Fibroblast growth factor receptor-1 is required for long-term potentiation, memory consolidation, and neurogenesis. Biol Psychiatry. 2007;62:381–390
Un rôle important dans la régulation de la neurogenèse, comme mentionné précédemment, est joué par la croissance et les facteurs neurotrophiques, notamment:- (BDNF)
- (NGF)
- -3 (NT-3)
- (VEGF)
- (PGF)
- -2 (FGF-2)
- (EGF)
Dans des expériences sur des animaux (rats et souris), il a été montré que l'administration intracérébrale des facteurs ci-dessus améliore toutes les étapes de la neurogenèse. La carence congénitale (souris transgéniques avec des gènes éliminés des facteurs pertinents) entraîne une neurogenèse altérée, ainsi que des déficits comportementaux et cognitifs. Ces données confirment le rôle régulateur important de ces facteurs dans la neurogenèse.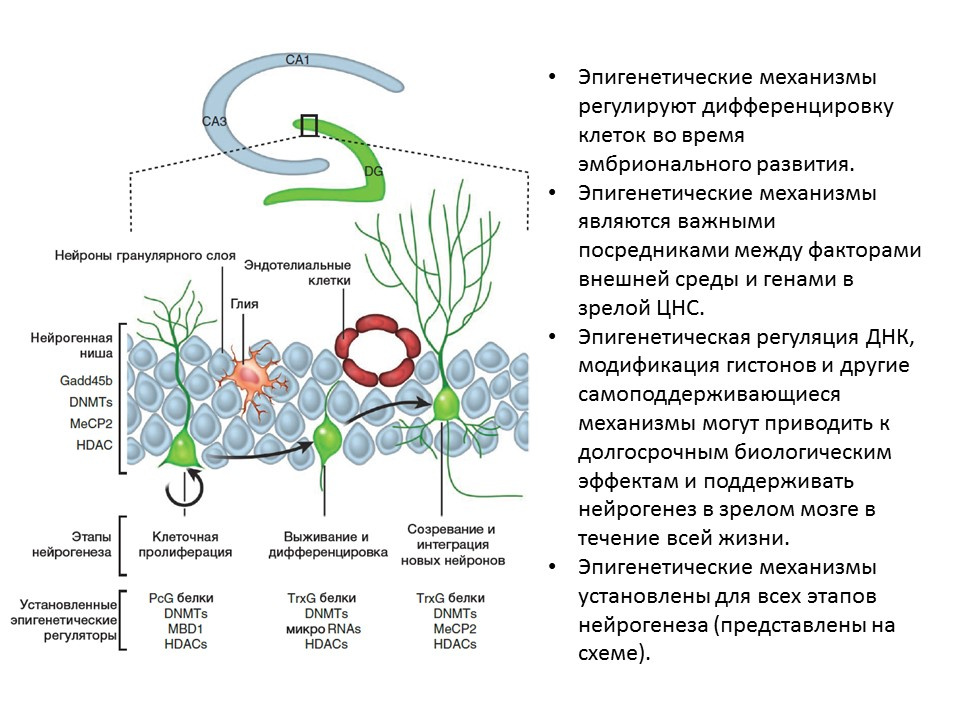 Ma DK, Marchetto MC, Guo JU, Ming GL, Gage FH, Song H. Chorégraphes épigénétiques de la neurogenèse dans le cerveau des mammifères adultes. Nat Neurosci.2010; 13 (11): 1338-44.Des facteurs de régulation épigénétiques ont été établis pour toutes les étapes de la neurogenèse, par exemple:
Ma DK, Marchetto MC, Guo JU, Ming GL, Gage FH, Song H. Chorégraphes épigénétiques de la neurogenèse dans le cerveau des mammifères adultes. Nat Neurosci.2010; 13 (11): 1338-44.Des facteurs de régulation épigénétiques ont été établis pour toutes les étapes de la neurogenèse, par exemple:- histone désacétylases (HDAC)
- ADN méthyl transférase (DNMT)
- micro ARN
- et d'autres.
Les sourcesCoras R, Siebzehnrubl FA, Pauli E, et al. Low proliferation capacities of adult hippocampal stem cells correlate with memory dysfunction in humans. Brain. 2010;133(11):3359-72
Cheyne JE, Grant L, Butler-Munro C, et al. Synaptic integration of newly generated neurons in rat dissociated hippocampal cultures. Mol Cell Neurosci. 2011;47(3):203-14
Hernández-Rabaza V, et al. Neuroscience. 2009;159(1):59-68).
Mochizuki N, Moriyama Y, Takagi N, et al. Intravenous injection of neural progenitor cells improves cerebral ischemia-induced learning dysfunction. Biol Pharm Bull. 2011;34(2):260-5
Sahay A., Hen R. Hippocampal neurogenesis and depression. Novartis Found Symp. 2008;289:152-60
Toni N, Laplagne DA, Zhao C, et al. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nat Neurosci. 2008; 11:901–7
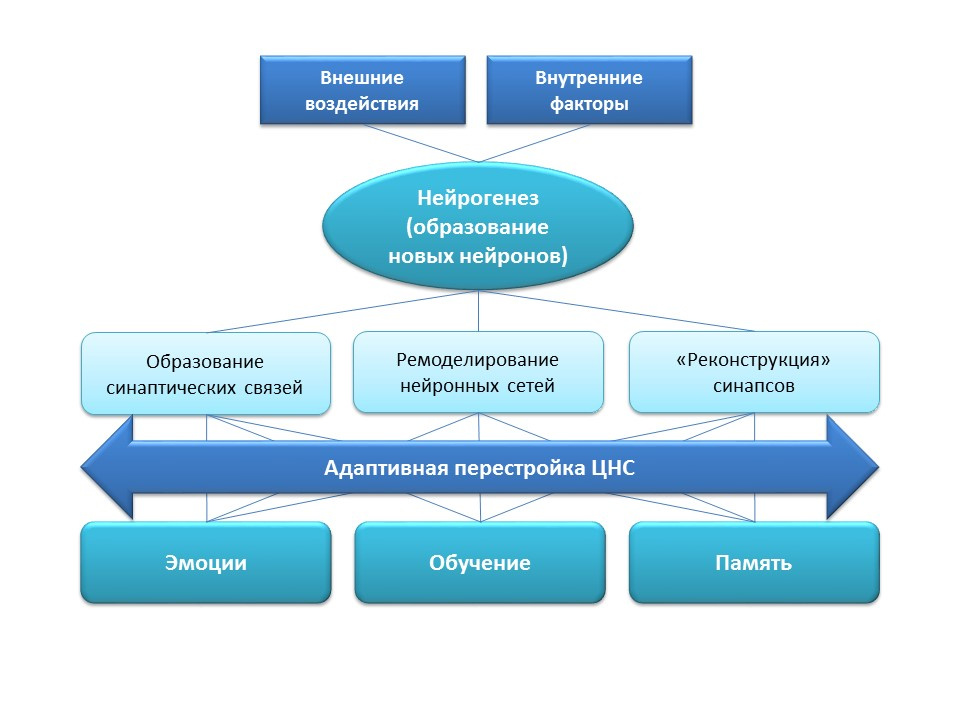
La neurogenèse remplit une fonction adaptative importante dans le système nerveux central, qui consiste en la formation de nouvelles connexions synaptiques (avec la participation de nouvelles cellules nerveuses), le remodelage (restructuration) des réseaux neuronaux existants en fonction de l'influence de facteurs externes (entraînement, activité physique, stress, etc.), "Reconstruction" des connexions synaptiques perdues (sous l'influence de facteurs externes et internes).Tous ces changements d'adaptation ont un impact direct sur la réponse émotionnelle, les processus d'apprentissage et la mémoire. La neurogenèse aide le système nerveux à maintenir sa «plasticité», à changer et à se reconstruire dans de nouvelles conditions et tâches.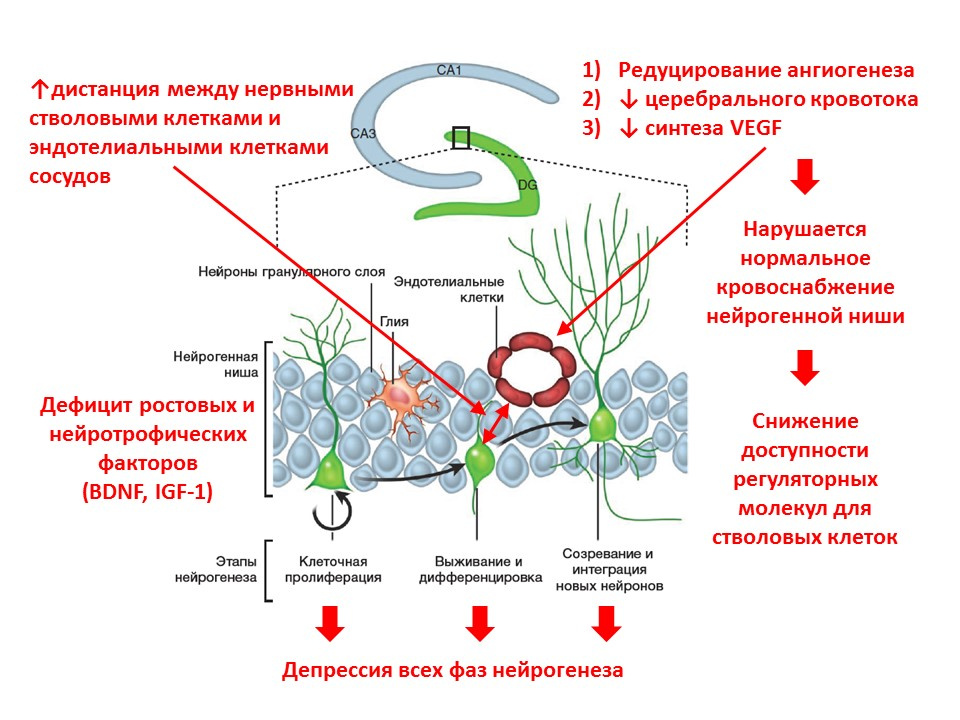
Les sourcesLichtenwalner RJ et al. Neuroscienc 2001;107, 603–613
Luo J, et al. Aging Cell. 2006;5(2):139-52
Cuppini R et al. Hippocampus. 2006;16(2):141-8;
Shetty AK, Hattiangady B, Shetty GA. Glia 2005; 51, 173–186
Drapeau E, Nora Abrous D. Aging Cell. 2008;7(4): 569-89
Hattiangady B, Shetty AK. Neurobiol. Aging.2008; 29: 129–177
Avec l'âge, les processus de neurogenèse commencent à s'estomper. Au niveau moléculaire, le vieillissement s'accompagne des changements suivants dans la neurogenèse:- carence en facteurs de croissance et en neurotrophine - l'un des principaux régulateurs;
- l'équilibre neurotransmetteur du cerveau change (le nombre de certains médiateurs diminue, d'autres augmentent au contraire);
- l'intensité de toutes les phases de la neurogenèse diminue;
- l'apport sanguin à la niche neurogène diminue (l'angiogenèse est réduite, l'expression du facteur de croissance endothélial vasculaire - VEGF diminue), ce qui réduit la disponibilité des facteurs régulateurs pour les cellules souches;
- la distance entre les cellules souches nerveuses et les cellules endothéliales vasculaires augmente (normal, les cellules souches se transforment près des vaisseaux).
Cependant, les changements liés à l'âge dans la neurogenèse ne sont pas irréversibles et la fonction cérébrale adaptative peut être stimulée.- , , .. (Jakubs K et al. Inflammation regulates functional integration of neurons born in adult brain. J Neurosci. 2008 Nov 19;28(47):12477-88).
- , . . (Bachstetter AD et al. Fractalkine and CX3CR1 regulate hippocampal neurogenesis in adult and aged rats. Neurobiol Aging. 2011;32(11):2030-44).
La photo montre des informations sur la stimulation de la neurogenèse chez les rats âgés par l'induction de la neuroinflammation et l'administration de protéine fractaline. Ces données démontrent le fait que le cerveau conserve la fonction adaptative que porte la neurogenèse.
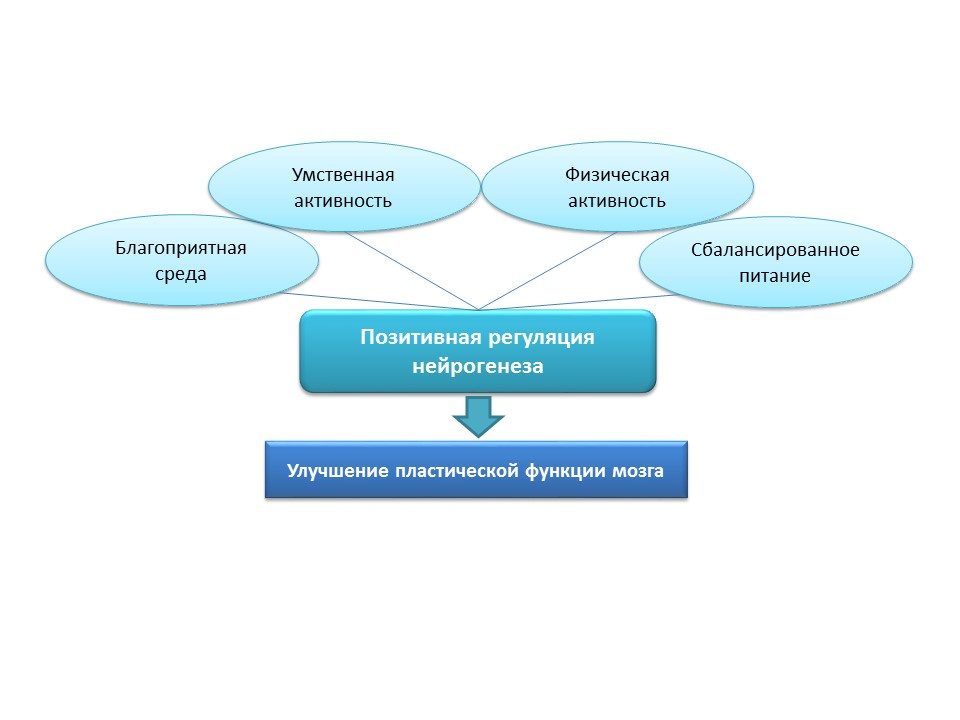
Pour la stimulation naturelle de la neurogenèse chez les personnes âgées, ces stratégies semblent trop agressives, par conséquent, les stimuli positifs naturels doivent être considérés comme des facteurs de «formation» et de «soutien» de la neurogenèse: environnement favorable, activité mentale, activité physique, alimentation équilibrée.
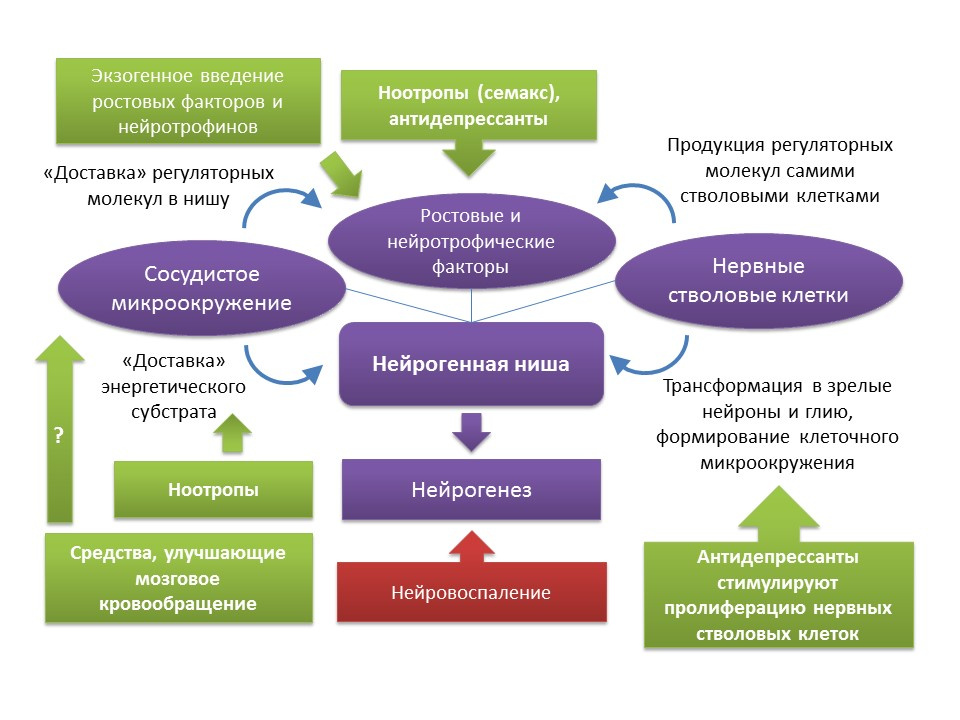 Medvedeva, EV, Dmitrieva, VG, Stavchansky, VV et al. Int J Pept Res Ther (2016) 22: 197.
Medvedeva, EV, Dmitrieva, VG, Stavchansky, VV et al. Int J Pept Res Ther (2016) 22: 197.
Jakubs K et al. L'inflammation régule l'intégration fonctionnelle des neurones nés dans le cerveau adulte. J Neurosci. 19 nov.2008; 28 (47): 12477-88
Les agents Taupin P. Nootropic stimulent la neurogenèse. Expert Opin Ther Pat. Mai 2009; 19 (5): 727-30.Comme mentionné précédemment, malgré les changements liés à l'âge que subit la niche neurogène, la fonction de la neurogenèse peut être restaurée s'il existe certaines incitations. Il convient de noter que le taux de vieillissement et les changements liés à l'âge dans la neurogenèse associés à ce processus sont hétérogènes et sont déterminés par les caractéristiques individuelles du corps. En particulier, on pense que les personnes ayant un niveau de neurogenèse initialement plus élevé ont un niveau plus élevé de neuroplasticité cérébrale et, par conséquent, sont plus résistantes aux changements liés à l'âge dans le système nerveux central. Cependant, il n'y a actuellement aucun moyen d'avoir un effet global sur l'ensemble de la niche neurogène. Comme mentionné précédemment, la niche neurogène elle-même est une sorte de microenvironnement qui comprend de nombreux éléments (microenvironnement vasculaire et cellulaire, un ensemble de facteurs de croissance et neurotrophiques). D'une part, il existe une expérience pharmacologique assez solide dans la régulation de la neurogenèse en raison de l'effet sur les composants individuels de ce "microenvironnement" (introduction ou induction de molécules régulatrices endogènes; stimulation par des médicaments de prolifération, différenciation et survie des neurones nouvellement formés; amélioration de la circulation cérébrale et du métabolisme énergétique dans le système nerveux central). D'autre part, il est connu que les cellules souches elles-mêmes produisent des facteurs de croissance et neurotrophes - BDNF, NGF, VEGF, etc. (
Guzman R. Thérapie cellulaire contre les AVC: du remplacement cellulaire au soutien trophique. Expert Review of Cardiovascular Therapy.2009; 7 (10 ): 1187-1190 ). Cela peut conduire à la conclusion que, pour restaurer la fonction d'une niche neurogène, on peut utiliser, par exemple, une thérapie avec des cellules souches elles-mêmes ou avec des agents qui peuvent stimuler la prolifération des cellules souches nerveuses. À ces moyens, comme déjà mentionné, sont des antidépresseurs de divers groupes pharmacologiques. Les preuves cliniques d'un risque réduit de démence sénile après un traitement antidépresseur (complication fréquente après une dépression à un âge précoce) peuvent indirectement confirmer une telle conclusion. Il convient de noter que les données sur l'effet des antidépresseurs sur le risque de démence sont controversées. Ainsi, il a été constaté que l'utilisation d'antidépresseurs tricycliques est associée à un risque réduit de démence, tandis que les inhibiteurs de la MAO (monoamine oxydases), les antidépresseurs hétérocycliques et les ISRS (inhibiteurs sélectifs du recaptage de la sérotonine), au contraire, peuvent augmenter le risque ou n'avoir aucun effet sur le développement de la démence. (
Kessing LV, Forman JL, Andersen PK. Les antidépresseurs continus protègent-ils contre la démence chez les patients souffrant d'un trouble dépressif sévère? Int Clin Psychopharmacol. 2011; 26 (6): 316-22; Lee CW et al .Traitement antidépresseur et risque de démence: une étude rétrospective cas-témoins basée sur la population, J Clin Psychiatry, janvier 2016; 77 (1): 117-22; questionnaire 122 ). Néanmoins, ces données cliniques nécessitent de la prudence dans l'interprétation, car ces revues cliniques ne prennent pas en compte un certain nombre de facteurs (antécédents tabagiques des patients, consommation d'alcool, gravité et formes de troubles dépressifs, pathologies concomitantes, etc.).
Un autre groupe intéressant de médicaments qui peuvent être considérés comme des agents neurogènes potentiels sont les nootropiques. Les médicaments nootropes ont un certain nombre de caractéristiques spécifiques: 1) n'agissent que dans le contexte de la pathologie des fonctions ménagères; 2) ont un caractère cumulatif de l'action; 3) divers dans leurs mécanismes d'action et leur structure chimique; 4) agissent comme des psychostimulants, mais n'ont pas les effets secondaires inhérents; 5) à ce jour, il n'y a pas de données convaincantes sur l'efficacité clinique des nootropiques. On pense que les médicaments nootropes ont un effet complexe sur le système nerveux central: ils améliorent la circulation cérébrale, le métabolisme énergétique, interagissent avec les récepteurs de la plupart des neurotransmetteurs (GABA, glutamate, acétylcholine). Dans des études expérimentales, la capacité potentielle de certains nootropiques à stimuler la neurogenèse a été démontrée. En particulier, le piracétam a amélioré le processus de différenciation dans une culture de cellules souches nerveuses humaines (les
agents Taupin P. Nootropic stimulent la neurogenèse. Expert Opin Ther Pat. 2009 mai; 19 (5): 727-30 ), un autre médicament nootrope Semax a amélioré l'expression génétique de plus de 20 croissances et les facteurs neurotrophiques dans le cerveau des rats après administration intrapéritonéale dans des conditions de modélisation de l'AVC ischémique (
Medvedeva, EV, Dmitrieva, VG, Stavchansky, VV et al. Int J Pept Res Ther (2016) 22: 197 ), ce qui indique également l'effet potentiellement provirogène du médicament . Compte tenu de la faible connaissance des nootropiques, il est difficile de parler du mécanisme spécifique de leur activité neurogène, auquel peuvent participer à la fois leur effet complexe sur le système nerveux central et certains composants spécifiques. De toute évidence, cette question nécessite des études plus approfondies.
Un autre groupe de médicaments qui pourraient stimuler la neurogenèse sont les correcteurs de circulation cérébrale (par exemple, la nimodipine ou la pentoxifylline). Cependant, les données sur l'effet de ces médicaments sur la neurogenèse sont rares. Dans des expériences sur des rats, il a été montré que le traitement à la pentoxifylline améliorait la mémoire à court terme et diminuait l'apoptose des neurones hippocampiques dans des conditions d'ischémie cérébrale, ce qui pourrait indiquer ses propriétés neuroprotectrices (
Park JH et al. par Suppressing Apoptosis in the Hippocampus of Rat Pups. Int Neurourol J 2016; 20 (2): 107-113 ). La nimodipine, en revanche, a montré la capacité de supprimer la neurogenèse stimulée par l'ischémie dans l'hippocampe de souris (Luo CX et al. Le blocage du canal Ca déclenché par la tension de type L inhibe la neurogenèse induite par l'ischémie en régulant à la baisse l'expression d'iNOS chez la souris adulte. Journal of neurochemistry, 2005) , qui, apparemment, est associée à son mécanisme d'action direct - le blocage des canaux calciques de type L.
Pour obtenir une image complète de la manipulation pharmacologique d'une niche neurogène dans des conditions de changements liés à l'âge, des études plus détaillées sont nécessaires pour élargir la compréhension de l'activité des médicaments neurogènes dans des conditions pertinentes et nous permettre de conclure qu'il existe des orientations prometteuses dans la création de médicaments qui empêcheraient et corrigeraient le déclin lié à l'âge de l'activité neurogène cérébrale.
Le rôle de la neurogenèse dans diverses pathologies du système nerveux central
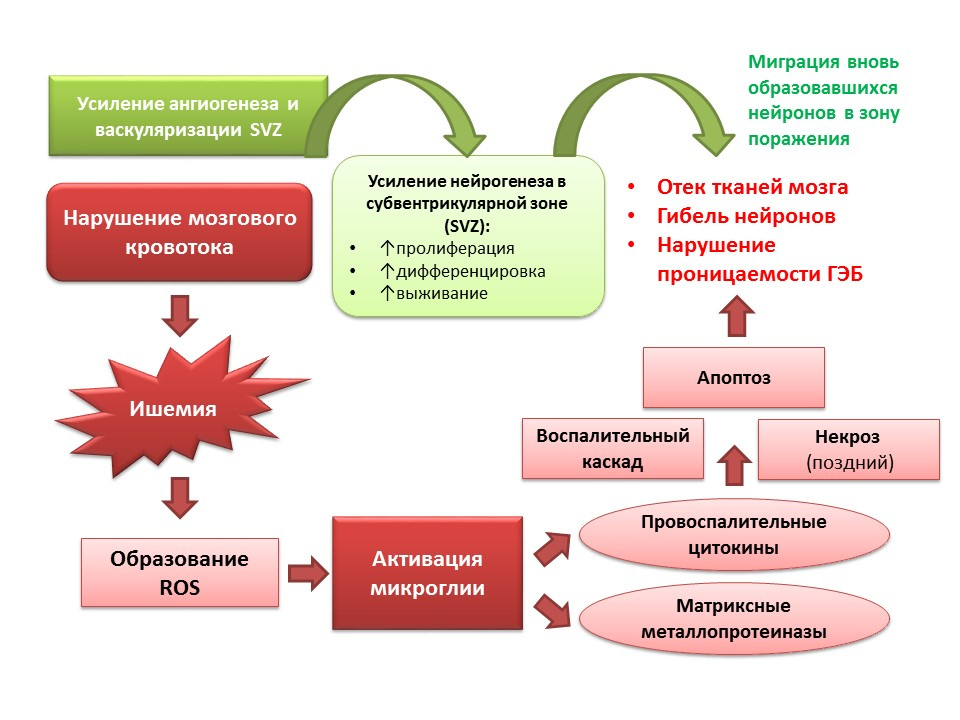
Les sourcesBordt, EA, Polster, BM (2014). Espèces d'oxygène réactif dérivées de la NADPH oxydase et des mitochondries dans l'activation microgliale pro-inflammatoire: une affaire bipartite? Radic Biol Med gratuit, 34–46
Liu J, Solway K, Messing RO, Sharp FR. Augmentation de la neurogenèse dans le gyrus denté après une ischémie globale transitoire chez les gerbilles. J Neurosci. 1998; 18 (19): 7768-78
Zhang ZG, Zhang L, Jiang Q et al. Le VEGF améliore l'angiogenèse et favorise les fuites de la barrière hémato-encéphalique dans le cerveau ischémique. J Clin Invest. 2000; 106: 829–38
Nakayama D, Matsuyama T, Ishibashi-Ueda H, et al. Cellules souches / progénitrices neurales induites par des blessures dans le cortex cérébral humain post-AVC. Eur J Neurosci. 2010; 31 (1): 90-8)
Minger SL, Ekonomou A, Carta EM, et al. Neurogenèse endogène dans le cerveau humain suite à un infarctus cérébral. Regen Med. 2007; 2 (1): 69-74).
La neurogenèse remplit également une fonction adaptative dans le contexte des pathologies du SNC. En particulier, un AVC ischémique entraîne la mort des cellules nerveuses (un schéma simplifié de la pathogenèse est montré sur la diapositive). Cependant, avec l'ischémie, un petit nombre de neurones meurent rapidement (minutes) - c'est le soi-disant noyau d'ischémie. La plupart des neurones sont déficients en glucose et en oxygène, mais ils restent viables pendant plusieurs heures (une fenêtre thérapeutique pour aider) - c'est ce qu'on appelle la pénombre ou la pénombre de l'ischémie. Dans les conditions de lésions cérébrales ischémiques, la neurogenèse est activée dans la zone sous-ventriculaire des ventricules latéraux et les neurones nouvellement formés migrent vers la zone de la pénombre.
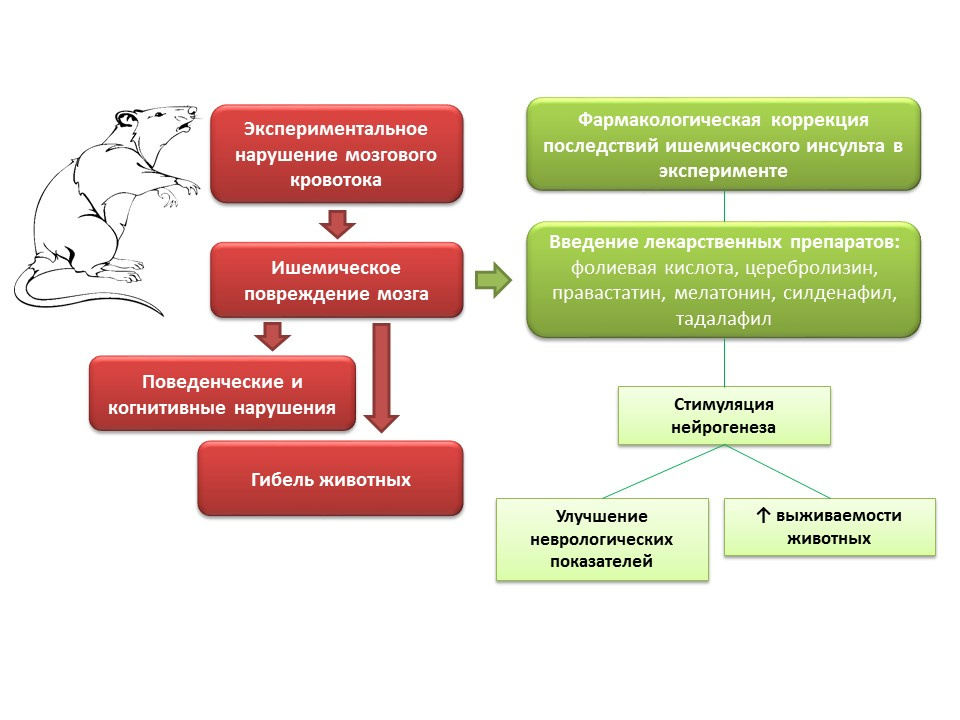
Les sourcesZhang, RL, Zhang, ZG et Chopp, M. (2013). Cibler l'oxyde nitrique dans le traitement de restauration subaigu de l'AVC ischémique. Opinion d'expert sur les drogues expérimentales, 22 (7), 843–851.
Chern CM, Liao JF, Wang YH, Shen YC. La mélatonine améliore la fonction neurale en favorisant la neurogenèse endogène via le récepteur de mélatonine MT2 chez les souris ayant subi un AVC ischémique. Radic Biol Med gratuit. 2012; 52 (9): 1634-47
Zhang X, Huang G, Liu H et al. L'acide folique améliore la signalisation Notch, la neurogenèse hippocampique et la fonction cognitive dans un modèle de rat d'ischémie cérébrale. Nutr Neurosci. 2012; 15 (2): 55-61
Zhang C, Chopp M, Cui Y et al. La cérébrolysine améliore la neurogenèse dans le cerveau ischémique et améliore les résultats fonctionnels après un AVC. J Neurosci Res. 15 nov.2010; 88 (15): 3275-81
Zhang RL, Zhang Z, Zhang L, et al. Un traitement retardé avec le sildénafil améliore la neurogenèse et améliore la récupération fonctionnelle chez les rats âgés après une ischémie cérébrale focale. J Neurosci Res. 2006; 83 (7): 1213-9
Zheng Z, Chen B. Effets de la pravastatine sur la neuroprotection et la neurogenèse après ischémie cérébrale chez le rat. Neurosci Bull. 2000; 23 (4): 189-97
Dans les expérimentations animales, lors de la modélisation des troubles du flux sanguin cérébral, des troubles neurologiques (déficits cognitifs et comportementaux) sont observés, ainsi qu'un pourcentage important de décès d'animaux. L'introduction de médicaments chez ces animaux avec un mécanisme d'action différent, mais avec une caractéristique commune - la capacité de stimuler la neurogenèse (acide folique, cérébrolysine, pravastatine, mélatonine, sildénafil, tadalafil) - améliorant les paramètres neurologiques des animaux et réduisant considérablement la mortalité.
Quelles sont les perspectives de manipulation de la neurogenèse pour les lésions cérébrales ischémiques?- La possibilité d'utiliser certains médicaments du groupe des neuroprotecteurs (cérébrolysine) dans le cadre du traitement complexe de l'AVC ischémique aigu pour prévenir la mort des neurones dans la pénombre.
- Pour de nombreux médicaments qui ont montré la capacité de stimuler la neurogenèse et d'améliorer l'état neurologique des animaux après la modélisation de l'AVC ischémique, cet effet n'est pas fondamental, par conséquent, leur utilisation clinique est compliquée par la présence de leurs propres effets, qui peuvent être indésirables.
- D'un autre côté, l'étude des mécanismes sous-jacents aux effets neuroprotecteurs est une tâche importante, car elle peut fournir la base pour le développement de médicaments fondamentalement nouveaux et hautement efficaces pour la thérapie réparatrice de l'AVC ischémique.
- La régulation pharmacologique de la neurogenèse, dans le contexte des lésions cérébrales ischémiques, ouvre la possibilité de créer un nouveau groupe de médicaments qui réduisent la mortalité et améliorent la qualité de vie des patients après un AVC ischémique.
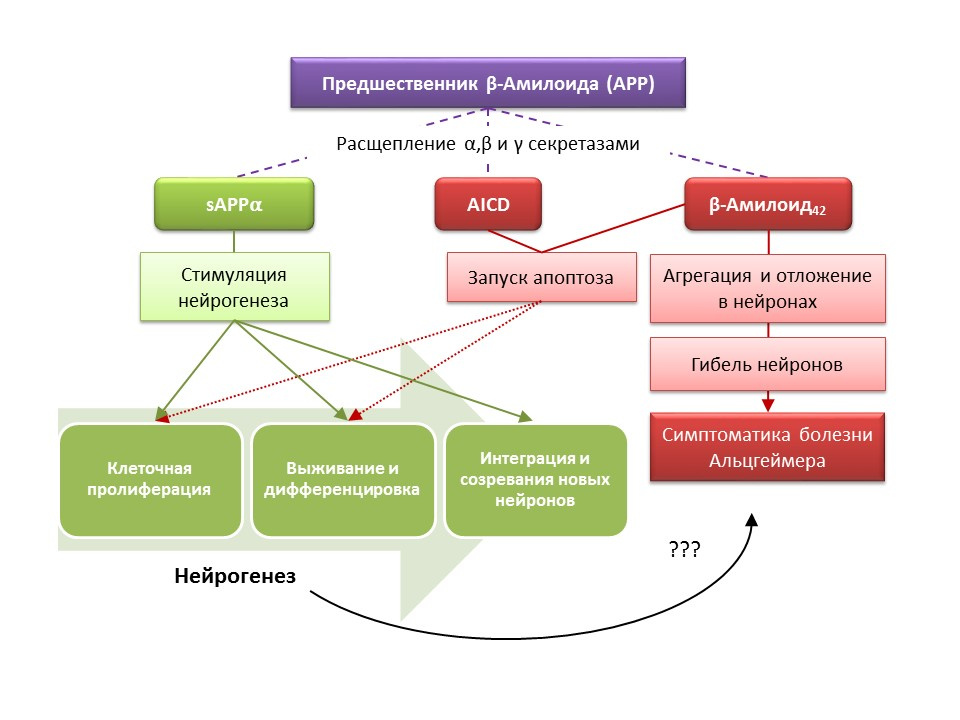
Les sourcesYu Y et al. Augmentation de la neurogenèse hippocampique au stade progressif du phénotype de la maladie d'Alzheimer dans un modèle de souris transgénique double APP / PS1. Hippocampe. 2009; 19 (12): 1247-53
Ghosal K, Stathopoulos A, Pimplikar SW. Le domaine intracellulaire APP altère la neurogenèse adulte chez les souris transgéniques en induisant une neuroinflammation. Plos un. 2010; 5 (7): e11866
Mu Y, Gage FH. Neurogenèse hippocampique adulte et son rôle dans la maladie d'Alzheimer. Mol Neurodegener. 2011; 6: 85
Jin K, Peel AL, Mao XO et al. Augmentation de la neurogenèse hippocampique dans la maladie d'Alzheimer. Proc Natl Acad Sci USA. 2004; 101 (1): 343–347
La maladie d'Alzheimer (MA) est une maladie neurodégénérative accompagnée de la mort des neurones cholinergiques (neurones qui produisent de l'acétylcholine). Les causes de la maladie d'Alzheimer ne sont actuellement pas précisément établies, la maladie est considérée comme multifactorielle. La pathogenèse de la MA est basée sur une violation du métabolisme de la protéine bêta-amyloïde, dont des fractions individuelles se déposent dans les neurones du système nerveux central et entraînent leur mort. Les fractions amyloïdes affectent la neurogenèse de différentes manières, de sorte que le précurseur soluble amyloïde alpha (sAPPα) stimule toutes les étapes de la neurogenèse, tandis que le domaine intracellulaire du précurseur amyloïde (AICD) et bêta-amyloïde-42 provoque l'apoptose des cellules souches nerveuses, réduisant la prolifération et taux de survie. L'activation de la neurogenèse est déjà enregistrée dans les premiers stades de la MA, lorsqu'il n'y a toujours pas de neurodégénérescence prononcée et de démence. Apparemment, la neurogenèse contre la MA joue également un rôle adaptatif. Dans la plupart des modèles animaux de MA (souris transgéniques avec altération du métabolisme bêta-amyloïde) et de matériel post mortem de patients MA, une augmentation du nombre de cellules BrdU positives a été enregistrée. Cependant, il existe des preuves d'un manque de changements dans la neurogenèse dans certains modèles animaux de la MA et le matériel post mortem de certains patients atteints de MA. Enfin, la question reste ouverte sur la capacité des cellules nouvellement formées à remplacer les neurones morts dans la MA.
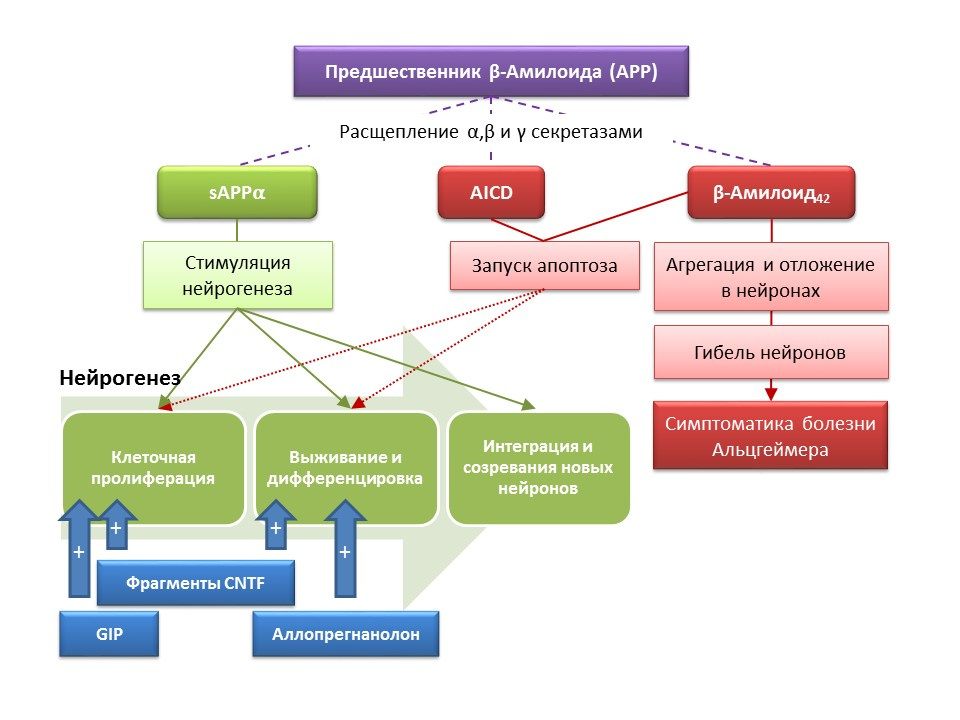 DOI: 10.3233 / JAD-2011-110914DOI: 10.1016 / j.ejphar.2011.11.007DOI: 10.1371 / journal.pone.0024293
DOI: 10.3233 / JAD-2011-110914DOI: 10.1016 / j.ejphar.2011.11.007DOI: 10.1371 / journal.pone.0024293Des études expérimentales sur de nouvelles approches de la correction pharmacologique de la maladie d'Alzheimer ont démontré la capacité d'un certain nombre de substances à stimuler la neurogenèse chez la souris transgénique (chez la souris, le métabolisme normal de la bêta-amyloïde est un modèle animal de la maladie d'Alzheimer) en combinaison avec de meilleures réactions comportementales (une réaction de recherche d'orientation, l'apprentissage et mémoire):
- L'introduction de fragments fonctionnels des peptides de neurotrophine ciliaire CNTF 6 et 6A a stimulé la formation de nouvelles cellules souches et la survie de neurones nouvellement formés dans la zone sous-ventriculaire, le gyrus denté de l'hippocampe et les bulbes olfactifs (Rockenstein E, Ubhi K, Doppler E, et al. Comparaison régionale des effets neurogènes de peptides dérivés de CNTF et de cérébrolysine chez des souris transgéniques AβPP. J Alzheimers Dis. 2011; 27 (4): 743-52)
- L'administration d'un peptide insulinotrope dépendant du glucose (GIF) avec des propriétés de facteur de croissance a conduit à une prolifération accrue de cellules souches nerveuses dans le gyrus denté de l'hippocampe (Faivre E, Hamilton A, Hölscher C.Effets de l'administration aiguë et chronique de GIP comparative sur la cognition, la plasticité synaptique et la neurogenèse chez la souris. Eur J Pharmacol. 2012; 674 (2-3): 294-306)
- L'administration chronique et subchronique de l'allopregnanolone stéroïde neuroactive a contribué à la survie des neurones nouvellement formés (Chen S, Wang JM, Irwin RW, et al. Allopregnanolone favorise la régénération et réduit la charge β-amyloïde dans un modèle préclinique de la maladie d'Alzheimer. PLoS One.2011; 6 ( 8): e24293; Singh C, Liu L, Wang JM, et al. Neurobiol Aging.2012; 33 (8): 1493-506)
Les résultats indiquent les perspectives d'utilisation de substances qui stimulent la neurogenèse pour soulager les symptômes de la maladie d'Alzheimer, ainsi que pour réduire le taux de progression de la neurodégénérescence, ce qui représente une approche fondamentalement nouvelle pour la correction médicamenteuse de cette maladie.
Perspectives de manipulation de la neurogenèse dans la maladie d'Alzheimer- L'étiologie exacte de la maladie d'Alzheimer reste inconnue aujourd'hui, ce qui rend difficile la recherche de nouveaux médicaments ciblant la cause de la maladie.
- Les données obtenues lors de la modélisation génétique de la maladie d'Alzheimer chez l'animal et de l'étude du matériel post-mortel chez les personnes atteintes de MA sont contradictoires.
- Dans le même temps, dans les modèles animaux de la maladie d'Alzheimer, il a été montré qu'une augmentation de la neurogenèse était déjà observée aux premiers stades de la maladie (avant altération de la fonction cognitive). On pense que cette amélioration peut être considérée comme une réaction adaptative-protectrice du système nerveux central.
- Dans des modèles animaux de la maladie d'Alzheimer, il a été montré qu'un certain nombre de substances (fragments actifs de neutrotrophine ciliaire - CNTF, peptide insulinotrope dépendant du glucose - GIP et allopregnanolone) peuvent stimuler la neurogenèse et améliorer le comportement des rongeurs.
- Un inconvénient important de ces manipulations est le fait qu'une violation de la neurogenèse n'est apparemment pas la cause de la maladie d'Alzheimer, mais seulement un symptôme. Cependant, les perspectives d'une telle thérapie peuvent être de ralentir la progression de la maladie et de retarder le développement de la démence.
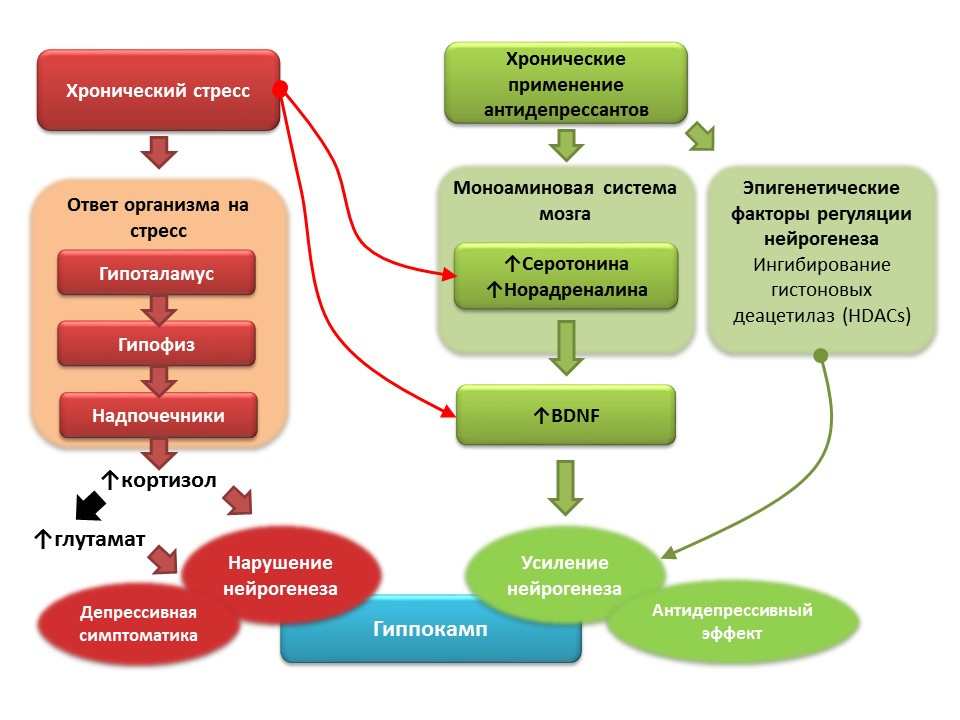 DOI: 10.1016 / j.pharma.2013.02.02.006PMID: 11124987DOI: 10.1186 / s13045-017-0499-7
DOI: 10.1016 / j.pharma.2013.02.02.006PMID: 11124987DOI: 10.1186 / s13045-017-0499-7Dans le contexte de la dépression clinique (trouble dépressif majeur), une diminution de la neurogenèse et une diminution du volume de l'hippocampe, qui se rétablit après une cure d'antidépresseurs, sont également enregistrées. On pense que le stress chronique joue le rôle d'un facteur déclencheur dans la pathogenèse des troubles dépressifs, ce qui déclenche une cascade de réactions dépendantes du stress qui entraînent une hyperproduction de cortisol et une augmentation de la concentration de glutamate dans le système nerveux central. Ces facteurs perturbent la plasticité du cerveau (et la neurogenèse en particulier) et contribuent au développement de symptômes dépressifs). Au contraire, l'utilisation chronique d'antidépresseurs stimule la neurogenèse, augmentant la concentration dans le système nerveux central des monoamines (sérotonine et norépinéphrine), un facteur neurotrophique cérébral. Certains antidépresseurs ont également des mécanismes supplémentaires pour réguler la neurogenèse. Par exemple, l'amitriptyline est capable d'inhiber les histones désacétylases, qui jouent le rôle de régulateurs épigénétiques de la neurogenèse, et stimulent ainsi la prolifération des cellules souches nerveuses.
Perspectives de manipulation de la neurogenèse dans la dépression- La plupart des antidépresseurs, quels que soient le groupe et le mécanisme d'action, sont capables de stimuler la neurogenèse dans des conditions de modélisation de la dépression dans des modèles animaux.
- Chez les personnes souffrant de dépression, l'utilisation chronique d'antidépresseurs restaure le volume de l'hippocampe, une diminution qui est généralement observée dans les troubles dépressifs.
- Le mécanisme d'action général de tous les antidépresseurs est l'effet sur le système des monoamines, en particulier la capacité d'augmenter les concentrations de sérotonine et de noradrénaline dans le système nerveux central.
- De nombreuses études expérimentales ont montré le rôle important des monoamines (sérotonine et norépinéphrine) dans la régulation de la neurogenèse hippocampique dans le cerveau adulte.
- Une direction prometteuse semble être une étude plus approfondie des mécanismes de régulation de la neurogenèse par la sérotonine et la noradrénaline, dont la compréhension peut aider au développement de nouveaux moyens de correction pharmacologique de la dépression.
- Cependant, tous les antidépresseurs ne peuvent pas stimuler seuls la neurogenèse, certains ne font que restaurer le niveau initial de neurogenèse, réduit par le stress chronique.
- Par conséquent, un autre domaine important est l'étude des mécanismes des antidépresseurs qui ne sont pas associés au système monoamine. Par exemple, l'effet des antidépresseurs sur les régulateurs épigénétiques de la neurogenèse.
- Une direction distincte est représentée par le développement de préparations basées sur le facteur neurotrophique cérébral (BDNF) et une diminution de l'effet du glutamate sur le système nerveux central (bloqueurs des récepteurs NMDA du glutamate).
Perspectives générales et approches de l'étude de la neurogenèse1. L'étude des mécanismes moléculaires de régulation de la neurogenèse dans le cerveau mature.- Quels sont les systèmes impliqués dans la régulation de la neurogenèse dans le cerveau adulte et quels troubles conduisent à l'inhibition de la neurogenèse?
- Prise en compte de ces systèmes et de leurs composants individuels comme cibles potentielles pour la correction médicamenteuse de la neurogenèse.
- La recherche de nouvelles «formules» de médicaments capables de réguler les processus de neurogenèse dans le cerveau adulte.
2. De nouvelles recherches devraient répondre à la question: dans quelle mesure les neurones nouvellement formés peuvent-ils remplacer le système nerveux central perdu au cours d'une pathologie spécifique?3. Il est nécessaire d'évaluer les conséquences possibles d'une stimulation exogène à long terme de la neurogenèse adulte.4. Il est nécessaire de développer une stratégie globale pour la correction des troubles de la neurogenèse, qui tiendrait compte de tous les principaux facteurs:- Le besoin d'angiogenèse
- La neurogenèse elle-même
- Synaptogenèse
- Remodelage axonal
- Créer des conditions extérieures favorables