 Fig. 1
Fig. 1Le noyau d'un atome est minuscule, son rayon est de 10 000 à 100 000 fois plus petit que l'atome total. Chaque noyau contient un certain nombre de protons (nous le désignons par Z) et un certain nombre de neutrons (nous le désignons par N), liés ensemble sous la forme d'une boule, dont la taille n'est pas beaucoup plus grande que la somme de leurs tailles. Notez que les protons et les neutrons ensemble sont souvent appelés «nucléons», et Z + N est souvent appelé A - le nombre total de nucléons dans le noyau. Aussi Z, le "numéro atomique" est le nombre d'électrons dans un atome.
Une image de dessin animé typique d'un atome (Fig. 1) exagère considérablement la taille du noyau, mais représente plus ou moins correctement le noyau comme un amas de protons et de neutrons négligemment connectés.
Contenu du noyau
Comment savons-nous ce qu'il y a dans le noyau? Ces petits objets sont faciles à caractériser (et c'était juste historiquement) grâce à trois faits de la nature.
1. Le proton et le neutron ne diffèrent en masse que d'un millième, donc si nous n'avons pas besoin d'une précision extrême, nous pouvons dire que tous les nucléons ont la même masse, et l'appeler la masse du nucléon, m
nucléon :
m
proton ≈ m
neutron ≈ m
nucléon(≈ signifie "approximativement égal")
2. La quantité d'énergie requise pour maintenir les protons et les neutrons dans le noyau est relativement faible - de l'ordre du millième de l'énergie de masse (E = mc
2 ) des protons et des neutrons, de sorte que la masse du noyau est presque égale à la somme des masses de ses nucléons:
Noyau M ≈ (Z + N) × m
nucléon3. La masse de l'électron est 1/1835 de la masse du proton - de sorte que presque toute la masse de l'atome est contenue dans son noyau:
Atome M
core noyau M
Cela implique la présence d'un quatrième fait important: tous les atomes d'un certain isotope d'un certain élément sont les mêmes, comme tous leurs électrons, protons et neutrons.
Étant donné que l'isotope de l'hydrogène le plus courant contient un électron et un proton:
M
hydrogène ≈ m
proton ≈ m
nucléonmasse atomique M l'
atome d'un certain isotope est simplement égal à Z + N fois la masse de l'atome d'hydrogène
Atome M
core M
noyau ≈ (Z + N) × m
nucléon ≈ (Z + N) × M
hydrogèneet l'erreur de ces équations est d'environ 0,1%.
Les neutrons étant électriquement neutres, la charge électrique Q du
noyau est simplement égale au nombre de protons multiplié par la charge électrique du proton ("e"):
Noyau Q = Z ×
proton Q = Z × e
Contrairement aux équations précédentes, cette équation est précise.
Pour résumer:
Z = Q
noyau / e
A = Z + N
atom M
atome / M
hydrogèneCes équations sont illustrées sur la fig. 2
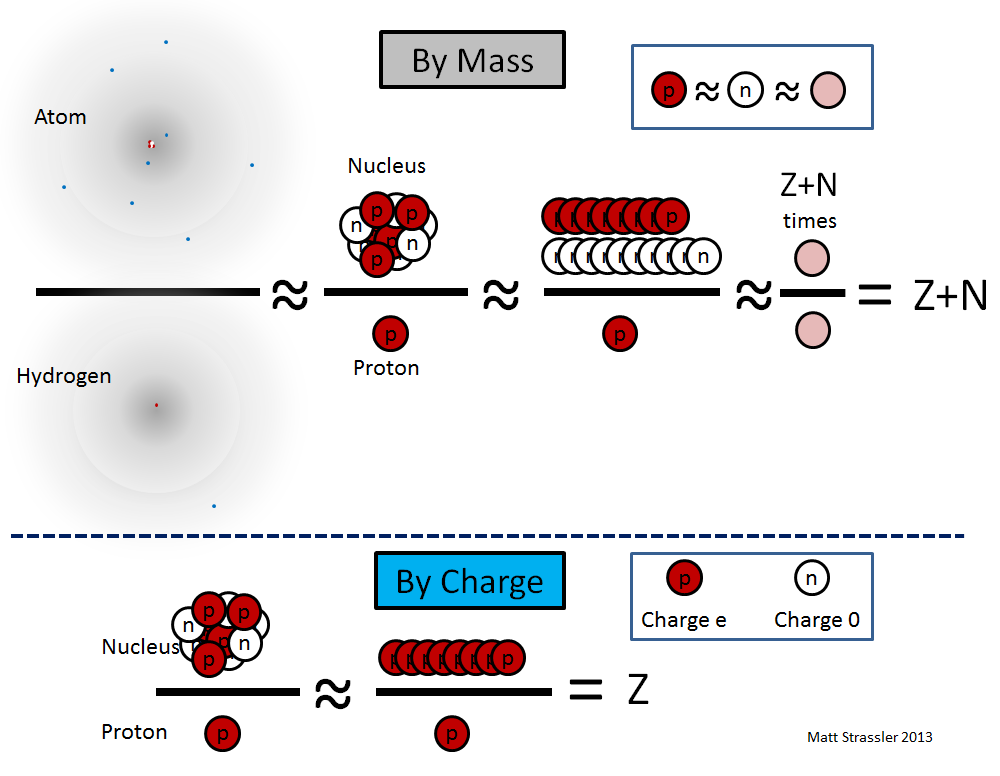 Fig. 2
Fig. 2En utilisant les découvertes des dernières décennies du 19e siècle et des premières décennies du 20e siècle, les physiciens ont su mesurer dans l'expérience les deux valeurs rouges: la charge nucléaire en e et la masse de tout atome en atomes d'hydrogène. Ces valeurs étaient donc déjà connues dans les années 1910. Cependant, ils n'ont pu être correctement interprétés qu'en 1932, lorsque James Chadwick a déterminé que le neutron (dont l'idée a été proposée par Ernest Rutherford en 1920) est une particule distincte. Mais dès qu'il est devenu clair que les neutrons existent et que leur masse est presque égale à la masse d'un proton, il est immédiatement devenu clair comment interpréter les nombres Z et N - le nombre de protons et de neutrons. Et aussi une nouvelle énigme est immédiatement née - pourquoi les protons et les neutrons ont presque la même masse.
Honnêtement, les physiciens de l'époque ont été scientifiquement chanceux que tout cela soit si facile à installer. Les lois de la masse et des charges sont si simples que même les puzzles les plus longs ont été découverts immédiatement après la découverte du neutron. Si même l'un des faits de la nature que j'ai énumérés s'avérait faux, alors il faudrait beaucoup plus de temps pour comprendre ce qui se passe à l'intérieur des atomes et de leurs noyaux.
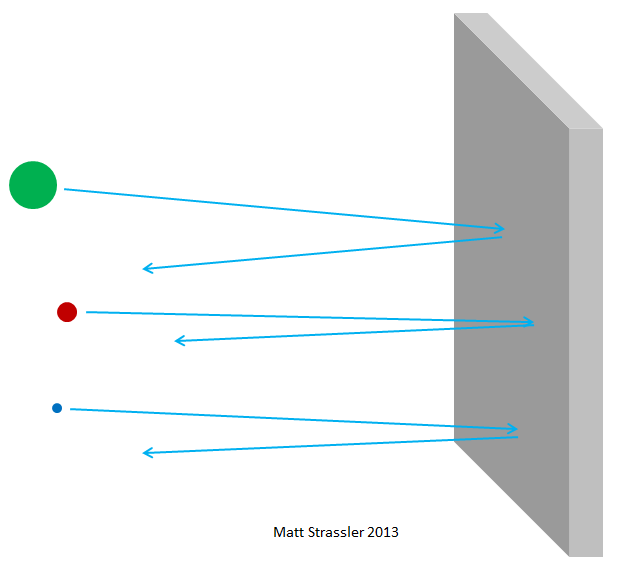 Fig. 3
Fig. 3Malheureusement, d'un autre point de vue, ce serait beaucoup mieux si tout se révélait plus compliqué. Il était à peine possible de saisir le pire moment pour cette percée scientifique. La découverte du neutron et la compréhension de la structure de l'atome ont coïncidé avec la crise économique mondiale, connue sous le nom de Grande Dépression, et l'émergence de plusieurs gouvernements autoritaires et expansionnistes en Europe et en Asie. La course aux principales puissances scientifiques dans le domaine de la compréhension et de l'obtention d'énergie et d'armes à partir du noyau d'un atome a rapidement commencé. Des réacteurs produisant de l'énergie nucléaire ont été obtenus en seulement dix ans, et dans treize - des armes nucléaires. Et aujourd'hui, nous devons vivre avec les conséquences de cela.
Comment savons-nous que le noyau d'un atome est petit?
C'est une chose de se convaincre qu'un certain noyau d'un certain isotope contient Z protons et N neutrons; l'autre est de vous convaincre que les noyaux atomiques sont minuscules et que les protons avec des neutrons, étant serrés ensemble, ne se salissent pas en bouillie et ne se décomposent pas, mais conservent leur structure, comme nous le montre l'image de la caricature. Comment cela peut-il être confirmé?
J'ai déjà mentionné que les atomes sont pratiquement vides. C'est facile à vérifier. Imaginez une feuille d'aluminium; rien n'est visible à travers elle. Puisqu'il est opaque, vous pouvez décider que les atomes d'aluminium:
1. Si grand qu'il n'y a pas d'écart entre eux,
2. Si dense et dur que la lumière ne les traverse pas.
Concernant le premier point, vous aurez raison; dans la matière solide, il n'y a presque pas d'espace libre entre deux atomes. Cela peut être observé sur des images d'atomes obtenues à l'aide de microscopes spéciaux; les atomes sont comme de petites sphères (dont les bords sont les bords des nuages électroniques), et ils sont assez denses. Mais avec le deuxième point, vous vous trompez.
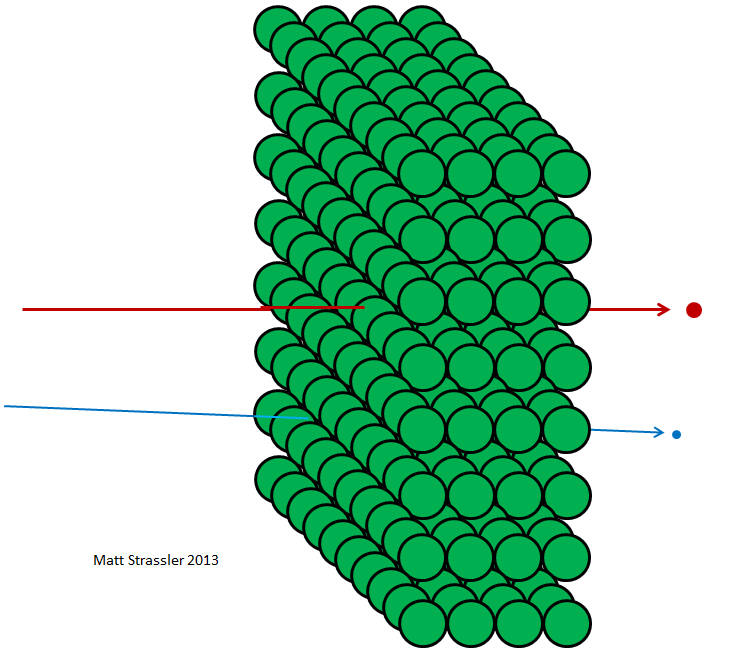 Fig. 4
Fig. 4Si les atomes étaient impénétrables, alors rien ne pourrait traverser la feuille d'aluminium - ni photons de lumière visible, ni photons de rayons X, ni électrons, ni protons, ni noyaux atomiques. Tout ce que vous pointeriez vers le film serait coincé ou rebondir - tout comme n'importe quel objet lancé devrait rebondir ou rester coincé dans une cloison sèche (Fig.3). Mais en fait, les électrons à haute énergie peuvent facilement passer à travers un morceau de papier d'aluminium, comme les photons à rayons X, les protons à haute énergie, les neutrons à haute énergie, les noyaux à haute énergie, etc. Les électrons et autres particules - presque tout, pour être plus précis - peuvent traverser un matériau sans perdre ni énergie ni élan lors de collisions avec tout ce qui est contenu à l'intérieur des atomes. Seule une petite partie d'entre eux atteindra le noyau atomique ou l'électron, auquel cas ils pourront perdre la majeure partie de leur énergie de mouvement initiale. Mais la plupart des électrons, des protons, des neutrons, des rayons X et tout ce genre de choses traversent calmement (Fig.4). Ce n'est pas comme lancer des cailloux contre un mur; cela revient à jeter des cailloux dans une clôture grillagée (Fig. 5).
 Fig. 5
Fig. 5Plus le papier est épais - par exemple, si vous empilez de plus en plus de feuilles de papier ensemble - plus les particules qui y sont projetées entrent en collision avec quelque chose, perdent de l'énergie, rebondissent, changent de direction ou même s'arrêtent. Il en irait de même si vous superposez du treillis métallique (Fig. 6). Et, comme vous le comprenez, à partir de la distance à laquelle le caillou moyen peut pénétrer à travers les couches de la grille et de la taille des lacunes de la grille, les scientifiques peuvent calculer en fonction de la distance parcourue par les électrons ou les noyaux atomiques à quel point l'atome est vide.
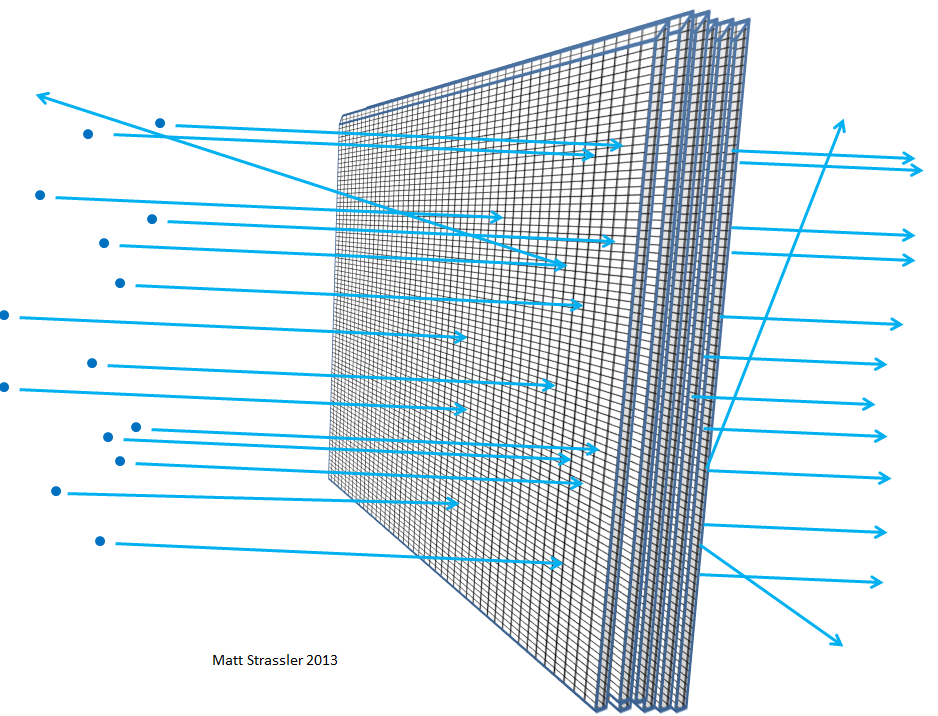 Fig. 6
Fig. 6Grâce à de telles expériences, les physiciens du début du XXe siècle ont découvert que rien à l'intérieur de l'atome - ni le noyau atomique ni les électrons - ne peut être supérieur à un millième de millionième de millionième de millionième de mètre, soit 100 000 fois plus petit que l'atome lui-même. Le fait que le noyau atteigne une telle taille et que les électrons soient au moins 1000 fois plus petits, nous établissons dans d'autres expériences - par exemple, dans la diffusion d'électrons de haute énergie les uns des autres, ou de positrons.
Pour être encore plus précis, il convient de mentionner que certaines particules perdent une partie de leur énergie lors du processus d'ionisation, dans lequel les forces électriques agissant entre la particule volante et l'électron peuvent tirer l'électron hors de l'atome. C'est un effet à longue portée et ce n'est pas vraiment une collision. La perte d'énergie totale est importante pour les électrons volants, mais pas pour un noyau volant.
Vous pourriez penser à la façon dont les particules traversent le papier d'aluminium, à la façon dont la balle traverse le papier - en poussant les morceaux de papier sur le côté. Peut-être que les premières particules séparent simplement les atomes, laissant de grandes ouvertures par lesquelles passent les suivantes? Nous savons que ce n'est pas le cas, car nous pouvons mener une expérience dans laquelle des particules entrent et sortent d'un récipient en métal ou en verre, à l'intérieur duquel il y a un vide. Si une particule traversant les parois d'un conteneur créait des trous plus grands que les atomes, les molécules d'air se précipiteraient et le vide disparaîtrait. Mais dans de telles expériences, le vide demeure!
Il est également assez facile de déterminer que le noyau n'est pas un tas particulièrement structuré, à l'intérieur duquel les nucléons conservent leur structure. Cela peut déjà être deviné du fait que la masse du noyau est très proche de la somme des masses des protons et neutrons qu'il contient. Cela est vrai pour les atomes et les molécules - leurs masses sont presque égales à la somme des masses de leur contenu, à l'exception d'une petite correction pour l'énergie de liaison - et cela se reflète dans le fait que les molécules sont assez faciles à décomposer en atomes (par exemple, en les chauffant pour qu'elles sont entrés en collision les uns avec les autres) et ont chassé les électrons des atomes (encore une fois, par chauffage). De même, il est relativement facile de diviser les noyaux en parties, et ce processus sera appelé fission, ou assemblera le noyau à partir de noyaux et de nucléons plus petits, et ce processus sera appelé synthèse. Par exemple, des protons relativement lents ou de petits noyaux entrant en collision avec un noyau plus gros peuvent le briser en morceaux; les particules en collision n'ont pas besoin de se déplacer à la vitesse de la lumière.
 Fig. 7
Fig. 7Mais pour comprendre que ce n'est pas inévitable, je mentionnerai que les protons et les neutrons eux-mêmes ne possèdent pas ces propriétés. La masse du proton n'est pas égale à la somme approximative des masses des objets qu'il contient; le proton ne peut pas être divisé en parties; et pour que le proton démontre quelque chose d'intéressant, des énergies comparables à l'énergie de masse du proton lui-même sont nécessaires. Les molécules, les atomes et les noyaux sont relativement simples; les protons et les neutrons sont extrêmement complexes.