Expression génique et thérapie génique
Le concept de thérapie génique existe depuis vingt à trente ans. Elle consiste dans le fait que la manière la plus radicale de lutter contre les maladies est de détruire la cause génétique même de la maladie, et non ses conséquences.
La raison peut être une violation d'un certain gène (mutation), qui a été transmis par les parents lors de maladies héréditaires, ou une mutation d'un gène déjà présent dans l'organisme adulte, provoquant, par exemple, un cancer. De plus, la cause peut être simplement une activité trop élevée (ou, inversement, faible) du gène normal, ce qui augmente le risque d'une maladie chronique, comme le diabète ou l'athérosclérose.
La façon de faire face à ces changements consiste à introduire de nouvelles informations génétiques dans la cellule pour corriger celle à laquelle la maladie est associée.
Tout d'abord, un peu plus profondément dans la théorie. La molécule d'ADN - l'acide désoxyribonucléique - est le porteur du code qui contrôle le développement et le fonctionnement de tous les êtres vivants. L'ADN contient un programme qui permet la transformation d'une seule cellule source en un organisme fonctionnant harmonieusement, composé de nombreuses cellules combinées en une variété de tissus et d'organes.
Déchiffrer la structure de l'ADN en 1953 a été l'un des tournants de l'histoire de la biologie. Pour cette découverte, les scientifiques
James Watson, Francis Crick et Maurice Wilkins ont reçu le prix Nobel de physiologie ou médecine en 1962.
L'ADN est une énorme molécule composée de milliers de petites molécules - des nucléotides, quatre types différents: la guanine (G), la cytosine (C), la thymine (T) et l'adénine (A). Les nucléotides se lient les uns aux autres, formant une chaîne; La molécule d'ADN se compose de 2 de ces chaînes torsadées en une double hélice.

Lors de la connexion de 2 chaînes, les règles suivantes sont remplies: l'adénine se connecte toujours à la thymine et la guanine - à la cytosine. Ainsi, à l'opposé de la thymine d'un brin, il y aura toujours de l'adénine d'un autre.
Cet arrangement nous a permis d'expliquer les mécanismes de la copie d'ADN pendant la division cellulaire. Les deux brins d'une spirale divergent, puis une copie exacte de son ancien «partenaire» en spirale est ajoutée à chacun d'eux. Sur le même principe qu'avec le négatif de la photo, ils s'impriment positivement.
La prochaine révolution dans l'étude de l'ADN s'est produite 50 ans plus tard, en 2003, lorsque l'énorme projet "Génome humain" a été achevé. Cela nous a permis de déchiffrer les 19 000 gènes de notre corps et a ouvert des opportunités sans précédent pour la médecine.
Un gène est une partie d'une molécule d'ADN dans laquelle un polypeptide (partie d'une molécule de protéine) ou un ARN fonctionnel est codé. Il fait généralement plusieurs centaines de nucléotides, mais il existe des exceptions. Les plus petits gènes du génome humain - les gènes d'ARN de transport - ne représentent que 76 paires de nucléotides, et le plus grand gène - le gène de la protéine dystrophine - 2,4 millions.
Dans les organismes les plus développés, y compris les humains, les gènes sont souvent séparés par des fragments d'ADN "insensé", non codant. L'ADN humain est enroulé autour d'un squelette moléculaire de protéines, avec lequel il forme un chromosome. Tout l'ADN humain est situé sur 46 chromosomes.
Si nous comparons la cellule avec la plante, alors l'ADN sera un peu d'information du disque dur stocké dans le bureau de la plante. Pour que la plante commence à fonctionner, cette information doit être transmise à tous les appareils dans les magasins de la plante - les acides ribonucléiques - l'ARN - jouent ce rôle dans la cellule. Et enfin, les produits qui commencent à être collectés dans les magasins de l'usine dans le cadre de ce programme sont des protéines cellulaires.
Le processus de lecture des informations de l'ADN est appelé «expression génique».
Si l'ADN est une information codée sur tous les processus du corps, alors les protéines sont les principaux exécuteurs et contrôleurs de ces processus. Il existe un grand nombre de classes de protéines différentes impliquées dans tous les processus importants pour l'organisme.
Il existe des protéines qui raccourcissent le cours des réactions chimiques dans le corps; remplir une fonction de construction - comme une sorte de renforcement, ils donnent forme aux cellules et à leurs pièces; protéger le corps en neutralisant les toxines, les bactéries pathogènes et les virus; réguler la lecture des informations de l'ADN et la synthèse des protéines correspondantes.
Il existe également des protéines qui transmettent des signaux entre les cellules, les tissus et les organes, transportent diverses molécules à travers les cellules et différents systèmes; l'énergie est stockée dans les protéines; les protéines sont des récepteurs - déclenchent une cascade d'événements cellulaires en réponse à certains signaux de l'environnement externe ou des systèmes internes du corps; ils peuvent effectuer une fonction motrice - fournir des mouvements corporels, par exemple, une contraction musculaire.

La thérapie génique est une intervention dans le travail d'une «plante» cellulaire pour la production de protéines. Il vous permet à la fois d'activer le travail des gènes nécessaires et de "désactiver" les gènes nuisibles. Dans le premier cas, un gène est délivré à la cellule, à partir duquel la protéine nécessaire au traitement de la maladie commence à être lue. Et dans le second, des ARN régulateurs sont introduits dans la cellule qui bloquent l'expression du gène «nocif».
Le plus souvent, le blocage des gènes est obtenu en raison du fait que de petits ARN interférents (siARN) sont délivrés à la cellule, qui se lient à l'ARN du gène qui doit être désactivé. La liaison de l'ARNsi et de l'ARN bloque la synthèse des protéines et conduit finalement à la dégradation de l'ARN.
Ce processus est appelé interférence ARN. Il a été découvert en 1998 par les scientifiques américains
Andrew Fire et Craig Mello et a été reconnu si important que déjà en 2006 le prix Nobel de physiologie et médecine a été décerné pour sa découverte.
Thérapie génique: succès et tendances
La thérapie génique est née il y a plus de 25 ans. La première étude clinique réussie (chez l'homme) a été menée en 1989 sur la thérapie génique de l'immunodéficience combinée sévère. Actuellement, la thérapie génique est en plein essor.
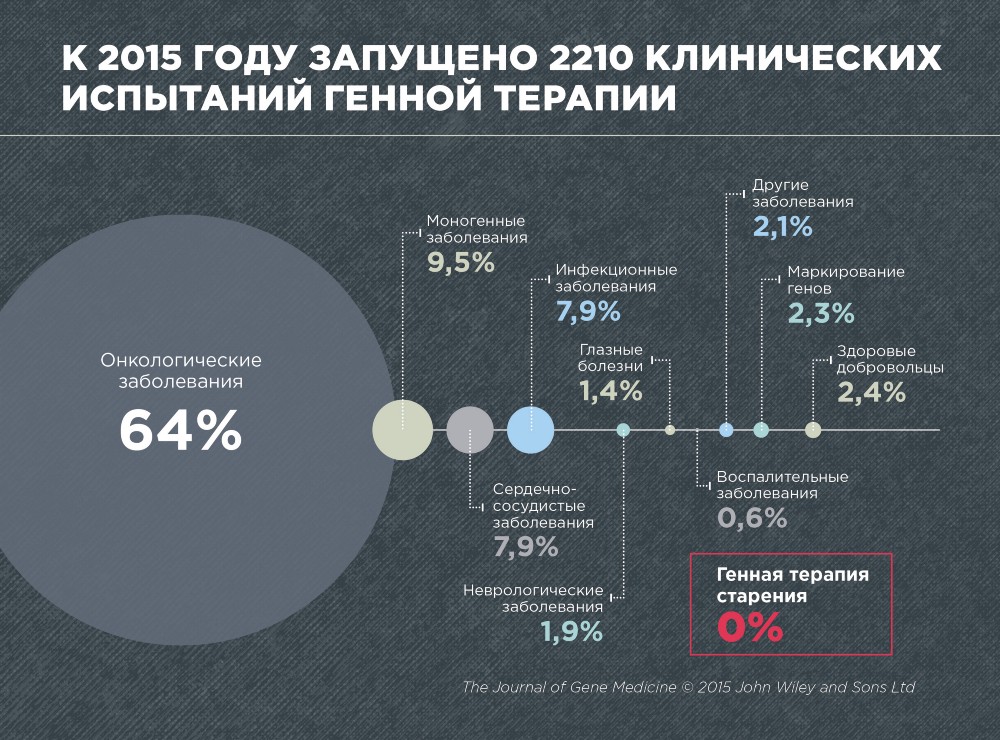
Selon la revue Gene Medicine, en 2015, 2 210 essais cliniques ont été menés sur la thérapie génique de diverses maladies. Il s'agit principalement du cancer (64%), des maladies monogéniques provoquées par des mutations dans un gène (9,5%), cardiovasculaires (7,9%) et infectieuses (7,9%).
Aucun essai clinique n'a été mené sur la thérapie génique du vieillissement, ce qui n'est pas surprenant, car le vieillissement n'est toujours pas reconnu comme une maladie. De plus, la thérapie génique du vieillissement est encore un domaine très jeune et en développement.
Pour un certain nombre de maladies, la thérapie génique a connu un certain succès. Parmi eux, les maladies héréditaires du système immunitaire - immunodéficience combinée sévère, syndrome de Wiskott-Aldrich et maladie granulomateuse chronique; une maladie héréditaire associée à des troubles métaboliques - adrénoleucodystrophie; maladie héréditaire de la rétine - amaurose de Leber et certaines formes de cancer.
À ce jour, 4 médicaments de thérapie génique ont été approuvés pour la vente. En 2003, Gendicine, un médicament pour le traitement du carcinome épidermoïde de la tête et du cou basé sur le gène p53, a été lancé, et en 2006, Oncorine, le virus oncolytique pour le traitement du carcinome nasopharyngé. En Europe, en 2012, la production du médicament «Glybera» a été lancée, destinée au traitement du déficit héréditaire en lipoprotéine lipase (LPL) en délivrant le même gène. Et en Russie, le médicament "Neovasculgen" est approuvé pour la vente pour le traitement des maladies des artères périphériques. Il s'agit d'un gène VEGF (facteur de croissance endothélial vasculaire).
Le principal problème de la thérapie génique est de savoir comment délivrer un gène thérapeutique (ou ARN) aux cellules cibles. En règle générale, les vecteurs de livraison - porteurs de constructions génétiques - sont utilisés à cette fin. Ils ne permettent pas à l'ADN de se décomposer dans le sang, assurent la sortie de l'ADN des capillaires (petits vaisseaux sanguins) dans les tissus et la pénétration dans les cellules et dans le noyau cellulaire.
Le plus souvent, les virus sont utilisés comme vecteurs, car ils ont des mécanismes très efficaces pour la pénétration des cellules animales par une évolution parfaite. En infectant une cellule dans la nature, le virus délivre son matériel génétique au noyau de cette cellule et commence à se reproduire et à produire ses propres protéines en utilisant les mécanismes d'expression génique de la cellule hôte.
Les scientifiques ont simplifié les virus en supprimant les gènes impliqués dans la pathogenèse et en provoquant la réponse immunitaire du corps, et les ont transformés en vecteurs pour la livraison de matériel génétique.

Les virus les plus utilisés en thérapie génique sont les adénovirus (ils sont utilisés dans 22,2% des essais cliniques), ainsi que les rétrovirus (ils représentent 18,4% des travaux). Seuls les nouveaux vecteurs gagnent en popularité - les virus adéno-associés (6% des essais cliniques) et les lentivirus (5% des études).
Les plus prometteurs pour la thérapie génique sont les vecteurs adéno-associés (AAV) et lentiviraux. Le premier permettra de délivrer la construction génétique dans le corps de manière systémique (c'est-à-dire dans un certain nombre de tissus et d'organes) sans effets secondaires. Certes, ils n'incorporent pas de matériel génétique dans le génome, de sorte que le gène délivré peut être perdu au fil du temps.
S'il est nécessaire d'assurer une efficacité de livraison élevée et une intégration de la construction délivrée dans le génome, des vecteurs lentiviraux doivent être utilisés. Cependant, ils ne conviennent pas à une administration systémique et sont utilisés pour une injection locale dans une petite zone de tissu ou dans des cellules in vitro. De plus, ils peuvent provoquer des effets secondaires en raison de leur incorporation dans des parties indésirables du génome (par exemple, dans les proto-oncogènes et provoquer le cancer).

L'utilisation de la technologie d'édition du génome CRISPR / Cas9 ouvre de nouvelles possibilités en thérapie génique. CRISPR / Cas9 vous permet de modifier très précisément et en toute sécurité l'ADN des cellules. Et si vous combinez la technologie CRISPR / Cas9 avec la livraison à l'aide de virus adéno-associés, cela, apparemment, vous permettra d'affecter systématiquement le corps et de changer complètement en toute sécurité le génome d'un très grand nombre de cellules. Autrement dit, son utilisation vous permet de combiner les avantages des vecteurs adéno-associés et lentiviraux.
Dans la nature, ce système se trouve dans les bactéries et les archées. Il est utilisé pour protéger contre les bactériophages (virus bactériens) ou d'autres éléments génétiques étrangers. En cas d'infection cellulaire, le système CRISPR / Cas reconnaît les séquences d'ADN étranger et les coupe. Le système CRISPR / Cas a été découvert pour la première fois en 1987, mais ses fonctions n'ont été activement étudiées que depuis 2005.
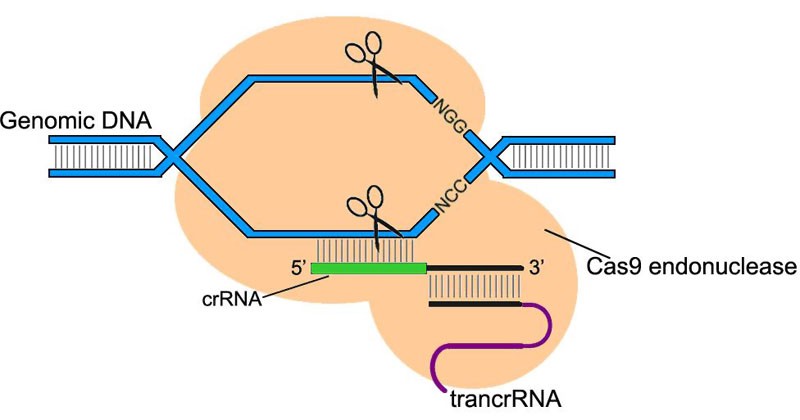
Puisque CRISPR / Cas reconnaît et coupe très précisément l'ADN, les scientifiques ont décidé de l'adapter pour éditer le génome des mammifères. L'utilisation de CRISPR / Cas a dépassé toutes les attentes. Avec un nombre minimal d'erreurs, cela a permis à la fois de «désactiver» les gènes requis et d'incorporer de nouveaux gènes dans des parties strictement définies du génome.
Le système CRISPR / Cas9 se compose de l'endonucléase Cas9, une enzyme qui coupe l'ADN et dirige l'ARN qui se lie uniquement à une séquence génomique strictement définie. Un tel système permet de trouver et de couper des coupes de génome au bon endroit, en les orientant vers le guide d'ARN.
Le guide de l'ARN est sélectionné par les chercheurs eux-mêmes, afin que le système CRISPR / Cas9 puisse être ciblé sur n'importe quelle partie souhaitée du génome.
Et plus récemment, en décembre 2015, le groupe scientifique Feng Jang a modifié ce système afin qu'il devienne complètement exempt d'erreurs, qui a été publié dans la principale revue scientifique Science. Les scientifiques ont remplacé 3 acides aminés (la «brique» qui composent la protéine) dans l'endonucléase Cas9, après quoi le nombre d'erreurs dans un tel système a été réduit à presque zéro.
L'utilisation de CRISP / Cas9 est particulièrement pertinente pour la thérapie génique du vieillissement, où il est nécessaire d'influencer les voies de longévité communes à la plupart des cellules du corps.
Types de vecteurs de livraison et leurs propriétésLes adénovirus (AV) et les virus adéno-associés (AAV) peuvent être utilisés à la fois pour la livraison étroitement ciblée de matériel génétique à certains tissus, et pour la livraison systémique au corps (c'est-à-dire à un grand nombre d'organes et de tissus). Ils fournissent le matériel génétique de manière très efficace, pénétrant dans les noyaux des cellules en division et non en division.
Une caractéristique importante de ces virus est qu'ils n'intègrent pas les gènes livrés dans le génome. Certes, dans le cas des vecteurs adéno-associés, il a néanmoins été montré que <1% des cas s'intègrent (s'intègrent) dans une région spécifique du génome hôte.
L'absence d'intégration aléatoire de gènes dans le génome est un gros plus en termes de sécurité de ces vecteurs. Dans ce cas, il n'y a aucun risque que le gène s'intègre accidentellement dans la séquence du proto-oncogène et provoque le cancer. En revanche, si un gène n'est pas intégré dans le génome, il peut être perdu au fil du temps, par exemple lors de la division cellulaire. Par conséquent, l'effet thérapeutique dans le cas de l'utilisation de tels vecteurs peut être temporaire.
Bien que les adénovirus soient utilisés beaucoup plus souvent en thérapie génique, les virus adéno-associés sont beaucoup plus prometteurs en raison de leur plus grande sécurité. Le fait est que lorsqu'ils sont introduits dans le corps, les adénovirus peuvent provoquer une forte réponse immunitaire et une réaction inflammatoire.
Aux premiers stades du développement de la thérapie génique, l'utilisation de vecteurs adénoviraux a même entraîné la mort du patient. Jesse Jelsinger souffrait d'une carence en ornithine transcarbamylase, une maladie génétique du foie. À l'âge de 18 ans, il a participé à un essai clinique de thérapie génique et est décédé des suites d'une réponse inflammatoire systémique en réponse à l'introduction de la construction virale.
Au contraire, l'introduction de virus adéno-associés dans le corps ne conduit qu'à une réponse immunitaire insignifiante, car dans la nature ces virus ne provoquent pas de maladies mammifères et sont à peine reconnus par le système immunitaire humain.
D'autres vecteurs viraux - rétrovirus et lentivirus - incorporent du matériel génétique dans le génome et fournissent un effet thérapeutique stable. Cependant, une intégration accidentelle dans le génome peut conduire à l'activation de mécanismes cancéreux, ce qui s'est déjà produit à plusieurs reprises dans l'histoire de la thérapie génique.
Les rétrovirus et les lentivirus sont utilisés presque exclusivement pour une distribution étroitement ciblée sur certains tissus et leurs sites, ou sur des cellules in vitro, car contrairement aux AV et aux AAV, ils transfèrent le matériel à des «distances» beaucoup plus courtes. L'inconvénient des rétrovirus est qu'ils ne peuvent pénétrer que dans les cellules en division. Par conséquent, les lentivirus sont beaucoup plus prometteurs, car ils infectent également les cellules non en division.
De plus, des méthodes non virales pour la livraison d'ADN et d'ARN, telles que les liposomes, sont souvent utilisées en thérapie génique. Ils sont bien inférieurs aux vecteurs viraux en termes d'efficacité, mais sont plus sûrs et moins chers.
 Analyse comparative de vecteurs pour la livraison de matériel génétique dans la cellule
Analyse comparative de vecteurs pour la livraison de matériel génétique dans la cellule Statut et perspectives de la thérapie génique du vieillissement
À l'heure actuelle, la thérapie génique du vieillissement se développe rapidement, mais elle est encore à un stade de développement préclinique (c'est-à-dire que des expériences humaines n'ont pas encore été menées). Parmi les 2210 essais cliniques de thérapie génique lancés à ce jour, il n'y en a aucun pour traiter le vieillissement. Cela est dû en partie à des problèmes juridiques: le vieillissement n'est toujours pas considéré comme une maladie. Mais ce domaine de recherche lui-même est apparu très récemment. Les premiers travaux sur la thérapie génique du vieillissement chez la souris ont été réalisés il y a moins de 5 ans.
Maintenant, toutes les études sur la thérapie génique du vieillissement sont menées sur des souris modèles, des rats, des singes et des cultures de cellules humaines - des cellules in vitro.
Toutes les approches de la thérapie génique du vieillissement sont divisées en celles où le gène de longévité est délivré au corps et celles où de petits ARN sont introduits pour «désactiver» le gène ou la voie du vieillissement. Autrement dit, dans le premier cas, quelque chose d'utile pour la longévité est introduit, et dans le second, le nocif est désactivé.
Au sens strict de la recherche sur la thérapie génique du vieillissement chez les mammifères, seules deux ont été menées. Dans ces travaux, les souris ont été injectées avec le gène thérapeutique et ont observé comment il affectait le vieillissement et la longévité. Le premier travail a été réalisé par un groupe de Maria Blasco en 2012, dans lequel ils ont réussi à prolonger la vie des souris de 20%. Et la seconde est la thérapie de l'hypothalamus avec le génome inhibiteur de NF-kB, que Dongsheng Kai et ses collègues ont menée en 2013. Dans ce document, la vie des souris a augmenté de 10%. Les deux travaux sont très encourageants: la thérapie a été très efficace et sans aucun effet secondaire.

Beaucoup plus de travaux modélisent la thérapie génique sur des souris transgéniques. Dans de telles études, le gène thérapeutique n'est pas délivré dans le corps d'une souris adulte et les souris sont créées en utilisant le génie génétique, dont le génome est modifié depuis la naissance. Comme la thérapie génique, cela vous permet d'explorer comment une augmentation ou une diminution de l'activité de différents gènes affecte l'espérance de vie et le vieillissement du corps.
Il y a tellement d'études où la thérapie génique du vieillissement est modélisée sur des lignées cellulaires. Ces travaux cherchent généralement à voir si la délivrance d'un gène thérapeutique ralentira ou non le vieillissement cellulaire in vitro. Mais cette approche donne des résultats mitigés, car la thérapie, qui prolonge la vie des cellules, ne prolonge pas toujours la vie du corps et vice versa. Par exemple, une activité accrue du gène de longévité et de la réponse au stress FOXO prolonge la vie du modèle drosophile. Et dans les expériences sur les cellules souches de la peau, le vieillissement cellulaire s'est ralenti lorsque le gène FOXO3, au contraire, a été «désactivé».
Actuellement, des approches de thérapie génique sont en cours d'élaboration en ce qui concerne tous les mécanismes de base de la longévité connus aujourd'hui: augmenter la stabilité du génome, rajeunir l'hypothalamus, détruire les cellules sénescentes, augmenter la résistance au stress, améliorer le fonctionnement des mitochondries et maintenir des cellules souches de niche.Cependant, beaucoup plus de recherches sont en cours sur la thérapie génique de certaines pathologies liées à l'âge, par exemple la fonte musculaire liée à l'âge et les troubles cognitifs. En soi, ce ne sont pas des maladies, mais elles détériorent la qualité de vie et peuvent entraîner un risque accru de nombreuses maladies liées à l'âge.Au total, environ 46 études ont été menées sur la thérapie génique des pathologies dépendantes de l'âge chez des rats, des souris et même des singes modèles. Ce sont des travaux sur la thérapie génique au «sens classique»: des animaux modèles (le plus souvent des vieux) ont reçu une injection d'un gène dans le cadre d'un vecteur de livraison. Et après le traitement, ils ont analysé comment cela affectait la survenue d'une pathologie liée à l'âge. Malheureusement, la grande majorité de ces travaux n'a pas examiné les effets secondaires.La plupart des études ont été consacrées aux pathologies du système nerveux central - une dizaine d'ouvrages. Il y a eu 6 études sur les troubles du cœur et des vaisseaux sanguins, 7 sur le système reproducteur, 6 sur la pathologie du cartilage, 4 sur l'obésité, 7 sur le tissu osseux, 3 sur la vision, 3 sur le système immunitaire et 3 sur le système immunitaire.En conclusion, je tiens à noter que, malgré le fait que relativement peu d'expériences ont été réalisées sur la thérapie génique du vieillissement avec un effet maximum de prolongation de la vie - 20%, elle a déjà un énorme avantage par rapport à d'autres approches pour prolonger la vie (par exemple, les géroprotecteurs ou la limitation nutrition, prolongeant la vie jusqu'à 30-50%). Il suffit de réaliser une thérapie génique une seule fois dans sa vie!Par exemple, dans un article de 2001 d'Andrzej Bartke, la restriction alimentaire a prolongé la vie des souris de 30%. Cependant, les souris ont consommé un régime hypocalorique jusqu'à 670 jours consécutifs, c'est-à-dire chaque jour pendant la moitié de leur vie! Et dans l'expérience Maria Blasco de 2012 sur la thérapie génique, la thérapie génique de la télomérase a conduit à un effet légèrement moindre - les souris ont commencé à vivre plus longtemps de 20%. Cependant, dans ce travail, les souris n'ont reçu qu'une seule injection du médicament dans le sang au cours d'une vie! Ici, vous devez déterminer où se situe l'ingénierie, où est la thérapie.Par conséquent, si nous parlons de diffuser des études sur la prolongation de la vie par personne, la thérapie génique présente un avantage absolu, car elle ne réduit pas la qualité de vie en raison de la nécessité d'un traitement constant - suivez un régime quotidien ou utilisez constamment des géroprotecteurs ou d'autres médicaments.
Ici, vous devez déterminer où se situe l'ingénierie, où est la thérapie.Par conséquent, si nous parlons de diffuser des études sur la prolongation de la vie par personne, la thérapie génique présente un avantage absolu, car elle ne réduit pas la qualité de vie en raison de la nécessité d'un traitement constant - suivez un régime quotidien ou utilisez constamment des géroprotecteurs ou d'autres médicaments.Thérapie génique de la télomérase
La découverte de la télomérase est une révolution dans l'étude du vieillissement
L'idée est d'utiliser la télomérase pour prolonger la vie de plus de 30 ans. La découverte de la télomérase en 1985 a fait sensation chez les chercheurs sur le vieillissement et a été si bien notée que Elizabeth Blackburn, Carol Grader et Jack Shostak ont reçu le prix Nobel en 2004 pour cela.L'histoire de la recherche sur la télomérase remonte à 1961. Le chercheur américain Leonard Hayflick a cultivé des fibroblastes d'embryons humains in vitro et a remarqué qu'ils ne peuvent pas partager plus de 50 fois, après quoi ils vieillissent. Et si nous prenons les cellules de donneurs plus âgés, ils se divisent encore moins. Le scientifique a suggéré qu'il existe un certain compteur de division dans les cellules, ce qui limite leur nombre total.Après 10 ans, le scientifique russe Alexei Olovnikov a proposé un mécanisme hypothétique pour le fonctionnement de ce compteur. Olovnikov a suggéré que pendant la division cellulaire, les extrémités des chromosomes, appelés télomères, se contractent légèrement. Et lorsque les télomères atteignent une longueur critique, la cellule cesse de se diviser et vieillit. Dans les cellules sans âge (par exemple, tige reproductrice et embryonnaire), au contraire, il doit y avoir une enzyme qui allonge les télomères, permettant aux cellules de se diviser presque à l'infini.Cette hypothèse a été pleinement confirmée avec la découverte de l'enzyme télomérase en 1985. Les données ont commencé à s'accumuler sur le rôle des télomères et de la télomérase non seulement dans le vieillissement des cellules, mais aussi dans le vieillissement de l'organisme entier. De plus, il a été démontré que les dommages au gène de la télomérase réduisent considérablement la durée de vie des animaux modèles et entraînent l'apparition d'un syndrome de vieillissement prématuré - progeria.Après la découverte de la télomérase, des dizaines de scientifiques ont tiré pour faire un remède à la vieillesse sur sa base. Il semblerait que «l'inclusion» de la télomérase dans toutes les cellules puisse rendre le corps immortel.Cependant, des craintes sont rapidement apparues du fait que la synthèse active de la télomérase est également observée dans 90% des tumeurs cancéreuses. La question s'est posée: l'activation de la télomérase entraînerait-elle un risque de transformation maligne? De plus, il s'est avéré que le vieillissement cellulaire est loin d'être toujours accompagné d'une contraction des télomères. Par exemple, dans le cas des cellules épithéliales de la muqueuse buccale ou de la cornée de l'œil humain. Cela suggère que l'activation de la télomérase seule peut ne pas être suffisante pour rajeunir le corps entier.Malgré les doutes causés par l'utilisation thérapeutique de la télomérase, des expériences ont commencé sur des lignées cellulaires et des animaux modèles. Des dizaines d'études ont été menées et les résultats ont dépassé toutes les attentes.Thérapie génique de la télomérase de la lignée cellulaire
Dans un certain nombre d'études, l'activité de la télomérase a été activée in vitro dans les cellules humaines. De tels travaux, d'une part, vous permettent d'en savoir plus sur les propriétés de la télomérase et, d'autre part, constituent la première étape du développement d'un médicament qui prolonge la vie.Pour cela, le gène de la sous-unité catalytique de la télomérase (TERT) est inséré dans l'ADN des cellules. C'est elle qui effectue l'extension des télomères dans la cellule.La première étude réussie de livraison de gène TERT a été menée en 1998 par Andreai Bodnar et ses collègues. Il s'est avéré que lors de l'activation de la télomérase, les fibroblastes humains, qui ne se divisent normalement pas plus de 75 à 80 fois, peuvent en partager 280. Cependant, ils ne montrent aucun signe de vieillissement, de pathologie ou de malignité (dégénérescence cancéreuse). Même si ces cellules sont transplantées chez des souris athymiques - complètement immunisées et plus sensibles au cancer - elles n'ont toujours pas de tumeurs.Au cours des années suivantes, des dizaines d'études ont été menées dans lesquelles le gène de la télomérase a été introduit dans une grande variété de types de cellules humaines. La livraison du gène TERT aux cellules en division a augmenté leur potentiel de prolifération, et la livraison aux vieilles cellules a conduit au "rajeunissement" et à la reprise de la division.Des expériences réussies ont été menées sur les cellules souches mésenchymateuses, les cellules souches osseuses (ostéoblastes), les myosatellites (précurseurs du tissu musculaire), les chondrocytes articulaires (précurseurs du tissu cartilagineux), ainsi que sur les cellules des disques intervertébraux, les lymphocytes T, les hépatocytes (cellules hépatiques), les cellules bulbes olfactifs, etc.Il est important de noter que dans la grande majorité des cas, l'apport du gène de la télomérase était absolument sûr. Les cellules ont conservé leurs fonctions et il n'y avait aucun signe de formation de tumeur. Cependant, dans certaines études, l'introduction du gène TERT a entraîné une augmentation de la fréquence des réarrangements chromosomiques (ruptures chromosomiques, adhésion et déplacement de coupes d'un chromosome à un autre). Ceci, bien sûr, est un facteur de risque de cancer, mais il peut ne pas avoir de conséquences négatives.En général, la recherche indique que l'activité de la télomérase dans la culture de cellules humaines ralentit considérablement le vieillissement et ne provoque pas nécessairement le cancer. C'est-à-dire que la télomérase est privée des propriétés oncogènes qui lui ont été attribuées. Apparemment, la propriété principale de la télomérase est la régulation de la division cellulaire, et des mutations et des facteurs supplémentaires sont nécessaires pour l'apparition de la croissance tumorale.Thérapie génique de la télomérase: des expériences sur souris à l'homme
Les premières expériences sur la thérapie génique du vieillissement ont été réalisées en 2012 par la chercheuse espagnole Maria Blasco en utilisant le gène de la télomérase (TERT). Les premiers résultats obtenus ont été très, très impressionnants. La thérapie génique non seulement chez l'adulte mais aussi chez la vieille souris prolonge la vie jusqu'à 20%! Si nous imaginons que de tels résultats peuvent être atteints chez l'homme, nous sauverons 14 ans de vie humaine!
Avant de passer à la thérapie génique, les effets de la télomérase ont été étudiés sur des souris transgéniques. Il s'est avéré que si vous activez le gène TERT dans toutes les cellules de souris, l'espérance de vie augmente de 40%! Cependant, l'activité constante de la télomérase a également augmenté le risque de cancer.
Par conséquent, la question était de savoir comment activer la télomérase pendant une durée plus courte.
C'est exactement ce qui a été fait dans le travail de Maria Blasco 2012. Le gène de la télomérase a été délivré à la souris à l'aide d'un virus adéno-associé (AAV9), capable de délivrer une administration systémique. Les virus adéno-associés sont très sûrs: ils n'intègrent pas le gène délivré dans le génome hôte et ne conduisent donc pas à une mutagenèse. De plus, ils ne provoquent presque pas de réponse immunitaire.
Le gène de la télomérase a été transmis à un large éventail de tissus et d'organes, y compris le foie, les reins, les poumons, le cœur, le cerveau et les muscles. La télomérase a été détectée dans ces tissus même 8 mois après la procédure. Chez l'animal, un certain nombre de paramètres liés à l'âge se sont améliorés: sensibilité à l'insuline augmentée, coordination neuromusculaire améliorée, risque d'ostéoporose (déplétion osseuse) et contenu des marqueurs moléculaires du vieillissement diminué. De plus, la thérapie génique TERT était totalement sûre: le risque de cancer chez la souris n'a pas augmenté.
Et, plus important encore, la thérapie génique a considérablement prolongé la vie des souris. L'espérance de vie médiane (l'âge auquel plus de la moitié des individus du groupe survivent) a augmenté de 24% et 13% respectivement chez les souris adultes (1 an) et âgées (2 ans). L'espérance de vie maximale a également augmenté: de 13% chez l'adulte et de 20% chez la vieille souris.
Dans une étude ultérieure, Maria Blasco a montré que l'administration du gène TERT au cœur de souris après un infarctus du myocarde améliore considérablement la fonction cardiaque et réduit le risque d'insuffisance cardiaque et de mortalité de 17%.
Grâce à ces expériences, la thérapie génique à la télomérase a une brillante réputation. Et en septembre 2015, la première expérience au monde sur la thérapie génique du vieillissement chez l'homme a été menée. L'Américaine Elizabeth Perrish a introduit le gène de la télomérase en combinaison avec le gène inhibiteur de la myostatine (pour stimuler la croissance musculaire). Cette étude vient de commencer, il est donc trop tôt pour parler des résultats, mais jusqu'à présent, Elizabeth se sent bien. Elizabeth a fait la promesse de fournir du matériel d'analyse à tout institut de recherche médicale sur demande. Cependant, comme une seule personne a participé à cette expérience, ses résultats ne permettront pas de tirer des conclusions fiables et statistiquement significatives.
Cependant, le fait même que des essais humains aient commencé suggère qu'un médicament à base de TERT est en route. C'est sans aucun doute le candidat numéro un pour la lutte contre le vieillissement par la thérapie génique.
Thérapie génique pour rajeunir l'hypothalamus
L'une des façons de prolonger la vie est un effet étroitement ciblé sur les structures qui régulent le vieillissement de l'organisme entier. Des études récentes montrent qu'une telle structure fait partie du cerveau - l'hypothalamus.
En 2013, des scientifiques américains dirigés par Donsheng Kai ont considérablement prolongé la vie des souris en rajeunissant l'hypothalamus à l'aide de la thérapie génique. Les chercheurs ont supprimé l'inflammation qui se produit avec l'âge dans l'hypothalamus, à la suite de laquelle le nombre de pathologies liées à l'âge a diminué et l'espérance de vie a augmenté de 10%.

Le vieillissement est largement associé à une violation de l'homéostasie - l'autorégulation du corps, sa capacité à maintenir son état interne. À l'état «jeune», le corps réagit à l'effet perturbateur par un ensemble de mesures qui le ramènent avec succès à son état «sain» d'origine. Par exemple, avec une augmentation de la température corporelle, le corps commence une série de processus de thermorégulation (par exemple, la transpiration), à la suite de quoi la température diminue au niveau initial. Cependant, avec le vieillissement, la capacité de maintenir l'homéostasie est altérée, ce qui entraîne un «déséquilibre» du corps.
L'hypothalamus est l'un des principaux centres de l'organisme qui régule l'homéostasie. Malgré le fait qu'il ne représente pas plus de 5% du cerveau, c'est lui qui lie les mécanismes nerveux et hormonaux du maintien de l'homéostasie en un seul système.
Avec l'âge, le travail de l'hypothalamus se dégrade considérablement, en particulier, la production de l'hormone la plus importante, la gonadolibérine, diminue. La fonction «classique» de cette hormone est de réguler la fonction sexuelle. Mais pour le vieillissement, il joue un rôle secondaire voire tertiaire. Il est important que la gonadolibérine active également la neurogenèse - la formation de nouvelles cellules nerveuses dans l'hypothalamus, ainsi que dans plusieurs autres régions du cerveau.
Une des principales causes de détérioration de l'hypothalamus liée à l'âge est l'inflammation. Avec l'âge, les facteurs de transcription NF-kB et IKK-b, molécules régulatrices qui activent toute la cascade de gènes responsables de l'inflammation, sont activés dans l'hypothalamus.
Pour rajeunir et réduire l'inflammation dans l'hypothalamus, Dongsheng Kai et ses collègues ont utilisé un gène qui inhibe le travail de NF-kB - IkB-a. Le gène IkB-a a été introduit chez des souris adultes par injection dans l'hypothalamus. Afin que le gène pénètre dans le noyau cellulaire et s'intègre dans le génome, des vecteurs lentiviraux ont été utilisés.
La thérapie a eu un effet très fort sur le vieillissement. La durée de vie maximale des souris a augmenté de 10%! La santé des souris s'est également considérablement améliorée. Même 6 mois après l'injection, les souris avaient de meilleures performances mentales et les muscles fonctionnaient mieux. Une analyse de la structure des tissus a également montré que les muscles, la peau et les os des souris étaient dans un état plus «jeune».
Ainsi, l'hypothalamus est un centre important pour réguler le vieillissement systémique. Son rajeunissement conduit à une prolongation de la vie du corps, apparemment, à la fois en améliorant ses propres fonctions régulatrices de l'hypothalamus et sécrétant des hormones sexuelles, et en stimulant la neurogenèse et, par conséquent, en améliorant le fonctionnement d'autres parties du cerveau.
Thérapie génique pour augmenter la résistance au stress
Parmi les moyens de prolonger la vie, étudiés à ce jour, le plus puissant est d'augmenter la résistance au stress. C'est en raison des impacts sur ce chemin que tous les enregistrements d'extension de vie actuels ont été établis. Robert Schmuckler-Rice a réussi à prolonger la vie du nématode 10 fois, et Andrzej Bartka la vie de la souris - 1,8.
Tout au long de la vie, le corps est constamment confronté à une variété de facteurs néfastes: faim, soif, froid, substances toxiques, radiations nocives, stress psychologique. La résistance à ces facteurs est appelée résistance au stress.
Une tolérance accrue au stress peut survenir à tous les niveaux: des molécules à l'organisme tout entier. Cependant, des mécanismes principalement moléculaires ont été étudiés. Une résistance accrue au stress s'accompagne d'une augmentation de la stabilité des protéines; s'il y a déjà des violations dans la structure des molécules de protéines - alors elles sont corrigées, et la cellule se débarrasse des molécules complètement détruites - elle est démontée en briques et digérée.
L'augmentation de la tolérance au stress peut être obtenue de plusieurs manières.
La première façon, la plus connue, est de limiter la nutrition. Dans le même temps, l'opération complexe MTOR est «désactivée». Le MTOR est une sorte de «commutateur» moléculaire. Il met la cellule dans un état de croissance et de reproduction actives. Dans le même temps, les mécanismes de résistance au stress énergivores sont supprimés. Si MTOR est désactivé, la cellule passera au contraire en mode de protection contre le stress.
La deuxième façon, également bien étudiée, d'augmenter la tolérance au stress est de bloquer la signalisation de l'insuline et du facteur de croissance analogue à l'insuline 1 (IGF-1). On entend par signalisation (ou signalisation) une cascade de processus moléculaires qui se produisent dans la cellule en réponse à l'action des hormones. L'insuline et l'IGF-1 signalent à la cellule la présence d'un nutriment glucose dans le sang. En conséquence, les processus de croissance sont lancés dans la cellule, la voie MTOR est activée et les processus de résistance au stress sont supprimés.
Inhibition de la voie MTOR ou de l'insuline - lance toute une cascade de gènes de réponse au stress, qui se sont également avérés être des gènes de longévité: FOXO, NRF2, AMPK, HIF-1, SIRT1 et SIRT6, etc. Ainsi, la troisième façon d'augmenter la résistance au stress est l'activation artificielle gènes de réponse au stress.

Toutes ces approches sont activement étudiées pour la thérapie génique du vieillissement. Dans certains travaux, ils agissent séparément sur l'hypothalamus - la structure qui régule le vieillissement, dans d'autres - de façon systémique - sur la plupart des cellules du corps. Il existe très peu d'études authentiques sur la thérapie génique partout où un gène thérapeutique est introduit dans un animal adulte, ou plutôt un seul. Dans la plupart des études, la thérapie génique est modélisée sur des animaux transgéniques ou des lignées cellulaires (sur des cellules in vitro).
Activation du gène du neuropeptide Y dans l'hypothalamusLe premier et le seul travail sur la thérapie génique pour augmenter la résistance au stress a été effectué sur des souris il y a moins d'un an. Il a agi sur le régulateur du vieillissement systémique - l'hypothalamus.
 Luís Pereira de Almeida, Janete Cunha Santos et Cláudia Cavadas
Luís Pereira de Almeida, Janete Cunha Santos et Cláudia CavadasUn groupe de scientifiques portugais et allemands dirigé par Luís Pereira de Almeida et Cláudia Cavadas a mené une expérience en 2015, où ils ont activé le gène du neuropeptide Y (NPY) dans l'hypothalamus de rat.
Le neuropeptide Y est l'une des molécules de signalisation les plus importantes de l'hypothalamus. Ces dernières années, de nombreuses données sont apparues sur le rôle de cette substance dans le vieillissement. Par exemple, le travail du gène NPY est nécessaire pour que la restriction calorique prolonge la vie. Et chez les rats transgéniques qui ont produit davantage de ce neuropeptide, l'espérance de vie médiane (l'âge auquel vivait la moitié des individus du groupe) a même augmenté.
Il est étonnant qu'il y a quelques années, on ne connaissait pas un mot du rôle du NPY dans le vieillissement. Et le neuropeptide Y n'a été mentionné qu'en relation avec son rôle dans l'obésité et sa capacité à stimuler la faim. Il est surprenant de voir comment ces fonctions se combinent avec la capacité de prolonger la vie!
Les scientifiques ont transmis le gène NPY via le virus adéno-associé à l'hypothalamus. En conséquence, le mécanisme le plus important de résistance au stress dans les cellules de l'hypothalamus a été stimulé - l'autophagie (le processus d'auto-nettoyage des cellules des molécules et des structures cellulaires endommagées par leur digestion).
Aucun autre effet de la thérapie génique NPY sur la longévité n'a été étudié dans ce travail, mais les chercheurs vont le faire à l'avenir.
Cependant, on peut déjà supposer que la thérapie inventée par de Almeida et Cavadas ralentira le vieillissement en rajeunissant l'hypothalamus (un régulateur du vieillissement systémique). D'autre part, il est possible que le neuropeptide Y stimule l'autophagie non seulement dans l'hypothalamus, mais également dans d'autres cellules du corps, ce qui entraînera également un ralentissement du vieillissement.
Activation du gène UCP2 dans l'hypothalamusEn 2006, des scientifiques américains dirigés par Tamás Bártfai ont mené une autre expérience élégante, où ils ont également agi sur l'hypothalamus. L'exposition a entraîné une légère baisse de la température corporelle et, de façon inattendue, une augmentation de l'espérance de vie!
Ce n'était pas une expérience en thérapie génique - des souris transgéniques, dont le génome a été modifié depuis la naissance, ont été utilisées. Mais, compte tenu de l'efficacité des méthodes actuelles de transmission des gènes dans l'organisme, la traduction de ces études en thérapie génique ne pose pas de problème particulier.
Les souris transgéniques des expériences Tamás Bártfai ont produit une quantité accrue de protéine de découplage 2 (UCP2) dans l'hypothalamus. Il s'agit d'une protéine mitochondriale qui, pendant le travail, réduit l'efficacité de la synthèse d'ATP et favorise la chaleur. En conséquence, la température de l'hypothalamus a légèrement augmenté. Et une augmentation de la température dans le thermorégulateur du corps principal a conduit au fait que la température totale du corps a légèrement baissé - de 0,3 à 0,5 ° C.
Une légère diminution de la température corporelle a provoqué chez les souris un effet similaire à l'effet de limiter la nutrition, malgré le fait que les souris ont mangé autant qu'elles le voulaient. De plus, la durée de vie médiane des souris a augmenté de manière significative: chez les mâles de 12% et chez les femelles de 20%.
Dans d'autres travaux, la résistance au stress a été augmentée, agissant de manière systémique sur la plupart des cellules du corps.
Inactivation de la voie de vieillissement MTORToren Finkel et ses collègues ont augmenté la résistance au stress et la longévité des souris en désactivant la voie de vieillissement MTOR la plus connue.
Dans les expériences, des souris transgéniques avec une mutation au locus MTOR (régions du chromosome où se trouvent les gènes correspondants) ont été utilisées, qui avaient 75% moins de protéine MTOR dans les cellules. Il s'est avéré que ces souris vivent 20% plus longtemps.

De plus, la mutation au locus MTOR a amélioré de manière significative de nombreux indicateurs de la santé de la souris: un certain nombre d'organes et de tissus étaient dans un état «plus jeune» et meilleur, il y avait moins d'agrégats de protéines (protéines collantes) et de dommages dans les tissus. De plus, la mémoire, la coordination motrice et la pensée spatiale de ces souris ont mieux fonctionné.
Cependant, la «désactivation» de la voie MTOR s'est également accompagnée d'effets secondaires: l'état des os s'est aggravé, les souris ont souvent souffert de maladies infectieuses de la bouche, de la peau et des yeux. De plus, les souris étaient plus petites. Ainsi, un arrêt prolongé des gènes du complexe MTOR est apparemment assez traumatisant pour le corps, et soit le temps d'inactivation du MTOR doit être réduit, soit il doit être combiné avec un autre effet qui compense les effets secondaires négatifs.
Activation du gène PTENUne autre cible prometteuse de la thérapie génique est le gène PTEN - il «désactive» la voie d'insuline du vieillissement. Le PTEN inhibe le travail de la phosphatidylinositol-3-kinase de type I (PI3K), une molécule nécessaire à la transmission d'un signal d'insuline à la cellule.
Des scientifiques espagnols dirigés par Manuel Serrano ont étudié des souris transgéniques avec surexpression (augmentation de l'activité) du gène PTEN. Ces souris étaient bien mieux protégées contre le cancer et leur espérance de vie maximale était de 16% plus longue. Les souris transgéniques étaient plus sensibles à l'insuline, protégées du diabète et de la stéatose - accumulation pathologique de graisse dans le foie, elles avaient moins de dommages à l'ADN à un âge avancé.

Un autre mécanisme a été découvert dans le travail (en plus de l'inactivation de la voie d'insuline) par lequel PTEN affecte la longévité. L'activation du PTEN a conduit au fait que le tissu adipeux brun a commencé à libérer beaucoup d'énergie sous forme de chaleur, ce qui a provoqué une augmentation de la dépense énergétique de tout l'organisme. Et, comme le montrent les travaux antérieurs, l'espérance de vie dépend directement de l'intensité de la consommation d'énergie.
Arrêt du gène AC5Une autre façon, moins connue, d'augmenter la tolérance au stress est de bloquer la transmission du signal de l'hormone du stress - l'adrénaline à la cellule. L'adrénaline est une hormone qui provoque une réaction de fuite ou de combat; il commence à se démarquer activement lorsqu'il sent le danger, la peur, les blessures, les brûlures, les chocs et dans les situations limites, mobilisant le corps pour éliminer la menace. Dans le même temps, l'adrénaline est une hormone du stress très puissante, avec une exposition prolongée, elle endommage les cellules et les tissus entiers, conduisant à l'épuisement du corps.
Le chercheur américain Stephen F. Vatner et ses collègues ont créé des souris transgéniques avec le gène de l'adénylate cyclase (AC5) de type 5 «éteint», une molécule nécessaire pour que le signal d'adrénaline soit transmis aux cellules par l'un de ses types de récepteurs, les récepteurs β-adrénergiques. Il est important de noter que de tels récepteurs sont présents sur presque toutes les cellules du corps.
La «fermeture» du gène AC5 a inopinément eu un effet très fort sur la santé et la longévité. Les souris transgéniques vivaient jusqu'à 30% plus longtemps que les souris ordinaires et étaient moins sensibles aux pathologies osseuses et cardiaques.
Au niveau moléculaire, ces effets étaient liés au fait que l'inactivation de l'AC5 a déclenché la voie de la résistance au stress - Raf / MEK / ERK. En conséquence, la cellule a produit tout un ensemble de molécules protectrices, déclenchant les mécanismes de survie cellulaire.
De plus, d'après des études antérieures, il est connu que l'action de l'adrénaline sur la cellule via les récepteurs β2-adrénergiques provoque directement des dommages à l'ADN. Ainsi, on peut supposer que «l'arrêt» du gène AC5 des souris a également contribué à une stabilité accrue du génome.
Activation des gènes sirtuinesLes sirtuines sont d'autres participants importants aux mécanismes de tolérance au stress et de longévité. En particulier, les sirtuines 1 et 6 (SIRT1 et SIRT6) ont été étudiées. Les sirtuines sont des histone désacétylases - elles modifient la densité de remplissage de l'ADN et inhibent l'expression (diminution de l'activité) des gènes.
Les histones sont des molécules qui fournissent un emballage spatial de l'ADN: l'ADN est enroulé autour d'eux comme un fil sur une bobine, et les bobines sont étroitement emballées. Si les bobines sont trop serrées, il devient presque impossible de leur lire des informations génétiques. Les désacétylases augmentent simplement la densité de l'emballage d'ADN, le rendant inaccessible à la lecture. À la suite de l'activation des sirtuines, l'expression de tout un ensemble de gènes est inhibée.
Sirtuin 1Sirtuin 1 régule un certain nombre de processus de longévité: il inhibe l'inflammation, favorise la survie des cellules, déclenche la division des stations d'énergie cellulaire - les mitochondries, et active le gène de résistance au stress et de longévité le plus important - FOXO. Plusieurs études sur des souris transgéniques ont montré que l'activation du gène SIRT1 a un effet positif sur la santé. Dans la première étude menée en 2010 par des scientifiques espagnols dirigée par Manuel Serrano, le gène SIRT1 a été activé dans tout le corps de souris. En conséquence, leurs cellules vieillissaient plus lentement, il y avait moins de dommages à l'ADN et le cancer s'est développé moins souvent. Et après 3 ans, Shin-ichiro Imai de l'Université de Washington a activé le gène SIRT1 non pas dans tout le corps, mais seulement dans le cerveau des souris, ce qui a entraîné une prolongation significative de leur vie. Les femmes transgéniques vivaient 16% plus longtemps et les hommes - 9%.De plus, à ce jour, de nombreux travaux ont été effectués là où la thérapie avec le gène SIRT1 a été modélisée sur des lignées cellulaires humaines. La délivrance du gène SIRT1 a rajeuni les cellules souches et les cellules humaines différenciées (fonctionnellement spécialisées) - a augmenté le nombre de divisions et ralenti le début du vieillissement cellulaire.Sirtuin 6Un autre acteur clé de la longévité est Sirtuin 6 (SIRT6). Il prévient l'inflammation, modifie les signaux du facteur de croissance analogue à l'insuline 1 IGF1, active les voies de réparation de l'ADN et certains autres mécanismes de stabilité du génome.Une expression accrue du gène SIRT6 favorise la longévité, ce qui a été démontré dans 2 études sur des souris transgéniques.En 2012, des scientifiques américains et israéliens dirigés par Haim Y. Cohen ont augmenté l'expression de SIRT6 dans tout le corps des souris, ce qui a prolongé la vie des hommes (mais pas des femmes) de 10 à 14,5%. Étonnamment, malgré la longévité, les souris transgéniques n'avaient pas moins de maladies séniles, mais même avec des maladies telles que le cancer, les souris transgéniques vivaient beaucoup plus longtemps. Et après plusieurs années dans les travaux des mêmes scientifiques (selon des données non publiées), l'activation du gène SIRT6 a augmenté la vie non seulement des hommes, mais aussi des femmes. Cependant, il convient de garder à l'esprit que l'activation SIRT6 est loin d'être utile dans tous les tissus. Dans le cerveau, sa production accrue, au contraire, prédispose aux maladies neurodégénératives.Un certain nombre d'études réussies ont été menées sur la thérapie avec le gène SIRT6 dans des lignées cellulaires humaines. Il a été démontré que son administration rajeunit les cellules de la muqueuse des bronches et des vaisseaux sanguins et du cartilage.Fait intéressant, la thérapie génique SIRT6 n'est pas encore utilisée pour le vieillissement, mais est déjà utilisée pour la pathologie du cartilage liée à l'âge - l'arthrose. Des études ont été menées sur la thérapie génique dans les cellules et les souris. Après que le gène SIRT6 a été introduit dans le genou, le cartilage a fonctionné beaucoup mieux, et beaucoup moins de changements pathologiques y sont apparus.
Et après 3 ans, Shin-ichiro Imai de l'Université de Washington a activé le gène SIRT1 non pas dans tout le corps, mais seulement dans le cerveau des souris, ce qui a entraîné une prolongation significative de leur vie. Les femmes transgéniques vivaient 16% plus longtemps et les hommes - 9%.De plus, à ce jour, de nombreux travaux ont été effectués là où la thérapie avec le gène SIRT1 a été modélisée sur des lignées cellulaires humaines. La délivrance du gène SIRT1 a rajeuni les cellules souches et les cellules humaines différenciées (fonctionnellement spécialisées) - a augmenté le nombre de divisions et ralenti le début du vieillissement cellulaire.Sirtuin 6Un autre acteur clé de la longévité est Sirtuin 6 (SIRT6). Il prévient l'inflammation, modifie les signaux du facteur de croissance analogue à l'insuline 1 IGF1, active les voies de réparation de l'ADN et certains autres mécanismes de stabilité du génome.Une expression accrue du gène SIRT6 favorise la longévité, ce qui a été démontré dans 2 études sur des souris transgéniques.En 2012, des scientifiques américains et israéliens dirigés par Haim Y. Cohen ont augmenté l'expression de SIRT6 dans tout le corps des souris, ce qui a prolongé la vie des hommes (mais pas des femmes) de 10 à 14,5%. Étonnamment, malgré la longévité, les souris transgéniques n'avaient pas moins de maladies séniles, mais même avec des maladies telles que le cancer, les souris transgéniques vivaient beaucoup plus longtemps. Et après plusieurs années dans les travaux des mêmes scientifiques (selon des données non publiées), l'activation du gène SIRT6 a augmenté la vie non seulement des hommes, mais aussi des femmes. Cependant, il convient de garder à l'esprit que l'activation SIRT6 est loin d'être utile dans tous les tissus. Dans le cerveau, sa production accrue, au contraire, prédispose aux maladies neurodégénératives.Un certain nombre d'études réussies ont été menées sur la thérapie avec le gène SIRT6 dans des lignées cellulaires humaines. Il a été démontré que son administration rajeunit les cellules de la muqueuse des bronches et des vaisseaux sanguins et du cartilage.Fait intéressant, la thérapie génique SIRT6 n'est pas encore utilisée pour le vieillissement, mais est déjà utilisée pour la pathologie du cartilage liée à l'âge - l'arthrose. Des études ont été menées sur la thérapie génique dans les cellules et les souris. Après que le gène SIRT6 a été introduit dans le genou, le cartilage a fonctionné beaucoup mieux, et beaucoup moins de changements pathologiques y sont apparus. Activation du gène NRF2Une approche alternative pour augmenter la tolérance au stress consiste à influencer le facteur de transcription NRF2. Cette voie est très active dans les cellules d'animaux à longue durée de vie: le rat-taupe nu et les souris naines Snell.NRF2 est un facteur de transcription, une molécule qui régule l'activité de centaines d'autres gènes. Il commence à agir en réponse à des effets toxiques et lance le travail de plus de 200 gènes qui protègent les cellules contre les dommages, l'inflammation et augmentent la stabilité des protéines.Cette voie a été immédiatement adoptée par les scientifiques impliqués dans le traitement des maladies neurodégénératives (notamment la maladie d'Alzheimer), et ont déjà réalisé plusieurs études sur la thérapie génique et génique-cellulaire chez la souris.De nombreux chercheurs sont enclins à traiter les maladies neurodégénératives en apportant des cellules souches au cerveau. Cependant, avec de telles maladies, un niveau élevé de stress oxydatif est observé dans le cerveau et les cellules souches meurent lors de l'injection. Et la pré-délivrance du gène NRF2 rend ces cellules plus résistantes au stress, de sorte qu'elles ne meurent pas après leur introduction dans le cerveau.Dans d'autres études, le gène NRF2 a été délivré directement au cerveau des souris d'Alzheimer. L'introduction du gène NRF2 dans l'hippocampe (la structure cérébrale responsable de la mémoire) a amélioré la mémoire et l'apprentissage spatial. Et dans un autre travail, la livraison du gène NRF2 au cerveau l'a rendu plus résistant à la privation d'oxygène (hypoxie) et a amélioré les capacités mentales des souris.En général, pour augmenter la résistance au stress, la plupart des recherches scientifiques sur la thérapie génique sont effectuées! Tous les principaux participants aux voies de signalisation sont testés - des molécules qui inhibent les voies de vieillissement de l'IGF-1 et du MTOP, ainsi que celles qui sont impliquées dans diverses voies de résistance au stress. C'est une augmentation de la résistance au stress qui conduit à l'effet maximal de prolonger la vie des souris transgéniques - jusqu'à 1,8 fois. Cependant, il existe encore très peu de travaux «classiques» sur la thérapie génique de la tolérance au stress (où le gène thérapeutique est délivré à l'animal modèle), ou plutôt, un seul. Mais lorsque les scientifiques se tournent vers la thérapie génique à partir d'expériences sur des animaux transgéniques, il y a toutes les chances de s'attendre à un succès sans précédent pour prolonger la vie.
Activation du gène NRF2Une approche alternative pour augmenter la tolérance au stress consiste à influencer le facteur de transcription NRF2. Cette voie est très active dans les cellules d'animaux à longue durée de vie: le rat-taupe nu et les souris naines Snell.NRF2 est un facteur de transcription, une molécule qui régule l'activité de centaines d'autres gènes. Il commence à agir en réponse à des effets toxiques et lance le travail de plus de 200 gènes qui protègent les cellules contre les dommages, l'inflammation et augmentent la stabilité des protéines.Cette voie a été immédiatement adoptée par les scientifiques impliqués dans le traitement des maladies neurodégénératives (notamment la maladie d'Alzheimer), et ont déjà réalisé plusieurs études sur la thérapie génique et génique-cellulaire chez la souris.De nombreux chercheurs sont enclins à traiter les maladies neurodégénératives en apportant des cellules souches au cerveau. Cependant, avec de telles maladies, un niveau élevé de stress oxydatif est observé dans le cerveau et les cellules souches meurent lors de l'injection. Et la pré-délivrance du gène NRF2 rend ces cellules plus résistantes au stress, de sorte qu'elles ne meurent pas après leur introduction dans le cerveau.Dans d'autres études, le gène NRF2 a été délivré directement au cerveau des souris d'Alzheimer. L'introduction du gène NRF2 dans l'hippocampe (la structure cérébrale responsable de la mémoire) a amélioré la mémoire et l'apprentissage spatial. Et dans un autre travail, la livraison du gène NRF2 au cerveau l'a rendu plus résistant à la privation d'oxygène (hypoxie) et a amélioré les capacités mentales des souris.En général, pour augmenter la résistance au stress, la plupart des recherches scientifiques sur la thérapie génique sont effectuées! Tous les principaux participants aux voies de signalisation sont testés - des molécules qui inhibent les voies de vieillissement de l'IGF-1 et du MTOP, ainsi que celles qui sont impliquées dans diverses voies de résistance au stress. C'est une augmentation de la résistance au stress qui conduit à l'effet maximal de prolonger la vie des souris transgéniques - jusqu'à 1,8 fois. Cependant, il existe encore très peu de travaux «classiques» sur la thérapie génique de la tolérance au stress (où le gène thérapeutique est délivré à l'animal modèle), ou plutôt, un seul. Mais lorsque les scientifiques se tournent vers la thérapie génique à partir d'expériences sur des animaux transgéniques, il y a toutes les chances de s'attendre à un succès sans précédent pour prolonger la vie.Thérapie génique pour détruire les vieilles cellules
Une autre stratégie pour prolonger la vie est la destruction de vieilles cellules sénescentes. Les vieilles cellules s'accumulent dans l'organisme avec l'âge et contribuent au vieillissement de l'organisme tout entier. En particulier, de nombreuses cellules sénescentes se trouvent dans les foyers de pathologies liées à l'âge - ulcères, plaques athérosclérotiques, articulations malades et cerveau dans la maladie d'Alzheimer.Les cellules deviennent séniles lorsqu'elles perdent la capacité de partager et de remplir leurs fonctions. Devenus sensoriels, ils commencent à sécréter tout un tas de substances nocives (SASP), qui perturbent la structure et la fonction des tissus voisins, et contribuent également à la transformation cancéreuse des cellules.Apparemment, la formation évolutive de ces cellules dans le corps est apparue comme un mécanisme protecteur contre le cancer. Afin de ne pas devenir cancéreuses, les cellules endommagées perdent leur capacité à se diviser, passant à une condition spéciale appelée senessence. Et les substances qu'elles libèrent (SASP) signalent aux autres cellules que des dommages se sont produits et stimulent la réparation des tissus et la cicatrisation des plaies.Selon une chercheuse de l'Institut de Bak (Californie) Judy Campisi, le vieillissement cellulaire est un phénomène utile chez les jeunes, mais très nocif dans la vieillesse. Chez les jeunes, l'émergence d'un petit nombre de ces cellules protège le corps contre le cancer et les substances sécrétées par elles contribuent à un changement dans la structure et la réparation des tissus. Cependant, l'accumulation d'un grand nombre de ces cellules dans la vieillesse conduit au fait qu'il y a trop de facteurs sécrétés par elles. Il en résulte une inflammation chronique qui, à son tour, contribue à toutes les pathologies liées à l'âge, de la neurodégénérescence au cancer.Pour la première fois, la destruction des cellules sénescentes pour ralentir le vieillissement a été appliquée par le chercheur américain Jan M. van Deursen. L'étude a été publiée en 2011 dans le meilleur magazine mondial Nature. Les expériences ont été menées sur des souris transgéniques avec un vieillissement prématuré. Un gène suicide a été inséré dans le génome de ces souris, qui ont seulement commencé à fonctionner dans les vieilles cellules. Dans les cellules restantes, il est resté inactif. Il était possible de provoquer la mort de cellules sénescentes chez de telles souris à tout moment en introduisant AP20187 dans des souris. L'enzyme codée dans le gène suicide a rendu cette substance toxique, qui a tué les cellules sénescentes.Les résultats ont montré que si les cellules sénescentes sont détruites toute leur vie à mesure qu'elles surviennent, des pathologies liées à l'âge (tissu adipeux, muscles, yeux et de nombreux autres organes) surviennent chez la souris beaucoup plus tard. Cependant, vous pouvez commencer à détruire les vieilles cellules dans les anciens organismes, lorsque toutes ces pathologies sont déjà apparues. Dans ce cas, l'état pathologique est beaucoup plus facile.Depuis lors, le groupe de recherche Jan M. van Deursen a fait des progrès significatifs dans ses recherches. Début 2016, ils ont publié un article, toujours dans la revue Nature, où ils ont montré que la destruction des cellules sénescentes ralentit le vieillissement chez la souris ordinaire avec un vieillissement normal (non accéléré). La thérapie a ralenti l'apparition du cancer, empêché l'apparition de pathologies du cœur, des reins et du tissu adipeux et, de plus, prolongé la vie de 17 à 35%!Thérapie génique pour améliorer la fonction mitochondriale
Avec l'âge, il y a une forte détérioration du travail des mitochondries, ce qui contribue au vieillissement des cellules et de l'organisme tout entier.Les mitochondries sont des centrales électriques cellulaires, elles fournissent à la cellule l'énergie de base. La «respiration cellulaire» se déroule en eux - la production d'énergie due à l'oxydation des nutriments et son stockage sous forme de molécules d'ATP à haute énergie.L'origine des mitochondries est particulièrement intéressante. Ce sont les descendants de bactéries avalées par les cellules primitives il y a 1,5 à 2 milliards d'années. Pendant l'existence des mitochondries à l'intérieur de la cellule, elles sont devenues beaucoup plus simples, sont devenues dépendantes de la cellule, mais elles ont conservé leur autonomie. Par exemple, les mitochondries ont leur propre ADN, ainsi que leurs propres "machines" moléculaires pour la synthèse d'ARN et de protéines.Avec le vieillissement, le nombre de mitochondries et leur qualité diminuent. Au cours de la "respiration cellulaire", les mitochondries commencent à sécréter beaucoup plus de sous-produits - des espèces d'oxygène actif qui endommagent la cellule et produisent également beaucoup moins d'énergie. En conséquence, la cellule n'a pas assez d'énergie pour mener à bien les processus de réparation et de régénération.À l'heure actuelle, une seule approche de la thérapie génique des mitochondries chez les personnes âgées est activement à l'étude - l'activation du gène PGC-1. Ce gène est le régulateur le plus important du nombre de mitochondries chez les mammifères, ainsi que le gène de longévité.La drosophile a montré que sa surexpression dans les cellules intestinales prolonge la vie de 33 à 37%. Chez l'homme, le gène PGC-1 est impliqué dans l'émergence d'un certain nombre de pathologies liées à l'âge. La carence en PGC-1 contribue à la neurodégénérescence et au diabète de type 2, et l'introduction de PGC-1 restaure le champ des lésions rénales.Le gène PGC-1 n'a pas encore été utilisé directement pour le traitement du vieillissement, mais il est activement utilisé pour traiter diverses pathologies liées à l'âge. Plusieurs études ont été menées à la fois sur des cellules et sur des souris modèles.Des chercheurs chinois, dirigés par Wei-Jia Kong, ont utilisé le gène PGC-1 pour traiter la surdité dans un modèle cellulaire. L'introduction de ce gène a ralenti le vieillissement des cellules de rat responsables de la perception des sons. Dans une autre étude, le scientifique chinois Bing Chen et ses collègues ont utilisé avec succès la livraison du gène PGC-1 aux cellules souches pour augmenter leur résistance au stress. Et Pei-Qing Liu a introduit le gène PGC-1 dans les cellules cardiaques, ce qui les a protégées de l'hypertrophie (prolifération pathologique).Plusieurs expériences ont déjà été réalisées sur des souris. Des scientifiques de Boston, dirigés par Zolt Arany, ont livré le gène PGC-1 à de vieilles souris atteintes d'une maladie artérielle périphérique. La thérapie a réussi à restaurer l'apport sanguin aux muscles. Et les chercheurs Hollinger et Selsby ont utilisé la thérapie génique PGC-1 pour traiter une maladie musculaire héréditaire - la myodystrophie de Duchenne, qui, cependant, n'est pas liée à l'âge. Cependant, la thérapie a également réussi dans ce cas: la délivrance du gène PGC-1 a considérablement amélioré la fonction musculaire chez les souris atteintes de pathologie.Thérapie génique pour maintenir la stabilité du génome et de l'épigénome
Une caractéristique et apparemment l'une des principales causes du vieillissement est l'accumulation de dommages à l'ADN. De plus, de nombreuses maladies du vieillissement prématuré - la progeria - surviennent également à la suite d'une accumulation excessive de dommages génomiques.Par conséquent, l'un des moyens les plus prometteurs de prolonger la vie est de réparer les dommages et d'augmenter la stabilité du génome.Tout au long de la vie, l'ADN est constamment endommagé par diverses influences. De l'environnement extérieur, la température, le rayonnement UV, les mutagènes chimiques et les virus agissent sur lui. Mais les processus internes de la cellule elle-même augmentent également l'instabilité génomique: l'ADN est endommagé par les espèces réactives de l'oxygène des mitochondries, et les systèmes de réplication (doublage de l'ADN) et de réparation fonctionnent souvent de manière inexacte et font eux-mêmes des erreurs.En conséquence, avec l'âge, tout un spectre de troubles s'accumule dans l'ADN: ruptures, mutations ponctuelles, déplacement de morceaux d'ADN d'un endroit à un autre, agrégation de chromosomes, intégration de virus et de transposons dans le génome. S'il y a trop de dommages, la cellule est obligée de suivre l'une des trois voies: démarrer le processus de suicide cellulaire (apoptose), devenir sénescente ou se transformer en cancer. Tous ces processus (si de nombreuses cellules y sont exposées) sont extrêmement nocifs pour le corps.La façon la plus étudiée d'augmenter la stabilité du génome est l'activation des systèmes de réparation de l'ADN. Cette approche est utilisée dans la plupart des travaux sur la thérapie génique.Activation de la réparation de l'ADNLa réparation de l'ADN est la tâche la plus importante pour les cellules, car elle vous permet d'enregistrer les informations les plus précieuses, intégrées dans l'ADN. Ce n’est pas un hasard si plusieurs systèmes complémentaires pour la détection des dommages à l’ADN et leur guérison se sont formés au cours de l’évolution de la cellule. Ce sont, par exemple, des moyens de reconnaître les ruptures d'ADN à 2 et 1 brins; divers systèmes de réparation de l'ADN - réparation par excision, qui permet d'éliminer les bases azotées endommagées, la connexion non homologue des extrémités et la recombinaison homologue, guérit les ruptures d'ADN à 2 brins, la réparation activée par la réplication, etc. Des centaines de protéines sont impliquées dans ces systèmes, dont les fonctions sont entrelacées par un réseau complexe et bizarre . Potentiellement, chacun de ces gènes est candidat à la thérapie génique du vieillissement, mais les études dans ce domaine ne font que commencer. En 2013, des scientifiques italiens dirigés par Gemma Calamandre ont étudié des souris transgéniques avec l'activation du gène MTH1. La protéine MTH1 est impliquée dans la réparation des dommages à l'ADN et à l'ARN causés par les espèces réactives de l'oxygène. Il corrige les nucléotides défectueux - les guanidines oxydées au huitième atome de carbone (des quatre lettres sur lesquelles l'ADN est écrit, cela est indiqué par "G").Il s'est avéré qu'une expression accrue de MTH1 prolonge la vie des souris transgéniques à 22%. De plus, les dommages génomiques ne se sont pas accumulés avec l'âge chez ces souris. Leur comportement a également changé: les souris sont devenues moins anxieuses et plus curieuses.Dans une autre étude, Johannes Grillari et al.A effectué la thérapie génique d'une autre protéine de réparation, SNEV, sur des cellules in vitro. SNEV «patche» l'ADN se casse et participe également à la destruction des protéines endommagées et au nettoyage cellulaire.La délivrance du gène SNEV dans les cellules de la muqueuse vasculaire humaine (endothéliales) a considérablement ralenti leur vieillissement: les cellules ont partagé 2 fois plus avant de vieillir et ont cessé de se diviser. De plus, ils sont devenus plus résistants au stress.La suppression de l'activité des rétrotransposonsendommage l'ADN peut également provoquer ses propres séquences génomiques - les rétrotransposons. Ce sont des résidus d'ADN de rétrovirus, qui dans les temps anciens étaient intégrés dans le génome, et occupent maintenant environ 42% du génome humain!En règle générale, les rétrotransposons sont inactifs dans les cellules, mais ils deviennent activés avec l'âge - et l'ARN commence à être lu à partir d'eux. Cela entraîne des dommages à l'ADN et des réarrangements chromosomiques, et peut également provoquer une réponse auto-immune, car la cellule décide qu'elle est infectée par des virus. Tous ces processus contribuent au vieillissement cellulaire.
En 2013, des scientifiques italiens dirigés par Gemma Calamandre ont étudié des souris transgéniques avec l'activation du gène MTH1. La protéine MTH1 est impliquée dans la réparation des dommages à l'ADN et à l'ARN causés par les espèces réactives de l'oxygène. Il corrige les nucléotides défectueux - les guanidines oxydées au huitième atome de carbone (des quatre lettres sur lesquelles l'ADN est écrit, cela est indiqué par "G").Il s'est avéré qu'une expression accrue de MTH1 prolonge la vie des souris transgéniques à 22%. De plus, les dommages génomiques ne se sont pas accumulés avec l'âge chez ces souris. Leur comportement a également changé: les souris sont devenues moins anxieuses et plus curieuses.Dans une autre étude, Johannes Grillari et al.A effectué la thérapie génique d'une autre protéine de réparation, SNEV, sur des cellules in vitro. SNEV «patche» l'ADN se casse et participe également à la destruction des protéines endommagées et au nettoyage cellulaire.La délivrance du gène SNEV dans les cellules de la muqueuse vasculaire humaine (endothéliales) a considérablement ralenti leur vieillissement: les cellules ont partagé 2 fois plus avant de vieillir et ont cessé de se diviser. De plus, ils sont devenus plus résistants au stress.La suppression de l'activité des rétrotransposonsendommage l'ADN peut également provoquer ses propres séquences génomiques - les rétrotransposons. Ce sont des résidus d'ADN de rétrovirus, qui dans les temps anciens étaient intégrés dans le génome, et occupent maintenant environ 42% du génome humain!En règle générale, les rétrotransposons sont inactifs dans les cellules, mais ils deviennent activés avec l'âge - et l'ARN commence à être lu à partir d'eux. Cela entraîne des dommages à l'ADN et des réarrangements chromosomiques, et peut également provoquer une réponse auto-immune, car la cellule décide qu'elle est infectée par des virus. Tous ces processus contribuent au vieillissement cellulaire. En 2011, Victoria Luniak de l'US Tank Institute a mené une étude sur la thérapie génique, où elle a supprimé l'activité des rétrotransposons dans les vieilles cellules souches humaines. Pour cela, des lentivirus ont été introduits dans de vieilles cellules, à partir desquelles de petits ARN (shRNA) ont été lus, ce qui supprime la lecture des informations des rétrotransposons.La thérapie génique a été couronnée de succès et a conduit au rajeunissement des vieilles cellules - elles ont recommencé à se diviser.Augmentation de la stabilité de l'épigénomePour prolonger la vie, il est extrêmement important de maintenir la stabilité non seulement du génome, mais aussi de l'épigénome. Le fait est qu'avec l'âge, des changements se produisent qui n'affectent pas la séquence d'ADN, mais changent néanmoins l'activité des gènes. Ces changements sont appelés épigénétiques. Leur caractéristique est qu'ils peuvent non seulement rester dans un certain nombre de divisions cellulaires, mais aussi être transmis aux générations futures.Il y a environ 18 000 gènes dans le génome humain, mais tous ne fonctionnent pas dans les cellules. Les cellules de la grande majorité des tissus ont un génome presque identique, sans compter un certain nombre de mutations qui se produisent à mesure que le corps se développe. Cependant, les différences dans la structure et les fonctions des différents tissus ne sont pas déterminées par ces écarts mineurs. Le fait est que la cellule de chaque tissu possède un ensemble très spécifique de gènes qui fonctionnent et qui sont «désactivés».Cet ensemble - le profil d'expression des gènes - est en partie déterminé par le travail de nombreuses protéines (par exemple, les activateurs et les répresseurs du travail des gènes). Mais dans une large mesure, il est associé à l'état épigénétique de la cellule (principalement - la densité de "l'emballage" de l'ADN). Par conséquent, le maintien de la stabilité d'un épigénome est un processus de la plus haute importance!Avec l'âge, cependant, des changements épigénétiques se produisent qui perturbent les profils de travail des gènes, ce qui affecte négativement les processus cellulaires et accélère le vieillissement cellulaire. Par exemple, avec l'âge, un ensemble complet de gènes et de séquences génomiques est activé et ne devrait normalement pas fonctionner (par exemple, les rétrotransposons).L'activité des gènes est régulée par de nombreux facteurs. L'un d'eux est la densité de «l'ADN» de l'emballage, qui détermine sa disponibilité pour les enzymes qui effectuent la synthèse de l'ARN. L'ADN dans le noyau est toujours dans un état «emballé» enroulé autour de protéines - histones. Comme un fil sur la canette. Si le gène est «trop serré», il est inaccessible aux enzymes et la synthèse d'ARN ne se produit pas. Si l '«emballage» est lâche - les enzymes s'y assoient facilement et commencent à fonctionner.L'activation des gènes au cours du vieillissement est précisément due au fait que la densité du «packaging» d'ADN diminue.À cet égard, plusieurs chercheurs ont décidé de développer une thérapie génique qui augmente globalement la densité du «conditionnement» de l'ADN dans la cellule.Stephen L Helfand et ses collègues ont activé le gène de la méthylase Suv39, une enzyme qui modifie les histones, augmentant la densité de remplissage de l'ADN. Les expériences ont été menées sur des mouches des fruits - la drosophile, qui à la suite de l'exposition a commencé à vivre plus longtemps.Et les scientifiques canadiens Igor Kovalchuk et Olga Kovalchuk ont utilisé la même approche, mais sur des cellules humaines. Dans leur travail, ils ont constaté que l'activité du gène Suv39h1 diminue dans la vieillesse. Ils ont introduit le gène Suv39h1 dans des cellules de fibroblastes humains (tissu conjonctif), ce qui a conduit à leur rajeunissement et à leur division stimulée.Il faut comprendre que cette approche est un effet extrêmement grossier sur l'épigénome. Assurément, le ralentissement du vieillissement nécessite un effet beaucoup plus «joaillier» et des changements épigénétiques dans un ensemble restreint de certains gènes. Cependant, pour l'instant, les connaissances sur le rôle de l'épigénétique dans le vieillissement sont très sommaires et approximatives.Actuellement, la thérapie génique pour augmenter la stabilité du génome et de l'épigénome est un domaine extrêmement jeune. La plupart des travaux ont été effectués non même sur des animaux transgéniques, mais sur des cellules in vitro, et les succès obtenus sont assez restreints. Cependant, il faut comprendre que jusqu'à présent, la recherche fondamentale n'a affecté qu'une petite couche de ce qui se passe réellement dans la vieillesse avec le génome et l'épigénome et a révélé très peu de moyens (plutôt approximatifs) pour contrer cela.Cependant, ce sujet est extrêmement prometteur et comporte certainement bien d'autres surprises et a un grand potentiel pour la thérapie génique!
En 2011, Victoria Luniak de l'US Tank Institute a mené une étude sur la thérapie génique, où elle a supprimé l'activité des rétrotransposons dans les vieilles cellules souches humaines. Pour cela, des lentivirus ont été introduits dans de vieilles cellules, à partir desquelles de petits ARN (shRNA) ont été lus, ce qui supprime la lecture des informations des rétrotransposons.La thérapie génique a été couronnée de succès et a conduit au rajeunissement des vieilles cellules - elles ont recommencé à se diviser.Augmentation de la stabilité de l'épigénomePour prolonger la vie, il est extrêmement important de maintenir la stabilité non seulement du génome, mais aussi de l'épigénome. Le fait est qu'avec l'âge, des changements se produisent qui n'affectent pas la séquence d'ADN, mais changent néanmoins l'activité des gènes. Ces changements sont appelés épigénétiques. Leur caractéristique est qu'ils peuvent non seulement rester dans un certain nombre de divisions cellulaires, mais aussi être transmis aux générations futures.Il y a environ 18 000 gènes dans le génome humain, mais tous ne fonctionnent pas dans les cellules. Les cellules de la grande majorité des tissus ont un génome presque identique, sans compter un certain nombre de mutations qui se produisent à mesure que le corps se développe. Cependant, les différences dans la structure et les fonctions des différents tissus ne sont pas déterminées par ces écarts mineurs. Le fait est que la cellule de chaque tissu possède un ensemble très spécifique de gènes qui fonctionnent et qui sont «désactivés».Cet ensemble - le profil d'expression des gènes - est en partie déterminé par le travail de nombreuses protéines (par exemple, les activateurs et les répresseurs du travail des gènes). Mais dans une large mesure, il est associé à l'état épigénétique de la cellule (principalement - la densité de "l'emballage" de l'ADN). Par conséquent, le maintien de la stabilité d'un épigénome est un processus de la plus haute importance!Avec l'âge, cependant, des changements épigénétiques se produisent qui perturbent les profils de travail des gènes, ce qui affecte négativement les processus cellulaires et accélère le vieillissement cellulaire. Par exemple, avec l'âge, un ensemble complet de gènes et de séquences génomiques est activé et ne devrait normalement pas fonctionner (par exemple, les rétrotransposons).L'activité des gènes est régulée par de nombreux facteurs. L'un d'eux est la densité de «l'ADN» de l'emballage, qui détermine sa disponibilité pour les enzymes qui effectuent la synthèse de l'ARN. L'ADN dans le noyau est toujours dans un état «emballé» enroulé autour de protéines - histones. Comme un fil sur la canette. Si le gène est «trop serré», il est inaccessible aux enzymes et la synthèse d'ARN ne se produit pas. Si l '«emballage» est lâche - les enzymes s'y assoient facilement et commencent à fonctionner.L'activation des gènes au cours du vieillissement est précisément due au fait que la densité du «packaging» d'ADN diminue.À cet égard, plusieurs chercheurs ont décidé de développer une thérapie génique qui augmente globalement la densité du «conditionnement» de l'ADN dans la cellule.Stephen L Helfand et ses collègues ont activé le gène de la méthylase Suv39, une enzyme qui modifie les histones, augmentant la densité de remplissage de l'ADN. Les expériences ont été menées sur des mouches des fruits - la drosophile, qui à la suite de l'exposition a commencé à vivre plus longtemps.Et les scientifiques canadiens Igor Kovalchuk et Olga Kovalchuk ont utilisé la même approche, mais sur des cellules humaines. Dans leur travail, ils ont constaté que l'activité du gène Suv39h1 diminue dans la vieillesse. Ils ont introduit le gène Suv39h1 dans des cellules de fibroblastes humains (tissu conjonctif), ce qui a conduit à leur rajeunissement et à leur division stimulée.Il faut comprendre que cette approche est un effet extrêmement grossier sur l'épigénome. Assurément, le ralentissement du vieillissement nécessite un effet beaucoup plus «joaillier» et des changements épigénétiques dans un ensemble restreint de certains gènes. Cependant, pour l'instant, les connaissances sur le rôle de l'épigénétique dans le vieillissement sont très sommaires et approximatives.Actuellement, la thérapie génique pour augmenter la stabilité du génome et de l'épigénome est un domaine extrêmement jeune. La plupart des travaux ont été effectués non même sur des animaux transgéniques, mais sur des cellules in vitro, et les succès obtenus sont assez restreints. Cependant, il faut comprendre que jusqu'à présent, la recherche fondamentale n'a affecté qu'une petite couche de ce qui se passe réellement dans la vieillesse avec le génome et l'épigénome et a révélé très peu de moyens (plutôt approximatifs) pour contrer cela.Cependant, ce sujet est extrêmement prometteur et comporte certainement bien d'autres surprises et a un grand potentiel pour la thérapie génique!Thérapie génique pour activer l'hormone klotho
Il y a près de 20 ans, en 1997, des scientifiques japonais et américains, dirigés par Yo-ichi Nabeshima, ont découvert un nouveau gène pour la longévité et lui ont donné un nom en l'honneur de la déesse grecque du destin, tissant le fil de la vie - Klotho. Son «arrêt» chez les souris transgéniques a provoqué un syndrome de vieillissement accéléré. Et après 7 ans, les mêmes chercheurs ont découvert que l'activation du klotho prolonge considérablement la vie des souris - mâles de 20 à 30% et femelles - jusqu'à 19%. Et en 2014, il a été montré que certaines variantes du gène klotho (SNP Rs9536314) sont associées à la longévité et à des capacités mentales élevées chez les personnes.Il est produit par le klotho dans les reins et les vaisseaux sanguins du cerveau et est transporté par le sang dans tout le corps, comme une hormone. Il affecte systématiquement la plupart des cellules de l'organisme - il se lie aux récepteurs à leur surface et inhibe la signalisation de l'insuline et de l'IGF-1 (l'une des principales voies de vieillissement).Seulement 3 ans après la découverte du gène klotho - en 2000 - les premiers travaux sur la thérapie génique ont été effectués, mais pas sur le vieillissement, mais sur les maladies vasculaires chroniques - l'athérosclérose. Ryozo Nagai et ses collègues ont systématiquement introduit ce gène chez le rat et ont permis une amélioration de l'état des vaisseaux sanguins et une réduction de la pression.Depuis lors, environ 4 à 5 études réussies ont été menées sur la thérapie du gène klotho chez des rats et des souris modèles. Certes, tous ne sont pas consacrés au vieillissement, mais à diverses pathologies liées au vieillissement du système cardiovasculaire et des reins. Cette pression artérielle élevée - hypertension, maladie rénale, maladie coronarienne et diabète.
Et en 2014, il a été montré que certaines variantes du gène klotho (SNP Rs9536314) sont associées à la longévité et à des capacités mentales élevées chez les personnes.Il est produit par le klotho dans les reins et les vaisseaux sanguins du cerveau et est transporté par le sang dans tout le corps, comme une hormone. Il affecte systématiquement la plupart des cellules de l'organisme - il se lie aux récepteurs à leur surface et inhibe la signalisation de l'insuline et de l'IGF-1 (l'une des principales voies de vieillissement).Seulement 3 ans après la découverte du gène klotho - en 2000 - les premiers travaux sur la thérapie génique ont été effectués, mais pas sur le vieillissement, mais sur les maladies vasculaires chroniques - l'athérosclérose. Ryozo Nagai et ses collègues ont systématiquement introduit ce gène chez le rat et ont permis une amélioration de l'état des vaisseaux sanguins et une réduction de la pression.Depuis lors, environ 4 à 5 études réussies ont été menées sur la thérapie du gène klotho chez des rats et des souris modèles. Certes, tous ne sont pas consacrés au vieillissement, mais à diverses pathologies liées au vieillissement du système cardiovasculaire et des reins. Cette pression artérielle élevée - hypertension, maladie rénale, maladie coronarienne et diabète.Thérapie génique pour les pathologies liées à l'âge
Dans la vieillesse, l'état de presque tous les tissus et systèmes du corps se détériore - le ton des vaisseaux sanguins et du cœur diminue, le thymus dégénère - l'organe le plus important du système immunitaire, les os, le cartilage et les tissus musculaires sont épuisés, de nombreuses déficiences cognitives se produisent - et ce n'est que le début de la liste.
La plupart de ces pathologies ne sont pas considérées comme des maladies, mais elles augmentent considérablement leur risque. Par exemple, l'hypertension artérielle - l'hypertension - est un puissant facteur de risque d'accident vasculaire cérébral, de crise cardiaque et d'insuffisance cardiaque. En outre, dans la vieillesse, ces pathologies se développent de manière globale, ce qui réduit considérablement la qualité de vie humaine et conduit à la décrépitude.
C'est avec de tels troubles que la thérapie génique des pathologies liées à l'âge se bat.
Cependant, contrairement à la thérapie génique du vieillissement, elle est toujours limitée à un seul tissu ou système - le traitement de l'obésité, de la dégénérescence rétinienne ou des troubles du centre de la mémoire - l'hypothalamus. La thérapie génique du vieillissement, au contraire, vise à rajeunir toutes les cellules et tous les tissus du corps, sans exception.
Et si la thérapie génique pour le vieillissement affecte les modes de vieillissement conservateurs communs à la plupart des cellules du corps, la thérapie génique pour les pathologies liées à l'âge se limite généralement à influencer les mécanismes spécifiques à un tissu particulier. Il s'agit bien souvent de voies «secondaires» ou «tertiaires» régulées par des mécanismes de longévité plus profonds et plus fondamentaux.
Il est clair que le traitement des pathologies liées à l'âge est beaucoup plus simple que le vieillissement - pour cela, aucune connaissance approfondie des mécanismes moléculaires du vieillissement n'est nécessaire. Par conséquent, il n'est pas surprenant que la thérapie génique des pathologies liées à l'âge soit un domaine beaucoup plus développé. Si pour le vieillissement, pas plus de 2-3 études ont été menées sur la thérapie génique chez les mammifères, alors pour les troubles liés à l'âge - plus de 40!
Le but d'une telle thérapie est de ramener l'ancien tissu ou système à un état qui ne se distingue pas des jeunes animaux. Naturellement, il est impossible de faire face au vieillissement en général. Si le patient est sauvé d'une crise cardiaque - après un certain temps, il développera, par exemple, un diabète! Il existe même des études qui montrent que si nous pouvions guérir complètement toutes les maladies cancéreuses (et c'est l'une des principales causes de décès), cela ne prolongerait l'espérance de vie moyenne des personnes que de trois ans. Ainsi, en général, cette approche est beaucoup moins efficace que la thérapie génique pour le vieillissement, qui rajeunit de nombreux systèmes en même temps et, en outre, prolonge la vie.
Néanmoins, beaucoup de travaux de haute qualité sur des animaux modèles - souris, rats, lapins et même singes - ont été effectués sur la thérapie génique des pathologies liées à l'âge. Il s'agit de thérapie génique au «sens classique»: un gène thérapeutique est introduit dans des animaux modèles dans le cadre d'un vecteur de livraison et analysé comment cela affectera la survenue d'une pathologie liée à l'âge. De plus, la valeur de l'étude augmente considérablement si de vieux animaux sont utilisés. Nous avons essayé d'analyser un tel travail.
Les approches développées sont un puissant moyen de prévention des maladies et de traitement de la sénilité. Cependant, il semble logique de les utiliser uniquement si le patient a une prédisposition claire à l'un ou l'autre type de maladie - cardiovasculaire, neurodégénérative, etc.
Système cardiovasculaireEn ce qui concerne la thérapie génique des pathologies du système cardiovasculaire liées à l'âge, environ 7 études ont été réalisées sur des souris et des rats âgés. C'est l'un des domaines les plus passionnants - étant donné qu'aujourd'hui les maladies cardiovasculaires sont la principale cause de décès dans le monde, elles représentent environ 30% de tous les décès - 17,3 millions de personnes par an. Cependant, l'émergence de ces maladies est précédée de diverses pathologies qui peuvent être diagnostiquées et traitées - il s'agit d'une violation de la formation de nouveaux vaisseaux sanguins, d'une diminution du tonus musculaire des vaisseaux sanguins et du cœur et de l'hypertension. Ils ont été choisis comme cibles pour la thérapie génique.
Dans la plupart des travaux sur la thérapie génique, ils ont utilisé des gènes très spécifiques qui améliorent le travail uniquement du cœur et des vaisseaux sanguins, aucun d'entre eux n'était également un gène de longévité. Par exemple, pour le traitement de l'hypertension artérielle - l'hypertension - le gène BNP (peptide natriurétique de type B) a été délivré au corps, qui est sécrété par le cœur sous un stress accru et dilate les vaisseaux sanguins, stabilisant la pression artérielle. Et pour la pathologie cardiaque sénile - perte de capacité à se détendre - ils ont utilisé le gène des pompes à calcium qui pompent le calcium du cytoplasme des cellules musculaires et détendent les muscles.
Toutes ces approches ont réussi, mais n'ont pas conduit à un rajeunissement radical; en outre, aucun effet secondaire n'a été étudié dans aucun travail.
L'étude la plus intéressante est sans aucun doute le travail du scientifique français Alain-Pierre Gadeau, où le gène de la cascade de signalisation embryonnaire - hérisson du désert (dh) a été utilisé comme agent thérapeutique. En plus de son rôle important dans le développement embryonnaire, ce gène «s'allume» également après des blessures ischémiques (avec un manque d'approvisionnement en sang), fournissant la formation de nouveaux vaisseaux sanguins. L'introduction de ce gène chez les vieilles souris après l'ischémie a été très réussie - l'approvisionnement en sang, ainsi que la densité des nerfs des membres chez les vieilles souris malades sont devenus les mêmes que chez les jeunes!
L'ostéoporoseEnviron 7 travaux ont été menés sur la thérapie génique de l'ostéoporose - déplétion du tissu osseux à un âge avancé, conduisant à la fragilité et aux fractures. Cependant, seulement deux d'entre elles ont été réalisées sur de vieux animaux. Dans le reste, l'ostéoporose a été induite artificiellement.
Dans toutes les études, des mécanismes spécifiques aux os ont été choisis comme cibles. Par exemple, dans 2 études, la livraison de gènes BMP favorisant la formation osseuse a été utilisée. Et dans plusieurs autres études, des gènes d'ostéoprotégérine (OPG) ou d'omentine 1 qui empêchent la destruction osseuse ont été délivrés. L'efficacité de toutes ces approches était modérée - l'état du tissu osseux s'est amélioré, mais seulement partiellement; et les effets secondaires n'ont pas été étudiés.
La seule exception est peut-être le travail de scientifiques américains dirigé par Xiao-Bing Zhanga - sur la thérapie génique-cellulaire de l'ostéoporose. Les scientifiques ont livré le gène PDGFB, un facteur de croissance qui stimule la formation osseuse, aux cellules souches de souris in vitro, après quoi les cellules ont été introduites dans le corps. Il s'est avéré extrêmement efficace: la structure osseuse s'est améliorée et la résistance a augmenté de 45%! Il est important que dans ce travail, les effets secondaires soient étudiés - et rien ne soit trouvé. Cependant, toutes les expériences ont été réalisées sur des souris adultes en bonne santé (et l'état de leurs os est devenu encore meilleur), par conséquent, il n'est pas clair comment la thérapie fonctionnera dans le cas d'animaux âgés et malades.
CartilagePlus de 5 travaux sur la thérapie génique sont consacrés aux pathologies du cartilage liées à l'âge - dégénérescence des disques intervertébraux et arthrose - troubles associés à la déformation et à l'épuisement du cartilage, conduisant à des douleurs chroniques. Il est important de noter que tous les travaux ont été effectués sur des adultes, pas sur de vieux animaux, dans lesquels des pathologies ont été causées chirurgicalement - endommageant le cartilage.
Plusieurs travaux visaient à améliorer la structure du cartilage. Par exemple, le gène Sox9 a été délivré au corps, stimulant la production de la molécule structurelle la plus importante - le collagène de type 2. Dans d'autres travaux, ils ont supprimé l'inflammation dans l'arthrose. Par exemple, des miARN ont été délivrés qui inhibent l'activité du gène pro-inflammatoire NF-κB. Toutes ces approches ont ralenti le développement des pathologies, mais ne l'ont pas arrêté.
Cependant, l'une des œuvres mérite une attention particulière! Dans cette étude, menée par le scientifique chinois Wang, le gène de longévité, SIRT6, a été utilisé. L'introduction de ce gène dans la zone de cartilage endommagé a ralenti à la fois l'inflammation, le vieillissement des cellules et la survenue d'arthrose. Il convient de noter que dans ce travail, ils ont agi sur le mécanisme de longévité commun à la plupart des cellules. Ce gène peut être utilisé non seulement pour le traitement de la pathologie locale liée à l'âge, mais aussi pour le rajeunissement de l'organisme entier.
MuscleL'épuisement du tissu musculaire est l'une des principales causes de faiblesse sénile et de décrépitude; ainsi que le fait qu'une personne commence à ressembler à un vieil homme. Faiblesse pure et misère atteignant la honte. Le nom exact de la vie est tordu dans la corne d'un bélier. Par conséquent, son traitement efficace est pertinent non seulement pour la médecine, mais aussi pour la cosmétologie.
Aujourd'hui, dans la thérapie génique des pathologies du muscle sénile, une seule approche est en cours de développement, qui est cependant très efficace. Il s'agit d'une suppression de l'activité du gène de la myostatine, qui inhibe la croissance musculaire. Son «arrêt» peut être obtenu, par exemple, en délivrant le gène de l'inhibiteur de la myostatine, le peptide MyoPPT. Selon Ketan Patel, son introduction sur de vieilles souris conduit à des résultats brillants: non seulement la masse musculaire est considérablement augmentée, mais les gènes de longévité (par exemple, FOXO) «s'allument» également.
 Elizabeth Perrish
Elizabeth PerrishIl convient de mentionner qu'Elizabeth Perrish, la femme qui a été la première au monde à subir une thérapie génique pour le vieillissement, en plus du gène de la télomérase, a introduit spécifiquement le gène inhibiteur de la myostatine pour améliorer la fonction musculaire.
Système immunitaireLes changements liés à l'âge affectent le système immunitaire - le corps devient plus sensible aux infections virales et bactériennes; leur mortalité augmente et la prévention des maladies - la vaccination - n'aide plus. Cependant, malgré l'importance du problème, il n'y a que 3 travaux sur la thérapie génique, et aucun d'entre eux ne peut être considéré comme suffisamment réussi. Cela n'est pas surprenant étant donné la rareté des connaissances sur les mécanismes moléculaires et génétiques qui sous-tendent le vieillissement du système immunitaire.
Deux travaux sont consacrés au traitement de la dégénérescence du thymus liée à l'âge, l'organe central du système immunitaire dans lequel mûrissent les lymphocytes T (acteurs clés de l'immunité acquise). Dans l'un d'eux, le gène du facteur de transcription FoxN1, qui régule le développement du thymus et la formation de cellules T, a été délivré au thymus. Et dans l'autre, ils ont amélioré l'apport sanguin au thymus en délivrant le gène VEGF, un facteur de croissance endothélial vasculaire. Cependant, dans les deux cas, les scientifiques n'ont réussi à obtenir qu'un léger ralentissement de la dégradation du thymus.
Et dans le troisième travail, avec l'aide de la thérapie génique, ils ont essayé d'améliorer l'efficacité de la vaccination dans la vieillesse. Pour ce faire, le gène IL-2, le médiateur le plus important de l'inflammation et de l'immunité, a été introduit dans le corps, ce qui a vraiment légèrement amélioré la réponse immunitaire systémique à la vaccination. Cependant, il est resté significativement plus faible que les jeunes souris.
À ce jour, la pharmacologie connaît le plus grand succès dans le domaine du rajeunissement du système immunitaire. Le géant agricole Novartis a même mené des essais cliniques sur l'analogue de la rapamycine (inhibiteur du vieillissement mTOR) pour améliorer la réponse vaccinale chez les personnes âgées! Le fait est que la suppression de l'inflammation chronique n'est pas seulement l'un des moyens de rajeunir le système immunitaire, mais ralentit également le vieillissement de tout le corps.
Système nerveux centralLa thérapie génique des pathologies séniles du système nerveux central (SNC) est un domaine activement étudié et en développement rapide - plus de 10 travaux y ont déjà été consacrés! Et ils ont été effectués non seulement sur de vieux rats et souris, mais même sur des primates - des singes rhésus. Cela n'est pas surprenant, étant donné que les maladies neurodégénératives (maladie d'Alzheimer et de Parkinson) sont parmi les 10 principales causes de décès dans le monde, et le traitement des pathologies séniles du SNC est une prévention efficace de ces maladies.
La plupart des travaux visent à rajeunir l'hippocampe, l'ancienne structure du cerveau responsable de la formation de la mémoire. Toutes les approches "visent" des mécanismes très spécifiques aux cellules nerveuses - les neurones. Les scientifiques tentent d'améliorer la structure des neurones en introduisant le gène de la protéine structurale Homer1c. Ou rendre la transmission du signal entre les cellules nerveuses plus efficace (en utilisant le gène PkcD impliqué dans la synapse). Notez que les gènes sont livrés à l'hippocampe par injection directe dans cette zone du cerveau. Dans la plupart des études, la thérapie a amélioré la mémoire et l'apprentissage spatial chez de vieilles souris ou rats, parfois même au niveau des jeunes animaux. Malheureusement, seuls les effets à très court terme d'une telle thérapie ont été étudiés, de sorte que leur efficacité réelle reste inconnue.
Le plus prometteur a été le travail de Matthew J. Pendant, non pas sur la thérapie, mais sur la prévention des troubles cognitifs. Le gène du facteur de transcription CREB (qui est impliqué dans la formation de la mémoire à long terme) a été introduit dans l'hippocampe de jeunes rats, et lorsque ces rats sont devenus vieux - il s'est avéré que leur mémoire était en bien meilleur état!
Il est intéressant de noter qu'en parallèle de la thérapie génique, à Los Angeles, des développements sont en cours pour créer un hippocampe artificiel de rat! Un tel hippocampe est modélisé comme un ensemble de réseaux nerveux et est destiné à être implanté dans le cerveau au lieu d'un endommagé. Il a déjà été testé sur des rats vivants, ce qui a effectivement restauré les troubles de la mémoire, et le chef de projet Theodore Berger est enthousiaste et promet de créer un hippocampe humain artificiel d'ici 2025!
Un travail sur la thérapie génique est consacré au rajeunissement d'une autre structure cérébrale - la substantia nigra, ou plutôt, son département Pars compacta. Cette partie du cerveau, en premier lieu, est responsable du contrôle des mouvements, cependant, une autre de ses fonctions est la synthèse d'un neurotransmetteur (une substance qui assure la transmission d'un signal d'un neurone à un autre) de dopamine.
La dopamine fait partie du «système de récompense» du cerveau; il est produit au cours d'une expérience positive - le sexe, la consommation d'aliments ou de drogues délicieux - et provoque du plaisir. Cependant, il n'est pas moins important de déplacer l'attention d'un stade de l'activité cognitive à un autre, et son insuffisance conduit à une inertie accrue de la pensée.
Pour rajeunir Pars compacta, la substantia nigra a activé le chemin de la longévité et de la résistance au stress - a augmenté la stabilité des protéines dans la cellule! Des rats adultes ont reçu une injection du gène chaperon GRP78, qui permet le repliement de protéines mal repliées ou de protéines après dégradation. Ensuite, ils ont surveillé l'état des animaux jusqu'à ce qu'ils soient très vieux et ont découvert que la thérapie génique protégeait les neurones de la mort, même s'ils étaient affectés par des substances nocives (alpha synucléine).
Et enfin, 3 travaux très intéressants ont été réalisés, où la thérapie génique a été utilisée pour le rajeunissement systémique du cerveau entier! Pour la livraison systémique, des constructions génétiques ont été injectées dans le liquide céphalo-rachidien, lavant diverses parties du cerveau.
Dans une étude, l'inflammation a été systématiquement supprimée dans le cerveau en inhibant les cytokines IL-12 et IL-23 pro-inflammatoires avec l'ARNsi, ce qui a réussi à améliorer les capacités cognitives des souris. Certes, des expériences ont été menées sur des animaux avec un vieillissement accéléré. Dans un autre travail, le cerveau de très vieux rats a été systématiquement rajeuni par le gène du facteur de croissance analogue à l'insuline-1 (IGF-1)! Comme vous le savez, l'IGF-1 déclenche l'une des principales façons de vieillir dans le corps, mais son rôle dans le système nerveux central est complètement différent - c'est un neuroprotecteur. L'apport systémique du gène IGF-1 au cerveau a amélioré de manière significative l'activité motrice chez le rat, mais pas au niveau des jeunes rats.
Et dans une étude remarquable, Mark H. Tuszynski a effectué une thérapie génique sur le cerveau de vieux singes rhésus avec le gène NGF, un facteur de croissance nerveuse qui est également un neuroprotecteur. L'introduction de ce gène a été très efficace - le nombre et la taille des cellules nerveuses (neurones cholinergiques) sont devenus, comme chez les jeunes singes! De plus, l'effet de la thérapie a duré très longtemps - plus d'un an.
Il convient de noter que le gène NGF a une très bonne réputation - depuis plus de 15 ans, il a été étudié avec succès dans des essais cliniques chez l'homme de la maladie d'Alzheimer.
Toutes ces approches montrent comment améliorer l'activité cérébrale chez les personnes âgées de diverses manières. Apparemment, l'utilisation d'approches combinées de la thérapie génique du cerveau peut même conduire à son rajeunissement.
Système reproducteurDe nombreux travaux sont consacrés à la thérapie génique des troubles sexuels chez les personnes âgées. Chez les hommes, il s'agit d'une dysfonction érectile selon laquelle, selon la Massachusetts Male Aging Study, 39% des hommes de 40 ans et 67% des 70 ans en souffrent. Et chez les femmes - l'arrêt de la période de reproduction - la ménopause, qui survient en moyenne à 50 ans et conduit à l'infertilité. Tous les travaux sur la thérapie génique ont été effectués sur de vieux animaux - rats ou souris.
Environ 6 approches pour le traitement de la dysfonction érectile ont été développées, mais elles sont toutes très uniformes - elles agissent sur les mécanismes spécifiques des muscles lisses du pénis. Dans plusieurs travaux, ils ont activé la molécule de signalisation NO nécessaire à la relaxation musculaire (eNOS, ecSOD, gènes siRNA contre l'arginase), et dans d'autres, ils ont introduit les gènes des canaux ioniques nécessaires au travail musculaire (CATF, Maxi-K). Apparemment, le plus efficace a été la délivrance du gène KATF - canaux potassiques ATP-dépendants, nécessaires au tonus musculaire normal. Dans ce cas, le rajeunissement a atteint le niveau des jeunes animaux.
Apparemment, dans tous les cas, le traitement de la dysfonction érectile sera plus efficace s'il s'accompagne d'une normalisation de l'équilibre hormonal.
Un seul travail a été entrepris pour la thérapie génique du système reproducteur féminin, mais c'est très intéressant! Il a agi sur le principal régulateur hormonal - l'hypothalamus, et le gène IGF-1, un facteur de croissance semblable à l'insuline, y a été introduit. Cela mérite une attention particulière car, comme nous l'avons déjà dit, au niveau de l'organisme tout entier, l'IGF-1 commence à vieillir, mais c'est un neuroprotecteur du système nerveux central. L'IGF-1 est également impliqué dans la régulation des hormones sexuelles (en particulier, il contrôle la libération de l'hormone de libération des gonadotrophines (GnRH) en réponse aux œstrogènes).Le gène IGF-1 a été injecté à des rats femelles d'âge moyen dans l'hypothalamus, et après quelques mois, leur cycle œstral s'est amélioré et leurs ovaires sont restés en bien meilleur état. Peut-être que les améliorations étaient liées à l'augmentation de la production d'IGF-1 et à sa régulation des hormones sexuelles. Mais, il est possible qu'une telle thérapie ait entraîné un rajeunissement de l'hypothalamus et, par conséquent, un rajeunissement du corps et de ses systèmes!En général, les approches développées sont assez intéressantes, mais elles sont sous-explorées. Cela concerne principalement la thérapie génique du système reproducteur masculin, où les effets à long terme de la thérapie, ainsi que les éventuels effets secondaires, n'ont pas été étudiés.Obésité liée à l'âgeUne autre pathologie liée à l'âge est une augmentation du poids corporel, ou plutôt du volume de graisse. L'obésité, d'une part, aggrave considérablement l'état de santé (par exemple, augmente le risque de diabète) et, d'autre part, rend une personne laide. La thérapie génique de cette pathologie ouvre donc de nouvelles perspectives tant pour la médecine que pour la cosmétologie.Il n'y a eu que 3 travaux sur la thérapie génique pour l'obésité chez les personnes âgées, et tous sont très intéressants. Dans 2 études pour réduire le poids a agi sur les centres de régulation du cerveau.Dans l'un des travaux, le gène du facteur neurotrophique GDNF a été introduit dans la région de la matière noire, ce qui contribue à la survie des neurones. En conséquence, les vieilles souris grasses ont perdu beaucoup de poids, ce qui est dû en partie au fait que les souris mangent moins et en partie au fait que la thérapie génique a conduit à l'activation de neurones hypothalamiques qui sécrètent de la corticotropine (CRH).Dans une autre étude, le gène Pomc, la proopiomélanocortine, précurseur des mélanocortines, qui sont importantes pour réguler l'équilibre énergétique et le métabolisme du glucose, a été introduit dans l'hypothalamus. Les expériences ont été réalisées sur de vieux rats gras qui, après thérapie, ont perdu beaucoup de poids. Il est intéressant de noter qu'au début, leur appétit a diminué de manière significative, mais s'est rétabli après un mois, ce qui n'a pas empêché une nouvelle perte de poids. La perte de poids est en partie due au fait que la thérapie a augmenté la dépense énergétique dans le tissu adipeux - elle s'est dissipée sous forme de chaleur. Il est également important que les rats améliorent également un certain nombre de paramètres de santé: l'équilibre des lipides et du glucose est normalisé et la sensibilité à l'insuline augmente.Et enfin, dans l'une des études, l'obésité musculaire a été traitée par un apport systémique du gène Wnt, qui contrôle le développement embryonnaire précoce, et dans les tissus adultes, il est nécessaire de maintenir les cellules souches et de réguler leur différenciation (transformation en cellules spécialisées). Le gène Wnt a été injecté à des rats adultes dans les muscles et surveillé leur santé au fil du temps. Fait intéressant, la thérapie a conduit de manière inattendue à de très bons résultats: les rats ont non seulement perdu du poids, même s'ils mangeaient des aliments très gras, mais ont également réduit le risque de pathologies liées à l'âge. Leur métabolisme du glucose s'est normalisé, le niveau de triglycérides dans le sang a diminué et, plus intéressant encore, la densité minérale des os a même augmenté!En général, je tiens à noter que les approches de la thérapie génique de l'obésité sont très prometteuses - en plus de la perte de poids, elles ont également observé des marqueurs de rajeunissement systémique: normalisation du glucose et du métabolisme des graisses, et même amélioration du tissu osseux! Apparemment, cela est dû au fait que dans chacun d'eux, ils ont essayé de traiter l'obésité avec des effets systémiques - rajeunir le système nerveux, normaliser l'équilibre hormonal ou affecter la voie des cellules souches.La visionDes méthodes de thérapie génique sont également en cours d'élaboration pour la déficience visuelle chez les personnes âgées, en particulier la dégénérescence maculaire liée à l'âge (DMLA), l'une des causes les plus courantes de perte de vision après 65 ans. officiellement reconnu comme une maladie. Elle est associée à une prolifération excessive des vaisseaux sanguins et à la mort des cellules visuelles - les photorécepteurs rétiniens.Tous les traitements de la DMLA utilisant la thérapie génique visent à supprimer la formation de vaisseaux sanguins - l'angiogenèse. Pour cela, en règle générale, ils inhibent le travail du principal stimulateur de l'angiogenèse - VEGF - facteur de croissance endothélial vasculaire.Par exemple, une section du gène du récepteur du VEGF, sFlt1, qui supprime le VEGF, est délivrée aux cellules. Cette approche a été mieux développée que tout le monde: non seulement des études sur des souris ont déjà été réalisées, mais les premières étapes d'essais cliniques chez des personnes atteintes de DMLA ont été lancées.Dans une étude publiée en 2015, 8 patients des deux sexes, âgés de 71 à 86 ans, ont participé. Le gène sFlt01.19 a été introduit dans la région des yeux et après 52 semaines, l'acuité visuelle s'est améliorée chez tous les patients. Aucun effet secondaire n'a été observé dans cette étude, ce qui ouvre des perspectives pour de nouveaux essais cliniques et l'introduction de médicaments dans la pratique clinique.Une autre approche de la thérapie génique de la DMLA vise également à supprimer la croissance vasculaire, mais en utilisant d'autres gènes - l'angiostatine et l'endostatine. Et il a également été efficace pour tester à la fois sur des lapins et sur des macaques.Ainsi, la thérapie génique de la DMLA est très efficace - et déjà au stade de la traduction en clinique. Cependant, en tant que cible, il utilise une voie plutôt spécifique d'angiogenèse et d'inflammation - le VEGF, qui est peu susceptible d'être intéressante pour la thérapie systémique du vieillissement. Il est intéressant de noter qu'il est utilisé pour traiter d'autres pathologies liées à l'âge, par exemple les troubles du système cardiovasculaire. Cependant, dans leur cas - le VEGF, au contraire, doit être activé!En général, la thérapie génique pour les pathologies liées à l'âge est un domaine assez développé par rapport à la thérapie génique pour le vieillissement, mais elle est incomparablement moins populaire que la thérapie génique pour toutes sortes de maladies. Rappelons que si environ 1415 essais cliniques ont été lancés sur la thérapie génique du cancer, seules 40 à 45 études ont été réalisées sur la thérapie génique pour les pathologies liées à l'âge, puis sur les souris, les rats et les singes. (Certes, des essais cliniques sont menés sur des patients atteints de DMLA, mais c'est parce que la DMLA est officiellement reconnue comme une maladie). Une telle «négligence» de la thérapie génique pour les pathologies liées à l'âge est apparemment associée à l'orientation générale de la médecine non pas sur la prévention des maladies, mais sur le traitement des maladies qui existent déjà.En ce qui concerne les travaux sur la thérapie génique des pathologies liées à l'âge, on peut noter qu'il existe des travaux prometteurs et de haute qualité, mais ils ne représentent pas plus du quart de toutes les études réalisées. Dans la plupart des travaux, la thérapie génique conduit à une amélioration assez modérée de l'état de santé (et, en règle générale, n'atteint pas le niveau des jeunes animaux), la durée de l'effet thérapeutique n'est pas étudiée et les effets secondaires ne sont pas étudiés.Mais il y en a aussi de très prometteurs, qui se distinguent par la qualité du travail. En particulier, beaucoup de ces travaux ont été effectués sur la thérapie génique des troubles cérébraux. Il s'agit par exemple de la thérapie génique du cerveau de vieux singes rhésus avec le gène NGF, un facteur de croissance nerveuse qui a rétabli le nombre de cellules nerveuses (neurones cholinergiques) au niveau des jeunes animaux! De nombreuses études prometteuses ont été menées sur la thérapie génique de l'obésité liée à l'âge. Ils ont non seulement entraîné une perte de poids, mais ont également amélioré tout un ensemble d'indicateurs de santé.En général, la thérapie génique des pathologies liées à l'âge me semble un moyen efficace de prévenir les maladies et de combattre la sénilité. Apparemment, il est particulièrement prometteur de le combiner avec une thérapie génique pour le vieillissement, comme, par exemple, Elizabeth Perrish l'a fait en introduisant un gène de télomérase avec un gène inhibiteur de la myostatine pour le rajeunissement musculaire.
Conclusion
En conclusion, on peut noter que bien que la thérapie génique du vieillissement soit encore un domaine scientifique très jeune, elle se développe activement dans diverses directions et inspire déjà de grandes promesses.Toutes les études sont encore au stade préclinique du test (sur des animaux ou des cellules modèles in vitro), cependant, la thérapie génique du vieillissement rattrape déjà des effets puissants et prolongeant la vie tels que la restriction nutritionnelle et les géroprotecteurs (par exemple la rapamycine ou la metformine).En examinant toute la variété des cibles et des approches de la thérapie génique, je veux les comparer et essayer de mettre en évidence les domaines de développement les plus prometteurs.Premièrement, il est beaucoup plus efficace de réaliser une thérapie génique du vieillissement que de viser des pathologies individuelles liées à l'âge. En effet, dans tous les travaux sur la thérapie génique du vieillissement, il n'y a pas seulement une prolongation de la vie, mais aussi un ralentissement du développement d'un certain nombre de pathologies liées à l'âge. Ainsi, dans les travaux de Maria Blasco sur la thérapie génique avec la télomérase, la vie des vieilles souris a non seulement augmenté de 20%, mais aussi augmenté la sensibilité à l'insuline, amélioré la coordination neuromusculaire, diminué le risque d'ostéoporose et le contenu des marqueurs moléculaires du vieillissement.Et Dongsheng Kai, en utilisant la thérapie hypothalamique avec le gène NF-kb, a non seulement permis de prolonger la vie de 10% chez la souris, mais aussi d'améliorer les performances mentales et la fonction musculaire. De plus, la structure des muscles, de la peau et des os de ces souris était également plus jeune que celle des animaux témoins (sans thérapie).Et le traitement d'une pathologie liée à l'âge distincte ne fait que réduire le risque d'un certain groupe de maladies, mais ne peut pas empêcher la mort d'autres maladies liées à l'âge.Deuxième point notable: parmi les approches de la thérapie génique du vieillissement, on peut distinguer celles qui affectent la plupart des cellules du corps et nécessitent un apport systémique, et celles qui se concentrent sur les structures régulant le vieillissement (par exemple l'hypothalamus). Le second est beaucoup plus facile et pratique à utiliser, et pour le moment, il semble plus facile à mettre en œuvre.Le fait est que l'exposition systémique est très difficile à réaliser, même avec l'état actuel des systèmes de transmission virale. Un vecteur introduit dans le sang est nécessaire pour pénétrer une partie importante des cellules dans tout le corps. Et bien que Maria Blasco ait brillamment réussi, il existe des preuves que d'autres laboratoires ne peuvent pas répéter son succès.Et dans le cas d'une thérapie hypothalamique, il est nécessaire que le gène ne pénètre que dans une petite zone du tissu cérébral. Et cela peut être facilement réalisé en injectant un vecteur avec le gène dans la région correspondante.Troisièmement, pour obtenir des résultats plus significatifs dans la thérapie génique du vieillissement, il est nécessaire de combiner différentes approches. Il existe de nombreuses preuves que l'impact sur plusieurs chemins de longévité à la fois donne un plus grand effet sur l'espérance de vie que l'impact sur eux individuellement. Par exemple, si vous désactivez le gène de l'hormone de croissance chez les souris, elles vivent 50% plus longtemps. Et si ces souris sont également limitées en nutrition, l'effet augmentera à 80%. Et l'extraordinaire longue durée de vie - un rat taupe nu - un rongeur qui vit 10 fois plus longtemps qu'une souris, s'en distingue par l'activation de tout un ensemble de voies de longévité: celles-ci incluent une résistance accrue au stress, une protection contre le cancer, la stabilité des molécules de protéines, une protection contre la neurodégénérescence, etc.Ainsi, afin de développer une thérapie génique qui prolonge considérablement la vie, il est nécessaire d'agir simultanément sur de nombreux chemins de longévité. Autrement dit, pour combiner les approches de la thérapie génique qui sont développées actuellement pour augmenter la stabilité du génome, rajeunir l'hypothalamus, détruire les cellules sénescentes, augmenter la résistance au stress, améliorer la fonction mitochondriale, maintenir des cellules souches de niche, etc.Si maintenant la thérapie avec un gène n'entraîne pas une augmentation de l'espérance de vie plus de 20%, nous espérons qu'à l'avenir, en raison de la thérapie complexe du vieillissement, il sera possible d'obtenir des résultats vraiment fantastiques.Auteur Anastasia ShubinaLittérature1.
http://www.wiley.com//legacy/wileychi/genmed/clinical/2. Slaymaker IM, Gao L, Zetsche B, Scott DA, Yan WX, Zhang F. Rationally engineered Cas9 nucleases with improved specificity. Science. 2016 Jan 1;351(6268):84–8. doi: 10.1126/science.aad5227. Epub 2015 Dec 1.
3. Anderson WF, Blaese RM, Culver K. The ADA human gene therapy clinical protocol: Points to Consider response with clinical protocol // Hum Gene Ther. — 1990. — v.1(3). — P.331–362.
4. Edelstein ML, Abedi MR, Wixon J., Edelstein RM Gene therapy clinical trials worldwide 1989–2004 — an overview // J Gene Med. — 2004. — v.6. — P.597–602.
5. Kay MA State-of-the-art gene-based therapies: the road ahead // Nat Rev Genet. — 2011. — v.12(5) — P. 316–28.
6. Greider, CW & Blackburn, EH (1985) «Identification of a specific telomere terminal transferase activity in Tetrahymena extracts.» Cell v.43, (2 Pt. 1) pp. 405–413.
7. Egan CA1, Savre-Train I, Shay JW, Wilson SE, Bourne WM. Analysis of telomere lengths in human corneal endothelial cells from donors of different ages. Invest Ophthalmol Vis Sci. 1998 Mar;39(3):648–53.
8. Kang MK, Guo W, Park NH. Replicative senescence of normal human oral keratinocytes is associated with the loss of telomerase activity without shortening of telomeres. Cell Growth Differ. 1998 Jan;9(1):85–95.
9. Ilmonen P, Panda B, Janina S, Dustin PJ, Michaela Th. Genetics of telomere length in wild derived house mice. Genetics of telomere length in wild derived house mice. August 21–23, 2014, Santa Clara, USA
10. Bodnar AG, Ouellette M., Frolkis M., Holt SE, Chiu CP, Morin GB, Harley CB, Shay JW, Lichtsteiner S., Wright WE Extension of life-span by introduction of telomerase into normal human cells // Science. — 1998. — v.279(5349). — P.349–52.
11. Jiang XR., Jimenez G., Chang E., Frolkis M., Kusler B., Sage M., Beeche M., Bodnar A., Wahl G., Tlsty T., Chiu CP. Telomerase expression in human somatic cells does not induce changes associated with a transformed phenotype // Nat. Genet. — 1999. — v. 21. — P. 111–114.
12. Chung SA, Wei AQ, Connor DE, Webb GC, Molloy T., Pajic M., Diwan AD Nucleus pulposus cellular longevity by telomerase gene therapy // Spine. — 2007. — v.32(11). — P.1188–96.
13. Bernardes de Jesus B., Vera E., Schneeberger K., Tejera AM, Ayuso E., Bosch F., Blasco MA Telomerase gene therapy in adult and old mice delays aging and increases longevity without increasing cancer // EMBO Mol Med. — 2012. — .v.4(8). — P.691–704.
14. Tomás-Loba A., Flores I., Fernández-Marcos PJ, Cayuela ML, Maraver A., Tejera A., Borrás C, Matheu A., Klatt P., Flores JM, Viña J., Serrano M., Blasco MA Telomerase reverse transcriptase delays aging in cancer-resistant mice // Cell. — 2008. — v.135(4). — P.609–22.
15. Bär C, Bernardes de Jesus B, Serrano R, Tejera A, Ayuso E, Jimenez V, Formentini I, Bobadilla M, Mizrahi J, de Martino A, Gomez G, Pisano D, Mulero F, Wollert KC, Bosch F, Blasco MA. Telomerase expression confers cardioprotection in the adult mouse heart after acute myocardial infarction. Nat Commun. 2014 Dec 18;5:5863. doi: 10.1038/ncomms6863.
16. Zhang G, Li J, Purkayastha S, Tang Y, Zhang H, Yin Y, Li B, Liu G, Cai D. Hypothalamic programming of systemic ageing involving IKK-β, NF-κB and GnRH. Nature. 2013. v.497(7448). P.211–6.
17. Michalkiewicz M, Knestaut KM, Bytchkova EY, Michalkiewicz T (2003) Hypotension and reduced catecholamines in neuropeptide Y transgenic rats. Hypertension 41(5): 1056–1062.
18. Aveleira CA, Botelho M, Carmo-Silva S, Pascoal JF, Ferreira-Marques M, Nóbrega C, Cortes L, Valero J, Sousa-Ferreira L, Álvaro AR, Santana M, Kügler S, Pereira de Almeida L, Cavadas C. Neuropeptide Y stimulates autophagy in hypothalamic neurons Proc Natl Acad Sci US A. 2015 Mar 31;112(13):E1642–51. doi: 10.1073/pnas.1416609112. Epub 2015 Mar 16.
19. Baranowska B, et al. (2006) Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol 57(Suppl 6):55–61.
20. Conti B, Sanchez-Alavez M, Winsky-Sommerer R, Morale MC, Lucero J, Brownell S, Fabre V, Huitron-Resendiz S, Henriksen S, Zorrilla EP, de Lecea L, Bartfai T. Transgenic mice with a reduced core body temperature have an increased life span. Science. 2006. v314(5800). P825–8.
21. Wu JJ, Liu J, Chen EB, Wang JJ, Cao L, Narayan N, Fergusson MM, Rovira II, Allen M, Springer DA, Lago CU, Zhang S, DuBois W, Ward T, deCabo R, Gavrilova O, Mock B, Finkel T. Increased mammalian lifespan and a segmental and tissue-specific slowing of aging after genetic reduction of mTOR expression. Cell Rep. 2013 Sep 12;4(5):913–20. doi: 10.1016/j.celrep.2013.07.030. Epub 2013 Aug 29.
22. Yan L, Vatner DE, O'Connor JP, Ivessa A, Ge H, Chen W, Hirotani S, Ishikawa Y, Sadoshima J, Vatner SF. Type 5 adenylyl cyclase disruption increases longevity and protects against stress. Cell. 2007 Jul 27;130(2):247–58.
23. Yamashita et.al. (2012). SIRT1 prevents replicative senescence of normal human umbilical cord fibroblast through potentiating the transcription of human telomerase reverse transcriptase gene. Biochemical and Biophysical Research Communications. 417: 630–634.
24. Yuan et.al. (2012). SIRT1 is required for long-term growth of human mesenchymal stem cells. J Mol Med. 90:389–400
25. Herranz et al. (2010) “Sirt1 improves healthy ageing and protects from metabolic syndrome-associated cancer.” Nat Commun 1:3
26. Satoh et al. (2013) “Sirt1 extends life span and delays aging in mice through the regulation of Nk2 homeobox 1 in the DMH and LH.” Cell Metab. 18(3):416–430
27. Ortega-Molina A, Efeyan A, Lopez-Guadamillas E, Muñoz-Martin M, Gómez-López G, Cañamero M, Mulero F, Pastor J, Martinez S, Romanos E, Mar Gonzalez-Barroso M, Rial E, Valverde AM, Bischoff JR, Serrano M. Pten positively regulates brown adipose function, energy expenditure, and longevity. Cell Metab. 2012 Mar 7;15(3):382–94. doi: 10.1016/j.cmet.2012.02.001.
28. Wu et.al. (2015). Overexpression of Sirtuin 6 suppresses cellular senescence and NF-κB mediated inflammatory responses in osteoarthritis development. Sci Rep. 5: 17602.
29. Leiser SF, Miller RA. Nrf2 signaling, a mechanism for cellular stress resistance in long-lived mice. Mol Cell Biol. 2010 Feb;30(3):871–84. doi: 10.1128/MCB.01145–09. Epub 2009 Nov 23.
30. Li et.al. (2005). Stabilization of Nrf2 by tBHQ Confers Protection against Oxidative Stress-Induced Cell Death in Human Neural Stem Cells. Toxicol. Sci. 83 (2): 313–328.
31. Kanninen et.al. (2009). Intrahippocampal injection of a lentiviral vector expressing Nrf2 improves spatial learning in a mouse model of Alzheimer's disease. Proc Natl Acad Sci US A. 106 (38): 16505–16510.
32. Wang et.al. (2014). CD36 upregulation mediated by intranasal LV-NRF2 treatment mitigates hypoxia-induced progression of Alzheimer's-like pathogenesis. Antioxid Redox Signal. 21 (16): 2208–2230.
33. Minagawa et.al. (2011). Accelerated epithelial cell senescence in IPF and the inhibitory role of SIRT6 in TGF-β-induced senescence of human bronchial epithelial cells. Am J Physiol Lung Cell Mol Physiol. 300 (3): L391–401.
34. Takasaka et.al. (2014).Autophagy induction by SIRT6 through attenuation of insulin-like growth factor signaling is involved in the regulation of human bronchial epithelial cell senescence. J Immunol.192 (3): 958–968.
35. Liu et.al. (2014). Oxidative stress induces endothelial cell senescence via downregulation of Sirt6. Biomed Res Int. 2014: 902842.
36. Mao et.al. (2012). Sirtuin 6 (SIRT6) rescues the decline of homologous recombination repair during replicative senescence. Proc Natl Acad Sci USA. 109 (29): 11800–5.
37. Xu et.al. (2015). SIRT6 rescues the age related decline in base excision repair in a PARP1-dependent manner. Cell Cycle. 14 (2): 269–276.
38. Chung et.al. (2015). Molecular Insights into SIRT1 Protection Against UV BInduced Skin Fibroblast Senescence by Suppression of Oxidative Stress and p53 Acetylation. J Gerontol A Biol Sci Med Sci. 70 (8): 959–968.
39. Conti B, Sanchez-Alavez M, Winsky-Sommerer R, Morale MC, Lucero J, Brownell S, Fabre V, Huitron-Resendiz S, Henriksen S, Zorrilla EP, de Lecea L, Bartfai T. Transgenic mice with a reduced core body temperature have an increased life span. Science. 2006. v314(5800). P825–8.
40. Kanfi Y, Naiman S, Amir G, Peshti V, Zinman G, Nahum L, Bar-Joseph Z, Cohen HY. The sirtuin SIRT6 regulates lifespan in male mice. Nature. 2012 Feb 22;483(7388):218–21. doi: 10.1038/nature10815.
41. Campisi J. Aging, cellular senescence, and cancer. Annu Rev Physiol. 2013;75:685–705. doi: 10.1146/annurev-physiol-030212–183653. Epub 2012 Nov 8.
42. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232–6. doi: 10.1038/nature10600.
43. Rera et al. (2011) “Modulation of longevity and tissue homeostasis by the Drosophila PGC-1 homolog.” Cell Metab. 14(5):623–634.
44. Zhao et.al. (2013). The effect of overexpression of PGC-1a on the mtDNA4834 common deletion in a rat cochlear marginal cell senescence model. Hearing Research. 296: 13–24
45. Jiang XY, Lu DB, Jiang YZ, Zhou LN, Cheng LQ, Chen B. PGC-1α prevents apoptosis in adipose-derived stem cells by reducing reactive oxygen species production in a diabetic microenvironment. Diabetes Res Clin Pract. 2013 Jun;100(3):368–75. doi: 10.1016/j.diabres.2013.03.036. Epub 2013 Apr 22.
46. Liu XP, Gao H, Huang XY, Chen YF, Feng XJ, He YH, Li ZM, Liu PQ. Peroxisome proliferator-activated receptor gamma coactivator 1 alpha protects cardiomyocytes from hypertrophy by suppressing calcineurin-nuclear factor of activated T cells c4 signaling pathway. Transl Res. 2015 Nov;166(5):459–473.e3. doi: 10.1016/j.trsl.2015.06.003. Epub 2015 Jun 9.
47. Hollinger K, Selsby JT. PGC-1α gene transfer improves muscle function in dystrophic muscle following prolonged disease progress. Exp Physiol. 2015 Oct;100(10):1145–58. doi: 10.1113/EP085339. Epub 2015 Sep 8.
48. De Luca G, Ventura I, Sanghez V, Russo MT, Ajmone-Cat MA, Cacci E, Martire A, Popoli P, Falcone G, Michelini F, Crescenzi M, Degan P, Minghetti L, Bignami M, Calamandrei G. Prolonged lifespan with enhanced exploratory behavior in mice overexpressing the oxidized nucleoside triphosphatase hMTH1. Aging Cell. 2013 Aug;12(4):695–705. doi: 10.1111/acel.12094. Epub 2013 May 30.
49. Wang J, Geesman GJ, Hostikka SL, Atallah M, Blackwell B, Lee E, Cook PJ, Pasaniuc B, Shariat G, Halperin E, Dobke M, Rosenfeld MG, Jordan IK, Lunyak VV. Inhibition of activated pericentromeric SINE/Alu repeat transcription in senescent human adult stem cells reinstates self-renewal. Cell Cycle. 2011 Sep 1;10(17):3016–30. Epub 2011 Sep 1.
50. SNEV overexpression extends the life span of human endothelial cells. Voglauer R, Chang MW, Dampier B, Wieser M, Baumann K, Sterovsky T, Schreiber M, Katinger H, Grillari J. Exp Cell Res. 2006 Apr 1;312(6):746–59. Epub 2006 Jan 4.
51. Wood J, Nan Jiang, Brian C Jones, Stephen L Helfand Maintaining repressive heterochromatin extends lifespan in drosophila. Abstracts of papers presented at the 2014 meeting on Molecular genetics of aging, September 29 — October 3, 2014, Cold Spring Harbor, USA.
52. Sidler et.al. (2014). A role for SUV39H1-mediated H3K9 trimethylation in the control of genome stability and senescence in WI38 human diploid lung fibroblasts. Aging 6 (7): 545–563.
53. Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, McGuinness OP, Chikuda H, Yamaguchi M, Kawaguchi H, Shimomura I, Takayama Y, Herz J, Kahn CR, Rosenblatt KP, Kuro-o M. Suppression of aging in mice by the hormone Klotho. Science. 2005 Sep 16;309(5742):1829–33. Epub 2005 Aug 25.
54. Kuro-o M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugi T, Ohyama Y, Kurabayashi M, Kaname T, Kume E, Iwasaki H, Iida A, Shiraki-Iida T, Nishikawa S, Nagai R, Nabeshima YI. Mutation of the mouse klotho gene leads to a syndrome resembling ageing. Nature. 1997 Nov 6;390(6655):45–51.
55. Wang Y, Kuro-o M, Sun Z. Klotho gene delivery suppresses Nox2 expression and attenuates oxidative stress in rat aortic smooth muscle cells via the cAMP-PKA pathway. Aging Cell. 2012 Jun;11(3):410–7. doi: 10.1111/j.1474–9726.2012.00796.x. Epub 2012 Feb 22.
56. Wang et.al. (2009). Klotho Gene Delivery Prevents the Progression of Spontaneous Hypertension and Renal Damage. Hypertension. 54 (4): 810.
57. Zhou et.al. (2015). Klotho Ameliorates Kidney Injury and Fibrosis and Normalizes Blood Pressure by Targeting the Renin-Angiotensin System. Am J Pathol. 185 (12): 3211–3223.
58. Deng M, Luo Y, Li Y, Yang Q, Deng X, Wu P, Ma H. Klotho gene delivery ameliorates renal hypertrophy and fibrosis in streptozotocin-induced diabetic rats by suppressing the Rho-associated coiled-coil kinase signaling pathway. Mol Med Rep. 2015 Jul;12(1):45–54. doi: 10.3892/mmr.2015.3367. Epub 2015 Feb 17.
59. Shu L, Chen M, Wen M, Huang C, Xu J. Study of klotho gene transfer for the protective effect of the coronary of diabetic rats. Pak J Pharm Sci. 2014 Nov;27(6 Suppl):2095–9.
60. Dena B. Dubal et al., Life Extension Factor Klotho Enhances Cognition, Cell Reports, 2014, DOI: 10.1016/j.celrep.2014.03.076
61. Saito Y, Nakamura T, Ohyama Y, Suzuki T, Iida A, Shiraki-Iida T, Kuro-o M, Nabeshima Y, Kurabayashi M, Nagai R. In vivo klotho gene delivery protects against endothelial dysfunction in multiple risk factor syndrome. Biochem Biophys Res Commun. 2000 Sep 24;276(2):767–72.
62. Brown KA, Chu Y., Lund DD, Heistad DD, Faraci FM Gene transfer of extracellular superoxide dismutase protects against vascular dysfunction with aging // Am J Physiol Heart Circ Physiol. — 2006. — v.290(6). — H2600–5.
63. Schmidt U., del Monte F., Miyamoto MI, Matsui T., Gwathmey JK, Rosenzweig A., Hajjar RJ Restoration of diastolic function in senescent rat hearts through adenoviral gene transfer of sarcoplasmic reticulum Ca(2+)-ATPase // Circulation. — 2000. — v.101(7). — P. 790–6.
64. Schmidt U., Zhu X., Lebeche D., Huq F., Guerrero JL, Hajjar RJ In vivo gene transfer of parvalbumin improves diastolic function in aged rat hearts // Cardiovasc Res. — 2005. — v.66(2). — P.318–23.
65. Wang H., Keiser JA, Olszewski B., Rosebury W., Robertson A., Kovesdi I., Gordon D. Delayed angiogenesis in aging rats and therapeutic effect of adenoviral gene transfer of VEGF // Int J Mol Med. — 2004. — v.13(4). — P.581–7.
66.
https://www.heart.org/idc/groups/ahamah-public/@wcm/@sop/@smd/documents/downloadable/ucm_470704.pdf67. Renault et.al. (2013). Hedgehog-Dependent Regulation of Angiogenesis and Myogenesis Is Impaired in Aged Mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 33: 2858–2866
68. Tonne et.al. (2014). Cardiac BNP gene delivery prolongs survival in aged spontaneously hypertensive rats with overt hypertensive heart disease. Aging (Albany NY). 6 (4): 311–319.
69. Wang QL., Han QL., Kang J., Gou S.-H., Wang L.-Zh. Polyethylenimine-mediated BMP-7 gene transfection promotes fracture healing in elderly rats // Academic Journal of Second Military Medical University. — 2008. — v.28(5). — P.514–518.
70. Yue B., Lu B., Dai KR, Zhang XL, Yu CF, Lou JR, Tang TT BMP2 gene therapy on the repair of bone defects of aged rats // Calcif Tissue Int. — 2005. — v.77(6). — P.395–403.
71. Liu B, Tang J, Ji J, Gu J. Prevention of osteoporosis in ovariectomized mice by electroporational gene transfer of parathyroid hormone. Biotechnol Lett. 2003 Dec;25(24):2117–22.
72. Xie H, Xie PL, Luo XH, Wu XP, Zhou HD, Tang SY, Liao EY. Omentin-1 exerts bone-sparing effect in ovariectomized mice. Osteoporos Int. 2012 Apr;23(4):1425–36. doi: 10.1007/s00198–011–1697–8. Epub 2011 Jul 14.
73. Chen W, Baylink DJ, Brier-Jones J, Neises A, Kiroyan JB, Rundle CH, Lau KH, Zhang XB. PDGFB-based stem cell gene therapy increases bone strength in the mouse. Proc Natl Acad Sci US A. 2015 Jul 21;112(29):E3893–900. doi: 10.1073/pnas.1501759112. Epub 2015 Jul 6.
74. Kostenuik et.al. (2004). Gene therapy with human recombinant osteoprotegerin reverses established osteopenia in ovariectomized mice. Bone 34: 656–664.
75. Yin et.al. (2015). Adenoviral vector-mediated overexpression of osteoprotegerin accelerates osteointegration of titanium implants in ovariectomized rats. Gene Ther. 22 (8): 636–644.
76. Paul et.al. (2003). Potential Use of Sox9 Gene Therapy for Intervertebral Degenerative Disc Disease. Spine (Phila Pa 1976). 28 (8): 755–763.
77. Chen et.al. (2008). Suppression of early experimental osteoarthritis by in vivo delivery of the adenoviral vector-mediated NF-kBp65-specific siRNA. Osteoarthritis and Cartilage. 16: 174–184
78. Hsieh et.al. (2010). Intraarticular Gene Transfer of Thrombospondin-1 Suppresses the Disease Progression of Experimental Osteoarthritis. J Orthop Res. 28 (10): 1300–1306.
79. Chu et.al. (2013). Protective effect of lentivirus-mediated siRNA targeting ADAMTS-5 on cartilage degradation in a rat model of osteoarthritis. INTERNATIONAL JOURNAL OF MOLECULAR MEDICINE 31: 1222–1228.
80. Pi et.al. (2015). Intra-articular delivery of anti-Hif-2α siRNA by chondrocyte-homing nanoparticles to prevent cartilage degeneration in arthritic mice. Gene Therapy. 22 (6): 439–448.
81. Wu et.al. (2015). Overexpression of Sirtuin 6 suppresses cellular senescence and NF-κB mediated inflammatory responses in osteoarthritis development. Sci Rep. 5: 17602.
82. Collins-Hooper et.al. (2014). Propeptide-mediated inhibition of myostatin increases muscle mass through inhibiting proteolytic pathways in aged mice. J Gerontol A Biol Sci Med Sci. 69 (9): 1049–1059.
83. Sun et.al. (2010). Declining expression of a single epithelial cell-autonomous gene accelerates age-related thymic involution. Aging Cell. 9 (3): 347–357.
84. Chung et.al. (2014). Engineering the human thymic microenvironment to support thymopoiesis in vivo. Stem Cells. 32 (9): 2386–2396.
85. Fayad R., Zhang H., Quinn D., Huang Y., Qiao L. Oral administration with papillomavirus pseudovirus encoding IL-2 fully restores mucosal and systemic immune responses to vaccinations in aged mice // J Immunol. — 2004. — v.173(4). –P.2692–8.
86. Gerstein H., Lindstrom MJ, Burger C. Gene delivery of Homer1c rescues spatial learning in a rodent model of cognitive aging // Neurobiol Aging. — 2013. — v.34(8). — P.1963–70.
87. Zhang GR, Liu M., Cao H., Kong L., Wang X., O'Brien JA, Wu SC, Cook RG, Geller AI Improved spatial learning in aged rats by genetic activation of protein kinase C in small groups of hippocampal neurons // Hippocampus. — 2009. — v.19(5). — P.413–23.
88. Sun M., Kong L., Wang X., Holmes C., Gao Q., Zhang W., Pfeilschifter J., Goldstein DS, Geller AI Coexpression of tyrosine hydroxylase, GTP cyclohydrolase I, aromatic amino acid decarboxylase, and vesicular monoamine transporter-2 from a helper virus-free HSV-1 vector supports high-level, long-term biochemical and behavioral correction of a rat model of Parkinson's disease // Hum Gene Ther. — 2004. — v.15. –P.1177–1196.
89. Mouravlev A., Dunning J., Young D., During MJ Somatic gene transfer of cAMP response element-binding protein attenuates memory impairment in aging rats // Proc Natl Acad Sci US A. — 2006. — v.103(12). — P.4705–10.
90. Pertusa M., García-Matas S., Mammeri H., Adell A., Rodrigo T., Mallet J., Cristòfol R., Sarkis C., Sanfeliu C. Expression of GDNF transgene in astrocytes improves cognitive deficits in aged rats // Neurobiol Aging. — 2008. — v.29(9). — P.1366–79.
91. Nishida F., Morel GR, Hereñú CB, Schwerdt JI, Goya RG, Portiansky EL Restorative effect of intracerebroventricular insulin-like growth factor-I gene therapy on motor performance in aging rats // Neuroscience. — 2011. — v.177. — P.195–206.
92. Nagahara AH, Bernot T., Moseanko R., Brignolo L., Blesch A., Conner JM, Ramirez A., Gasmi M., Tuszynski MH Long-term reversal of cholinergic neuronal decline in aged non-human primates by lentiviral NGF gene delivery // Exp Neurol. — 2009. — v.215(1). — P.153–9.
93. Rodríguez SS, Schwerdt JI, Barbeito CG, Flamini MA, Han Y., Bohn MC, Goya RG Hypothalamic IGF-I gene therapy prolongs estrous cyclicity and protects ovarian structure in middle-aged female rats // Endocrinology. — 2013. — v.154(6). — P.2166–73.
94. Bivalacqua TJ, Armstrong JS, Biggerstaff J., Abdel-Mageed AB, Kadowitz PJ, Hellstrom WJ, Champion HC Gene transfer of extracellular SOD to the penis reduces O2-* and improves erectile function in aged rats // Am J Physiol Heart Circ Physiol. — 2003. — v.284(4). — H1408–21.
95. Bivalacqua TJ, Deng W., Kendirci M., Usta MF, Robinson C., Taylor BK, Murthy SN, Champion HC, Hellstrom WJG, Kadowitz PJ Mesenchymal stem cells alone or ex vivo gene modified with endothelial nitric oxide synthase reverse age-associated erectile dysfunction // Am J Physiol Heart Circ Physiol. — 2007. — v.292. — H1278–H1290.
96. Bivalacqua TJ, Burnett AL, Hellstrom WJ, Champion HC Overexpression of arginase in the aged mouse penis impairs erectile function and decreases eNOS activity: influence of in vivo gene therapy of anti-arginase // Am J Physiol Heart Circ Physiol. — 2007. — v.292(3). — H1340–51. a.
97. Bivalacqua TJ, Champion HC, Mehta YS, Abdel-Mageed AB, Sikka SC, Ignarro LJ, Kadowitz PJ, Hellstrom WJ Adenoviral gene transfer of endothelial nitric oxide synthase (eNOS) to the penis improves agerelated erectile dysfunction in the rat // Int J Impot Res. — 2000. — Suppl 3: S8–S17.
98. So I., Chae MR, Lee SW Gene transfer of the K(ATP) channel restores age-related erectile dysfunction in rats // BJU Int. — 2007. — v.100(5). — P.1154–60.
99. Melman A., Biggs G., Davies K., Zhao W., Tar MT, Christ GJ Gene transfer with a vector expressing Maxi-K from a smooth muscle-specific promoter restores erectile function in the aging rat // Gene Ther. — 2008. — v.15(5). — P.364–70.
100. Tümer N., Scarpace PJ, Dogan MD, Broxson CS, Matheny M., Yurek DM, Peden CS, Burger C., Muzyczka N., Mandel RJ Hypothalamic rAAV-mediated GDNF gene delivery ameliorates age-related obesity // Neurobiol Aging. — 2006. — v.27(3). — P.459–70.
101. Boghossian S., Ueno N., Dube MG, Kalra P., Kalra S. Leptin gene transfer in the hypothalamus enhances longevity in adult monogenic mutant mice in the absence of circulating leptin // Neurobiol Aging. — 2007. — v.28(10). — P.1594–604.
102. Aslanidi G1, Kroutov V, Philipsberg G, Lamb K, Campbell-Thompson M, Walter GA, Kurenov S, Ignacio Aguirre J, Keller P, Hankenson K, Macdougald OA, Zolotukhin S. Ectopic expression of Wnt10b decreases adiposity and improves glucose homeostasis in obese rats. Am J Physiol Endocrinol Metab. 2007 Sep;293(3):E726–36. Epub 2007 Jun 19.
103. Manfredsson FP1, Tumer N, Erdos B, Landa T, Broxson CS, Sullivan LF, Rising AC, Foust KD, Zhang Y, Muzyczka N, Gorbatyuk OS, Scarpace PJ, Mandel RJ. Nigrostriatal rAAV-mediated GDNF overexpression induces robust weight loss in a rat model of age-related obesity. Mol Ther. 2009 Jun;17(6):980–91. doi: 10.1038/mt.2009.45. Epub 2009 Mar 10.
104. MacLachlan et.al. (2011). Preclinical Safety Evaluation of AAV2-sFLT01 — A Gene Therapy for Age-related Macular Degeneration. The American Society of Gene & Cell Therapy. 19 (2): 326–334
105. Binley et.al. (2012). Safety and Biodistribution of an Equine Infectious Anemia Virus-Based Gene Therapy, RetinoStat, for Age-Related Macular Degeneration. HUMAN GENE THERAPY. 23: 980–991
106. Rakoczy et.al. (2015). Gene therapy with recombinant adeno-associated vectors for neovascular age-related macular degeneration: 1 year follow-up of a phase 1 randomised clinical trial. Lancet.
107. Hwangbo DS, Gershman B, Tu MP, Palmer M, Tatar M. Drosophila dFOXO controls lifespan and regulates insulin signalling in brain and fat body. Nature. 2004 Jun 3;429(6991):562–6.
Liu et.al. (2015). Senescence of human skin-derived precursors regulated by Akt-FOXO3-p27KIP1/p15INK4b signaling. Cell. M