Le médicament de thérapie génique Luxturna, développé par Spark Therapeutics, aide à restaurer la vision chez les patients atteints d'une forme héréditaire de cécité.
La dose de virus remplis d'ADN injectée directement dans les yeux est à quoi ressemble la première thérapie génique autorisée aux États-Unis pour traiter une maladie génétique. La résolution d'un tel médicament est un moment important pour la région criblée de hauts et de bas, depuis que la première étude de thérapie génique a commencé il y a près de trois décennies.
Luxturna est la troisième thérapie génique approuvée cette année. En août, l’agence a approuvé Kymriah de Novartis (immunothérapie par cellules CAR-T, dans laquelle les cellules immunitaires d’un patient sont retirées, modifiées à l’extérieur du corps, puis retournées dans la circulation sanguine pour lutter contre la leucémie). La deuxième immunothérapie à cellules CAR-T approuvée était Yescarta de Gilead Sciences. Contrairement à ceux cités, Luxturna est le premier médicament qui correspond à la perception «traditionnelle» de la thérapie génique, lorsque des virus remplis d'ADN sont introduits directement dans l'organisme. À ce jour, plus de 600 essais cliniques utilisant la thérapie génique sont en cours aux États-Unis.
Les origines de Luxturna ont commencé avec les études de Jean Bennet à l'Université de Pennsylvanie dans les années 1990. En 2000, elle a testé la thérapie génique pour traiter les maladies génétiques rétiniennes chez les chiens. Cependant, il y avait des difficultés avec un financement supplémentaire après les décès de patients largement médiatisés dans d'autres essais cliniques de thérapie génique. Bennett s'est ensuite associé à l'Hôpital pour enfants de Philadelphie, qui a décidé de commercialiser la technologie en fournissant 50 millions de dollars pour lancer Spark Therapeutics en 2013.
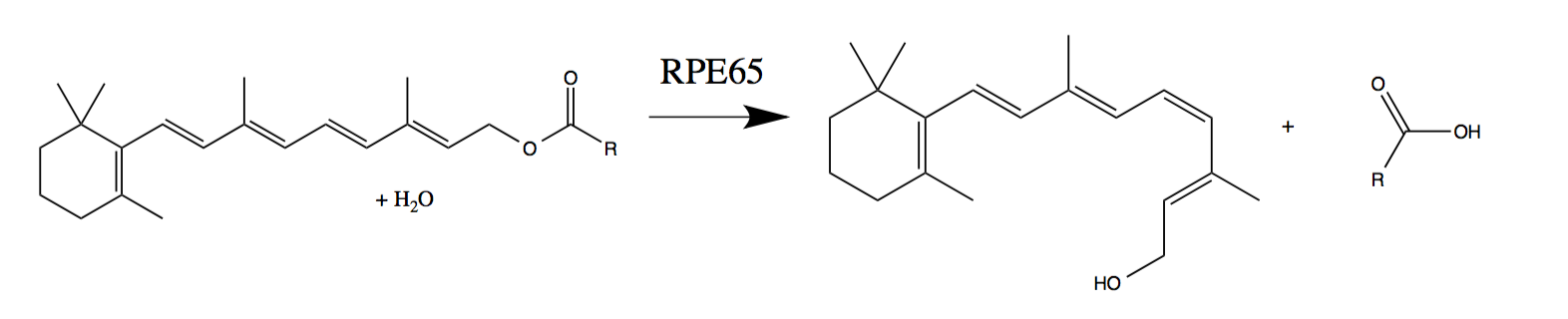
Luxturna améliore la vision chez les personnes présentant une mutation du gène RPE65, qui code pour une enzyme importante pour la vision.
L'exposition à la lumière entraîne la transition d'un cis-rétinien «serré» vers un trans-rétinien «expansé». Ce changement physique déclenche le signal au cerveau. Pour recommencer le cycle, l'enzyme RPE65 renvoie le trans-rétinien au cis-rétinien. Cependant, les personnes qui ont une mutation génétique qui inhibe la production de RPE65 ne peuvent pas "faire un cycle". Cela conduit à une déficience visuelle, qui commence généralement dans la petite enfance ou l'enfance et conduit à une cécité presque totale.
Régénération des cellules photosensibles avec une enzyme RPE65 fonctionnant normalement (phototransduction du trans-rétinol en 11-cis-rétinien -
wiki ):
Bien que de nombreuses mutations dans RPE65 puissent conduire à la cécité, Luxturna devrait en théorie toutes les traiter. Le produit contient une copie complète du RPE65, emballé dans un virus adéno-associé, nécessaire au transfert d'ADN aux cellules rétiniennes pour obtenir une enzyme entièrement fonctionnelle.
L'outil est destiné à une thérapie unique, lorsque le chirurgien injecte une solution contenant environ 150 milliards de particules virales d'ADN rempli directement sous la rétine de chaque œil. Des tests sur des obstacles avec différents niveaux d'éclairage ont montré que le traitement améliorait la vue des patients.
Selon la FDA, 1 000 à 2 000 patients atteints de mutations RPE65 aux États-Unis pourraient bénéficier de Luxturna. Cependant, le prix élevé du médicament peut être un problème, même pour un petit nombre de patients, pour recevoir une thérapie. Le prix n'a pas encore été divulgué, mais selon une déclaration du PDG de Spark, le coût de la thérapie pourrait dépasser 1 million de dollars par patient.
Addition, ancienne vidéo avec démonstration animée de l'administration de médicaments:
En savoir plusCe que les personnes atteintes de cette forme de cécité peuvent voir:
Jean Bennett et une démonstration du succès de la thérapie sur l'exemple d'un enfant avec des problèmes de travail RPE65: