Les protéines jouent un rôle crucial dans tous les organismes vivants, remplissant de nombreuses fonctions différentes. Comme vous le savez, ils sont composés d'acides aminés. Afin de remplir leurs fonctions, les protéines doivent être non seulement une chaîne de certains acides aminés, mais avoir une certaine forme spatiale, c'est-à-dire être correctement ajustées dans l'espace. Pour diverses raisons, un dysfonctionnement peut se produire dans le repliement normal de la protéine dans la structure souhaitée. Ensuite, au lieu de protéines mal repliées, qui ont tendance à s'unir en grappes, les agrégats de protéines sont des fibrilles amyloïdes. Le plus célèbre de ces agrégats est la β-amyloïde (Aβ, Abeta), probablement associée au développement de neuropathologies, ainsi que certains types de cancer et l'une des causes de démence chez les personnes atteintes du syndrome de Down.
Ces structures protéiques ont un diamètre d'environ 5 à 10 nm et une longueur pouvant atteindre 800 nm, et se composent de deux ou plusieurs filaments multidirectionnels parallèles qui forment une structure spécifique - la conformation croisée bêta croisée. C'est cette structure qui détermine la propriété optique spécifique de l'amyloïde - la capacité de biréfringence. Et la découverte de cette propriété est à la base du diagnostic de l'amylose. La microscopie des préparations colorées au Congo rouge dans la lumière polarisée amyloïde change la couleur rouge en une lueur verte [1].
Les auteurs du concept SENS qualifient les accumulateurs de protéines anormales de «débris extracellulaires» (débris extracellulaires) et déterminent l'une des causes du vieillissement, ce qui semble assez juste. Les fibrilles amyloïdes, en raison de leur structure, ne sont pas soumises à l'action d'enzymes spéciales qui décomposent les protéines (protéases), et ont donc la propriété de s'accumuler dans les tissus du corps, perturbant leur travail. Les propriétés structurelles et physico-chimiques de l'amyloïde dépendent de la principale protéine précurseur, dont la teneur en fibrilles est d'environ 80%, ce qui détermine un trait spécifique pour chaque type d'amylose. Le terme amylose fait référence à un groupe de maladies héréditaires ou acquises associées au dépôt extracellulaire de fibrilles de protéines insolubles qui provoquent des troubles structurels des tissus et des dysfonctionnements d'organes. Actuellement, plus de 20 protéines précurseurs amyloïdogènes et le même nombre de variantes cliniques de l'amylose sont connues. En plus de la β-amyloïde bien connue, il existe une amyloïde AA associée à la polyarthrite rhumatoïde, aux maladies cardiaques, aux maladies rénales et à l'inflammation intestinale, une amyloïde AIAPP impliquée dans la pathogenèse du diabète sucré de type 2, etc. [2].
 β-amyloïde.
β-amyloïde.Les auteurs de SENS voient un moyen de résoudre le problème de l'accumulation d'agrégats de protéines en utilisant des anticorps spécialisés catalytiquement actifs, les soi-disant abzymes (abzyme anglaise, enzyme enzyme), qui sont sélectionnés spécifiquement pour les amyloïdes et les retirent du tissu. Récemment, une méthode prometteuse a été développée dans le cadre de cette approche. Un sous-ensemble d'anticorps humains a été découvert qui a une activité catalytique contre un antigène spécifique, le brisant en fragments plus petits et moins nocifs, plutôt que de le capturer pour élimination ou destruction par d'autres cellules immunitaires. L'utilisation de ces nouveaux anticorps catalytiques comme thérapies ciblant les amyloïdes offre des avantages potentiels par rapport aux anticorps séquestrants utilisés dans d'autres vaccins amyloïdes. La première est qu'une réduction de dose est nécessaire pour éliminer efficacement les agrégats extracellulaires des tissus. En effet, les anticorps séquestrants peuvent capturer puis transporter une seule molécule amyloïde à la fois. Pendant que les abzymes se lient à la molécule amyloïde, broyez-la puis passez à la suivante l'une après l'autre, permettant à chaque molécule d'anticorps de détruire rapidement plusieurs molécules amyloïdes. Un autre est que les anticorps catalytiques appartiennent à une classe qui est transportée plus efficacement à travers la barrière hémato-encéphalique qui protège notre cerveau, tandis que la séquestration des anticorps est plus difficile à surmonter cette barrière [3].
L'amyloïde β-amyloïde la plus célèbre et la mieux étudiée aujourd'hui, que de nombreux chercheurs attribuent à la maladie d'Alzheimer. Cette pathologie a été décrite il y a plus d'un siècle par A. Alzheimer, qui a été le premier à indiquer le principal symptôme pathomorphologique de cette maladie - des plaques séniles insolubles trouvées dans le cerveau des morts qui ont souffert de cette maladie. Aujourd'hui, dans le monde, plus de 40 millions de personnes ont un diagnostic de maladie d'Alzheimer - la probabilité de développer cette pathologie double tous les cinq ans après 65 ans. Et les estimations à long terme de l'OMS concernant l'augmentation massive du nombre de ces patients au cours des prochaines décennies sont extrêmement pessimistes.
Il est connu que les plaques insolubles dans le cerveau des patients sont principalement formées par le peptide β-amyloïde (Aβ), qui a un poids moléculaire de 4 kDa et une longueur d'environ 40 résidus d'acides aminés. Aβ est un fragment de la protéine transmembranaire de la protéine précurseur amyloïde (protéine précurseur amyloïde, APP), qui se trouve dans de nombreux tissus du corps, y compris dans les synapses des neurones. L'APP est impliquée dans certains processus physiologiques associés à la neuroplasticité, à la formation de synapses et à la neuroprotection (survie des cellules nerveuses) [4].
Contrairement à son prédécesseur, l'Aβ est toxique pour les cellules nerveuses, contribuant à leur dégénérescence et à leur mort. Il est formé en séparant le domaine extracellulaire N-terminal (sAPP) de la protéine précurseur. Ce processus peut être effectué par deux sécrétases différentes - α-sécrétase et β-sécrétase, qui ont une différence fondamentale dans leur action. Dans le premier cas, la fragmentation se produit entre les résidus d'acides aminés au sein de la séquence Aβ, ce qui empêche la formation ultérieure d'un peptide amyloïde. Deuxièmement, pathologique, sous l'influence de la β-sécrétase, le processus de fragmentation dû à ses caractéristiques aboutit à la formation de Aβ. Cette seconde voie associée au développement des neuropathologies est plus rare, et pourquoi la fragmentation de la protéine précurseur la suit, elle n'est pas totalement claire [5].
 β-sécrétase.
β-sécrétase.La neurotoxicité de l'Aβ est associée à une violation de l'homéostasie du calcium, de l'excitotoxicité, des processus inflammatoires, de la stimulation du stress oxydatif et de l'apoptose. L'opinion dominante était que l'accumulation d'Aβ dans le cerveau est un processus purement pathologique en raison de l'impossibilité d'éliminer l'Aβ du tissu cérébral. On sait aujourd'hui que l'Aβ peut néanmoins être éliminé du cerveau de 2 manières au moins: périvasculaire (par lymphe) et protéolytique (clivage par différentes enzymes) [6, 7]. Par conséquent, la formation à un âge avancé de la maladie d'Alzheimer avec l'accumulation qui l'accompagne de fibrilles amyloïdes insolubles peut être associée à divers facteurs stimulants. Qui peut être de nature génétique et peut être associée au stress, à l'hypoxie, à l'ischémie et aux accidents vasculaires cérébraux antérieurs [8].
La β-amyloïde oxyde le cholestérol et les acides gras polyinsaturés, formant les formes les plus toxiques d'espèces réactives de l'oxygène - le radical hydroxyle et le peroxyde d'hydrogène. La racémisation de l'acide L-aspartique dans les protéines à longue durée de vie favorise la formation de β-amyloïde et d'a-synucléine. Des accumulations pathologiques de ces derniers sont observées dans la maladie de Parkinson, la maladie d'Alzheimer, la maladie de Levy et d'autres maladies neurodégénératives.
Un autre signe pathomorphologique de la neurodégénérescence dans la maladie d'Alzheimer est les agrégats de protéine tau hyperphosphorylée (protéine τ): filaments hélicoïdaux appariés (PHF) et enchevêtrements neurofibrillaires (NFT). Physiologiquement, la protéine τ est impliquée dans la stabilisation des microtubules des neurones, qui assurent le transfert à travers le cytoplasme des neurones des organites cellulaires, des glycoprotéines et d'autres substances. Dans la maladie d'Alzheimer, la protéine τ est hyperphosphorylée, perd sa capacité normale à stabiliser les microtubules et s'accumule dans la cellule avec des structures neurotoxiques insolubles. Ce qui se passe plus tôt lors de la formation de la pathologie - la formation d'agrégats d'amyloïdes ou de protéines τ - n'est pas une question claire. Mais, évidemment, ces deux processus sont interconnectés et se stimulent mutuellement. Ainsi, les deux protéines pathologiques présentent des propriétés de prion similaires à la protéine de prion PrPsc: des formes de protéines mal repliées par le type de réaction en chaîne stimulent la transformation de protéines normales en protéines irrégulières dans les neurones sains qui les entourent. Entre eux, Aβ et la protéine τ interagissent également par le type de prions: il est décrit comment Aβ active la protéine kinase GSK3 en phosphorylant la protéine τ et en provoquant sa formation incorrecte [5].
 protéine τ.
protéine τ.Plus récemment, on pensait que bien que les maladies à prions et la maladie d'Alzheimer présentent certaines similitudes biochimiques, la deuxième pathologie, contrairement à la première, n'est pas infectieuse et n'est pas transmise d'un organisme à un autre. Mais en 2015, les premières nouvelles inquiétantes sont apparues. Dans la revue Nature, un article a été publié par des neurologues britanniques dans lequel ils parlaient de la voie possible de transmission d'Aβ d'une personne à une autre. Les auteurs ont réalisé une étude d'autopsie du cerveau de huit personnes décédées de la maladie de Creutzfeldt-Jakob. Chez les six morts, en plus des blessures associées à la maladie sous-jacente, des accumulations importantes d'amyloïdes ont été trouvées dans le cerveau. Ce qui n'est inhabituel ni pour le jeune âge des morts, ni pour cette pathologie. Aucun défaut associé à l'amyloïdogenèse et aux neuropathologies n'a également été trouvé dans leurs génomes. Les chercheurs ont suggéré que l'Aβ a été introduit dans le corps du défunt lors de l'injection d'hormone de croissance infectée par l'amyloïde. De la même manière que plusieurs centaines de personnes étaient précédemment infectées et sont mortes d'injections de prions contenant de l'hormone de croissance [9].
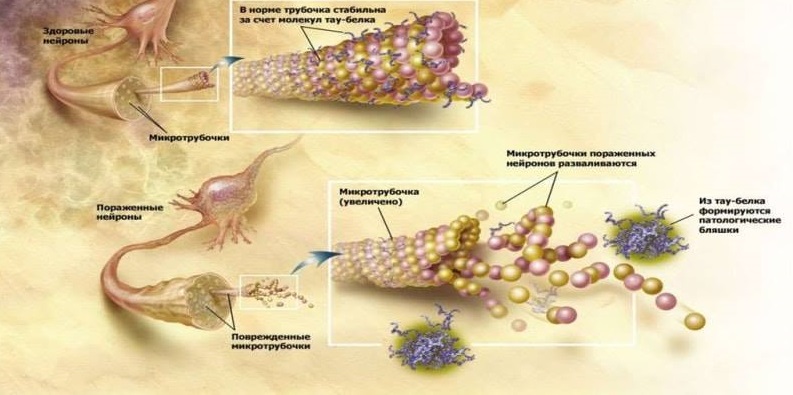 Les fonctions de la protéine τ sont normales et pathologiques.
Les fonctions de la protéine τ sont normales et pathologiques.La confirmation de l'infectiosité de la maladie d'Alzheimer peut être une autre étude dans laquelle des souris de laboratoire présentant une amyloïdogenèse accrue et des souris normales ont été combinées chirurgicalement avec le flux sanguin. En conséquence, des souris saines ont commencé à accumuler Aβ dans le cerveau, ce qui n'est pas typique de ces rongeurs. Cette étude a pour la première fois montré le potentiel de pénétration d'Aβ avec le sang dans le cerveau et sa participation ultérieure au développement de la neurodégénérescence [10].
La relation entre l'accumulation de β-amyloïde et de τ-protéine dans les tissus présentant des neuropathologies liées à l'âge détermine la nécessité de rechercher des méthodes efficaces pour identifier ces agrégats de protéines comme biomarqueurs de la neuropathologie future et du vieillissement accéléré. Aujourd'hui, plusieurs de ces méthodes sont déjà connues.
Les dépôts amyloïdes dans le tissu cérébral peuvent être détectés par tomographie par émission de positrons, lorsque la β-amyloïde est déterminée par l'isotope radioactif introduit dans le corps et connecté à l'amyloïde.
L'un des biomarqueurs les plus sensibles dans le diagnostic précoce de la maladie d'Alzheimer et des troubles congestifs modérés (UKI) dans la transition vers la phase pathologique est aujourd'hui considéré comme les niveaux d'amyloïde Aβ-42, de protéine τ totale et de protéine τ phosphorylée dans le liquide céphalo-rachidien (LCR). De plus, les amyloïdes avec pathologie montrent une diminution du niveau, et les niveaux dans le liquide céphalo-rachidien de protéines τ, totales et phosphorylées, augmentent. Cela est dû au fait que chez les personnes en bonne santé, il n'y a pas d'accumulation d'amyloïde sous forme de plaques et, par conséquent, une grande quantité d'amyloïde libre se trouve dans le liquide céphalorachidien. De faibles valeurs de la protéine τ montrent l'absence de destruction du cytosquelette neuronal.
Une corrélation significative a été trouvée entre l'âge et un ralentissement de l'excrétion de β-amyloïde du système nerveux, qui peut être associé à la sclérose des vaisseaux lymphatiques et à une diminution de leur capacité de drainage. La restauration du drainage est l'un des traitements prometteurs de la maladie d'Alzheimer, proposé par Leucadia, dont une interview avec le fondateur a été traduite et publiée sur
habr.com/post/371513Ainsi, la concentration de Aβ-42 dans le liquide céphalorachidien au niveau de 716,9 ± 94,2 ng / ml peut être considérée comme un indicateur normal pour une personne en bonne santé. Et le niveau d'Aβ-42, montrant un risque accru de neuropathologie, est <209 ng / ml. Pour une protéine τ, des niveaux de 73,9 ± 51,7 ng / ml sont considérés comme des valeurs normales dans le liquide céphalorachidien. Une augmentation des niveaux de protéines τ à 231,6 ± 158,5 ng / ml peut déjà indiquer la présence d'un processus neurodégénératif actif. Selon les idées d'aujourd'hui, une étude combinée des niveaux de protéine Aβ-42 et τ dans le liquide céphalorachidien montre une sensibilité élevée dans le diagnostic précoce des neuropathologies - 94% de la probabilité de diagnostiquer la maladie d'Alzheimer [11].
Bientôt, l'émergence de méthodes immunologiques et spectrométriques de masse ultra-sensibles pour le diagnostic de l'amylose (ratios Aβ42 / 40 ou APP669-711 / Aβ42) et de la neurodégénérescence (protéines τ et neurofilaments) dans le plasma sanguin est attendue [12]. Il existe également des méthodes «sans marque» pour détecter les protéines mal repliées dans le plasma [13].
Auteurs de la revue: Denis Odinokov, Alexey Rzheshevsky.
Liste de la littérature utilisée- Rameev V., Kozlovskaya L. Amylose: méthodes modernes de diagnostic et de traitement. Pharmacothérapie efficace. Urologie et néphrologie. 2012. N ° 11, p. 6-15.
- Butler L.I., Karpova O.Yu., Alexandrova E.N., Petrova S.Yu. Amylose du cœur chez les personnes âgées. Archives de médecine interne. 2015. n ° 6 (26), p. 28-36.
- AmyloSENS: Suppression des déchets entre les cellules.
- 4Lee, V., Goedert, M., Trojanowski, J. (2001) Neurodégénératives tauopathies, Annu. Rev. Neurosci., 24, 1121–1159.
- Tatarnikova O.G., Orlov M.A., Babkova N.V. Protéine amyloïde bêta et Tau: structure, interaction et propriétés de type prion. Advances in Biological Chemistry, vol. 55, 2015, p. 351-390.
- Weller, R., Yow, H., Preston, S., Mazanti, I., Nicoll, J. (2002) Les maladies cérébrovasculaires sont un facteur majeur de l'échec de l'élimination de la bêta-amyloïde du cerveau humain vieillissant, Ann. NY Acad. Sci., 977, 162-168.
- Nalivaeva, N., Fisk, L., Belyaev. N., Turner, A. (2008) Enzymes dégradant les amyloïdes comme cibles thérapeutiques dans la maladie d'Alzheimer, Curr. Alzheimer Res., 5, 212-224.
- Fisk, L., Nalivaeva, N., Boyle, J., Peers C., Turner A. (2007) Effects of hypoxia and oxydative stress on expression of neprilysin in human neuroblastoma cells and rat cortical neurones and astrocytes, Neurochem. Résolution 32, 1741-1748.
- Jaunmuktane Z., Mead S., Ellis M., Wadsworth JDF, Nicoll AJ, Kenny J., et al. (2015). Preuve de la transmission humaine de la pathologie amyloïde β et de l'angiopathie amyloïde cérébrale. Nature 525, 247-250.
- XL Bu, Y Xiang, WS Jin, J Wang, LL Shen, ZL Huang, K Zhang, YH Liu, F Zeng, JH Liu, HL Sun, ZQ Zhuang, SH Chen, XQ Yao, B Giunta, YC Shan, J Tan , XW Chen, ZF Dong, HD Zhou, XF Zhou, W Song et YJ Wang. La protéine β-amyloïde dérivée du sang induit des pathologies de la maladie d'Alzheimer. Psychiatrie moléculaire. 2017.
- V.Yu. Lobzin, A.Yu. Emelin, L.A. Alekseeva. Biomarqueurs liquorologiques de la neurodégénérescence dans le diagnostic précoce des troubles cognitifs. Bulletin de l'Académie de médecine militaire russe. 2013, n ° 4, p. 15-20.
- Blennow, Kaj et Henrik Zetterberg. "Biomarqueurs de la maladie d'Alzheimer - état actuel et perspectives d'avenir." Journal de médecine interne (2018).
- Nabers, Andreas et al. "Le biomarqueur sanguin amyloïde détecte la maladie d'Alzheimer." Médecine moléculaire EMBO (2018).