Le développement d'une thérapie du vieillissement n'est pas possible sans un diagnostic fiable du vieillissement. Il ne semble pas raisonnable de s’attendre à la mort d’une personne ou à l’apparition d’une maladie mortelle pour comprendre: avons-nous ralenti le processus de vieillissement ou non, avec telle ou telle thérapie. Nous devons immédiatement voir le tableau objectif provoqué par nos interventions anti-âge.
Dans la pratique clinique, il n'y a pas encore de «diagnostic important de vieillissement». Autrement dit, il n'est pas possible pour le patient et le médecin traitant de détecter des changements liés à l'âge au niveau moléculaire précédant l'apparition des maladies. Nous voulons combler cette lacune en décrivant tout d'abord tous les principaux marqueurs des changements liés à l'âge et le niveau technologique disponible pour les mesurer.
Nous continuerons la présentation du concept de diagnostic SENS du vieillissement, basé sur le fait qu'aujourd'hui le programme SENS (atteindre un vieillissement négligeable par des méthodes d'ingénierie) décrit le plus complètement les approches pour augmenter la durée de vie humaine.
Beaucoup ont entendu parler de la glycosylation des protéines, des produits finaux de glycation (CNG, AGE) et des dommages qu'ils font au corps. Mais, il faut noter que l'ajout de sucres à d'autres molécules est loin d'être toujours une pathologie. La glycosylation elle-même est un processus physiologique très courant et important dans les organismes vivants. Ainsi, une partie importante de toutes les protéines synthétisées dans les cellules subissent une glycosylation enzymatique, nécessaire à leur fonctionnement normal.
Fondamentalement, deux glycanes (la partie glucidique du ligament est une molécule organique) participent à la glycosylation: les N-glycanes (liés au groupe amide de l'asparagine) et les O-glycanes (liés au groupe hydroxyle de la sérine ou de la thréonine). En raison du vieillissement, nous nous intéressons davantage aux N-glycanes. Il est décrit qu'avec le vieillissement, le spectre des chaînes de sucre change, qui s'attachent aux protéines immunitaires pendant la N-glycosylation. Et un tel changement joue un rôle clé dans l'augmentation liée à l'âge de l'inflammation générale dans le corps. Ainsi, le niveau d'anticorps IgG glycosylés peut prédire l'âge biologique d'une personne encore plus précisément que la longueur des télomères [1].
En outre, deux autres glycanes, NGA2F et N2AF, se sont révélés être des biomarqueurs de vieillissement prometteurs. Dans le cadre du programme européen de recherche MARK-AGE sur les biomarqueurs vieillissants, qui s'est achevé en 2013, le test GlycoAgeTest a été développé pour déterminer l'âge biologique d'une personne. Il est basé sur le rapport du nombre de glycanes NGA2F (augmentant avec l'âge) et N2AF (dont le niveau diminue avec l'âge). Un autre biomarqueur potentiel du vieillissement et des maladies liées à l'âge (cardiovasculaires et diabétiques) décrit dans l'étude MARK-AGE était la glycoprotéine clusterine, impliquée dans la stabilisation des structures protéiques [2].
Nous passons maintenant à la prise en compte de la partie pathologique de ce phénomène. En plus de la glycosylation enzymatique régulée par l'organisme, il existe une forme non enzymatique de ce processus, ce que l'on appelle Réaction de Maillard, dont le résultat est l'apparition dans le corps d'une variété de produits de glycation. Il est à noter que le processus de glycosylation non enzymatique n'est pratiquement pas régulé. Bien qu'il existe la possibilité de "restreindre" la glycosylation par transglication, dans laquelle le glutathion, les polyamines, les thiols, les acides aminés libres, par exemple la taurine, la lysine sont consommés. Et aussi par l'inactivation du méthylglyoxal par le système de la glyoxalase: la glyoxalase I convertit le méthylglyoxal et le glutathion réduit en lactoylglutathion, qui est ensuite métabolisé en D-lactate par la glyoxalase II.
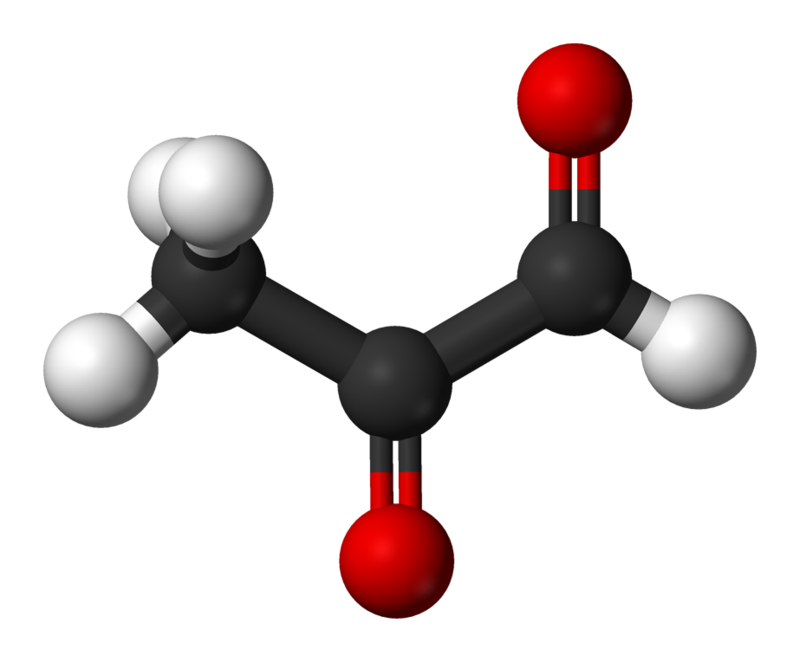 Structure méthylglyoxal
Structure méthylglyoxalParmi les produits de glycation, on distingue les produits de glycation précoce (produits Amadori) et tardif (ou final). La glycosylation non enzymatique se déroule en plusieurs étapes. Ce processus commence par le fait que le glucose et d'autres sucres simples se combinent avec le groupe amino et déclenchent une chaîne de réactions supplémentaires. Au début, lors de la réaction entre le groupe des sucres aldéhydes et le groupe amino, un groupe aldimine instable (base de Schiff) est formé, qui peut se transformer en un certain nombre d'autres composés plus stables, des produits de glycosylation précoce, les soi-disant Produits Amadori. L'un des premiers produits de l'addition de glucose aux protéines est la néfructosyl-lysine, qui, à son tour, se dégrade forme divers produits finaux de la glycation (CNG). Les hydroimidazolones, dérivés de résidus d'arginine modifiés par le glyoxal, le méthylglyoxal et la 3-désoxyglucosone (3-DG), sont produites en plus grande quantité que le GNC. D'autres GNC bien étudiés sont le Nδ - carboxyméthyl - lysine (CML) et le Nδ - carboxyéthyl - lysine (CEL), ainsi que le glucosepane et la pentosidine, qui sont caractéristiques de la réticulation des protéines [3]. L'un des types de GNC les plus facilement définis est la pentosidine, qui s'accumule, par exemple, dans les tendons des gros muscles d'une personne (c'est-à-dire où la vitesse de renouvellement du collagène est ralentie) à partir de 20 ans et sa concentration augmente linéairement jusqu'à la vieillesse.
Jusqu'à récemment, on pensait que le glucose était la principale substance pour la formation de GNC. Mais l'établissement exact de différents taux de formation intra et extracellulaire de GNC a montré que ce n'était pas le cas. Les sucres tels que le fructose, le glucose-6-phosphate et le glycéraldéhyde-3-phosphate ont un taux plus élevé de formation de CNG intracellulaire. L'effet négatif du glycéraldéhyde sur la molécule de l'actine, principale protéine contractile et cytosquelettique, a été décrit, ce qui conduit à la formation de réticulations de pentosidine et de bithyrosine et à une perte de fonctionnalité de l'actine [4].
 Réticulation des molécules de collagène avec glucosepan.
Réticulation des molécules de collagène avec glucosepan.On pense maintenant que la glycosylation non enzymatique et le GNC sont étroitement associés à une gamme de maladies liées à l'âge, telles que le diabète, la polyarthrite rhumatoïde, l'athérosclérose, la maladie de Parkinson et la maladie d'Alzheimer, la sclérose latérale amyotrophique, les cataractes et le cancer [5]. Les protéines soumises à la glycation dans la réaction de Maillard deviennent réticulées aphisiologiquement, tout en perdant leurs propriétés. Cela pose un problème particulièrement important pour les protéines à longue durée de vie (par exemple, les molécules de collagène cutané, selon un certain nombre d'études, ont une demi-vie de 15 ans et le cartilage plus de 100 ans), qui constituent une partie importante de toutes les protéines du corps - environ un tiers. La réticulation supplémentaire qui en résulte entre les molécules viole les fonctions de ces protéines, ce qui entraîne une perte d'élasticité tissulaire et est souvent observée avec le vieillissement et les pathologies. La glycation fait aussi que la protéine de collagène déjà lentement renouvelée devienne encore plus longue - après la glycation, elle acquiert une résistance à l'action physiologique des collagénases endogènes, qui assurent le renouvellement des tissus.
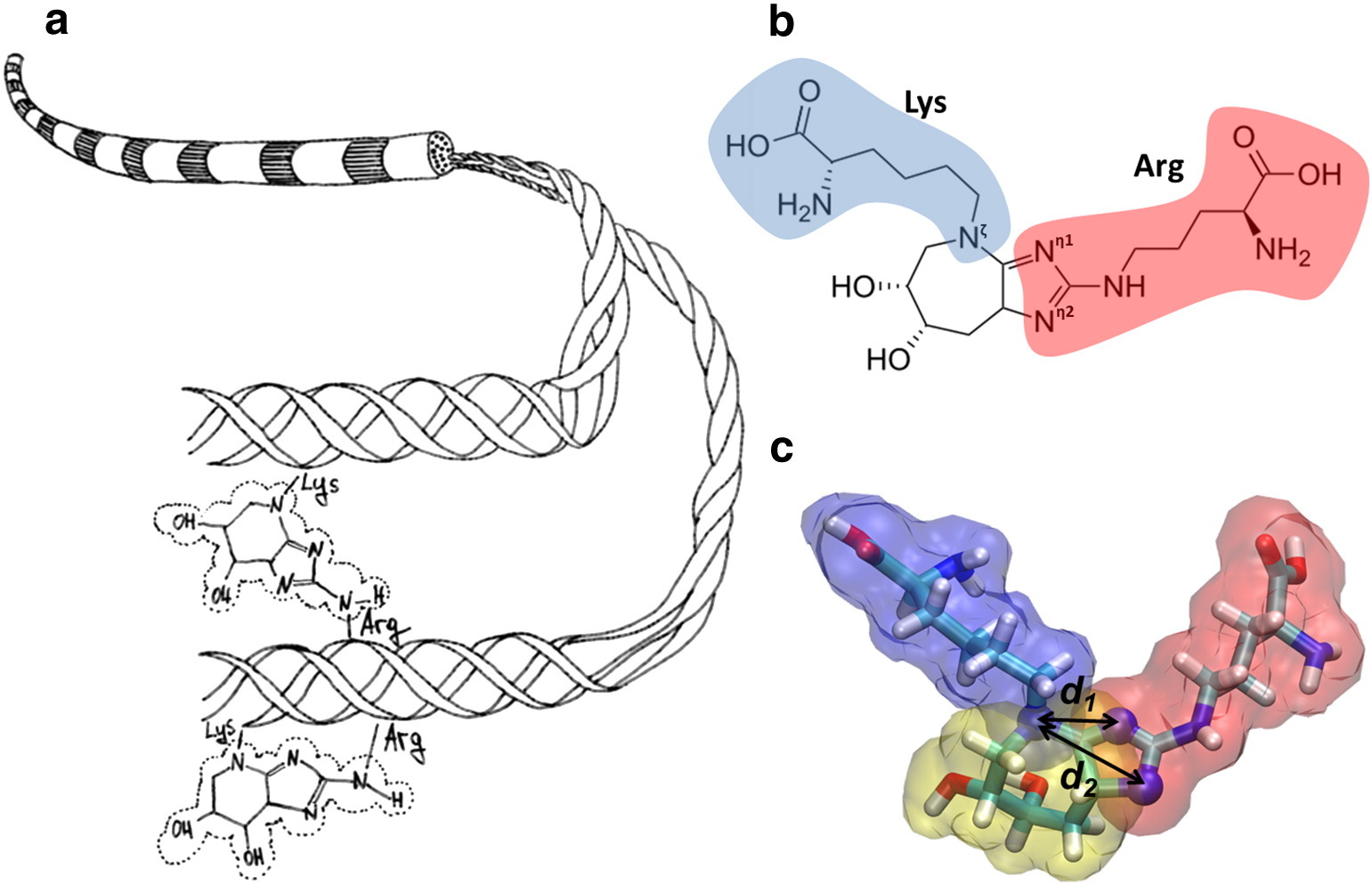 La figure (a) montre un diagramme des fibrilles de collagène et de la formation de glucoseépan, qui lie de manière covalente les chaînes latérales de la lysine et de l'arginine. (b) La structure chimique du glucosopan est montrée, qui réticule la lysine (bleue) avec l'arginine (rouge). (c) Un modèle moléculaire du glucosopane est montré.
La figure (a) montre un diagramme des fibrilles de collagène et de la formation de glucoseépan, qui lie de manière covalente les chaînes latérales de la lysine et de l'arginine. (b) La structure chimique du glucosopan est montrée, qui réticule la lysine (bleue) avec l'arginine (rouge). (c) Un modèle moléculaire du glucosopane est montré.La participation du facteur de croissance des fibroblastes glyqué β-FGF dans la formation de la fibrose est décrite. La glycation de la séquence arg-gli-asp de la protéine de fibronectine entraîne une violation de la capacité de régénération vasculaire et de la progression des pathologies vasculaires. Les GNC s'accumulent dans le cristallin et la rétine avec l'âge. Les cristallins, les principales protéines structurales du cristallin de l'œil, sont sensibles à la glycation et à la réticulation. La glycation des protéines du cristallin entraîne des cataractes. L'hémoglobine glyquée, qui est utilisée pour déterminer le niveau moyen de glycémie au cours des 3 derniers mois, perd la capacité de transférer l'oxygène aux tissus, ce qui affecte négativement de nombreux processus chimiques.
Il est également connu que la glycation des protéines et la formation de CNG s'accompagnent d'une augmentation de l'activité des radicaux libres et de la peroxydation lipidique, ce qui contribue au développement de maladies liées à l'âge. Cela est dû au fait que dans le processus de glycation des protéines, les processus d'auto-oxydation du sucre sont lancés, accompagnés d'une augmentation de la production d'espèces réactives de l'oxygène (ROS). De plus, la liaison du CNG au récepteur CNG (RAGE) conduit également à la formation de ROS réactifs et à l'activation ultérieure du facteur de transcription sensible au stress oxydatif NF-kB associé à l'inflammation et à l'athérogenèse.
À son tour, l'activation de NF-κB augmente l'expression de RAGE, créant un cycle de rétroaction positive qui améliore la production de promoteurs inflammatoires. De plus, l'interaction CNG-RAGE active la NADPH oxydase (un complexe d'enzymes qui produit du superoxyde), ce qui augmente le stress oxydant intracellulaire. Et l'augmentation du stress oxydatif par la NADPH oxydase en réponse à l'interaction de AGE-RAGE active à son tour NF-κB. Et ici, nous pouvons observer un certain nombre de «cercles vicieux» - des cycles avec une rétroaction positive.
La glycation des protéines de la chaîne respiratoire mitochondriale contribue également à ce processus: la perturbation de la chaîne respiratoire sert de source constante de radicaux superoxyde. De plus, la formation dans les mitochondries et dans d'autres structures sous l'influence de la glycation de CNG indécomposables peut être responsable de la mise en œuvre d'un phénomène tel que la «mémoire métabolique». Chez les patients atteints de diabète de type 2, un contrôle glycémique strict n'empêche plus le développement de complications associées aux maladies cardiovasculaires. On suppose que les GNC indécomposables jouent un rôle majeur dans ce phénomène [6].
De plus, avec la glycation, une augmentation des processus inflammatoires se produit. Ainsi, lors de la glycosylation du collagène, les produits finaux de ce processus s'accumulent dans la matrice extravasculaire, que le corps perçoit comme étrangère. Pour cette raison, une réponse immunitaire se produira au cours de laquelle les cellules immunitaires - les macrophages - augmenteront la sécrétion de cytokines pro-inflammatoires (TNF-α, interleukine-6, etc.), qui sont connues pour leur capacité à affecter négativement la résistance à l'insuline et l'athérogenèse [7].
De plus, les protéines «réticulées» modifient la structure (nanotopographie) et augmentent la rigidité de la matrice extracellulaire et, à travers les mécanorécepteurs membranaires et le cytosquelette cellulaire, ainsi que les molécules de signalisation influencent l'expression des gènes, la fonction des cellules, des tissus et du corps dans son ensemble. De plus, grâce à la proline, les molécules de collagène conduisent de faibles ondes électromagnétiques générées par les cellules et les tissus et, éventuellement, en plus des signaux mécaniques et chimiques, forment un seul système de signaux bioélectriques du corps. Il est intéressant de noter qu'en modifiant la topographie du rayonnement moyen ou électromagnétique, vous pouvez non seulement contrôler le cycle cellulaire, mais aussi transformer des cellules somatiques adultes en cellules souches sans l'aide de virus avec le vecteur des facteurs Yamanaka.
Même des modifications mineures du module de cisaillement et de la viscoélasticité du milieu intercellulaire ont un effet important sur les cellules - la «vieille» matrice extracellulaire peut limiter considérablement l'efficacité de l'utilisation des sénolytiques et de la thérapie par cellules souches. Ainsi, les «jeunes» fibroblastes vieillissent rapidement dans l'ancienne matrice et vice versa - les «vieilles» cellules perdent les signes d'un phénotype sécrétoire lié au vieillissement dans la «jeune» matrice.
Quelles sont les causes des protéines glyquées et du GNC? On pense que le principal pour l'homme moderne aujourd'hui est la malbouffe. La croûte brune-noire frite sur les produits représente la collection de GNC, formée en raison du traitement thermique des produits (friture de viande, pommes de terre, etc.) à des températures élevées. Le bacon frit est considéré comme le détenteur du record du nombre de GNC formés. De plus, la consommation d'aliments contenant de nombreux glucides rapides (confiseries, boissons sucrées, etc.) peut également contribuer à la glycation des protéines et à la formation de CNG. Il existe des produits connus qui, au contraire, aident à résister à l'accumulation de GNC - radis noir, radis, brocoli, grâce à la substance sulforaphane qu'ils contiennent. Ce n'est pas surprenant, mais avec les gourmets, les fumeurs se fournissent régulièrement des doses élevées de GNC. La fumée de tabac contient des glycotoxines qui réagissent avec les résidus de lysine et d'arginine pour former du GNC. C'est probablement pourquoi les fumeurs ont une inflammation chronique des organes respiratoires [8].
Comme déjà mentionné, en plus des facteurs externes, la formation de CNG se produit également normalement de manière endogène (c'est-à-dire à l'intérieur du corps) dans des conditions physiologiques. Bien que ce processus soit lent et insignifiant, il augmente de manière significative avec une concentration accrue de radicaux libres, avec une résistance à l'insuline, un diabète sucré et une augmentation de la glycémie. Accumulant dans le corps, le GNC entraîne une personne dans le «marais» des processus pathologiques, dont il n'est alors pas si facile de sortir.
Dans l'expression figurative des auteurs de SENS, la réticulation des protéines agit comme des «menottes» moléculaires qui lient les molécules de protéines, violant ainsi leur fonction. Les auteurs de SENS voient une solution à ce problème dans le développement de médicaments qui peuvent réagir par réticulation et les briser sans détruire d'autres caractéristiques structurelles des molécules. À leur avis, une circonstance favorable dans ce processus est que les réticulations qui se produisent en tant qu'accidents chimiques dans les structures de nos molécules de protéines ont une structure chimique très inhabituelle, qui ne se produit normalement pas dans les substances produites par le corps. Ce qui devrait faciliter la recherche et la création d'agents thérapeutiques.
De plus, les auteurs de SENS identifient un certain nombre d'approches prometteuses pour résoudre ce problème. Telles que trouver ou développer des enzymes, au lieu de médicaments, pour briser les liaisons croisées. Ainsi que le développement de protéines «jetables» qui détruiraient la réticulation, puis elles-mêmes seraient détruites dans le processus. Il est connu que de telles protéines existent à d'autres fins, par exemple, la protéine régénératrice d'ADN MGMT [9]. En faveur d'une approche de recherche d'enzymes, le fait que les enzymes déshydratantes soient décrites dans les organismes vivants dit. Ainsi, dans les champignons et les bactéries, des enzymes résistantes à la glycation, l'amadoriasis, la fructosolysine-6-kinase frlD et la fructosolysine-6-phosphate déglycase frlB, agissant sur des composés d'acides aminés de bas poids moléculaire avec des sucres, ont été trouvées [10]. Chez les vertébrés, les enzymes fructosamine-3-kinase (FN3K) et sa protéine apparentée FN3K-RP ont été trouvées, qui sont capables de décomposer les produits de glycation intracellulaire dans les processus dépendants de l'ATP [11].
On pense que le glucose-épane a le plus grand effet sur l'évolution des maladies chez les personnes âgées et est donc une cible prioritaire pour la thérapie anti-âge.
Malheureusement, le glucose n'a pas été choisi comme cible pour les médicaments anti-réticulation développés précédemment, tels que Alagebrium / ALT-711 (Wolffenbuttel et al., 1998), C36 (Cheng et al., 2007), TRC4149 (Pathal et al., 2008 ), et il n'a qu'à prouver son rôle dans les mécanismes du vieillissement. Ces substances visaient à neutraliser la carboxyméthyllysine, le produit de réaction de Maillard tardif le plus courant qui s'accumule dans l'organisme avec le diabète.
À l'heure actuelle, un groupe de David Spiegel de l'Université de Yale travaille sur la synthèse d'anticorps contre les protéines contenant du glucoseépan. Aubrey de Gray confirme l'importance de la recherche sur le glucose-épane et a récemment annoncé l'enregistrement de Revel, sur la base duquel la recherche commencée à l'université sera probablement poursuivie.
Cependant, il est probable que ni les anticorps ni les enzymes, en raison de leur taille, ne pourront pénétrer entre les fibrilles de collagène. De plus, la réticulation déchirée du collagène est restaurée après la prise du médicament, ce qui nécessitera un deuxième traitement.
Par conséquent, les catalyseurs artificiels de type enzyme, dont les tailles peuvent être plusieurs fois plus petites que les tailles des enzymes d'origine, semblent être une alternative plus intéressante. Des molécules similaires ayant une activité catalytique donnée - les spiroligomères - sont développées par un groupe de Christian Schaffmeister de l'Université Temple.
Comme indiqué précédemment, comme les produits finaux de la glycation s'accumulent au cours du vieillissement, leur quantification peut être un biomarqueur précis et fiable du vieillissement. Cependant, à la fois la détection du GNC dans le corps et le diagnostic précoce des changements dans la composition et la structure de la matrice intercellulaire sont difficiles en raison de la nature des changements, limités par les organes et les systèmes, et la nécessité de biopsies multiples. Même dans un organisme, les résultats sont très différents selon l'emplacement de la biopsie et le type de produit final de glycation final examiné.
Les méthodes disponibles pour déterminer les produits de glycation finaux dans la peau, telles que l'autofluorescence, c'est-à-dire sans l'utilisation de colorants spéciaux (le dispositif AGE-READER fabriqué par la société néerlandaise DiagnOptics BV) ne fournissent pas de données précises et de nombreux facteurs peuvent influencer les résultats de mesure, par exemple, les changements dans l'eau - .
La méthode principale et la plus précise pour quantifier le GNC dans le corps aujourd'hui est la méthode de chromatographie en combinaison avec la détection par spectrométrie de masse. La spectrométrie de masse permet l'identification de protéines avec un haut degré de certitude et la détermination de leurs quantités dans des mélanges de protéines complexes.. ( , .). , –. . ( , ) .
, , , - (). , , . , , (RAGEs). RAGE , Nf-κB (, -, -6 C- ). , . , - , [12].
, - , . 6- Invecchiare in Chianti, 1.013 65 , , , , , , [13]. 2018 , D1-B2, , . [14]
- (, DOGDIC, MODIC GODIC), [15]. , – GOLD MOLD [16].
: , .
:- Krištić J, Vučković F, Menni C, Klarić L, Keser T, Beceheli I, Pučić-Baković M. et al. Glycans are a novel biomarker of chronological and biological ages.Gerontol A Biol Sci Med Sci. 2014 Jul;69(7):779-89.
- Bürkle A, Moreno-Villanueva M, Bernhard J, Blasco M, Zondag G, Hoeijmakers JH6, Toussaint O, Grubeck-Loebenstein B, Mocchegiani E, Collino S, Gonos ES, Sikora E. et al. MARK-AGE biomarkers of ageing. Mech Ageing Dev. 2015 Nov;151:2-12.
- Ahmed N., Thornalley PJ . . 2009. №9, . 642-51.
- . ., . ., . ., . . in vitro , . . 2006, №2, . 51-59.
- .., . : . , 2010, : 56(2), 168-178.
- .. «» . . . 2011. № 4.
- Bernheim J, Rashid G, Gavrieli R, Korzets Z, Wolach B. In vitro effect of advanced glycation end-products on human polymorphonuclear superoxide production. Eur J Clin Invest. 2001. Dec;31(12):1064-9.
- Mullick AE, McDonald JM, Melkonian G, Talbot P, Pinkerton KE, Rutledge JC. Reactive carbonyls from tobacco smoke increase arterial endothelial layer injury. Am J Physiol Heart Circ Physiol. 2002 Aug;283(2):H591-7.
- GlycoSENS: Breaking extracellular crosslinks.
- Monnier VM, Sell DR. Prevention and repair of protein damage by the Maillard reactionin vivo. Rejuvenation Res. 2006;9(2):264–273.
- Szwergold BS1, Bunker RD, Loomes KM. The physiological substrates of fructosamine-3-kinase-related-protein (FN3KRP) are intermediates of nonenzymatic reactions between biological amines and ketose sugars (fructation products). Med Hypotheses. 2011 Nov;77(5):739-44.
- Semba RD, Najjar SS, Sun K, et al. Serum carboxymethyl-lysine, an advanced glycation end product, is associated with increased aortic pulse wave velocity in adults. Am J Hypertens. 2009;22:74–79
- Semba, RD, Bandinelli, S., Sun, K., Guralnik, JM, & Ferrucci, L. (2009). Plasma Carboxymethyl-Lysine, an Advanced Glycation End Product, and All-Cause and Cardiovascular Disease Mortality in Older Community-Dwelling Adults. Journal of the American Geriatrics Society, 57(10), 1874–1880.
- Wendel U, Persson N, Risinger C, Bengtsson E, Nodin B, Danielsson L, Welinder C, Nordin Fredrikson G, Jansson B, Blixt O. A novel monoclonal antibody targeting carboxymethyllysine, an advanced glycation end product in atherosclerosis and pancreatic cancer. PLoS One. 2018 Feb 8;13(2):e0191872.
- Biemel KM, Fried DA, Lederer MO. Identification and quantification of major maillard cross-links in human serum albumin and lens protein. Evidence for glucosepane as the dominant compound. J Biol Chem. 2002 Jul 12;277(28):24907-15. Epub 2002 Apr 26.
- Chellan P, Nagaraj RH. Protein crosslinking by the Maillard reaction: dicarbonyl-derived imidazolium crosslinks in aging and diabetes. Arch Biochem Biophys. 1999 Aug 1;368(1):98-104.